一种尿液游离DNA保存剂以及一种尿液保存管的制作方法
一种尿液游离dna保存剂以及一种尿液保存管
技术领域
1.本发明涉及医学检验技术领域,具体涉及一种尿液游离dna保存剂以一种及尿液保存管。
背景技术:
2.近年来,国内外相继报道了从各种类型的尿液样本中提取游离dna的研究。研究人员已从肺结核患者尿液中提取出结核杆菌的dna、怀有男胎孕妇的尿液样本中提取到y染色体,同时在大量泌尿系统疾病患者尿液中也检测到了相关突变基因,使得尿液中的dna作为一种生物标记物来研究基因突变引起的各类疾病成为一种需求。尿液样本易获取,方便操作,且属于非介入采集样本方式。尿液是经膀胱排出的含有大量代谢终产物的液体,因人体自身差异导致其盐浓度、酸碱度、比重指标差异较大,因此dna所处的环境复杂,极易发生降解,同时尿液中含有大量细菌,离体后很容易造成细菌滋生,所以用于提取dna的尿液样本需在采集后2小时内进行分离提取dna。
3.但现实样本量大或者检测条件不允许,并不能保证所有样本均能够于2小时内进行处理,为了方便采集、运输和保存尿液,同时给尿液中的脱落细胞及游离dna提供一个稳定的环境,需要研发一种能于常温保存尿液的保存剂。
技术实现要素:
4.为解决上述技术中存在的问题,本发明提供一种尿液游离dna保存剂,为包含以下质量浓度的物质的tris-hcl缓冲液:8%~11%的抗细胞凝结剂、1.5%~25%的细胞固定剂、7.5%~11%的核酸酶抑制剂、0.5%~1.5%的细胞代谢抑制剂、1%~5%自由基清除剂。
5.其中,各物质质量浓度为:8%的抗细胞凝结剂、15%的细胞固定剂、9.25%的核酸酶抑制剂、1.5%的细胞代谢抑制剂、5%自由基清除剂。
6.其中,所述细胞抗凝剂为右旋糖酐。
7.其中,所述细胞固定剂为咪唑烷基脲、重氮咪唑烷基脲中的一种或多种。
8.其中,所述细胞固定剂为咪唑烷基脲、重氮咪唑烷基脲,其比例为2:1。
9.其中,所述核酸酶抑制剂为乙二胺四乙酸二钾。
10.其中,所述细胞代谢抑制剂为氟化钠。
11.其中,所述自由基清除剂为谷胱甘肽。
12.一种内含上述尿液游离nda保存剂的尿液保存管。
13.其中,所述保存剂体积为a,所述保存管加入尿液后液体总体积为b,则(a/b)*100%≥2%。
14.本发明的有益效果为:本发明提供的一种尿液保存剂其能够将尿液样本于常温(25℃)保存至少7天,并且保存剂相较于尿液样本用量少。
附图说明
15.下面结合附图和具体实施方式对本发明作进一步详细的说明。
16.图1是本发明验证试验一尿液样本组dna电泳图;
17.图2是本发明验证试验二尿液样本组dna电泳图。
具体实施方式
18.下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
19.本发明提供一种尿液游离dna保存剂以及内含该保存剂的尿液保存管。
20.上述保存剂包含如下质量浓度的各成分:
21.8%~11%的抗细胞凝结剂、1.5%~25%的细胞固定剂、7.5%~11%的核酸酶抑制剂、0.5%~1.5%的细胞代谢抑制剂、1%~5%自由基清除剂。
22.其余成分1.25mol/l的tris-hcl缓冲液。
23.本保存剂的ph为7.5,使用hcl调节ph。
24.其制备方法为,将tris溶于纯化水中,用hcl调节ph到7.5,制得tris-hcl溶液;分别将上述各成分加入缓冲液中,最终调节ph至7.5,过滤即得。
25.本发明提供的尿液保存管内保存剂的用量遵循以下原则:
26.保存剂体积为a,保存管加入尿液后液体总体积为b,则(a/b)*100%≥2%。
27.实施例一
28.保存剂成分:
29.抗细胞凝结剂:右旋糖酐(质量浓度8%);
30.细胞固定剂:咪唑烷基脲(质量浓度10%)、重氮咪唑烷基脲(质量浓度5%);
31.细胞代谢抑制剂:氟化钠(质量浓度1.5%);
32.自由基清除剂:谷胱甘肽(质量浓度5%);
33.核酸酶抑制剂:乙二胺四乙酸二钾(质量浓度9.25%);
34.其余成分为:1.25mol/l的tris-hcl缓冲液。
35.保护剂ph7.5。
36.实施例二
37.保存剂成分:
38.抗细胞凝结剂:右旋糖酐(质量浓度9%);
39.细胞固定剂:咪唑烷基脲(质量浓度1.5%);
40.细胞代谢抑制剂:氟化钠(质量浓度0.5%);
41.自由基清除剂:谷胱甘肽(质量浓度1%);
42.核酸酶抑制剂:乙二胺四乙酸二钾(质量浓度7%);
43.其余成分为:1.25mol/l的tris-hcl缓冲液。
44.保护剂ph7.5。
45.实施例三
46.保存剂成分:
47.抗细胞凝结剂:右旋糖酐(质量浓度11%);
48.细胞固定剂:咪唑烷基脲(质量浓度25%);
49.细胞代谢抑制剂:氟化钠(1%);
50.自由基清除剂:谷胱甘肽(质量浓度2.5%);
51.核酸酶抑制剂:乙二胺四乙酸二钾(质量浓度11%);
52.其余成分为:1.25mol/l的tris-hcl缓冲液。
53.保护剂ph7.5。
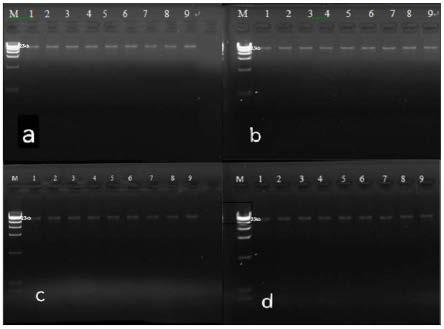
54.验证试验一
55.1.细胞保存效果测试:
56.将上述实施例1至3中的保护剂(0.2ml)加入采集管中,并抽真空至抽吸体积9.8ml,采集志愿者a和b的晨尿样本,每个志愿者的样本分别装入实施例1-3对应的采集管中,每个实施例为6管。
57.上述内含样本的采集管(共计36只)均于室温(25℃)保存0天、4天、7天,每个对应时间点对样本提取dna进行测试,并对核酸浓度进行测试,取两个平行试验。
58.样本处理:1800g、4℃离心10min,分离尿液细胞,使用核酸提取纯化试剂盒按要求进行dna提取,quawell q5000超微量紫外分光光度计测定核酸浓度,并进行凝胶电泳分析。
59.结果见图1至图4以及表1;
60.图1a和图1b为志愿者a的电泳结果,其中泳道1-3为实施例1-3对应的保存管于0天的测试结果,泳道4-6为实施例1-3对应的保存管于4天的测试结果,泳道7-9为实施例1-3对应的保存管于7天的测试结果。
61.图1c和图1d为志愿者b的电泳结果,其中泳道1-3为实施例1-3对应的保存管于0天的测试结果,泳道4-6为实施例1-3对应的保存管于4天的测试结果,泳道7-9为实施例1-3对应的保存管于7天的测试结果。
62.图1a-图1d最左泳道为marker。
63.表1:验证试验一核酸浓度测试结果
64.[0065][0066]
表1结合图1a-图1d的结果显示,提取核酸浓度并无明显变化,说明经过常温保存后并未出现细胞裂解释放组dna的情况,其中第0天数据可理解为对照。
[0067]
2.游离dna保存效果测定:
[0068]
将上述实施例1至3中的保护剂(0.2ml)加入采集管中,并抽真空至抽吸体积9.8ml,采集志愿者a和b的晨尿样本,每个志愿者的样本分别装入实施例1-3对应的采集管中,每个实施例为6管,取两个平行。
[0069]
每支采集管添加1000ng/10ml尿液的基因组内参基因gapdh片段(上海生工),室温放置,分别在室温(25℃)保存0天、4天、7天。每个时间点取对应样本进行dna提取,并对游离dna(gapdh)片段进行荧光定量分析。
[0070]
样本前处理条件:1800g、4℃离心10min,分离上清液至新的离心管中,将上清液继续10000g、4℃离心5min,得到前处理的尿液。用游离dna提取试剂盒(cwbio cwy007s)提取出尿液中的cfdna,用pcr仪进行荧光定量分析。
[0071]
荧光定量分析条件:以提取的游离dna为模板,选择添加的dna片段gapdh,进行荧光定量pcr测定尿液样本中添加gapdh的剩余量,结果如表2所示。
[0072]
引物为:
[0073]
gapdh-f:ggactgaggctcccac;
[0074]
gapdh-r:gcatggactgtggtctgcaa。
[0075]
pcr条件:
[0076][0077]
表2验证实验一游离dna测定结果
[0078]
[0079][0080]
结果:cp值越小说明cfdna的量越多,反之说明cfdna的量越少。
[0081]
验证试验二
[0082]
在发明人试验过程中发现,本技术提供的保存液能够在一段时间内使尿液样本在45℃条件下良好保存36h,这种功能可适用于偏远县级或乡镇级等需要送检的医疗机构,能够一定程度降低由于快递延误导致样本升温cfdna降解或细胞裂解释放组dna影响检测结果的问题。
[0083]
将上述实施例1至3中的保护剂(0.2ml)加入采集管中,并抽真空至抽吸体积9.8ml,采集志愿者c的晨尿样本,每个实施例采集两管,取两个平行,每支采集管添加1000ng/10ml尿液的基因组内参基因gapdh片段(上海生工),每个平行组内三管样本(共6管)于室温(25℃)放置4天后放入培养箱内,三小时升温至45℃,并于升温后24h、36h、48h进行凝胶电泳、核酸浓度以及cp值测定。
[0084]
测定方法与验证试验一相同。
[0085]
其测试结果如图2a、图2b、图2c以及表3和表4所示。
[0086]
图2a中泳道1-3号为实施例1-3三管样本24h对应样本(第一组平行),泳道4-6号为实施例1-3三管24h对应样本(第二组平行),最右泳道为marker,图2b为36h结果、图2c为48h结果,泳道样本与图2a对应。
[0087]
取第一组平行样本于室温保存4天时升温前进行检测作为对照:
[0088]
实施例1-3核酸浓度分别为:143.42ng/ul、151.03ng/ul、147.76ng/ul;
[0089]
实施例1-3cp值分别为:14.24、15.74、14.59。
[0090]
表3验证试验二核酸浓度测试结果
[0091][0092]
表4验证试验二游离dna测定结果
[0093][0094][0095]
由表3和表4可知三个实施例的保存剂能够在45℃温度下维持36h有核细胞不破碎,游离dna不降解,而48h时实施例3样本的有核细胞破碎释放组dna,造成游离dna的cp值降低,实施例2样本组dna量变化不大,但游离dna cp值增大,样本中游离核酸降解明显。
[0096]
由图2c能够看出,48h时,3号和6号泳道条带暗淡,证明细胞内dna数量减小,也证明有核细胞的破碎。
[0097]
对于45℃条件下的验证,还选取了其余4位志愿者进行试验,每个志愿者采集3管样本分别对应三个时间点进行上述试验,由于篇幅限制仅列出对应数据,具体见表5和表6。
[0098]
表5验证试验二志愿者d-g核酸浓度测试结果
[0099][0100][0101]
表6验证试验二志愿者d-g游离dna测定结果
[0102][0103]
结合本验证试验的数据可知,本技术提供的保存剂以及使用该保存剂的保存管能够在常温保存一段时间后遇到升温情况还能延长36h的保存期限。
[0104]
显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1