一种影响猪骨骼肌肌纤维类型组成百分比的SNP分子标记及其应用
一种影响猪骨骼肌肌纤维类型组成百分比的snp分子标记及其应用
技术领域
1.本发明属于动物分子生物及动物遗传育种技术领域,具体涉及一种影响猪骨骼肌肌纤维类型组成百分比的snp分子标记及其应用。
背景技术:
2.肌纤维是肌肉最基本的组成单位,肌纤维的组成及其类型转化直接影响着畜禽的肉品质。不同类型的肌纤维具有不同的形态、代谢以及生理生化特性。atpase酶组织化学染色方法主要将肌纤维分为i型、iia型和iib型3种类型。其中,i型肌纤维的收缩速度缓慢并且持续时间长,也称为慢收缩肌;iib型肌纤维收缩速度快,但持续时间短,被称为快收缩肌。此外,i型肌纤维的直径小,外观呈红色,线粒体含量丰富,能快速进行有氧代谢,抗疲劳能力强,为氧化型肌纤维,而iib型肌纤维的特性恰好相反,直径大,外观呈白色,线粒体含量少,主要进行无氧代谢且抗疲劳能力弱,适用于爆发性肌肉活动,为酵解型肌纤维。iia肌纤维的性质介于i型、iib型纤维之间,呈粉色,这种肌纤维被称为中间型纤维。正是因为不同类型肌纤维自身的特性存在很大差异,使得肌纤维类型占比不同的肌肉呈现不同的理化特性。当肌肉中酵解型纤维(iib)占比大时,会使肌肉ph值下降较快,甚至产生pse(pale,soft,exudative)肉。larzul等在法国大白猪群体的研究结果显示iibw/iib型纤维比例与ph
30min
、ph
24h
、糖酵解潜力和亮度指标高度遗传相关(遗传相关系数分别为-0.46、-0.62、0.31和0.55),表明酵解型纤维的增加可能会降低ph
30min
和ph
24h
值并增加糖酵解潜力和亮度(larzul etal.,journal ofanimal science,1997)。bereta等在纯种波兰大白和长白的肌纤维特性研究中发现iib型肌纤维的比例与背最长肌的imf含量呈显著负相关(rp=-0.162,p《0.05),i型和iia型肌纤维比例与imf含量呈正相关(相关系数分别为rp=0.187和0.097)(bereta etal.,annals ofanimal science,2014)。因此,研究肌纤维类型的调控机制对于改善肉品质具有重要意义。
3.尽管如此,受肌肉样本数目、表型测定困难等因素的影响,关于肌纤维比例的遗传学研究主要是利用微卫星标记且样本数少,pigqtldatabase数据库中共报道了62个关于肌纤维类型的qtls位点(https://www.animalgenome.org/cgi-bin/qtldb/ss/index),这种方法的定位区间很大,不利于后续功能基因的搜寻。zhang等利用猪60k芯片在421头大白
×
民猪的f2群体开展了i型、iia型和iib型肌纤维比例的gwas分析,但是没有鉴别到显著相关的snps位点(zhang,etal.,animal,2019)。截止至目前,尚没有基于基因组全序列开展肌纤维比例的研究报道,与影响肌纤维比例显著关联的候选基因和snps位点报道较少。
技术实现要素:
4.本发明目的在于提供一种影响猪骨骼肌肌纤维类型组成百分比的snp分子标记及其应用。
5.为达到上述目的,本发明采用的技术方案如下:
6.一种影响猪骨骼肌肌纤维类型组成百分比的snp分子标记,至少包括如下(i)~(xiv)中的一种:
7.(i)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第4号染色体上,所述snp分子标记位于国际猪基因组11.1版本第4号染色体上自5’端起的第59035654位点的碱基处,为c或a;
8.(ii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第9号染色体上,所述snp分子标记位于国际猪基因组11.1版本第9号染色体上的自5’端起的第11607366位点的碱基处,为g或c;
9.(iii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第11号染色体上,所述snp分子标记位于国际猪基因组11.1版本第11号染色体上的自5’端起的第73324220位点的碱基处,为a或t;
10.(iv)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第9号染色体上,所述snp分子标记位于国际猪基因组11.1版本第9号染色体上的自5’端起的第4996621位点的碱基处,为t或c;
11.(v)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第9号染色体上,所述snp分子标记位于国际猪基因组11.1版本第9号染色体上的自5’端起的第12114310位点的碱基处,为aaag或a;
12.(vi)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第10号染色体上,所述snp分子标记位于国际猪基因组11.1版本第10号染色体上的自5’端起的第18627657位点的碱基处,为c或t;
13.(vii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第3号染色体上,所述snp分子标记位于国际猪基因组11.1版本第3号染色体上的自5’端起的第21093392位点的碱基处,为c或t;
14.(viii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第8号染色体上,所述snp分子标记位于国际猪基因组11.1版本第8号染色体上的自5’端起的第14207579位点的碱基处,为t或c;
15.(ix)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第9号染色体上,所述snp分子标记位于国际猪基因组11.1版本第9号染色体上的自5’端起的第12202149位点的碱基处,为g或a;
16.(x)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第12号染色体上,所述snp分子标记位于国际猪基因组11.1版本第12号染色体上的自5’端起的第54924531位点的碱基处,为a或g;
17.(xi)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第13号染色体上,所述snp分子标记位于国际猪基因组11.1版本第13号染色体上的自5’端起的第197677254位点的碱基处,为agctcatg或a;
18.(xii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第15号染色体上,所述snp分子标记位于国际猪基因组11.1版本第15号染色体上的自5’端起的第17210397位点的碱基处,为g或a;
19.(xiii)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第16号染
色体上,所述snp分子标记位于国际猪基因组11.1版本第16号染色体上的自5’端起的第13400266位点的碱基处,为cactaag或tactaaa;
20.(xiv)含有所述snp分子标记的核酸的序列位于国际猪基因组11.1版本第18号染色体上,所述snp分子标记位于国际猪基因组11.1版本第18号染色体上的自5’端起的第16030131位点的碱基处,为g或a。
21.基于一个总的发明构思,本发明的第二个目的在于请求保护上述影响猪骨骼肌肌纤维类型组成百分比的snp分子标记在检测猪骨骼肌中不同类型肌纤维的组成百分比中的应用。
22.基于一个总的发明构思,本发明的第三个目的在于提供一种猪的遗传改良的方法,确定种猪核心群中的种猪如权利要求1所述的snp分子标记,并根据所述snp分子标记做出相应的选择:
23.对于(i),从所述种猪核心群中选择在所述国际猪基因组11.1版本第4号染色体上自5’端起的第59035654位点为c/a和a/a基因型的种猪个体,淘汰在该位点为c/c基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
24.对于(ii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第11607366位点为g/c和c/c基因型的种猪个体,淘汰在该位点为g/g基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
25.对于(iii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第11号染色体上自5’端起的第73324220位点为a/t和t/t基因型的种猪个体,淘汰在该位点为a/a基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
26.对于(iv),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第4996621位点为t/c和t/t基因型的种猪个体,淘汰在该位点为c/c基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
27.对于(v),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第12114310位点为aaag/a和aaag/aaag基因型的种猪个体,淘汰在该位点为a/a基因型的种猪个体,以逐代提高该位点的等位基因aaag的频率;
28.对于(vi),从所述种猪核心群中选择在所述国际猪基因组11.1版本第10号染色体上自5’端起的第18627657位点为c/t和t/t基因型的种猪个体,淘汰在该位点为c/c基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
29.对于(vii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第3号染色体上自5’端起的第21093392位点为c/t和c/c基因型的种猪个体,淘汰在该位点为t/t基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
30.对于(viii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第8号染色体上自5’端起的第14207579位点为t/c和c/c基因型的种猪个体,淘汰在该位点为t/t基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
31.对于(ix),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第12202149位点为g/a和g/g基因型的种猪个体,淘汰在该位点为a/a基因型的种猪个体,以逐代提高该位点的等位基因g的频率;
32.对于(x),从所述种猪核心群中选择在所述国际猪基因组11.1版本第12号染色体
上自5’端起的第54924531位点为a/g和a/a基因型的种猪个体,淘汰在该位点为g/g基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
33.对于(xi),从所述种猪核心群中选择在所述国际猪基因组11.1版本第13号染色体上自5’端起的第197677254位点为agctcatg/a和
34.agctcatg/agctcatg基因型的种猪个体,淘汰在该位点为a/a基因型的种猪个体,以逐代提高该位点的等位基因agctcatg的频率;
35.对于(xii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第15号染色体上自5’端起的第17210397位点为g/a和a/a基因型的种猪个体,淘汰在该位点为g/g基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
36.对于(xiii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第16号染色体上自5’端起的第13400266位点为cactaag/tactaaa和tactaaa/tactaaa基因型的种猪个体,淘汰在该位点为cactaag/cactaag基因型的种猪个体,以逐代提高该位点的等位基因tactaaa的频率;
37.对于(xiv),从所述种猪核心群中选择在所述国际猪基因组11.1版本第18号染色体上自5’端起的第16030131位点为g/a和a/a基因型的种猪个体,淘汰在该位点为g/g基因型的种猪个体,以逐代提高该位点的等位基因a的频率。
38.优选地,利用分析所述种猪的核酸序列确定snp分子标记的位点,并根据所述snp分子标记做出相应的选择:
39.对于(i),从所述种猪核心群中选择在所述国际猪基因组11.1版本第4号染色体上自5’端起的第59035654位点为a/a基因型的种猪个体,淘汰在该位点为c/a和c/c基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
40.对于(ii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第11607366位点为c/c基因型的种猪个体,淘汰在该位点为g/c和g/g基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
41.对于(iii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第11号染色体上自5’端起的第73324220位点为t/t基因型的种猪个体,淘汰在该位点为a/a和a/t基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
42.对于(iv),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第4996621位点为t/t基因型的种猪个体,淘汰在该位点为t/c和c/c基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
43.对于(v),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第12114310位点为aaag/aaag基因型的种猪个体,淘汰在该位点为aaag/a和a/a基因型的种猪个体,以逐代提高该位点的等位基因aaag的频率;
44.对于(vi),从所述种猪核心群中选择在所述国际猪基因组11.1版本第10号染色体上自5’端起的第18627657位点为t/t基因型的种猪个体,淘汰在该位点为c/t和c/c基因型的种猪个体,以逐代提高该位点的等位基因t的频率;
45.对于(vii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第3号染色体上自5’端起的第21093392位点为c/c基因型的种猪个体,淘汰在该位点为c/t和t/t基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
46.对于(viii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第8号染色体上自5’端起的第14207579位点为c/c基因型的种猪个体,淘汰在该位点为t/c和t/t基因型的种猪个体,以逐代提高该位点的等位基因c的频率;
47.对于(ix),从所述种猪核心群中选择在所述国际猪基因组11.1版本第9号染色体上自5’端起的第12202149位点为g/g基因型的种猪个体,淘汰在该位点为g/a和a/a基因型的种猪个体,以逐代提高该位点的等位基因g的频率;
48.对于(x),从所述种猪核心群中选择在所述国际猪基因组11.1版本第12号染色体上自5’端起的第54924531位点为a/a基因型的种猪个体,淘汰在该位点为a/g和g/g基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
49.对于(xi),从所述种猪核心群中选择在所述国际猪基因组11.1版本第13号染色体上自5’端起的第197677254位点为agctcatg/agctcatg基因型的种猪个体,淘汰在该位点为a/a和agctcatg/a基因型的种猪个体,以逐代提高该位点的等位基因agctcatg的频率;
50.对于(xii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第15号染色体上自5’端起的第17210397位点为a/a基因型的种猪个体,淘汰在该位点为ga和c/c基因型的种猪个体,以逐代提高该位点的等位基因a的频率;
51.对于(xiii),从所述种猪核心群中选择在所述国际猪基因组11.1版本第16号染色体上自5’端起的第13400266位点为tactaaa/tactaaa基因型的种猪个体,淘汰在该位点为cactaag/tactaaa和cactaag/cactaag基因型的种猪个体,以逐代提高该位点的等位基因tactaaa的频率;
52.对于(xiv),从所述种猪核心群中选择在所述国际猪基因组11.1版本第18号染色体上自5’端起的第16030131位点为a/a基因型的种猪个体,淘汰在该位点为g/a和g/g基因型的种猪个体,以逐代提高该位点的等位基因a的频率。
53.基于一个总的发明构思,本发明的第四个目的在于提供一种鉴别猪肉质性状优劣的方法,确定猪如权利要求1所述的snp分子标记,并根据所述snp分子标记确定所述猪肉质性状:
54.对于(i),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第4号染色体上自5’端起的第59035654位点的基因型排序,依次为:a/a基因型、c/a基因型和c/c基因型;
55.对于(ii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第9号染色体上自5’端起的第11607366位点的基因型排序依次为:c/c基因型、g/c基因型和g/g基因型;
56.对于(iii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第11号染色体上自5’端起的第73324220位点的基因型排序依次为:t/t基因型、a/t基因型和a/a基因型;
57.对于(iv),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第9号染色体上自5’端起的第4996621位点的基因型排序依次为:t/t基因型、t/a基因型和a/a基因型;
58.对于(v),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第9号染色体上自5’端起的第12114310位点的基因型排序依次为:aaag/aaag基因型、aaag/a基因型和a/a基因型;
59.对于(vi),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第10号染色体上自5’端起的第18627657位点的基因型排序依次为:t/t基因型、c/t基因型和c/c基因
型;
60.对于(vii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第3号染色体上自5’端起的第21093392位点的基因型排序依次为:c/c基因型、c/t基因型和t/t基因型;
61.对于(viii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第8号染色体上自5’端起的第14207579位点的基因型排序依次为:c/c基因型、t/c基因型和t/t基因型;
62.对于(ix),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第9号染色体上自5’端起的第12202149位点的基因型排序依次为:g/g基因型、g/a基因型和a/a基因型;
63.对于(x),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第12号染色体上自5’端起的第54924531位点的基因型排序依次为:a/a基因型、g/a基因型和g/g基因型;
64.对于(xi),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第13号染色体上自5’端起的第197677254位点的基因型排序依次为:agctcatg/agctcatg基因型、agctcatg/a基因型和a/a基因型;
65.对于(xii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第15号染色体上自5’端起的第17210397位点的基因型排序依次为:a/a基因型、g/a基因型和g/g基因型;
66.对于(xiii),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第16号染色体上自5’端起的第13400266位点的基因型排序依次为:tactaaa/tactaaa基因型、cactaag/tactaaa基因型和
67.cactaag/cactaag基因型;
68.对于(xiv),所述猪肉质性状从优到劣,以所述国际猪基因组11.1版本第18号染色体上自5’端起的第16030131位点的基因型排序依次为:a/a基因型、g/a基因型和g/g基因型;
69.基于一个总的发明构思,本发明的第五个目的在于提供一种通过改变肌纤维组成改善猪肉品质的猪新品系和/或猪新品种建立的方法,包括如下步骤:对于权利要求1所述snp分子标记的基因型为:
70.(i)c/a或c/c的猪,通过定点突变的方式将其中的c/a和c/c突变为a/a基因型;
71.(ii)g/c或g/g的猪,通过定点突变的方式将其中的g/c和g/g突变成c/c基因型;
72.(iii)a/t或a/a的猪,通过定点突变的方式将其中的a/t和a/a突变成t/t基因型;
73.(iv)t/c或c/c的猪,通过定点突变的方式将其中的t/c和c/c突变为t/t基因型;
74.(v)aaag/a或a/a的猪,通过定点突变的方式将其中的aaag/a和a/a突变为aaag/aaag基因型;
75.(vi)c/t或c/c的猪,通过定点突变的方式将其中的c/t和c/c突变为t/t基因型;
76.(vii)c/t或t/t的猪,通过定点突变的方式将其中的c/t和t/t突变为c/c基因型;
77.(viii)t/c或t/t的猪,通过定点突变的方式将其中的t/c和t/t突变为c/c基因型;
78.(ix)g/a或a/a的猪,通过定点突变的方式将其中的g/a和a/a突变为g/g基因型;
79.(x)a/g或g/g的猪,通过定点突变的方式将其中的a/g和g/g突变为a/a基因型;
80.(xi)agctcatg/a或a/a的猪,通过定点突变的方式将其中的agctcatg/a和a/a突变
为agctcatg/agctcatg基因型;
81.(xii)g/a或g/g的猪,通过定点突变的方式将其中的g/a和g/g突变为a/a基因型;
82.(xiii)cactaag/tactaaa或cactaag/cactaag的猪,通过定点突变的方式将其中的cactaag/tactaaa和cactaag/cactaag突变为tactaaa/tactaaa基因型;
83.(xiv)g/a或g/g的猪,通过定点突变的方式将其中的g/a和g/g突变为a/a基因型。
84.进一步地,所述定点突变的方式为利用转基因的方法或基因编辑的方法进行突变。
85.较佳地,利用crispr/cas9基因编辑方法进行突变。
86.本发明的snp分子标记与猪骨骼肌不同类型肌纤维类型组成百分比密切相关,因此,可以通过本发明的snp分子标记中的至少一个来检测猪的相关指标,或者通过这些snp分子标记中的至少一个来进行遗传改良。
附图说明
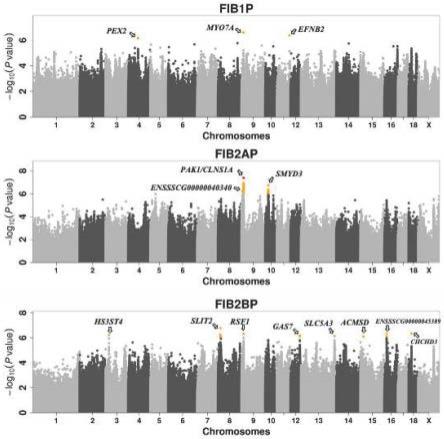
87.图1显示了嵌合f6群体猪骨骼肌中三种不同肌纤维类型组成百分比的gwas分析的曼哈顿图(manhattan plot)。其中,x轴为snp位点在染色体上的位置,y轴为snp位点对应的-log10(p值),不同颜色的圆点对应筛选显著性snp位点的阈值,其中橘色圆点表示-log10(1
×
10-6
),红色圆点表示-log10(5
×
10-8
),其他颜色圆点表示阈值低于-log10(1
×
10-6
)。
具体实施方式
88.为使本发明的目的、技术方案和优点更加明白清楚,结合具体实施方式,对本发明做进一步描述,但是本发明并不限于这些实施例。在本发明中,若非特指,所有的份、百分比均为质量单位,所采用的设备和原料等均可从市场购得或是本领域常用的。下述实施例中的方法,如没有特别说明,均为本领域的常规方法。
89.本文中所用的术语“包含”、“包括”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
90.当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或者优选值与任何范围下限或优选值的任意一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1至5”时,所描述的范围应被解释为包括范围“1至4”、“1至3”、“1至2”、“1至2和4至5”、“1至3和5”等。当数值范围在本文中被描述时,除非另外地说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
91.本发明中使用的嵌合家系f6群体是由杜洛克、大白、长白、皮特兰4种西方商业品种猪和二花脸、莱芜、巴马香、藏猪4种中国地方品种猪经过多个世代杂交产生的后代。
92.实施例
93.1.猪的全基因组重测序数据的获得、质控及判型
94.从f6屠宰群体中830头个体中,分别采集每个个体一小块耳组织样,并以标准酚氯仿方法提取得到其每个个体的基因组dna,将所提取的基因组dna溶解于te缓冲液中。用
nanodrop-nd1000分光光度计检测所提取的基因组dna质量,当a260/280比值在1.8-2.0,a260/230比值在1.7-1.9左右时达到质量标准。
95.将符合标准的dna样品的浓度稀释至50ng/μl,利用illumina公司的hiseq x ten测序仪平台对每份dna样品进行低深度重测序(平均测序深度约为7.8x),所得的全部双端读长(read)使用bwa软件映射至11.1版本的国际猪基因组,然后依次使用samtools,platypus以及beagle等软件得到每个个体的基因型数据。使用plink1.9对获得的基因型数据进行质量控制,剔除次等位基因频率(minor allele frequency,maf)《0.03,保留个体中snps的检出率大于0.9以及有肌纤维总数目数据的个体,最后得到了29441528个snps和约580头个体用于后续分析。
96.2.猪的骨骼肌纤维总数目表型的测定
97.不同类型肌纤维比例的测定过程包括:切片、atpase染色、五张不同切片视野的肌纤维数目统计,过程中区分i型、iia型和iib型肌纤维,然后用每种类型的肌纤维数目除以总的肌纤维数目(肌纤维数目加和大于750个)即是i型(fib1p)、iia型(fib2ap)和iib型(fib2bp)肌纤维比例指标。具体的操作步骤参考文章(yizhong huang,et al.journal of visualized experiments,2017;tianfu guo,et al.asian-australasian journal of animal sciences,2020)。f6群体中三种肌纤维类型比例表型的描述性统计如表1所示。
98.表1嵌合家系f6群体三种肌纤维类型比例表型的描述性统计分析结果
[0099][0100]
3.全基因组关联分析(gwas)分析
[0101]
基于基因组全序列的单性状关联分析使用gemma version0.94(https://github.com/genetics-statistics/gemma)软件完成。采用单变量线性混合模型:
[0102]
y=wα+xβ+u+ε
[0103]
u~mvnm(0,λτ-1
k)
[0104]
ε~mvnn(0,τ-1in
)
[0105]
其中,y表示测定的表型向量;w表示固定效应指示矩阵;α是w相应的固定效应向量;x是基因型相关矩阵;β表示标记效应向量;u代表符合多元正态分布的随机效应向量;k代表的是使用全基因组信息计算得到的亲缘关系矩阵;ε代表的是符合多元正态分布的剩余残差向量;in表示一个单位矩阵;λ表示随机效应的方差与剩余残差方差的比值,τ-1
代表的是剩余残差的方差;n是个体数量,m是群体的数量。
[0106]
嵌合家系f6群体猪骨骼肌中三种不同肌纤维类型比例的gwas分析结果见图1。由图1可知,仅iia型肌纤维比例的gwas结果有达到染色体显著性阈值的信号位点且大部分得位点都落在9号染色体(fib2ap),其余两个表型的gwas位点较分散且都只是达到基因组显著性阈值(注:-log10(p值)大于或等于6的位点,即曼哈顿图中橘色和红色位点,下同)。f6群体的14个代表性snp位点(指同一染色体上相距较远的或不同染色体上
“‑
log10(p值)”最
大的位点或为最有可能的因果突变位点)的基本遗传学参数信息见表2。其中代表性snp位点的名称信息可由ensembl(www.ensembl.org)网站给出,如rs325098830,若网站无该位点的snp名称信息,则以“染色体_位置”的形式表示该位点的snp名称;各代表性位点的其他一些重要的遗传学参数信息均可由gemma软件的gwas分析结果给出,包括位点所在的染色体及位置信息,等位基因,效应大小及p值等。
[0107]
表2嵌合家系f6群体14个代表性snp位点的基本遗传学参数信息
[0108][0109]
虽然本发明已经参照具体实施方式进行了描述,但是本领域的技术人员应该理解在没有脱离本发明的真正的精神和范围的情况下,可以进行的各种改变。此外,可以对本发明的主体、精神和范围进行多种改变以适应特定的情形、材料、材料组合物和方法。所有的这些改变均包括在本发明的权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1