水稻OsPR6基因或其编码的蛋白在调控水稻对稻瘟病菌抗性中的应用的制作方法
水稻ospr6基因或其编码的蛋白在调控水稻对稻瘟病菌抗性中的应用
技术领域
1.本发明涉及水稻稻瘟病防治技术领域,特别是涉及水稻ospr6基因或其编码的蛋白在调控水稻对稻瘟病菌抗性中的应用。
背景技术:
2.植物在自然生态系统中面临各种各样的病原体的侵染威胁,导致农业生产的产量和品质下降。植物病害主要包括真菌病害,细菌病害,病毒病害等,以重要单子叶粮食作物水稻病害为例:最具代表性的真菌病害如稻瘟病,由稻瘟病菌(magnaporthe oryzae)侵染引起;细菌病害如白叶枯病,由白叶枯病菌(xanthomonas oryzae pv.oryzae)侵染引起;病毒病害如水稻条纹病毒病,由水稻条纹病毒(rice stripe virus)侵染引起;而侵染双子叶作物或蔬菜的常见真菌病害有灰霉菌(b.cinerea)侵染引起的腐烂病等;其中稻瘟病在水稻生长发育的不同阶段不同部位均可以发生,主要为叶瘟、穗颈瘟、谷粒瘟。稻瘟菌在田间主要以无性态进行繁殖,并完成其侵染循环。前一年散落在田间杂草或病残株上的稻瘟菌三细胞分生孢子伴随空气、雨水等散落到水稻叶片表面,分生孢子顶端细胞释放出黏液,紧紧附着于疏水的水稻叶片表面,避免分生孢子在雨水等外力作用下脱落。随后,分生孢子在1~2h内消耗自身营养物质,萌发形成狭窄的芽管沿水稻叶片表面延伸。芽管在水稻表面延伸一段距离后停止生长,在顶端膨大分化形成一个特化的侵染结构附着胞。单细胞的附着胞逐渐成熟,三细胞的分生孢子发生自噬死亡,将能量和物质运输至附着胞。随后附着胞逐渐膨大,在甘油和黑色素积累作用下产生约8mpa的膨压,并在基部形成一个特殊结构“侵染栓”刺穿水稻叶片的角质层,侵入寄主细胞。初生侵染菌丝可在水稻细胞内分化产生次生侵染菌丝在水稻细胞间扩展。在潮湿环境下,稻瘟病菌侵染72-96h后,灰色或灰褐色的梭形病斑出现在水稻叶片上,这一过程中,稻瘟病菌从活体营养型转变为死体营养型。而病斑处新产生的分生孢子可通过风雨被传播到新的寄主植物上,开始新一轮的侵染。
3.这些病害对作物或蔬菜产量和品质的影响最为严重,每年造成的减产就相当于总产量的10-30%,而农药的使用减轻了病害的影响,但存在农药残留以及对自然环境有负面影响等不利因素。因此,抗病育种是目前最经济有效的抵御病原菌的方法。挖掘新的稻瘟病抗病基因、抗性资源、培育广谱抗病品种,是一种绿色、高效保障作物产量和品质的策略,对农业生产具有重要意义。
4.但是,有效防控水稻稻瘟病的新型药剂目前知之甚少。本发明经研究从分子水平揭示水稻抗病性的调控机理,寻找到新的抗病相关基因,应用其抑制稻瘟病菌附着胞的形成。试图将其有效应用于防治稻瘟病,研发高效防治稻瘟病的药剂。
技术实现要素:
5.本发明研究发现水稻ospr6基因与水稻对稻瘟病的免疫反应相关,敲除ospr6基因后,水稻对稻瘟病菌的防御能力降低,而过表达ospr6基因能够提高水稻对稻瘟病菌的抗病
能力。且ospr6蛋白对稻瘟病菌的附着胞形成具有明显的抑制作用,可作为药剂施用防治稻瘟病。
6.本发明的技术方案如下:
7.本发明提供了水稻ospr6基因或其编码的蛋白在调控水稻对稻瘟病菌抗性中的应用。
8.本发明还提供了水稻ospr6基因或其编码的蛋白在制备抗稻瘟病菌药物中的应用。
9.ospr6纯化蛋白(pr6gst蛋白)对稻瘟病菌附着胞具有明显的抑制作用,当pr6gst浓度为0.1μg/μl时,稻瘟病菌附着胞形成率仅有23.97%,而当pr6gst浓度达到0.2μg/μl时,稻瘟病菌孢子萌发被极显著地抑制,无附着胞形成。
10.优选的,水稻ospr6基因cds核苷酸序列如seq id no.2所示,水稻ospr6基因编码的蛋白的氨基酸序列如seq id no.1所示。
11.本发明还提供了一种调控水稻对稻瘟病菌抗性的方法,当需要降低水稻对稻瘟病菌抗性时,将水稻中的ospr6基因沉默或敲除;当需要提高水稻对稻瘟病菌抗性时,将水稻中的ospr6基因过表达。
12.本发明还提供了水稻ospr6基因在水稻育种中的应用,通过筛选高表达水稻ospr6基因的水稻植株获得抗稻瘟病菌的水稻株系。
13.本发明还提供了水稻ospr6基因编码的蛋白在水稻育种中的应用,通过筛选水稻ospr6基因编码的蛋白表达量高的水稻植株获得抗稻瘟病菌的水稻株系。
14.本发明还提供了一种抗稻瘟病菌药物,活性成分包括cds核苷酸序列如seq id no.2所示的水稻ospr6基因或氨基酸序列如seq id no.1所示的水稻ospr6基因编码的蛋白。
15.本发明还提供了所述的抗稻瘟病菌药物在防治水稻稻瘟病菌感染中的应用。
16.本发明还提供了一种抗稻瘟病菌的转基因水稻构建方法,将水稻ospr6基因转入水稻植株内获得高表达水稻ospr6基因的转基因水稻。
17.具体的,将水稻ospr6基因的cds区核苷酸序列克隆到载体中,先转入到农杆菌中,再通过愈伤转化转入水稻细胞内,获得高表达水稻ospr6基因的转基因水稻。
18.本发明经研究发现水稻基因ospr6在水稻抗稻瘟病的过程中具有重要作用,该基因可用于筛选获得抗稻瘟病菌的水稻株系,或其编码的蛋白质可以作为药剂用于防治稻瘟病。
附图说明
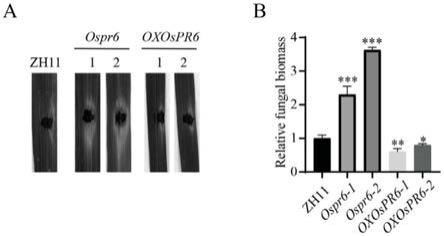
19.图1为水稻ospr6敲除与过表达突变体稻瘟病抗性鉴定结果图,其中,a为离体接种图;b为发病叶片相对菌丝生物量图,*p<0.05,**p<0.01,***p<0.001。
20.图2为水稻ospr6蛋白纯化检测结果图。
21.图3为水稻ospr6纯化蛋白对稻瘟病菌附着胞形成抑制结果图,其中,a为稻瘟病菌附着胞形成图,b为稻瘟病菌附着胞形成统计结果图。
具体实施方式
22.实施例1
23.水稻ospr6基因敲除突变体的获得。
24.水稻ospr6蛋白的氨基酸序列如seq id no.1所示,水稻ospr6基因的基因序列(cds序列)如seq id no.2所示。我们通过crispr/cas9技术对目的基因进行定向敲除,从而获得ospr6基因的敲除突变体。
25.敲除载体构建步骤如下:
26.(1)首先根据ospr6的基因号,下载其在日本晴(nipponbare)中的参考序列“http://rice.uga.edu/cgi-bin/sequence_display.cgi?orf=loc_os12g25090.1”,确定靶位点并设计接头引物ospr6cas9-f/r。引物序列如下:
27.ospr6cas9-f:ggcacgagggaagatgagctcgt;
28.ospr6cas9-r:aaacacgagctcatcttccctcg;
29.(2)靶点接头制备:将接头引物溶解成100μm的母液,各取1μl加入到98μl ddh2o混合稀释到1μm后,混合液90℃处理30s后,移至室温冷却20min完成退火;
30.(3)grna表达盒连接反应:酶切过的pyl grna-u3载体与对应把靶点接头进行连接,pcr反应体系如下:
[0031][0032]
pcr反应条件为:
[0033]
37℃,5min;20℃,5min。共5个循环。
[0034]
(4)grna表达盒扩增(两轮巢式pcr扩增):
[0035]
用(3)中连接所得产物进行第一轮扩增,pcr反应体系如下:
[0036][0037]
第一轮pcr扩增引物u-f/gdna-r序列为:
[0038]
u-f:5-ctccgttttacctgtggaatcg-3;
[0039]
grna-r:5-cggaggaaaattccatccac-3。
[0040]
第一轮pcr扩增反应条件如表1所示:
[0041]
表1
[0042][0043]
扩增完成后,取3μl扩增产物进行电泳检查。目的条带大小564bp。
[0044]
将第一轮扩增所得产物稀释20倍作为模板,进行第二轮扩增。
[0045]
第二轮pcr扩增反应体系如下:
[0046][0047]
第二轮pcr扩增引物序列为:
[0048]
uctcg-b1’:5
’‑
ttcagaggtctctctcgcactggaatcggcagcaaagg-3’:
[0049]
grcggt-bl:5
’‑
agcgtgggtctcgaccgggtccatccactccaagctc-3’。
[0050]
第二轮pcr扩增反应条件如表2所示:
[0051]
表2
[0052][0053]
[0054]
扩增完成后,取3μl扩增产物进行电泳,检查产物长度。纯化第二轮扩增产物并测定其浓度。
[0055]
(5)边切边连(两轮巢式pcr扩增):
[0056]
取步骤(4)中纯化产物约20ng,加入未切割的pylcrispr/cas9-mh质粒约20ng,在15μl反应体系中用10u bsai酶于37℃酶切10min。
[0057]
酶切后,向体系中加入1.5μl 10
×
t4 ligase buffer和35u t4 ligase,pcr反应体系如表3所示:
[0058]
表3
[0059][0060]
采用热激法将连接后的质粒转化至大肠杆菌e.coli,挑选阳性克隆进行检测。测序正确后将质粒送武汉伯远生物科技有限公司做愈伤转化,以zh11(中花11)品系为背景,获得水稻ospr6基因敲除突变体ospr6-1和ospr6-2。
[0061]
实施例2
[0062]
水稻ospr6基因过表达突变体的获得。
[0063]
根据ospr6的cds序列,设计引物ospr6ox-f/r。引物序列如下:
[0064]
ospr6ox-f:gttacttctgcactaggtaccatgaactctacaagtcattttgtcgc;
[0065]
ospr6ox-r:tcttagaattcccggggatccttaatttaaagctatatatattctgctagctagc;
[0066]
以zh11(中花11)基因组为模板,利用引物ospr6ox-f/r扩增出基因ospr6的cds序列。扩增产物纯化后,通过无缝克隆技术将其连接至pcambia1390载体(kpni/bamhi双酶切)上。采用热激法将连接后的质粒转化至大肠杆菌e.coli,挑选阳性克隆进行检测。测序正确后将质粒送武汉伯远生物科技有限公司,转化到农杆菌后导入水稻愈伤组织内做转化,以zh11(中花11)品系为背景,获得水稻ospr6基因过表达突变体oxospr6-1和oxospr6-2。
[0067]
实施例3
[0068]
ospr6对水稻抗病性的影响。
[0069]
为验证基因ospr6参与水稻对稻瘟病的防御反应,我们检测了ospr6敲除突变体和过表达突变体对稻瘟病的抗性变化。具体操作如下:
[0070]
在oa培养基上活化野生稻瘟病菌菌株guy11,25℃黑暗培养3天,光照培养4天。向培养皿中加入无菌ddh2o,用接种环轻刮菌丝,将稻瘟病菌孢子从培养基上洗脱下来,洗脱液经神奇滤布过滤,获得孢子悬浮液。孢子悬浮液置于2ml离心管中,12000rpm离心2min,弃上清(避免倒出底部孢子),加入灭菌ddh2o调整孢子浓度至不低于1
×
106个/ml。向孢子液中加入1/10体积的0.1%gelatin(gelatin终浓度为0.01%,v/v),用于稻瘟病菌接种。
[0071]
离体接种:将离体叶片整齐置于2%水琼脂表面铺平,培养皿中加入少量无菌ddh2o保湿。用10μl灭菌枪头轻戳水稻叶片表面轻戳(避开叶脉),造成损伤即可,避免用力过度形成穿孔。吸取10μl孢子悬浮液滴至叶片伤口处,静置30min。用保鲜膜密封培养皿,放置25℃培养箱,静置培养7d后,对接种叶片进行拍照并统计菌丝生物量。
[0072]
菌丝生物量测定:剪取水稻病斑处,通过ctab法提取总dna。以水稻基因
osubiquitin作为内参(loc_os03g13170),检测稻瘟病菌mopot2基因(mgg_13294)的量,通过实时荧光定量pcr分析真菌生物量。用2-δδct
法计算基因的相对表达量。引物序列为:
[0073]
qosubq-f:aagaagctgaagcatccagc;
[0074]
qosubq-r:ccaggacaagatgatctgcc;
[0075]
mopot2-f:acgacccgtctttacttatttgg;
[0076]
mopot2-r:aagtagcgttggttttgttggat。
[0077]
离体接种结果(图1)显示:与野生型相比,敲除突变体ospr6-1,ospr6-2的病斑面积明显大于野生型,对稻瘟病抗性显著减弱;过表达突变体oxospr6-1,oxospr6-2的病斑面积明显小于野生型,对稻瘟病抗性明显增强,表明ospr6对水稻抗稻瘟病是必需的。
[0078]
实施例4
[0079]
ospr6纯化蛋白的获得。
[0080]
根据基因ospr6的cds序列,设计引物ospr6gst-f/r。引物序列如下:
[0081]
ospr6gst-f:gatctggttccgcgtggatccaactctacaagtcattttgtcgcca;
[0082]
ospr6gst-r:ctcgagtcgacccgggaattcttaatttaaagctatatatattctgctagctagc。
[0083]
构建载体:以zh11(中花11)基因组为模板,利用引物ospr6gst-f/r扩增出基因ospr6的cds序列。通过无缝克隆技术将扩增片段连接至pegx-4t-1载体上。采用热激法将连接后的质粒转化至大肠杆菌e.coli,挑选阳性克隆进行检测。
[0084]
诱导pr6-gst蛋白表达:pr6-gst载体测序正确后,将质粒以热激法转入大肠杆菌菌株bl21,挑选阳性克隆于37℃培养至od值为0.6后,16℃下诱导16h,iptg浓度为1mm,其后通过考马斯亮蓝染色以及蛋白免疫印迹实验western-blot检测蛋白表达情况,确认蛋白诱导成功。
[0085]
pr6-gst蛋白纯化:
[0086]
(1)每150ml菌体10000rpm离心2min,去上清;向沉淀的菌块中加入15ml gst binding/washing buffer悬浮菌体,再向其中加入300μl 10mg/ml溶菌酶,30μl 0.5m mgcl2,150μl 0.1m苯甲基磺酰氟(pmsf)。于4℃下缓慢摇晃酶解30min;
[0087]
(2)酶解过程完成后,将菌体通过超声破碎,然后于4℃离心10min,转速10000rpm;
[0088]
(3)取200μl上清标记为input,将剩余上清液转移至已经过平衡的gst树脂流动柱中,调节流速,控制在8-10s/滴,收集200μl流出液标记为flow through;菌体残渣中加15ml水悬浮,取200μl标记为bacteria pellet;整个过程于4℃冰箱中进行,防止蛋白变性;
[0089]
(4)加入5ml gst binding/washing buffer,控制流速为3-5s/滴,柱下方收集流出液200μl,标为wash1;重复本步骤一次,收集流出液200μl标为wash2;
[0090]
(5)1ml的gst elution buffer中加入适量谷胱甘肽洗脱目的蛋白,收集洗脱液(洗脱液中含有目的蛋白)标记为elution1;重复此步骤3次,分别标记为elution2、elution3和elution4;
[0091]
通过考马斯亮蓝染色以及蛋白免疫印迹实验western-blot检测纯化蛋白(图2),随后测定纯化蛋白的浓度。
[0092]
实施例5
[0093]
ospr6纯化蛋白抑制稻瘟病菌附着胞形成。
[0094]
于oa培养基上活化野生稻瘟病菌菌株guy11,培养条件与孢子悬浮液获得过程同
实施例3。利用血球计数板调整孢子浓度至1-2
×
105个/ml,并设置pr6-gst纯化蛋白在悬浮液中浓度分别为0、0.01、0.05、0.1和0.2μg/μl。将孢子液滴在疏水玻片表面,避免水滴之间聚集成团,于25℃保湿培养16h后,在显微镜下观察稻瘟病菌附着胞形成情况。
[0095]
如图3所示,pr6gst蛋白对稻瘟病菌附着胞具有明显的抑制作用,当pr6-gst浓度为0.1μg/μl时,稻瘟病菌附着胞形成率仅有23.97%,而当pr6-gst浓度达到0.2μg/μl时,稻瘟病菌孢子萌发被极显著地抑制,无附着胞形成。该结果表明ospr6蛋白有望作为一种药剂用于防治水稻稻瘟病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1