一种双载药红细胞载体其制备方法与应用
1.本发明属于医药技术领域,具体涉及一种双载药红细胞载体其制备方法与应用。
背景技术:
2.红细胞(red blood cell,rbc)是一种独特的天然药物载体。自上世纪70年代起,由于红细胞在生物降解,释放曲线方面表现出许多有利的性质,被作为药物递送载体进行了近半世纪的研究,并已成功包载了各种分子,包括抗体/酶,多肽,核酸,纳米粒子和化学药物等,其中一些已成功地转化为人类临床试验,例如l-天冬酰胺酶,地塞米松等。但是目前用红细胞作载体大部分局限于通过包载在红细胞内或偶联在红细胞膜表面的方式担载单种分子。
3.紫杉醇(paclitaxel,ptx),是一种双萜类紫杉烷类,临床上常用于治疗多种肿瘤疾病。但近些年来,研究发现其在中枢神经系统疾病的治疗中能显著提高神经元的分化比率。西妥昔单抗(cetuximab,cet)为嵌合型免疫球蛋白1的单克隆抗体,分子靶点为表皮生长因子受体(epidermal growth factor receptor,egfr)。对神经元的研究表明,egfr抗体可显著反转髓鞘蛋白等抑制分子对神经轴突生长的不利作用,且西妥昔单抗与egfr结合的亲和力约为其内源性配体的5到10倍,故西妥昔单抗阻断egfr与其内源性配体的结合,从而抑制其受体功能。
4.公开号为cn110279672a的中国专利公开了一种双载药红细胞载体、其制备方法与应用,所述双载药红细胞载体包括红细胞、包载于红细胞内的第一药物分子和偶联在红细胞表面的第二药物分子。所述第一药物分子可以是紫杉醇等,第二药物分子可以是西妥昔单抗等。本发明的双载药红细胞载体利用红细胞同时负载第一药物分子和第二药物分子两种治疗性分子,一方面通过载体红细胞的包载,降低药物带来的耐药风险和毒副作用,增加给药的安全性,另一方面还通过两种不同功能的药物担载,可针对不同问题发挥更好的治疗效果。同时,本发明的双载药红细胞载体制备工艺简单,原料经济易得,不需要依赖于复杂设备,易于工业化生产。
5.但是,仍然存在下列问题:
6.现有的载药红细胞载体的包封率和红细胞回收率较低,纳米载体药物体内靶向性差;
技术实现要素:
7.针对现有技术中存在的上述不足之处,本发明提供了一种双载药红细胞载体其制备方法与应用,用以解决现有技术现有的载药红细胞载体的包封率和红细胞回收率较低,纳米载体药物体内靶向性差等问题,本发明的制备方法,操作方便,简单易懂,操作人员经过简单的培训,即可熟练掌握;操作简单,各个步骤还能够独立工作,提高本发明的可操作性。
8.为了解决上述技术问题,本发明采用了如下技术方案:
9.一种双载药红细胞载体其制备方法与应用,包括红细胞抽离和红细胞的分离纯化,所述红细胞抽离前置还有造血干细胞的采集,所述造血干细胞的采集包括供者筛选检测和采集。
10.优选的,所述供者筛选亲属供者无年龄限制,无关供者规定18-40岁。采集前应充分了解供者病史,必须的检査:hla-a、b、dr,混合淋巴细胞培养符合临床要求,abo和rh血型、感染性疾病的血清学检査等。采集前应对供者采集1300~1600ml自身外周血以备术中用。采集量控制在20~30ml/kg体重为宜,最低白细胞数量2xl58/kg,一般要采集3x158/kgml。
11.优选的,所述采集过程应保持无菌,穿刺点仅9~12个;而选择整个骼后上棘时则穿刺达到350-450个,但此时在每个穿刺点抽吸量应低于8ml,以最大限度地防止血液稀释。采集后血液需经200~300mm滤网滤过。采集的体积因受者的体重而有所不同,但是一般以供者体重计算为10~15ml/kg。有核细胞数的最低剂量以受者体重计算为2xl8/kg。采集的血液含有小粒与脂肪,直接输注有引起栓塞的危险,经过采集过程中过滤除去小粒后,将骨髓离心或放于4y让脂肪凝集后挤岀脂肪。
12.优选的,所述采集步骤为:
13.釆集前应选择血管弹性好、损伤小的四肢大血管,一般情况下行大静脉穿刺即可,外周静脉穿刺困难时需行中心静脉置管;
14.预先运转cs~3000plus血细胞分离机,体外血量为200~400ml左右,可能出现低血容量综合征的供者,在采集前予以300~300ml红细胞悬液以充盈分离管路;
15.处理血量与采集效率密切相关,采集过程至少要处理3倍的循环血量;
16.釆集效率,由于cd34+相对百分数量受到外周血白细胞总数的影响,常常难以准确的估计外周中hsc的准确数量。容量白细胞单釆是指采集时的循环血量大于3倍的体循环量或者不小于15l,它是近年来提高干细胞产率、减少采集次数的重要手段。对于多数供者,单采两次就可获得4x106/kgo
④
对于成人,血流速率为50~70ml/min,儿童的血流流速减慢;acd/全血的比率,成人的比率控制在1:(9~11),儿童保持在1:13以防止枸檄酸钠中毒;应用pro-count方法进行cd34+细胞绝对计数能够可靠预示自体外周干细胞的采集效果。
17.优选的,所述红细胞的分离纯化步骤为:
18.将血液与pbs按1:1比例稀释,将15mlficoll-hypague加入50ml离心管中,将30m1pbs稀释的血液缓慢地加到ficoll-hypague液面上明显可见一层细胞,即为单个核细胞层。用吸管吸出单个核细胞层转移到另一个离心管中,加入pbs,室温下1000r/min离心10mino倒掉上清液,用pbsa重悬细胞,室温下1000r/min离心lomin。
19.分离过程:加pbs洗涤,室温200g离心15min,加适量的缓冲液重悬细胞,根据mncs的细胞总数选择合适的分离柱类型,将柱子放入macs(吸附单克隆抗体-磁珠分离系统)分离仪的磁场中,加入缓冲液润洗柱子,用40|xm的尼龙滤网过滤细胞,去除细胞团,将细胞悬液加入柱子,用缓冲液将未结合的细胞洗去,将柱子从分离仪中移出,置于合适的管中,将柱子加满缓冲液。用柱子内塞加压,将结合的细胞冲洗出来,加pbs将cd34+细胞洗一遍,室温200g离心15min,用培养造血干细胞的imdm完全培养基重悬细胞。
20.扩增培养:用添加细胞因子的培养基重悬细胞,按2x154个/ml的细胞浓度将cd34+细胞接种到t25培养瓶中。每周两次半量换液。每108个mncs用终体积为300讪的缓冲液重
悬,每108个mncs悬液加入100,11fcr阻断剂,抑制cd34微珠非特异性结合或通过fc受体介导与非靶细胞结合。每108个mncs悬液加入100皿cd34微珠进行细胞标记,充分混匀后在6~12y冰箱放置30min。
21.优选的,所述红细胞的分离纯化后还有储存步骤,所述储存步骤有液氮冷冻和-80龙冰箱深低温冻存两种,两种储存方式分别为:
22.一种是利用液氟蒸气储存,温度为-194
‑‑
100t;另一种是储存于液氮-196龙中,应用dmso联合hes,lecchi等用10%二甲基亚砚和4%hes作为保护剂,釆用二步降温法进行程序降温保存红细胞载体:以1龙/min的速率从4龙降温至-45y,然后以5y/min的速率从-45y降温至-110t,转入液氮中保存,复苏后细胞存活率为81.4%~94.8%,cfu-gm回收率为66.1%。
[0023]-80龙冰箱深低温冻存,采用-80y或-70y冰箱作为非程控降温冷冻保存的制冷源及保存场所,样品的降温速率控制在l~3t/min,降温平台期控制在4min以内。程控降温、液氮保存的降温速率由计算机精密控制,保证了细胞在冻存过程中不会因为降温速率波动而引起细胞不稳定,降低了降温对细胞的损伤;-80龙冰箱深低温冻存不需要程序降温仪,省时省力,易于操作,红细胞载体浓度可用到4x108/mlo融化是冷冻过程的反过程,多主张采用快速融化,缩短细胞融化肿胀过程,同时还可避免再结晶及重新形成冰块。常釆用台盼蓝拒染检测、体外半同体集落培养及单克隆抗体检测等来测定红细胞载体冷冻保存效果。
[0024]
优选的,双载药红细胞载体的应用包括,载药方法是将药物包封进活态红细胞内,通过注射载有药物颗粒的红细胞注入患者体内,裂解红细胞释放药物颗粒,完成病情控制。通过静脉注射或者动脉血管插管的方式输注给患者;进入血液循环后,纳米颗粒由于剪切应力或与内皮细胞直接接触而解吸附,有效改善纳米载体药物肝脾摄取严重、体内靶向性差等问题,配合临床上使用的血管插管治疗方式,可大幅度提升纳米载体药物的器官靶向能力,将治疗药物靶向到循环红细胞在体外制备药物-抗体/多肽复合物,然后将这种复合物注入体内,靶向连接到循环红细胞上,能在一定程度上避免体外操作和重新输注引发的问题,还可用于清除体内的病原体。用红细胞表面抗原cr1的抗体-c3b和一种病原体的抗体共轭结合得到复合物-双特异性单克隆抗体复合物,该复合物可同时特异性结合红细胞表面抗原cr1和病原体;向实验动物注射模型病原体,继而注射该复合物,发现其可高效实现红细胞介导的病原体清除。
[0025]
本发明与现有技术相比,具有如下有益效果:
[0026]
本发明的一种双载药红细胞载体其制备方法与应用,红细胞具有循环周期长、易获得、比表面积和体积较大、生物相容性高、消除机制安全,包封率达到58.36%,红细胞回收率达到84.94%,本发明的制备方法适于将药物靶向到注射下游的第1处毛细血管富集器官,该方法可有效改善纳米载体药物肝脾摄取严重、体内靶向性差等问题,配合临床上使用的血管插管治疗方式,可大幅度提升纳米载体药物的器官靶向能力。
附图说明
[0027]
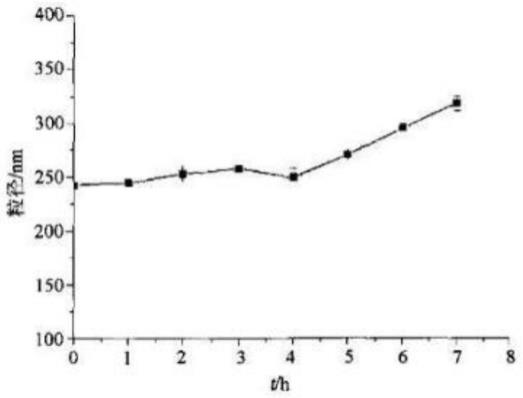
图1为本发明一种双载药红细胞载体其制备方法与应用实施例中纳米载体的稳定性的折线图;
[0028]
图2为本发明一种双载药红细胞载体其制备方法与应用实施例中红细胞膜与体积
的柱状图;
[0029]
图3为本发明一种双载药红细胞载体其制备方法与应用施例中载药红细胞图;
具体实施方式
[0030]
为了使本领域的技术人员可以更好地理解本发明,下面结合附图和实施例对本发明技术方案进一步说明。需要说明,本发明实施例中所有方向性指示(诸如上、下、左、右、前、后
……
)仅用于解释在某一特定姿态(如附图所示)下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
[0031]
另外,在本发明中涉及“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
[0032]
实施例
[0033]
如图1-3所示,一种双载药红细胞载体其制备方法与应用,包括红细胞抽离和红细胞的分离纯化,红细胞抽离前置还有造血干细胞的采集,造血干细胞的采集包括供者筛选检测和采集。
[0034]
供者筛选亲属供者无年龄限制,无关供者规定18-40岁。进一步说明,采集前应充分了解供者病史,必须的检査:hla-a、b、dr,混合淋巴细胞培养符合临床要求,abo和rh血型、感染性疾病的血清学检査等。采集前应对供者采集1300~1600ml自身外周血以备术中用。采集量控制在20~30ml/kg体重为宜,最低白细胞数量2xl58/kg,一般要采集3x158/kgml。
[0035]
采集过程应保持无菌,穿刺点仅9~12个;而选择整个骼后上棘时则穿刺达到350-450个,但此时在每个穿刺点抽吸量应低于8ml,以最大限度地防止血液稀释。进一步说明,采集后血液需经200~300mm滤网滤过。采集的体积因受者的体重而有所不同,但是一般以供者体重计算为10~15ml/kg。有核细胞数的最低剂量以受者体重计算为2xl8/kg。采集的血液含有小粒与脂肪,直接输注有引起栓塞的危险,经过采集过程中过滤除去小粒后,将骨髓离心或放于4y让脂肪凝集后挤岀脂肪。
[0036]
采集步骤为:
[0037]
釆集前应选择血管弹性好、损伤小的四肢大血管,一般情况下行大静脉穿刺即可,外周静脉穿刺困难时需行中心静脉置管;
[0038]
预先运转cs~3000plus血细胞分离机,体外血量为200~400ml左右,可能出现低血容量综合征的供者,在采集前予以300~300ml红细胞悬液以充盈分离管路;
[0039]
处理血量与采集效率密切相关,采集过程至少要处理3倍的循环血量;
[0040]
釆集效率,由于cd34+相对百分数量受到外周血白细胞总数的影响,常常难以准确的估计外周中hsc的准确数量。进一步说明,容量白细胞单釆是指采集时的循环血量大于3倍的体循环量或者不小于15l,它是近年来提高干细胞产率、减少采集次数的重要手段。对于多数供者,单采两次就可获得4x106/kgo
④
对于成人,血流速率为50~70ml/min,儿童的
血流流速减慢;acd/全血的比率,成人的比率控制在1:(9~11),儿童保持在1:13以防止枸檄酸钠中毒;应用pro-count方法进行cd34+细胞绝对计数能够可靠预示自体外周干细胞的采集效果。
[0041]
红细胞的分离纯化步骤为:
[0042]
将血液与pbs按1:1比例稀释,将15mlficoll-hypague加入50ml离心管中,将30m1pbs稀释的血液缓慢地加到ficoll-hypague液面上明显可见一层细胞,即为单个核细胞层。用吸管吸出单个核细胞层转移到另一个离心管中,加入pbs,室温下1000r/min离心10mino倒掉上清液,用pbsa重悬细胞,室温下1000r/min离心lomin。
[0043]
分离过程:加pbs洗涤,室温200g离心15min,加适量的缓冲液重悬细胞,根据mncs的细胞总数选择合适的分离柱类型,将柱子放入macs(吸附单克隆抗体-磁珠分离系统)分离仪的磁场中,加入缓冲液润洗柱子,用40|xm的尼龙滤网过滤细胞,去除细胞团,将细胞悬液加入柱子,用缓冲液将未结合的细胞洗去,将柱子从分离仪中移出,置于合适的管中,将柱子加满缓冲液。用柱子内塞加压,将结合的细胞冲洗出来,加pbs将cd34+细胞洗一遍,室温200g离心15min,用培养造血干细胞的imdm完全培养基重悬细胞。
[0044]
扩增培养:用添加细胞因子的培养基重悬细胞,按2x154个/ml的细胞浓度将cd34+细胞接种到t25培养瓶中。每周两次半量换液。进一步说明,每108个mncs用终体积为300讪的缓冲液重悬,每108个mncs悬液加入100,11fcr阻断剂,抑制cd34微珠非特异性结合或通过fc受体介导与非靶细胞结合。每108个mncs悬液加入100皿cd34微珠进行细胞标记,充分混匀后在6~12y冰箱放置30min。
[0045]
红细胞的分离纯化后还有储存步骤,储存步骤有液氮冷冻和-80龙冰箱深低温冻存两种,两种储存方式分别为:
[0046]
一种是利用液氟蒸气储存,温度为-194
‑‑
100t;另一种是储存于液氮-196龙中,应用dmso联合hes,lecchi等用10%二甲基亚砚和4%hes作为保护剂,釆用二步降温法进行程序降温保存红细胞载体:以1龙/min的速率从4龙降温至-45y,然后以5y/min的速率从-45y降温至-110t,转入液氮中保存,复苏后细胞存活率为81.4%~94.8%,cfu-gm回收率为66.1%。
[0047]-80龙冰箱深低温冻存,采用-80y或-70y冰箱作为非程控降温冷冻保存的制冷源及保存场所,样品的降温速率控制在l~3t/min,降温平台期控制在4min以内。进一步说明,程控降温、液氮保存的降温速率由计算机精密控制,保证了细胞在冻存过程中不会因为降温速率波动而引起细胞不稳定,降低了降温对细胞的损伤;-80龙冰箱深低温冻存不需要程序降温仪,省时省力,易于操作,红细胞载体浓度可用到4x108/mlo融化是冷冻过程的反过程,多主张采用快速融化,缩短细胞融化肿胀过程,同时还可避免再结晶及重新形成冰块。常釆用台盼蓝拒染检测、体外半同体集落培养及单克隆抗体检测等来测定红细胞载体冷冻保存效果。
[0048]
双载药红细胞载体的应用包括,载药方法是将药物包封进活态红细胞内,通过注射载有药物颗粒的红细胞注入患者体内,裂解红细胞释放药物颗粒,完成病情控制。进一步说明,通过静脉注射或者动脉血管插管的方式输注给患者;进入血液循环后,纳米颗粒由于剪切应力或与内皮细胞直接接触而解吸附,有效改善纳米载体药物肝脾摄取严重、体内靶向性差等问题,配合临床上使用的血管插管治疗方式,可大幅度提升纳米载体药物的器官
靶向能力,将治疗药物靶向到循环红细胞在体外制备药物-抗体/多肽复合物,然后将这种复合物注入体内,靶向连接到循环红细胞上,能在一定程度上避免体外操作和重新输注引发的问题,还可用于清除体内的病原体。用红细胞表面抗原cr1的抗体-c3b和一种病原体的抗体共轭结合得到复合物-双特异性单克隆抗体复合物,该复合物可同时特异性结合红细胞表面抗原cr1和病原体;向实验动物注射模型病原体,继而注射该复合物,发现其可高效实现红细胞介导的病原体清除。
[0049]
本实施例的优点在于:红细胞具有循环周期长、易获得、比表面积和体积较大、生物相容性高、消除机制安全,包封率达到58.36%,红细胞回收率达到84.94%,本发明的制备方法适于将药物靶向到注射下游的第1处毛细血管富集器官。该法可有效改善纳米载体药物肝脾摄取严重、体内靶向性差等问题,配合临床上使用的血管插管治疗方式,可大幅度提升纳米载体药物的器官靶向能力。
[0050]
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述,所属领域普通技术人员知晓申请日或者优先权日之前发明所属技术领域所有的普通技术知识,能够获知该领域中所有的现有技术,并且具有应用该日期之前常规实验手段的能力,所属领域普通技术人员可以在本技术给出的启示下,结合自身能力完善并实施本方案,一些典型的公知结构或者公知方法不应当成为所属领域普通技术人员实施本技术的障碍。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1