一种新型青蒿素类衍生物、脂质体的制备方法和应用
1.本发明属于中药制剂领域,具体涉及一种新型青蒿素类衍生物、脂质体的制备方法和抗 肿瘤作用。
背景技术:
2.在抗肿瘤应用中青蒿素及其衍生物与其他药物的机制具有很大不同,部分化疗药物是通 过干预肿瘤细胞核酸生物合成、破坏dna功能等途径来发挥抗肿瘤作用(参文献:房淼,王 德刚,刘培庆.天然药物抗肿瘤作用机制研究[j].食品与药品,2022,24(2):167-171;魏秋红,刘晓月, 王盼,张文锐.抗肿瘤药物的分类和药效学研究进展[j].医学综述,2020,26(18):3707-3711,3716; 徐焦,蒙凌华,卿晨.传统抗肿瘤药物的临床应用现状与发展[j].药学学报,2021,56(6):1551-156); 而青蒿素类药物是通过释放氧自由基ros,启动线粒体凋亡程序、合并细胞模结构的氧化损 伤产生抗肿瘤作(参考文献:zhou y,li w,xiao y.profiling of multiple targets of artemisininactivated by hemin incancer cell proteome[j].acs chem biol,2016,11:882
–
888;刘晴晴,杨振 华.青蒿素及其衍生物的抗肿瘤研究进展[j].生命科学,2020,32(1):62-69)。由于青蒿素类药 物独特的抗肿瘤机制,此类药物已成为极具吸引力的抗肿瘤候选药物,受到国际的广泛关注。 但青蒿素类药物存在溶解性不佳、生物利用度低和不具备肿瘤靶向性等问题,如此制约其抗 肿瘤药效的发挥。综上,提高青蒿素类药物的溶解性和靶向性是增加其抗肿瘤药效的关键。
[0003]
本发明以肿瘤细胞膜转运蛋白glut1为靶标,构建肿瘤靶向脂质体,实现了青蒿素类 药物的肿瘤靶向递送;并以三苯基膦线粒体靶向迁移为基础合成了青蒿素类线粒体靶向前药, 进一步实现脂质体的线粒体靶向递药。本发明通过肿瘤和肿瘤细胞线粒体双靶向药物递送, 提高了青蒿素类药物的抗肿瘤药效。
技术实现要素:
[0004]
针对现有技术中存在的问题,本发明的目的在于提供一种新型青蒿素类衍生物、脂质体 的制备方法和应用。青蒿素类衍生物进入肿瘤细胞后,他们共同的结构过氧桥基团会发生断 裂,产生大量的自由基,引起癌症细胞的氧化应激及线粒体功能损伤。基于此,本发明设计、 制备了一种具有肿瘤细胞及其线粒体双重靶向性的新型青蒿素类衍生物脂质体 tpp-ss-ats-ls。
[0005]
本发明的技术方案为:
[0006]
一种新型青蒿素类衍生物,其特征在于,所述新型青蒿素类衍生物的结构如下式所示:
[0007][0008]
一种新型青蒿素类衍生物脂质体的制备方法,其步骤包括:首先合成对谷胱甘肽gsh敏 感及具有线粒体靶向作用的青蒿素类衍生物tpp-ss-ats;然后采用薄膜分散法制备得到新型 青蒿素类衍生物脂质体tpp-ss-ats-ls。
[0009]
进一步的,所述新型青蒿素类衍生物脂质体的粒径呈正态分布,透射电镜下观察为规则 的圆球形。
[0010]
进一步的,合成青蒿素类衍生物tpp-ss-ats的方法为:
[0011]
(1)称取青蒿琥酯和2,2-二硫二乙醇溶于有机溶剂中,其中青蒿琥酯和2,2-二硫二乙醇 的用量比例为1:50至50:1,在-20至40℃下反应0.1-96小时,反应结束后使用旋转蒸发仪在 20-100℃回收有机溶剂,得到ss-ats粗品;以石油醚:乙酸乙酯溶液为流动相,采用硅胶柱 对中间体ss-ats粗品进行纯化,得到中间体ss-ats;
[0012]
(2)称取中间体ss-ats和4-羧丁基三苯基溴化膦tpp溶于有机溶剂中,其中中间体 ss-ats和4-羧丁基三苯基溴化膦tpp用量比例为1:50至50:1,在-20至40℃下反应0.1-96 小时,反应结束后使用旋转蒸发仪在20-100℃回收有机溶剂,得到tpp-ss-ats粗产物;以 二氯甲烷:甲醇溶液为流动相,采用硅胶柱对粗产物进行纯化,得到新型青蒿素类衍生物 tpp-ss-ats。
[0013]
进一步的,采用薄膜分散法制备新型青蒿素类衍生物脂质体tpp-ss-ats-ls的具体方法 为:将磷脂、烷基糖苷、新型青蒿素类衍生物tpp-ss-ats、胆固醇和二棕榈酰磷脂酰乙醇胺
ꢀ‑
甲氧基聚乙二醇2000dspe-peg2000溶解于有机溶剂中;然后将所得溶液转移到旋转蒸发 仪的蒸发瓶中,20-100℃减压浓缩至有机溶剂完全挥发,向旋转蒸发瓶中加入超纯水,20-80℃ 水合,水合时间0.1-3.0小时,然后依次通过超声震荡、微孔滤膜过滤,制得新型青蒿素类衍 生物脂质体tpp-ss-ats-ls。
[0014]
进一步的,磷脂的重量百分比为0.2-5.0%,胆固醇的重量百分比为0.01-0.5%,烷基糖苷 的重量百分比为0.2-3.0%,二棕榈酰磷脂酰乙醇胺-甲氧基聚乙二醇2000的重量百分比为 0.02-5.0%,新型青蒿素类衍生物tpp-ss-ats的重量百分比为0.02-3.0%,纯化水的重量百分 比为73.5-99.0%。
[0015]
进一步的,所述磷脂为大豆卵磷脂、蛋黄卵磷脂、氢化大豆卵磷脂和peg化磷脂中的一 种或几种。
[0016]
进一步的,所述烷基糖苷为每分子烷基葡萄糖苷中含有烷基碳数在2-30、葡萄糖分子片 段数在1-10的烷基葡萄糖苷中的一种或几种。
[0017]
进一步的,石油醚:乙酸乙酯的比例范围为10:1~2:1;二氯甲烷:甲醇的比例范围为 500:1~50:1;采用50~500目的硅胶柱进行纯化。
[0018]
一种新型青蒿素类衍生物脂质体在制备抗肿瘤药物中的应用。
[0019]
本发明选取青蒿琥酯作为原料合成了对谷胱甘肽gsh敏感和具有线粒体靶向作用的新 型青蒿素类衍生物tpp-ss-ats,通过核磁、质谱等方法确认其结构后,采用薄膜分散法制备 得到新型青蒿素类衍生物脂质体tpp-ss-ats-ls。
[0020]
一种新型青蒿素类衍生物脂质体tpp-ss-ats-ls的制备方法,其步骤包括:首先合成对 谷胱甘肽gsh敏感及具有线粒体靶向作用的青蒿素类衍生物tpp-ss-ats;然后采用薄膜分 散法制备得到新型青蒿素类衍生物脂质体tpp-ss-ats-ls。
[0021]
新型青蒿素类衍生物tpp-ss-ats的合成方法为:(1)称取青蒿琥酯和2,2-二硫二乙醇 溶于有机溶剂中,其中青蒿琥酯和2,2-二硫二乙醇的用量比例为1:50至50:1,在-20至40℃ 下反应0.1-96小时,反应结束后使用旋转蒸发仪在20-100℃回收有机溶剂,得到ss-ats粗 品;以石油醚:乙酸乙酯溶液为流动相,采用硅胶柱对中间体ss-ats粗品进行纯化,得到中 间体ss-ats。(2)称取中间体ss-ats和4-羧丁基三苯基溴化膦tpp溶于有机溶剂中,其 中中间体ss-ats和4-羧丁基三苯基溴化膦tpp用量比例为1:50至50:1,在-20至40℃下反 应0.1-96小时,反应结束后使用旋转蒸发仪在20-100℃回收有机溶剂,得到新型青蒿素类衍 生物tpp-ss-ats粗产物;以二氯甲烷:甲醇溶液为流动相,采用硅胶柱对粗产物进行纯化, 得到新型青蒿素类衍生物tpp-ss-ats。
[0022]
新型青蒿素类衍生物tpp-ss-ats的合成步骤(1)中纯化中间体ss-ats所用柱层析硅 胶的粒度在50-500目之间,的洗脱剂石油醚:乙酸乙酯的比例范围为10:1~2:1。
[0023]
新型青蒿素类衍生物tpp-ss-ats的合成步骤(2)中纯化中间体ss-ats所用柱层析硅 胶的粒度在100-500目之间,的洗脱剂二氯甲烷:甲醇的比例范围为500:1~50:1。
[0024]
采用薄膜分散法制备青蒿素类衍生物脂质体tpp-ss-ats-ls的具体方法为:(1)将磷 脂、烷基糖苷、新型青蒿素类衍生物tpp-ss-ats、胆固醇和二棕榈酰磷脂酰乙醇胺-甲氧基 聚乙二醇2000dspe-mpeg2000溶解于有机溶剂中;(2)然后将所得溶液转移到旋转蒸发 仪的蒸发瓶中,减压浓缩至有机溶剂完全挥发,向旋转蒸发瓶中加入超纯水,水合,然后依 次通过超声震荡、微孔滤膜过滤,制得新型青蒿素类衍生物脂质体tpp-ss-ats-ls。
[0025]
制备新型青蒿素类衍生物脂质体tpp-ss-ats-ls的步骤(1)和步骤(2)中所用辅料的 用量为(重量百分比):磷脂0.2-5.0%,胆固醇0.01-0.5%,烷基糖苷0.2-3.0%,二棕榈酰磷 脂酰乙醇胺-甲氧基聚乙二醇2000 0.02-5.0%,青蒿素类衍生物tpp-ss-ats,0.02-3.0%,纯 化水73.5-99.0%。
[0026]
制备新型青蒿素类衍生物脂质体tpp-ss-ats-ls的步骤(1)所用磷脂为:大豆卵磷脂、 蛋黄卵磷脂、氢化大豆卵磷脂和peg化磷脂的一种或几种。
[0027]
制备新型青蒿素类衍生物脂质体tpp-ss-ats-ls的步骤(2)所用烷基糖苷为:每分子 烷基葡萄糖苷中含有烷基碳数在2-30、葡萄糖分子片段数在1-10的烷基葡萄糖苷的一种或几 种。
[0028]
制备新型青蒿素类衍生物脂质体tpp-ss-ats-ls的步骤(2)中采用旋转蒸发仪减压去 除有机溶剂的温度为20-100℃;脂质体水合温度为20-80℃,水合时间为0.1-3.0小时。
[0029]
本发明的优点如下:
[0030]
(1)本发合成的新型青蒿素类衍生物tpp-ss-ats,结构中具有三苯基膦结构片段,该 衍生物可以利用三苯基膦的线粒体靶向性,实现药物的线粒体靶向递送,提高线粒体杀
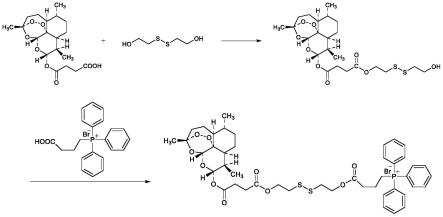
伤能 力,从而增强青蒿素类药物的抗肿瘤性能。
[0031]
(2)本发明制备的脂质体新型青蒿素类衍生物脂质体tpp-ss-ats-ls可实现对肿瘤组 织和肿瘤细胞线粒体的双靶向药物递送,显著提高了青蒿素类药物的抗肿瘤药效。
[0032]
(3)本发明采用两步缩合酯化反应合成tpp-ss-ats,无需加热,反应速快,原料成本 低廉,合成工艺成熟。
[0033]
(4)本发明选用常规辅料进行脂质体tpp-ss-ats-ls制备,工艺简单,能耗低,可有 效控制生产成本。
[0034]
(5)本发明制备的脂质体tpp-ss-ats-ls制剂学特性优异,生物安全性高。
附图说明
[0035]
图1为新型青蒿素类衍生物tpp-ss-ats的合成路线图。
[0036]
图2为中间体ss-ats的化学结构图。
[0037]
图3中间体ss-ats的质谱图。
[0038]
图4为中间体ss-ats的核磁共振氢谱图。
[0039]
图5为新型青蒿素类衍生物tpp-ss-ats的化学结构图。
[0040]
图6为新型青蒿素类衍生物tpp-ss-ats的质谱图。
[0041]
图7为新型青蒿素类衍生物tpp-ss-ats的核磁共振氢谱图。
[0042]
图8为新型青蒿素类衍生物tpp-ss-ats的核磁共振碳谱图。
[0043]
图9为新型青蒿素类衍生物tpp-ss-ats的核磁共振hsqc谱图。
[0044]
图10为青蒿素类衍生物tpp-ss-ats的化学结构及核磁共振hmbc相关信号图;
[0045]
(a)tpp-ss-ats的化学结构;
[0046]
(b)tpp-ss-ats的核磁共振hmbc相关信号图。
[0047]
图11为脂质体tpp-ss-ats-ls的粒径分布图。
[0048]
图12为脂质体tpp-ss-ats-ls的透射电子显微镜图。
[0049]
图13为脂质体tpp-ss-ats-ls和空白脂质体blank ls的差示扫描量热曲线图。
[0050]
图14为脂质体tpp-ss-ats-ls的稳定性数据图;
[0051]
(a)tpp-ss-ats-ls的粒径和多分散性系数;
[0052]
(b)tpp-ss-ats-ls的包封率和电动电位(zeta电位)。
[0053]
图15为脂质体tpp-ss-ats-ls的线粒体靶向成像图。
[0054]
图16为脂质体tpp-ss-ats-ls的肿瘤靶向活体成像图。
[0055]
图17为脂质体tpp-ss-ats-ls对三种乳腺癌细胞的体外抗癌活性评估结果图。
[0056]
图18为在体抗肿瘤实验给药方案示意图。
[0057]
图19为药物的抗乳腺癌作用效果图(a:各给药组小鼠的肿瘤外观;b:药物对肿瘤重 量的影响;c:实验期间各组小鼠的体重)。
[0058]
图20为给药后小鼠脏器组织的病理学分析(h&e染色)图。
[0059]
图21为给药后小鼠的血常规及肝肾功能指标检测结果图(a:血常规生化指标;b:肝 肾功能血生化指标)。
具体实施方式
[0060]
下面结合附图对本发明进行进一步详细描述,所举实例只用于解释本发明,并非用于限 定本发明的范围。
[0061]
一、青蒿素类衍生物的合成和结构鉴定
[0062]
1.中间体ss-ats的合成
[0063]
称取5g青蒿琥酯、3.6g二环己基碳二亚胺dcc溶于500ml二氯甲烷,350rpm室温下 搅拌1h,促使三者完全溶解;添加3g 2,2-二硫二乙醇heds、0.5g对二甲氨基吡啶dmap 至二氯甲烷溶液中,350rpm室温下搅拌反应3h(图1);反应结束后,使用旋转蒸发仪在 35℃条件下回收二氯甲烷,即得到中间体ss-ats粗品。以石油醚:乙酸乙酯(10:1~2:1)为流动 相,采用硅胶(200~300目)柱进行纯化,得到中间体ss-ats。采用质谱ms和核磁共振光谱 nmr确定其结构。
[0064]
2.新型青蒿素类衍生物tpp-ss-ats的合成
[0065]
称取1.6g中间体ss-ats偶联物、3.2g 1-乙基-3(3-二甲基丙胺)碳二亚胺edci溶于50ml 二氯甲烷,350rpm室温下搅拌1h,完全溶解得到澄清溶液后将3.2g 4-羧丁基三苯基溴化膦 tpp、0.6g对二甲氨基吡啶dmap加入到二氯甲烷溶液中,350rpm室温下搅拌,继反应 12h(图1);反应结束后,使用旋转蒸发仪在35℃下减压回收二氯甲烷,得到tpp-ss-ats 粗产物。以二氯甲烷:甲醇(500:1~50:1)为流动相,采用硅胶(200~300目)柱进行纯化,得到青 蒿素类衍生物tpp-ss-ats。测定产物的一维,二维核磁共振光谱和分子量数据,从而确定其 化学结构。
[0066]
3.中间体ss-ats和新型青蒿素类衍生物tpp-ss-ats的结构鉴定
[0067]
(1)中间体ss-ats的结构鉴定
[0068]
ss-ats偶联物为油状物,质谱数据显示其准分子离子峰m/z:559.1[m+k]
+
,结合nmr 光谱分析确定该化合物的分子式为c
23h36
o9s2(图2,图3)。1h nmr(600mhz,cdcl3) 显示了ss-ats偶联物的特征质子信号:δ
h 2.37(1h,brt,j=13.5hz,h-4α),2.03(1h,brd,j=14.5, h-4β),1.43-1.52(1h,m,h-5α),1.88-1.94(1h,overlapped,h-5β),1.27-1.30(1h,m,h-5a), 1.34-1.36(1h,m,h-6),0.96-1.05(1h,m,h-7α),1.72(1h,overlapped,h-7β),1.36-1.38(1h, overlapped,h-8α),1.78(1h,brd,j=13.3hz,h-8β),1.62(1h,br d,j=13.9hz,h-8a),2.53-2.59 (1h,m,h-9),5.78(1h,d,j=9.8hz,h-10),5.44(1h,s,h-12),1.43(3h,s,h-14),0.96(3h,d, j=5.0hz,h-15),0.86(3h,d,j=6.6hz,h-16)。上述1h nmr和ms谱图提示ss-ats被成功合 成(图4)。
[0069]
(2)新型青蒿素类衍生物tpp-ss-ats的结构鉴定
[0070]
tpp-ss-ats偶联物为白色无定形固体,质谱数据显示其准分子离子峰m/z:851.4 [m-br]
+
,结合nmr光谱分析确定该化合物的分子式为c
45h56
bro
10
ps2(图5,6)。1h nmr (600mhz,cdcl3)和hsqc谱(图7,9)显示青蒿琥酯结构片段的特征质子信号:δ
h 2.37 (1h,td,j=14.0,3.8hz,h-4α),2.03(1h,dt,j=14.5,3.8hz,h-4β),1.43-1.52(1h,m,h-5α), 1.87-1.92(1h,m,h-5β),1.27-1.30(1h,m,h-5a),1.33-1.34(1h,m,h-6),0.96-1.07(1h,m, h-7α),1.72(1h,dd,j=13.4,3.0hz,h-7β),1.37(1h,dd,j=13.5,3.3hz,h-8α),1.78(1h,dd, j=13.6,3.6hz,h-8β),1.62(1h,dt,j=13.7,4.4hz,h-8a),2.54-2.56(1h,m,h-9),5.78(1h,d, j=9.8hz,h-10),5.31(1h,s,h-12),1.41(3h,s,h-14),0.96(3h,d,j=6.1hz,
h-15),0.85(3h,d, j=7.1hz,h-16);2,2-二硫二乙醇结构片段的特征质子信号:δ
h 4.32(4h,dd,j=15.9,6.6hz, h-2
′
and 7
′
)及2.90-2.91(4h,m,h-3
′
and 6
′
);4-羧丁基三苯基溴化膦结构片段的特征质子信 号:δh 2.92-2.94(2h,m,h-b),1.93-1.99(2h,m,h-c),4.00-4.05(2h,m,h-d)及7.70-7.90(15h, m,h-tpp芳烃质子)。
[0071]
13
c nmr(150mhz,cdcl3)谱(图8)的特征信号如下:δ
c 171.1(c-17,青蒿琥酯结 构片段的酯羰基),171.9(c-20,青蒿琥酯结构片段的酯羰基),62.5and 62.6(c-2
′
or c-7
′
),36.9 及37.0(c-3
′
or c-6
′
),172.9(c-a),117.9-135.1(c-f,三苯基膦结构片段的芳香碳)(图9)。在 hmbc谱(图10)中,δ
h 4.32(h-2
′
)与δ
c 171.9(c-20)的远程相关信号,确定了与青蒿琥酯 结构片段的c-20连接在4-羧丁基三苯基溴化膦结构片段的c-2
′
位置;δ
h 4.32(h-7
′
)与δ
c 172.9 (c-a),δ
h 1.93-1.99(h-c)与δ
c 172.9(c-a)的远程相关信号,确认了2,2-二硫二乙醇结构片段 的c-7
′
连接在4-羧丁基三苯基溴化膦结构片段的c-a位置。上述光谱特征显示新型青蒿琥酯 衍生物tpp-ss-ats已被成功合成。
[0072]
二、脂质体的制备
[0073]
1.脂质体tpp-ss-ats-ls的制备
[0074]
本发明新型青蒿素类衍生物脂质体及其制备方法如图1所示,采用薄膜分散法制备青蒿 素类衍生物脂质体,具体方法如下(各辅料和药物的总重量为100%):将重量占比为1.43% 的大豆卵磷脂、重量占比为0.14%的n-辛基-β-d-吡喃葡萄糖苷、重量占比为0.19%的青蒿素 类衍生物tpp-ss-ats、重量占比为0.07%的胆固醇和重量占比为0.17%的二棕榈酰磷脂酰乙 醇胺-甲氧基聚乙二醇2000(dspe-mpeg2000)溶解于20ml二氯甲烷中,将溶液转移到旋 转蒸发仪瓶中,40℃条件下减压浓缩至二氯甲烷完全挥发,向旋转蒸发仪瓶中加入重量占比 为98%的超纯水,于40℃、150rpm条件下水合25min,然后在250w功率下超声震荡3min, 经0.22μm微孔滤膜过滤,制得青蒿素类衍生物脂质体tpp-ss-ats-ls,外观为半透明状液 体,呈浅蓝色乳光。
[0075]
2.空白脂质体的制备
[0076]
空白脂质体的制备方法与脂质体tpp-ss-ats-ls基本相同。两者唯一的区别在于空白脂 质体处方中不含有新型青蒿素类衍生物tpp-ss-ats。
[0077]
三、脂质体tpp-ss-ats-ls的制剂学评价
[0078]
1.脂质体tpp-ss-ats-ls粒径、zeta电位分布、pdi粒径分散系数测定
[0079]
(1)实验方法
[0080]
取适量脂质体tpp-ss-ats-ls样品置于测试皿中,采用malvern zetasizer nano zs纳米 粒度仪测定脂质体粒径、zeta电位分布及多分散性系数pdi。测定方法:测试温度25℃,测 试次数3次,取数据的平均值进行结果分析。
[0081]
(2)实验结果
[0082]
脂质体tpp-ss-ats-ls的粒径呈正态分布(图11),测得其平均粒径为87.60
±
1.65nm, zeta电位及pdi多分散系数分别为31.4
±
1.7mv,0.241
±
0.013;空白脂质体的粒径、zeta电 位及pdi分别为94.83
±
0.71nm,-36.9
±
1.2mv,0.200
±
0.008(表1)。
[0083]
表1为脂质体的zeta电位、粒径、多分散性系数pdi和包封率
rsd%分别为1.60%和0.96%;且在稳定性研究中,脂质体tpp-ss-ats-ls的zeta电位始终 大于26mv,说明脂质体tpp-ss-ats-ls在4℃条件下具有良好的稳定性(图14,a:粒径 大小,pdi;b:包封率,zeta电位)。
[0107]
四、脂质体tpp-ss-ats-ls的靶向性评价
[0108]
1.线粒体靶向性评价
[0109]
(1)实验方法
[0110]
将mda-mb-231细胞接种96孔培养皿中,细胞密度为2000个细胞/孔,培养12h;随后 使用线粒体红色荧光探针(mito tracker red cmxros)对线粒体进行染色,用2'-[4-乙氧基苯 基]-5-[4-甲基-1-哌嗪基]-2,5'-bi-1h-苯并咪唑三盐酸化物三水合物(hoechst 33342蓝色荧光探 针)对细胞核进行染色。用pbs洗涤后,加入荧光素peg磷脂标记的脂质体 fitc-tpp-ss-ats-ls(绿色荧光)。用pe perkin elmer operetta clstm(美国perkinlemer) 连续监测细胞48小时,观察线粒体靶向情况。
[0111]
(2)实验结果
[0112]
使用高内涵成像系统监测脂质体tpp-ss-ats-ls的线粒体靶向定为情况,实验过程中, 在给药后的第6小时,荧光标记脂质体tpp-ss-ats-ls在线粒体中被发现(图15),随后荧 光标记的脂质体tpp-ss-ats-ls逐渐在线粒体内积累;相关结果表明tpp-ss-ats-ls具有线 粒体靶向性。
[0113]
2.在体肿瘤靶向性评价
[0114]
(1)实验方法
[0115]
将荷瘤鼠腋窝肿瘤组织的4t1细胞,生理盐水清洗后重悬,调整密度为1
×
107个/ml,给 小接种0.2ml细胞悬液,肿瘤模型建立后腹腔注射1,1-二十八烷基-3,3,3,3-四甲基吲哚菁碘化 物dir标记的脂质体tpp-ss-ats-ls。在注射药物后第4、8、12、24、36、48、60、72、96、 120、144和168h,将小鼠用异氟烷进行麻醉,使用ivis lumina iii成像系统(美国perkinlemer) 检测荧光标记脂质体在体内的分布情况前。
[0116]
(2)实验结果
[0117]
活体成像的研究结果表明脂质体tpp-ss-ats-ls具有良好的肿瘤靶向性,如图16所示。 在本研究中,以腹腔注射方式将脂质体tpp-ss-ats-ls注射到肿瘤模型动物体内,肿瘤部位 的荧光强度随时间逐渐增加,而给药部位(腹腔)的荧光强度逐渐减弱(图16)。肿瘤部位 的荧光信号强度在给药后24-60小时达到最高水平,然后逐渐降低。采用腹腔注射方式,脂 质体tpp-ss-ats-ls靶向肿瘤组织的可能过程如下:给药后,脂质体通过腹膜中的毛细血管 和淋巴管进入体循环,然后脂质体逐渐被肿瘤组织捕获,达到肿瘤靶向递送的效果。
[0118]
五、脂质体tpp-ss-ats-ls的药效及安全性评价
[0119]
1.cck-8法检测药物对各种乳腺癌细胞的细胞毒作用
[0120]
(1)实验方法
[0121]
1)铺板:观察细胞状态,待细胞贴壁长到90%时消化,使用计数板细胞计数后按 3000-5000/孔细胞密度接种于96孔板中,37℃5%co2培养箱中培养24h。
[0122]
2)加药:显微镜下观察到细胞密度约为60%-70%时开始给药,组别为空白脂质体blank-ls 组、新型青蒿素类衍生物脂质体tpp-ss-ats-ls组、青蒿素类衍生物tpp-ss-ats
组和青蒿 琥酯原药ats组。加药浓度均设置为2.5μm-160μm。
[0123]
3)加入cck-8:加药12h、24h、48h后分别观察细胞状态,96孔板中加入cck-8放入 培养箱中继续孵育2h。
[0124]
4)检测:使用酶标仪450nm处测定od值,并计算存活率。
[0125]
(2)实验结果
[0126]
药物对乳腺癌细胞活力的影响如图17显示,脂质体tpp-ss-ats-ls、tpp-ss-ats、ats 分别给药12h、24h、48h后,均能抑制乳腺癌细胞的细胞活力,且呈剂量依赖性。脂质体 tpp-ss-ats-ls和tpp-ss-ats具有相似的抑制作用,都能明显抑制不同类型乳腺癌细胞的 生长,同一浓度条件下从20μm开始,与原药ats相比,脂质体tpp-ss-ats-ls抗肿瘤作用 更为明显。脂质体tpp-ss-ats-ls的ic50值为17.69μm(4t1细胞,48h)~67.48μm(mcf-7 细胞,12h);ats的ic50值为33.50μm(4t1细胞,48h)~797.5μm(mcf-7细胞,12h)。
[0127]
2.脂质体的在体抗肿瘤活性评价
[0128]
(1)实验方法
[0129]
将荷瘤鼠腋窝肿瘤组织的4t1细胞,生理盐水清洗后重悬,调整密度为1
×
107个/ml,给 小鼠接种0.2ml细胞悬液。荷瘤小鼠随机分为六组,分别为对照组、ats低剂量组、ats高 剂量组、脂质体tpp-ss-ats-ls低剂量组、脂质体tpp-ss-ats-ls高剂量组、吉西他滨(gem) 阳性对照组。低剂量及高剂量组药物剂量均为15mg/kg或30mg/kg,从接种第4天开始腹腔 注射,每两天注射一次;gem组药物剂量为30mg/kg,每4天注射一次;对照组小鼠给予生 理盐水。给药方案如图18。
[0130]
取材及抑瘤率计算:在取材前称量小鼠体重,小鼠安乐死后将其仰卧位固定于鼠板,解 剖取心、肝、肾、脾、脑以及肿瘤组织,并记录重量;根据以下公式计算乳腺癌小鼠肿瘤生 长抑制率tgi:
[0131][0132]
其中“t”表示实验组肿瘤组织的平均质量,“c”表示对照组肿瘤组织的平均质量。
[0133]
(2)实验结果
[0134]
本发明通过记录小鼠体重随干预时间的变化及取材后各组小鼠的瘤重情况,评价脂质体 tpp-ss-ats-ls对4t1乳腺癌荷瘤小鼠的抗癌效果。结果显示与模型组相比,青蒿琥酯原药 低、高剂量组的乳腺癌肿瘤组织重量明显减少;而脂质体tpp-ss-ats-ls低、高剂量组的瘤 重减小更多;相同给药浓度30mg/kg条件下青蒿琥酯原药的肿瘤生长抑制率(tgi)为37.7%, 而同等剂量的脂质体tpp-ss-ats-ls组肿瘤生长抑制率(tgi)接近56.4%。与模型组相比, 吉西他滨组肿瘤重量最低,脂质体tpp-ss-ats-ls高剂量组与之接近。各给药组对荷瘤小鼠 的体重影响不大(图19)。
[0135]
3.青蒿素类衍生物新型脂质体的安全性评价
[0136]
本发明进一步研究了脂质体tpp-ss-ats-ls对其他非肿瘤器官的器质性毒性,药物干预 后,取小鼠心、肝、肾、脾、脑组织进行病理分析,同时检测小鼠的血常规及肝肾功能生化 指标。
[0137]
(1)病理分析
[0138]
1)实验方法
[0139]
为评价脂质体tpp-ss-ats-ls的安全性,本发明对给药后小鼠的主要组织器官(心、肝、 肾、脾、脑)进行病理分析。病理切片制作的主要步骤如下:10%福尔马林组织固定、石蜡 包埋,切片和h&e染色(苏木精-伊红染色法)等;病理切片制作完成后在显微镜下观察并 拍照保存。
[0140]
2)实验结果
[0141]
病理组织切片观察发现,脂质体tpp-ss-ats-ls治疗组小鼠的心、肝、脾、肾和脑组织 与生理盐水组相似,未见由脂质体引起的病理改变,结果如图20所示:(1)心脏:空白对 照组、模型组及各给药组心肌细胞形态结构均正常,心肌纤维细胞排列整齐规则,横线清晰, 细胞膜完整,染色均匀。(2)肝脏:吉西他滨gem组肝细胞空泡变性较为明显,其余给药 组肝脏组织病理变化与模型组相似,说明脂质体tpp-ss-ats-ls及青蒿琥酯ats不会加重模 型小鼠的肝脏损伤。
[0142]
(3)肾脏:空白组、模型组及各给药组小鼠肾小管上皮细胞整齐排列,系膜基质分布未 见增多,肾小球结构清晰、大小均匀。(4)脾脏:空白组、模型组及各给药组脾脏皮质与髓 质连接明显,白髓和红髓中有密集分布的淋巴细胞,显示脾脏未受影响。(5)脑:各组小鼠 脑组织神经元细胞和胶质细胞排列紧密,无细胞肿胀。以上结果分析均提示脂质体 tpp-ss-ats-ls对小鼠各器官均无明显毒性。
[0143]
(2)血液生化分析
[0144]
1)实验方法
[0145]
将收集的血液4℃静置过夜,3500rpm室温离心15min后吸取上清,采用自动生化仪检 测小鼠血常规指标血白细胞wbc、红细胞rbc、血小板plt、血红蛋白hgb、血细胞比容 hct、平均血小板体积mpv、平均血红蛋白量mch、平均红细胞体积mcv、血小板分布宽 度pdw以及肝肾功能指标血肌酐crea,血尿素氮bun、丙氨酸转氨酶alt、天冬氨酸转 氨酶ast、碱性磷酸酶alp水平。
[0146]
2)实验结果
[0147]
血常规检测结果如图20显示,与模型组相比,药物干预组各项指标均为正常,两组间比 较差异无统计学意义(p>0.05),提示脂质体tpp-ss-ats-ls干预对小鼠并未造成明显损伤 及炎症。肝肾功能血液生化指标显示与模型组相比,各治疗组无显著差异,数据无统计学差 异(p>0.05),说明脂质体tpp-ss-ats-ls对小鼠肝、肾功能无明显影响(图21)。说明 脂质体tpp-ss-ats-ls具有安全低毒的优势。
[0148]
六、数据统计学分析
[0149]
实验结果采用均数
±
标准差(mean
±
sd)表示,采用graphpad prism软件,用单因素方 差分析进行总体及两组间比较分析,若方差不齐使用dunnett检验。p《0.05表明差异具有统 计学意义。
[0150]
新型青蒿素类衍生物脂质体抗乳腺癌作用如图18~图21所示。
[0151]
尽管为说明目的公开了本发明的具体实施例,其目的在于帮助理解本发明的内容并据以 实施,本领域的技术人员可以理解:在不脱离本发明及所附的权利要求的精神和范围内,各 种替换、变化和修改都是可能的。因此,本发明不应局限于最佳实施例所公开的内容,本发 明要求保护的范围以权利要求书界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1