一种酵母优化的工艺制备方法与流程
1.本发明属于优化酵母技术领域,具体涉及一种酵母优化的工艺制备方法。
背景技术:
2.大肠杆菌表达出来的蛋白质没有经过修饰,不一定具有天然的活性,且表达系统无法对表达时间以及表达水平进行调控,过量表达可能导致非生理反应,目前蛋白常以包涵体形式表达,导致纯化困难,使得整个制备方法操作流程复杂,表达产物产量低,为此我们提出一种酵母优化的工艺制备方法。
技术实现要素:
3.本发明的目的在于提供一种酵母优化的工艺制备方法,以解决上述背景技术中提出的问题。
4.为实现上述目的,本发明提供如下技术方案:一种酵母优化的工艺制备方法,包括,
5.构建载体:对目的基因信号肽预测,去除信号肽序列,根据毕赤酵母表达系统进行密码子优化,基因合成至ppiczαa;目的基因信号肽预测采用signalp 4.0和signalp5.1预测;
6.在对毕赤酵母表达系统进行密码子优化时,避开saci酶切位点;
7.当基因合成至ppiczαa时,目的基因紧挨着载体α-factor,c端带上6
×
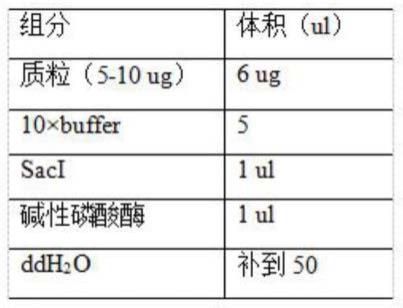
his。
8.优选的,将毕赤酵母通过电转化成质粒状;
9.优选的,将目的载体线性化;
10.其中,将目的载体线性化包括如下步骤:
11.(1)按下表配制载体酶切体系:
12.组分体积(ul)质粒(5-10ug)6ug10
×
buffer5saci1ul碱性磷酸酶1ulddh2o补到50
13.(2)37℃酶切过夜;
14.(3)琼脂糖凝胶电泳检测,以未酶切的质粒作为对照;
15.(4)检测酶切成功后,65℃ 20min灭活。
16.优选的,将线性化载体纯化回收;
17.其中,将线性化载体纯化回收;包括以下步骤:
18.(1)按下表配置载体纯化体系:
19.组分体积(ul)
酶切产物50核酸助沉剂103m naac,ph=5.26无水乙醇165
20.(2)-20℃静置35min以上;
21.(3)4℃12000rpm离心15min,弃上清,此时可以观察到壁上有白色沉淀;
22.(4)加入400ul预冷的80%乙醇重悬沉淀;
23.(5)4℃12000rpm离心10min,弃上清,开盖干燥;
24.(6)加入10ulddh2o溶解沉淀。
25.优选的,制备酵母电转感受态;
26.其中,制备酵母电转感受态,包括以下步骤:
27.第一天:
28.(1)50ml离心管中加入5mlypd,接入x-33菌株,30℃过夜培养;
29.第二天:
30.(2)10-12h后,转移50ul菌液至50mlypd的250ml锥形瓶中,过夜培养至od600=1.3-1.5;
31.第三天:
32.(3)4℃4000rpm离心5min,用10mlbuffera重悬,30℃水浴15min,加入预冷的灭菌水至50ml;
33.buffera:20mlypd+2ml2mhepes(ph=8.0,过滤灭菌)+0.5ml1mdtt(过滤灭菌);
34.(4)4℃4000rpm离心5min,用50ml预冷的无菌水(含0.3ml2mhepes,ph=8.0)重悬;
35.(5)4℃4000rpm离心5min,用4ml预冷的1msorbitol重悬;
36.(6)4℃4000rpm离心5min,用100ul预冷的1msorbitol重悬,此时菌液呈粘稠状,80ul/管分装,至于冰上。
37.优选的,通过线性化载体电转酵母;
38.其中,通过线性化载体电转酵母包括以下步骤:
39.(1)取80ul感受态细胞,加入6ug线性化ppiczαa-gene,混匀后转移到预冷的0.2cm电击杯中;
40.(2)冰上放置5min;
41.(3)根据对酵母电击参数设置(1.5kv,25uf,200ω),电击;
42.(4)立即加入2ml预冷的1m sorbitol+hepes(10ml 1m sorbitol+100ul 2m hepes,ph=8.0),转移至2ml无菌离心管中;
43.(5)30℃静置孵育1-2h;
44.(6)分别稀释5倍、10倍、100倍后300ul/板涂布于15cm含有100mg/lzeocin的ypd平板上,30℃培养至长出克隆。
45.优选的,将转化子进行筛选;
46.其中,将转化子进行筛选包括以下步骤:
47.(1)从平板上随机挑选24个克隆,进行菌落pcr;(菌落pcr使用的是本公司自主研发的一款快速扩增酵母克隆试剂盒,货号:ry8001);
48.(2)选择其中2个进行测序,比对正确后保留7个克隆待用。
49.优选的,转化子表达小试;
50.其中,转化子表达小试包括以下步骤:
51.(1)准备7个50ml锥形瓶,分别加入5mlypg培养基,分别接入上述验证正确的克隆,30℃220rpm培养1-2天至菌液饱和;
52.ypg培养基:1%酵母提取物,2%蛋白胨,1%甘油;
53.(2)转移到50ml离心管中,4000rpm离心5min,弃上清;
54.(3)用5mlbmmy培养基重悬菌体,转移至新的无菌的50ml锥形瓶中,加入甲醇至终浓度为0.5%,28℃220rpm培养6d;
55.bmmy培养基:1%酵母提取物,2%蛋白胨,1.34%酵母氮源,100mmpbs缓冲液(ph=5.7);
56.(4)每隔24h加一次甲醇(终浓度为0.5%);
57.(5)第6d上午收集菌液,4000rpm离心5min,收集上清,用于表达鉴定。
58.优选的,转化子扩大表达。
59.其中,转化子扩大表达包括以下步骤:
60.(1)250ml锥形瓶中加入50mlypg培养基,接入最优表达转化子,30℃220rpm培养1-2天至菌液饱和;
61.(2)转移到50ml离心管中,4000rpm离心5min,弃上清;
62.(3)用50mlbmmy培养基重悬菌体,转移至新的无菌的250ml锥形瓶中,加入甲醇至终浓度为0.5%,28℃220rpm培养6d;
63.(4)每隔24h加一次甲醇(终浓度为0.5%);
64.(6)第6d上午收集菌液,4000rpm离心5min,收集上清,用于表达鉴定。
65.与现有技术相比,本发明的有益效果是:
66.本发明通过酵母表达克服大肠杆菌表达系统的不足,能繁殖快,高密度发酵,可以对蛋白质进行翻译后的修饰和加工。其次,目的蛋白分泌到培养基中,后续纯化过程大大简便。最后,适合真核生物的蛋白表达,人表皮生长因子为真核蛋白,酵母表达能提高产量,降低成本。
附图说明
67.图1为本发明的载体酶切体系配料表示意图;
68.图2为本发明的载体纯化体系配料表示意图;
具体实施方式
69.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
70.请参阅图1、图2,本发明提供一种技术方案:
71.一种酵母优化的工艺制备方法,包括,
72.构建载体:对目的基因信号肽预测,去除信号肽序列,根据毕赤酵母表达系统进行密码子优化,基因合成至ppicz αa;目的基因信号肽预测采用signalp 4.0和signalp5.1预测;
73.在对毕赤酵母表达系统进行密码子优化时,避开saci酶切位点;
74.当基因合成至ppicz αa时,目的基因紧挨着载体α-factor,c端带上6
×
his。
75.本实施例中,优选的,将毕赤酵母通过电转化成质粒状;
76.本实施例中,优选的,将目的载体线性化;
77.其中,将目的载体线性化包括如下步骤:
78.(1)按下表配制载体酶切体系:
79.组分体积(ul)质粒(5-10ug)6ug10
×
buffer5saci1ul碱性磷酸酶1ulddh2o补到50
80.(2)37℃酶切过夜;
81.(3)琼脂糖凝胶电泳检测,以未酶切的质粒作为对照;
82.(4)检测酶切成功后,65℃ 20min灭活。
83.本实施例中,优选的,将线性化载体纯化回收;
84.其中,将线性化载体纯化回收;包括以下步骤:
85.(1)按下表配置载体纯化体系:
86.组分体积(ul)酶切产物50核酸助沉剂103m naac,ph=5.26无水乙醇165
87.(2)-20℃静置35min以上;
88.(3)4℃12000rpm离心15min,弃上清,此时可以观察到壁上有白色沉淀;
89.(4)加入400ul预冷的80%乙醇重悬沉淀;
90.(5)4℃12000rpm离心10min,弃上清,开盖干燥;
91.(6)加入10ulddh2o溶解沉淀。
92.本实施例中,优选的,制备酵母电转感受态;
93.其中,制备酵母电转感受态,包括以下步骤:
94.第一天:
95.(1)50ml离心管中加入5mlypd,接入x-33菌株,30℃过夜培养;
96.第二天:
97.(2)10-12h后,转移50ul菌液至50mlypd的250ml锥形瓶中,过夜培养至od600=1.3-1.5;
98.第三天:
99.(3)4℃4000rpm离心5min,用10mlbuffera重悬,30℃水浴15min,加入预冷的灭菌水至50ml;
100.buffera:20mlypd+2ml2mhepes(ph=8.0,过滤灭菌)+0.5ml1mdtt(过滤灭菌);
101.(4)4℃4000rpm离心5min,用50ml预冷的无菌水(含0.3ml2mhepes,ph=8.0)重悬;
102.(5)4℃4000rpm离心5min,用4ml预冷的1msorbitol重悬;
103.(6)4℃4000rpm离心5min,用100ul预冷的1msorbitol重悬,此时菌液呈粘稠状,80ul/管分装,至于冰上。
104.本实施例中,优选的,通过线性化载体电转酵母;
105.其中,通过线性化载体电转酵母包括以下步骤:
106.(1)取80ul感受态细胞,加入6ug线性化ppiczαa-gene,混匀后转移到预冷的0.2cm电击杯中;
107.(2)冰上放置5min;
108.(3)根据对酵母电击参数设置(1.5kv,25uf,200ω),电击;
109.(4)立即加入2ml预冷的1m sorbitol+hepes(10ml 1m sorbitol+100ul 2m hepes,ph=8.0),转移至2ml无菌离心管中;
110.(5)30℃静置孵育1-2h;
111.(6)分别稀释5倍、10倍、100倍后300ul/板涂布于15cm含有100mg/lzeocin的ypd平板上,30℃培养至长出克隆。
112.本实施例中,优选的,将转化子进行筛选;
113.其中,将转化子进行筛选包括以下步骤:
114.(1)从平板上随机挑选24个克隆,进行菌落pcr;(菌落pcr使用的是本公司自主研发的一款快速扩增酵母克隆试剂盒,货号:ry8001);
115.(2)选择其中2个进行测序,比对正确后保留7个克隆待用。
116.本实施例中,优选的,转化子表达小试;
117.其中,转化子表达小试包括以下步骤:
118.(1)准备7个50ml锥形瓶,分别加入5mlypg培养基,分别接入上述验证正确的克隆,30℃220rpm培养1-2天至菌液饱和;
119.ypg培养基:1%酵母提取物,2%蛋白胨,1%甘油;
120.(2)转移到50ml离心管中,4000rpm离心5min,弃上清;
121.(3)用5mlbmmy培养基重悬菌体,转移至新的无菌的50ml锥形瓶中,加入甲醇至终浓度为0.5%,28℃220rpm培养6d;
122.bmmy培养基:1%酵母提取物,2%蛋白胨,1.34%酵母氮源,100mmpbs缓冲液(ph=5.7);
123.(4)每隔24h加一次甲醇(终浓度为0.5%);
124.(5)第6d上午收集菌液,4000rpm离心5min,收集上清,用于表达鉴定。
125.本实施例中,优选的,转化子扩大表达。
126.其中,转化子扩大表达包括以下步骤:
127.(1)250ml锥形瓶中加入50mlypg培养基,接入最优表达转化子,30℃220rpm培养1-2天至菌液饱和;
128.(2)转移到50ml离心管中,4000rpm离心5min,弃上清;
129.(3)用50mlbmmy培养基重悬菌体,转移至新的无菌的250ml锥形瓶中,加入甲醇至终浓度为0.5%,28℃220rpm培养6d;
130.(4)每隔24h加一次甲醇(终浓度为0.5%);
131.(6)第6d上午收集菌液,4000rpm离心5min,收集上清,用于表达鉴定。
132.以上所述,仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其它修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1