一种靶向降解FLT3-ITD突变蛋白的PROTAC类化合物及其制备方法与应用
一种靶向降解flt3-itd突变蛋白的protac类化合物及其制备方法与应用
技术领域
1.本发明涉及医药技术领域,特别涉及一种靶向降解flt3-itd突变蛋白的protac类化合物及其制备方法与应用。
背景技术:
2.急性髓性白血病(acute myeloid leukemia,aml)是全球范围内最致命的血液系统恶性肿瘤之一。在所有亚型白血病中,aml占白血病死亡的最高百分比,约高达62%,且患者预后较差,生存期短,五年总生存率不到30%。新诊断的aml患者中最常见的突变形式是flt3-itd突变,其与患者的不良预后、高死亡率以及高复发率密切相关。
3.目前针对flt3-itd突变的主要药物是小分子抑制剂,根据其对flt3蛋白激酶的特异性可分为第一代与第二代。第一代抑制剂是非选择性和多靶点抑制剂,例如米哚妥林等。作为单药治疗,这些药物疗效较差,不良反应较多,部分药物正作为联合疗法被进一步研究。第二代抑制剂具有更高的选择性并对flt3-itd突变显示出更强的抑制作用与更少的脱靶毒性,其中吉列替尼于2018年获得fda批准作为单药用于复发或难治型aml患者的治疗。然而尽管二代抑制剂在临床上取得了一定的疗效,但仍面临着一些意想不到的安全性以及耐药性问题,其中由于微环境的改变或是二次突变所引起的耐药性是迫切需要克服的。
4.相较于传统的小分子抑制剂通过结合靶蛋白的活性位点抑制靶蛋白的功能的作用机制,protac(蛋白水解靶向嵌合体)可以通过劫持体内固有的泛素-蛋白酶体系统降解靶标蛋白,从而达到治疗的目的。protac是一种双功能分子,其由识别靶标蛋白的小分子配体、e3泛素蛋白连接酶招募原件以及连接两者的连接链三部分组成。由于其对靶向蛋白小分子配体的亲和力要求不高,并且其催化性质使其少量便可发挥蛋白降解功能,使得此技术能很好地克服现有药物的严重耐药性问题。
5.因此,有必要开发一种靶向降解flt3-itd突变蛋白的protac类化合物及其制备方法。
技术实现要素:
6.本发明目的是提供一种靶向降解flt3-itd突变蛋白的protac类化合物及其制备方法与应用,所述的靶向降解flt3-itd突变蛋白的protac类化合物具有抗aml的活性,且对人急性髓原白血病细胞molm-13细胞系具有明显的抑制活性,可以作为新型抗aml药物进行开发,具有广泛的应用前景。
7.为了实现上述目的,本发明采用如下技术方案:
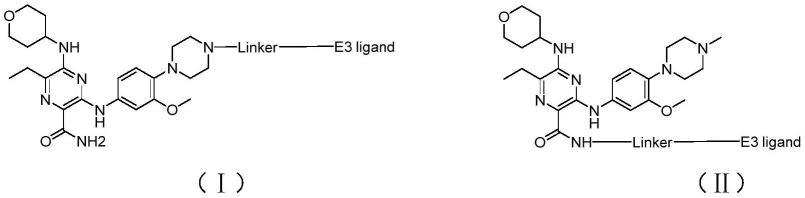
8.在本发明的第一方面,提供了一种靶向降解flt3-itd突变蛋白的protac类化合物,所述靶向降解flt3-itd突变蛋白的protac类化合物具有以下式i或式ii所示的结构式:
[0009][0010]
所述式i或式ii中,
[0011]
linker为连接基团,选自以下基团中一或多种直链或带有支链的亚烷基、烷氧基或杂环基,-(ch2)
n-、-(ch2)nco-、-nr1(ch2)nco-、-nr2(ch2)
n-、-(och2ch2o)
n-、-(ch2ch2o)
n-、-(och2ch2och2)
n-、-(ch2ch2och2)
n-、-(ch2ch2och2ch2)
n-、亚烯基、亚炔基、亚环烷基、亚杂芳烃基或它们的任意组合,其中n表示1至20的自然数,r1、r2各自独立的选择h或者为c
1-10
烷基;
[0012]
e3 ligand为e3连接酶配体,选自以下配体中的一种:
[0013][0014]
进一步地,所述靶向降解flt3-itd突变蛋白的protac类化合物包括以下化合物x1-x22中的一种,所述化合物x1-x22如表1所示。
[0015]
表1:靶向降解flt3-itd突变蛋白的protac类化合物概览
[0016]
[0017]
[0018]
[0019]
[0020]
ligand为上述带甲基vhl配体;
[0029]
系列ⅳprotac化合物为通式(ⅰ)所示化合物,linker为-杂环基,e3 ligand为上述带甲基vhl配体;
[0030]
系列ⅰprotac化合物的制备包括两方面:
[0031]
(1)吉列替尼衍生物ⅰ与末端卤原子取代的vhl配体衍生物或带甲基vhl配体衍生物在碳酸钾、碘化钾条件下于dmf(n,n-二甲基甲酰胺)中反应,得到系列ⅰ(1)protac化合物。反应在90℃下进行,反应的优选时间为12h。
[0032][0033]
系列ⅰ(1)protac化合物的合成路线
[0034]
(2)吉列替尼衍生物ⅰ与末端卤原子取代的的烷基链crbn配体衍生物在碳酸氢钠条件下于dmf中反应,得到系列ⅰ(2)protac化合物。反应在90℃下进行,反应的优选时间为5h。
[0035][0036][0037]
系列ⅰ(2)protac化合物的合成路线
[0038]
系列ⅱprotac化合物的制备包括如下步骤:末端为n-boc(叔丁氧羰基)取代、连接链为烷基链的vhl配体衍生物先在酸性条件下脱去boc保护基团,然后与吉列替尼衍生物ⅱ在hatu(o-(7-氮杂苯并三唑-1-基)-n,n,n
′
,n
′‑
四甲基脲六氟磷酸酯)、dipea(n,n-二异丙基乙胺)条件下于dmf中反应,得到系列ⅱprotac化合物。反应在室温下进行,反应时间优选为0.5h。
[0039][0040]
系列ⅱprotac化合物的合成路线
[0041]
系列ⅲprotac化合物的制备包括如下步骤:末端为叔丁酯取代、连接链为烷氧基链的吉列替尼衍生物ⅰ先于酸性条件下脱去叔丁酯,然后与带甲基的vhl配体在hatu、dipea
条件下于dmf中反应,得到系列ⅲprotac化合物。反应在室温下进行,反应时间优选为0.5h。
[0042][0043]
系列ⅲprotac化合物的合成路线
[0044]
系列ⅳprotac化合物的制备包括如下步骤:末端为叔丁酯取代、连接链为杂环基链的吉列替尼衍生物ⅰ先在酸性条件下脱去叔丁酯,然后与带甲基的vhl配体在hatu、dipea条件下于dmf中反应,得到系列ⅳprotac化合物。反应在室温下进行,反应时间优选为0.5h。
[0045][0046]
系列ⅳprotac化合物的合成路线
[0047]
其中,连接链为n=1-20的-亚烷基、-烷氧基链或-杂环基;r为h原子或者ch3的任一种;x为co或ch;y为n或c。
[0048]
进一步地,所述系列ⅰ中吉列替尼衍生物ⅰ、vhl配体衍生物(或带甲基vhl配体衍生物)、碳酸钾和碘化钾的物质的量之比为1:1.2:4:1.4;
[0049]
系列ii中吉列替尼衍生物ⅰ、crbn配体衍生物、nahco3的物质的量之比为1:1.2:2;系列ⅱ中吉列替尼衍生物ⅱ、带甲基vhl配体衍生物、hatu和dipea的物质的量之比为1:1.2:1.1:6.0;
[0050]
系列ⅲ中带烷氧基侧链的吉列替尼衍生物ⅰ、带甲基vhl配体、hatu和dipea的物质的量之比为1:1.2:1.1:6.0;
[0051]
系列ⅳ中带杂环基侧链的吉列替尼衍生物ⅰ、带甲基vhl配体、hatu和dipea的物质的量之比为1:1.2:1.1:6.0。
[0052]
在本发明的第三方面,提供了所述的一种靶向降解flt3-itd突变蛋白的protac类化合物或者所述的抗aml的药用组合物作为flt3-itd降解剂在抗aml中的应用。
[0053]
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
[0054]
本发明所涉及的靶向降解flt3-itd突变蛋白的protac类化合物可以有效抑制molm-13细胞活性,并有较好的flt3-itd蛋白降解能力,对于aml突变细胞具有较好的活性,可用于制备抗aml的药物。
附图说明
[0055]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
[0056]
图1是本发明合成的部分化合物蛋白降解活性结果。
具体实施方式
[0057]
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
[0058]
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
[0059]
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
[0060]
下面将结合实施例、对比例及实验数据对本技术的一种靶向降解flt3-itd突变蛋白的protac类化合物及其制备方法与在抗急性髓系白血病中的应用进行详细说明。
[0061]
实施例1、6-乙基-3-(3-甲氧基-4-(哌嗪-1-基)苯基)氨基)-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺
[0062]
该制备在本发明中提供两条合成路线,合成路线一如下所示。
[0063][0064]
步骤1:制备4-(2-甲氧基-4-硝基苯基)哌嗪-1-羧酸叔丁酯
[0065][0066]
称取化合物2-氟-5-硝基苯甲醚1(1.0g,1.0eq)与化合物1-叔丁氧羰基哌嗪2(1.2g,1.1eq)于100ml圆底烧瓶中,加入dmf(10ml)溶解,随后加入无水k2co3(2.4g,3.0eq),升温至95℃搅拌4h。tlc监测反应完全后,将反应液放冷至室温,加入适量水,有固体析出,抽滤,滤饼用pe润洗两遍,65℃下烘干得黄色固体产物3,1.8g,反应产率为91.32%。1h nmr(400mhz,chloroform-d)δ7.88(dd,j=8.8,2.5hz,1h),7.74(d,j=2.5hz,1h),6.90(d,j=8.8hz,1h),3.98(s,3h),3.63(t,j=5.0hz,4h),3.18(t,j=5.0hz,4h),1.50(s,9h).
[0067]
步骤2:制备4-(4-氨基-2-甲氧基苯基)哌嗪-1-羧酸叔丁酯
[0068]
[0069]
称取化合物3(1.0g,1.0eq)于100ml圆底烧瓶中,加入溶剂etoh(25ml)溶解,随后加入fe粉(1.3g,8.0eq),称取nh4cl(1.6g,10.0eq)配置成水溶液加入,升温至90℃,于该温度下搅拌1h。tlc监测反应完全后,反应液通过硅藻土过滤,用etoh(25ml)洗涤滤饼,收集滤液并减压浓缩,用ea(50ml)溶解浓缩产物,水洗两次(2
×
50ml),无水na2so4干燥有机相,减压蒸馏除去ea,柱层析纯化得到淡棕色固体产物4,600.0mg,反应产率为65.85%。1h nmr(400mhz,chloroform-d)δ6.76(d,j=8.2hz,1h),6.29(d,j=2.5hz,1h),6.26(dd,j=8.2,2.5hz,1h),3.83(s,3h),3.60(t,j=5.0hz,4h),3.56(s,2h),2.91(t,j=5.0hz,4h),1.50(s,9h).
[0070]
步骤3:制备4-(3-氨甲酰-6-氯-5-乙基吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-羧酸叔丁酯
[0071][0072]
称取化合物4(200.0mg,1.0eq)与化合物3,5-二氯-6-乙基吡嗪-2-甲酰胺5(171.8mg,1.2eq)加入40ml容积的封管中,加入nmp(2ml)溶解,随后加入dipea(252.3mg,2.0eq),升温至170℃搅拌2h。tlc监测反应完全,用ea(3
×
30ml)与水(40ml)萃取反应液,合并有机层并用饱和食盐水(2
×
40ml)洗涤,无水na2so4干燥,减压蒸馏除去ea,柱层析纯化得到黄色固体产物6,304.0mg,反应产率为95.16%。1h nmr(400mhz,chloroform-d)δ10.73(s,1h),7.77(d,j=4.3hz,1h),7.41(d,j=2.4hz,1h),7.18(dd,j=8.6,2.4hz,1h),6.91(d,j=8.5hz,1h),5.65(d,j=4.0hz,1h),3.93(s,3h),3.64(t,j=4.9hz,4h),3.00(t,j=5.0hz,4h),2.88(q,j=7.5hz,2h),1.51(s,9h),1.33
–
1.30(m,3h).
[0073]
步骤4:制备叔丁基4-(4-(3-氨甲酰-5-乙基-6-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-羧酸盐
[0074][0075]
称取化合物6(230mg,1.0eq)与化合物4-氨基四氢吡喃7(189.5mg,4.0eq)加入40ml容积的封管中,加入nmp(1.5ml)溶解,随后加入dipea(242.3mg,4.0eq),将封管置于微波反应器中于120℃下搅拌2h。tlc监测反应完全,用ea(3
×
30ml)与水(40ml)萃取反应液,合并有机层并用饱和食盐水(2
×
40ml)洗涤,无水na2so4干燥,减压蒸馏除去ea,柱层析纯化得到黄色固体产物8,247.1mg,反应产率为94.93%。1h nmr(400mhz,chloroform-d)δ10.78(s,1h),7.55(d,j=2.4hz,1h),7.52(d,j=2.3hz,1h),6.92(d,j=2.3hz,1h),6.85(d,j=8.7hz,1h),5.28(d,j=4.6hz,1h),4.67(d,j=7.3hz,1h),4.27
–
4.18(m,1h),4.08
–
4.02(m,2h),3.90(s,3h),3.64(t,j=5.0hz,4h),3.59
–
3.51(m,2h),3.04
–
2.96(m,4h),2.54(q,j=7.4hz,2h),2.14
–
2.06(m,2h),1.64
–
1.54(m,2h),1.51(s,9h),1.32(t,j=7.4hz,3h).
[0076]
步骤5:制备6-乙基-3-(3-甲氧基-4-(哌嗪-1-基)苯基)氨基)-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺
[0077][0078]
称取化合物8(385.1mg,1.0eq)于50ml的圆底烧瓶中,加入dcm(4ml)溶解,加入过量的tfa(4ml),室温下搅拌1h。tlc监测反应完全后,减压蒸馏除去dcm,用饱和nahco3溶液调节ph至弱碱性,用ea(3
×
30ml)萃取反应液,合并有机层,无水na2so4干燥,减压蒸馏除去溶剂,柱层析纯化得到黄色固体产物9,262.5mg,反应产率为83.14%。1h nmr(400mhz,chloroform-d)δ10.75(s,1h),7.54(d,j=4.4hz,1h),7.50(dd,j=8.6,2.4hz,1h),6.92(d,j=2.3hz,1h),6.87(d,j=8.7hz,1h),5.38(d,j=4.5hz,1h),4.67(d,j=7.3hz,1h),4.27
–
4.17(m,1h),4.07
–
4.00(m,2h),3.89(s,3h),3.59
–
3.50(m,2h),3.12
–
3.06(m,4h),3.06
–
2.98(m,4h),2.53(q,j=7.4hz,2h),2.14
–
2.06(m,2h),1.64
–
1.52(m,2h),1.31(t,j=7.4hz,3h).
[0079]
合成路线二如下所示。
[0080][0081]
步骤1:制备3,5-二氯-6-乙基吡嗪-2-羧酸甲酯
[0082][0083]
称取化合物3,5-二氯-6-乙基吡嗪-2-甲酰胺(600mg,1.0eq)于50ml圆底烧瓶中,加入2mol/l的盐酸甲醇溶液(14ml,过量)溶解,将圆底烧瓶放置于70℃的油浴锅中回流反
应24h。tlc检测反应完全后,减压蒸馏除去溶剂,加饱和nahco3溶液(40ml)溶解,用dcm萃取(3
×
30ml)萃取,合并有机层并用饱和食盐水(2
×
40ml)洗涤,无水na2so4干燥,减压蒸馏除去溶剂得到粗品,柱层析纯化得到446mg无色透明油状液体10,产率为69.59%。1h nmr(400mhz,chloroform-d)δ4.01(s,3h),3.00(q,j=7.5hz,2h),1.32(t,j=7.5hz,3h).
[0084]
步骤2:制备3-氯-6-乙基-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-羧酸甲酯
[0085][0086]
称取化合物10(446mg,1.0eq)于50ml单口瓶中,加入4-氨基四氢吡喃(383.8mg,2.0eq),随后依次加入dmf(3ml)和三乙胺(576.0mg,3.0eq),室温下搅拌2h。tlc监测反应完全,加水(30ml)稀释溶液,用ea(3
×
30ml)萃取反应液,合并有机层并用饱和食盐水(2
×
40ml)洗涤除去dmf,无水na2so4干燥,减压蒸馏除去溶剂得到粗品,柱层析纯化得到469mg纯白色固体11,产率为82.40%。1h nmr(400mhz,chloroform-d)δ5.02(d,j=7.5hz,1h),4.28
–
4.17(m,1h),4.02
–
3.95(m,2h),3.92(s,3h),3.59
–
3.50(m,2h),2.65(q,j=7.5hz,2h),2.07
–
2.00(m,2h),1.64
–
1.49(m,2h),1.27(t,j=7.5hz,3h).
[0087]
步骤3:制备甲基3-(4-(叔丁氧羰基)哌嗪-1-基)-3-甲氧基苯基)氨基)-6-乙基-5-((四氢-2h-吡喃-4-基)氨基)吡嗪-2-羧酸盐
[0088][0089]
取规格为40ml的封管,依次称取化合物11(214.5mg,1.1eq)、化合物4(200.0mg,1.0eq)、4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(xant-phos,113.0mg,0.3eq)、碳酸铯(636.0mg,3.0eq)和醋酸钯(43.8mg,0.3eq),在氩气保护下加入溶剂thf(1.5ml)。反应体系于微波反应器中在100℃下反应1h。反应结束后恢复至室温,加入水约40ml,用ea(3
×
30ml)萃取反应液,合并有机层并,有机层依次使用饱和食盐水(40ml)和饱和nahco3溶液洗涤,无水na2so4干燥,减压蒸馏除去溶剂得到粗品,柱层析纯化得到306mg黄色固体12,产率为82.41%。1h nmr(400mhz,chloroform-d)δ10.78(s,1h),7.53(t,j=3.7hz,1h),7.50(d,j=2.4hz,1h),6.92(d,j=2.3hz,1h),6.84(d,j=8.6hz,1h),5.41(d,j=4.6hz,1h),4.72(d,j=7.3hz,1h),4.24
–
4.15(m,1h),4.07
–
4.00(m,2h),3.89(s,3h),3.63(t,j=5.0hz,4h),3.56
–
3.47(m,2h),2.98(dd,j=8.2,3.5hz,4h),2.53(q,j=7.4hz,2h),2.11
–
2.04(m,2h),1.63
–
1.55(m,2h),1.50(s,9h),1.30(t,j=7.4hz,3h).
[0090]
步骤4:制备3-(4-(叔丁氧羰基)哌嗪-1-基)-3-甲氧基苯基)氨基)-6-乙基-5-((四氢-2h-吡喃-4-基)氨基)吡嗪-2-羧酸
[0091][0092]
称取化合物12(306mg,1.0eq)于50ml单口瓶中,加入甲醇(8ml)溶解,加入lioh
·
h2o(101.2mg,4.0eq),于80℃下反应18h。tlc监测反应完全,使用ea(3
×
30ml)与饱和nh4cl(50ml)溶液进行萃取操作,合并有机层并用饱和食盐水(2
×
40ml)洗涤,无水na2so4干燥,减压蒸馏除去ea得到粗品棕色固体13(315.5mg),无需进一步纯化直接用于下一步反应。
[0093]
步骤5:制备叔丁基4-(4-(3-氨甲酰-5-乙基-6-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-羧酸盐
[0094][0095]
称取化合物13(315.5mg,1.0eq)于50ml的单口瓶中,加入溶剂dmf(5ml)溶解,随后滴入dipea(293.0mg,4.0eq),搅拌数分钟后依次加入nh4cl(45.5mg,1.5eq)与hatu(237.1mg,1.1eq),反应液在室温下搅拌过夜。tlc显示反应完全后,用ea(3
×
30ml)与水(40ml)萃取反应液,合并有机层并用饱和食盐水(2
×
40ml)洗涤,无水na2so4干燥,减压蒸馏除去ea,柱层析纯化得到300.0mg黄色固体8,产率为95.40%。1h nmr(400mhz,chloroform-d)δ10.78(s,1h),7.53(t,j=3.7hz,1h),7.50(d,j=2.4hz,1h),6.92(d,j=2.3hz,1h),6.84(d,j=8.6hz,1h),5.41(d,j=4.6hz,1h),4.72(d,j=7.3hz,1h),4.26
–
4.16(m,1h),4.07
–
4.00(m,2h),3.89(s,3h),3.63(t,j=5.0hz,4h),3.58
–
3.49(m,2h),2.98(dd,j=8.2,3.5hz,4h),2.53(q,j=7.4hz,2h),2.12
–
2.06(m,2h),1.63
–
1.55(m,2h),1.50(s,9h),1.30(t,j=7.4hz,3h).
[0096]
步骤6:制备6-乙基-3-(3-甲氧基-4-(哌嗪-1-基)苯基)氨基)-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺
[0097][0098]
称取化合物8(300.0mg,1.0eq)于50ml的单口瓶中,加入溶剂dcm(1.5ml)溶解,滴加tfa(1.5ml,过量),在室温下搅拌30min。tlc监测反应完全,减压蒸馏除去溶剂和tfa。柱层析分离纯化得到黄色固体9,230.0mg,产率为93.52%。1h nmr(400mhz,chloroform-d)δ10.76(s,1h),7.57
–
7.52(m,1h),7.49(dd,j=8.6,2.3hz,1h),6.92(d,j=2.3hz,1h),6.86(d,j=8.7hz,1h),5.47(s,1h),4.69(d,j=7.3hz,1h),4.27
–
4.17(m,1h),4.06
–
4.01(m,
2h),3.88(s,3h),3.58
–
3.50(m,2h),3.15
–
3.11(m,4h),3.09
–
3.02(m,4h),2.53(q,j=7.4hz,2h),2.13
–
2.06(m,2h),1.64
–
1.52(m,2h),1.32(t,j=7.4hz,3h).
[0099]
吉列替尼衍生物ⅱ的合成方法同上述合成路线一中化合物13的合成。
[0100]
实施例2、(2s,4r)-1-(s)-2-氨基-3,3-二甲基丁酰基)-4-羟基-n-(s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺
[0101][0102]
步骤1:制备叔丁基(s)-(1-(4-溴苯基)乙基)氨基甲酸酯
[0103][0104]
称取(s)-(-)-1-(4-溴苯)乙胺14(5g,1.0eq)加入100ml单口瓶中,加入溶剂dcm(15ml)溶解,随即加入et3n(2.8g,1.1eq),冰浴数分钟后边搅拌边缓慢加入溶有二碳酸叔丁酯(6.0g,1.1eq)的dcm(5ml)溶液。加毕,撤去冰浴,室温下反应2h。tlc监测反应完全后,用水与dcm(3
×
30ml)进行萃取操作,合并有机层并用水反洗两次(2
×
40ml),无水na2so4干燥,减压蒸馏除去dcm即得粗品白色固体产物15,7.57g,产率为100%。
[0105]
步骤2:制备叔丁基(s)-(1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨基甲酸酯
[0106][0107]
分别称取化合物15(6g,1.0eq)、4-甲基噻唑(4.0g,2.0eq)、醋酸钯(44.8mg,0.01eq)、醋酸钾(3.9g,2.0eq)于150ml单口瓶中,置换氩气,在惰性气体保护下加入溶剂dmac(15ml)溶解,加热至90℃反应18h。反应结束后漏斗内铺硅藻土过滤,滤渣用dmac(20ml)洗涤,取滤液,在冰浴条件下往滤液中加入4-5倍滤液体积的水,搅拌1h,有灰白色固体析出。过滤取滤渣,pe冲洗,烘干后进行柱层析纯化操作得到纯白色产物17,3.3g,收率为52%。1h nmr(400mhz,chloroform-d)δ8.68(s,1h),7.42(d,j=8.4hz,2h),7.37(d,j=8.1hz,2h),4.94(s,1h),2.54(s,3h),1.48(d,j=6.8hz,3h),1.44(s,9h).
[0108]
步骤3:制备叔丁基(2s,4r)-4-羟基-2-(s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)
氨甲酰)吡咯烷-1-羧基
[0109][0110]
称取化合物17(6.0g,1.0eq)于50ml单口瓶中,加入dcm(6ml)溶解,随即滴加tfa(12ml),室温下搅拌30min。tlc监测反应完全后,减压蒸馏除去溶剂与tfa,得到棕色油状液体18,直接用于下一部反应。脱保护中间体18溶解于dmf(10ml)中,随后滴加dipea(9.7g,4.0eq),室温下搅拌数分钟后依次加入boc-l-羟脯氨酸(4.8g,1.1eq)和hatu(7.9g,1.1eq),室温下反应30min。tlc监测反应结束后,用ea(3
×
40ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤后用无水na2so4干燥,减压蒸馏除去ea,进一步柱层析纯化得到白色固体产物19,5.8g。两步总产率为71%。
[0111]
步骤4:制备叔丁基((s)-1-((2s,4r)-4-羟基-2-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨甲酰)吡咯烷-1-基)-3,3-二甲基-1-氧代丁烷-2-基)氨基甲酸酯
[0112][0113]
称取化合物19(5.8g,1.0eq)于50ml单口瓶中,加入dcm(10ml)溶解,随即滴加tfa(10ml),室温下搅拌30分钟。tlc监测反应完全后,减压蒸馏除去溶剂与tfa,得到棕色油状液体20,直接用于下一部反应。脱保护中间体20溶解于dmf(6ml)中,随后滴加dipea(10.4g,6.0eq),室温下搅拌数分钟后依次加入boc-l-叔亮氨酸(4.7g,1.5eq)和hatu(5.6g,1.1eq),室温下反应30min。tlc监测反应结束后,用ea(3
×
40ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤后用无水na2so4干燥,减压蒸馏除去ea,进一步柱层析纯化得到白色固体产物21,2.6g。两步总产率为36%。
[0114]
步骤5:制备(2s,4r)-1-(s)-2-氨基-3,3-二甲基丁酰基)-4-羟基-n-(s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺
[0115][0116]
称取化合物21(3.0g,1.0eq)于50ml单口瓶中,加入dcm(6ml)溶解,随即滴加tfa(6ml),室温下搅拌30min。tlc监测反应完全后,减压蒸馏除去溶剂与大部分tfa,用饱和nahco3溶液调节ph为9-10,配置dcm:meoh=10:1溶剂萃取(3
×
30ml)并合并有机相,有机相用无水na2so4干燥,减压蒸馏除去溶剂,进一步柱层析纯化得到白色固体产物22,2.0g,产率为82%。1h nmr(400mhz,chloroform-d)δ8.66(s,1h),8.22(d,j=7.3hz,1h),7.37(s,4h),5.07(p,j=7.0hz,1h),4.78(t,j=8.3hz,1h),4.41(d,j=3.7hz,1h),3.79(d,j=11.3hz,1h),3.62
–
3.55(m,1h),3.38(s,1h),2.51(s,3h),2.22
–
2.12(m,2h),1.50(d,j=6.9hz,
3h),0.99(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.26,170.77,150.40,148.28,143.97,131.66,130.52,129.46,126.27,69.84,60.33,58.77,56.87,48.87,37.13,35.67,26.13,22.42,16.08.
[0117]
不带甲基的vhl配体的制备方法同上。
[0118]
实施例3、末端为卤原子取代的烷基链vhl配体的制备
[0119]
以(2s,4r)-1-(s)-2-(5-溴代戊胺基)-3,3-二甲基丁酰基)-4-羟基-n-(s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺(24)的制备为例,通过下式反应得到。
[0120][0121]
称取化合物22(150.0mg,1.0eq)与相应链长的酸23(73.3mg,1.2eq)于50ml单口瓶,加入溶剂dmf溶解,随后滴加dipea(261.6mg,6.0eq),搅拌数分钟后加入缩合剂hatu(141.4mg,1.1eq),室温下反应30min。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步柱层析纯化得到相应白色固体产物24,105mg,反应产率为62%。1h nmr(400mhz,chloroform-d)δ8.70(s,1h),7.51(d,j=7.9hz,1h),7.41(d,j=8.4hz,2h),7.38(d,j=8.5hz,2h),6.39(d,j=8.9hz,1h),5.10(p,j=7.0hz,1h),4.68(t,j=7.9hz,1h),4.59(d,j=8.9hz,1h),4.51(s,1h),4.03(d,j=11.3hz,1h),3.64(dd,j=11.3,3.8hz,1h),3.39(t,j=6.4hz,2h),2.53(s,3h),2.44
–
2.36(m,1h),2.25
–
2.17(m,2h),2.12
–
2.03(m,1h),1.90
–
1.81(m,2h),1.79
–
1.70(m,2h),1.50
–
1.48(m,3h),1.05(s,9h).
[0122]
其他末端为卤原子取代的烷基链vhl配体的制备方法同上。
[0123]
实施例4、末端为卤原子取代的烷基链crbn配体的制备
[0124]
以8-溴-n-(2-(2,6-二氧哌啶-3-基)-1,3-二氧异辛醇-4-基)辛酰胺(29)的制备为例,通过下式反应得到。
[0125][0126]
称取化合物25(1.5g,1.0eq)与单口瓶中,氩气置换,在惰性气体保护下加入溶剂dcm(5ml)溶解,于冰浴下缓慢滴加化合物26即草酰氯(1.7g,2.0eq),随后滴入一滴dmf,冰浴下搅拌数分钟后室温下反应2h。反应完全后减压浓缩去除dcm得到化合物27,无需纯化,直接用于下一步。将其中加入溶剂thf(5ml)溶解,然后加入化合物28(0.92g,0.5eq),室温
下反应过夜。反应结束后减压蒸馏除去thf,经柱层析纯化得到白色固体产物29,850mg,两步总收率为26%。1h nmr(400mhz,chloroform-d)δ9.42(s,1h),8.83(d,j=8.9hz,2h),7.72(dd,j=8.5,7.3hz,1h),7.55(d,j=7.3hz,1h),5.03
–
4.94(m,1h),3.41(t,j=6.8hz,2h),2.94
–
2.85(m,1h),2.85
–
2.72(m,2h),2.47(t,j=7.5hz,2h),2.21
–
2.14(m,1h),1.90
–
1.82(m,2h),1.80
–
1.71(m,2h),1.47
–
1.33(m,6h).
[0127]
以4-(8-溴辛基)氧基)-2-(2,6-二氧哌啶-3-基)异吲哚-1,3-二酮(32)的制备为例,通过下式反应得到。
[0128][0129]
称取化合物30(300mg,1.0eq)和化合物31(357.1mg,1.2eq)于50ml单口瓶内,加入溶剂dmf(5ml)溶解,随后滴加dipea(424.2mg,3.0eq),加热至90℃反应3h。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到白色固体化合物32,165.0mg,产率为32%。1h nmr(400mhz,chloroform-d)δ9.12(d,j=5.7hz,1h),7.60(t,j=7.9hz,1h),7.34(dd,j=7.5,2.6hz,1h),7.16(d,j=8.5hz,1h),4.50
–
4.92(m,1h),4.10(t,j=6.6hz,2h),3.36(t,j=6.8hz,2h),2.83
–
2.68(m,3h),2.12
–
2.01(m,1h),1.85
–
1.75(m,4h),1.50
–
1.41(m,2h),1.40
–
1.26(m,6h).
[0130]
其他末端为卤原子取代的烷基链crbn配体的制备方法同上。
[0131]
实施例5、系列ⅰ(1)protac化合物的制备
[0132]
以6-乙基-3-((4-(4-(5-((s)-1-((2s,4r)-4-羟基-2-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨甲酰)吡咯烷-1-基)-3,3-二甲基-1-氧代丁烷-2-基)氨基)-5-氧代戊基)哌嗪-1-基)-3-甲氧基苯基)氨基)-5-((四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺(x-1)的制备为例,通过下式反应得到。
[0133][0134]
称取相应的化合物24(64mg,1.2eq)、k2co3(48.5mg,4.0eq),ki(21.9mg,1.4eq)于单口瓶中,加入溶剂dmf溶解,搅拌数分钟后加入化合物9(40mg,1.0eq)、加热至90℃过夜。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步柱层析纯化得到相应目标终产物黄色固体x-1,26.6mg,反应产率为31%。1h nmr(400mhz,chloroform-d)δ10.74(s,1h),8.67(s,1h),7.59(d,j=7.9hz,1h),7.54(d,j=4.8hz,1h),7.46(dd,j=8.6,2.3hz,1h),7.38(d,j=1.4hz,4h),6.91(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),6.60(d,j=8.9hz,1h),5.60(d,j=4.6hz,1h),5.10(t,j=7.2hz,1h),4.75
–
4.69(m,2h),4.64(d,j=9.0hz,1h),4.51(s,1h),4.23
–
4.15(m,1h),4.07(d,j=11.3hz,1h),4.05
–
3.97(m,2h),3.85(s,3h),3.66
–
3.62(m,1h),3.55
–
3.47(m,4h),3.16
–
3.02(m,4h),3.68
–
2.79
(m,4h),2.53
–
2.50(m,5h),2.43
–
2.37(m,1h),2.30
–
2.23(m,2h),2.16
–
2.11(m,1h),2.07(dd,j=11.4,3.2hz,2h),1.65(d,j=8.4hz,2h),1.60
–
1.54(m,4h),1.49(d,j=6.9hz,3h),1.33
–
1.29(m,3h),1.06(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.50,171.95,170.37,170.00,152.37,151.92,151.03,150.39,148.39,143.28,136.00,135.90,131.62,130.78,130.72,129.53,126.45,117.94,112.62,112.51,105.03,69.81,66.89,58.74,57.97,57.55,55.66,53.25,50.54,48.81,36.00,35.34,33.12,31.93,29.70,29.37,26.56,25.82,24.55,23.47,22.70,16.09,14.16,10.51.hrms-esi(m/z):[m+h]
+
calcd for[c
51h72n11
o7s]
+
982.5331;found 982.5368.
[0135]
其他系列ⅰ(1)化合物的制备方法同上。
[0136]
实施例6、系列ⅰ(2)protac化合物的制备
[0137]
以3-(4-(8-(2-(2,6-二氧哌啶-3-基)-1,3-二氧异辛醇-4-基)氨基)-8-氧辛基)哌嗪-1-基)-3-甲氧基苯基)氨基)-6-乙基-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺(x-14)的制备为例,通过下式反应得到。
[0138][0139]
称取化合物29(100.8mg,1.2eq)、化合物9(80mg,1.0eq)于50ml单口瓶内,加入溶剂dmf(3ml)溶解,然后加入nahco3固体(29.5mg,2.0eq),加热至90℃反应3h。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到终产物黄色固体x-14,62.4mg,产率为42%。1h nmr(400mhz,chloroform-d)δ10.71(d,j=5.4hz,1h),9.45(s,1h),8.78(d,j=8.5hz,1h),7.72
–
7.63(m,1h),7.50(dd,j=9.6,5.6hz,2h),7.44(dd,j=8.6,2.3hz,1h),6.89(d,j=2.3hz,1h),6.84(d,j=8.7hz,1h),5.66(d,j=4.6hz,1h),4.97
–
4.91(m,1h),4.75(d,j=7.3hz,1h),4.21
–
4.13(m,1h),4.03
–
3.96(m,2h),3.83(s,3h),3.54
–
3.46(m,2h),3.13
–
3.02(m,4h),2.85
–
2.82(m,1h),2.80
–
2.58(m,6h),2.52
–
2.44(m,2h),2.43
–
2.37(m,2h),2.18
–
2.12(m,1h),2.08
–
2.02(m,2h),1.78
–
1.68(m,2h),1.60
–
1.50(m,4h),1.45
–
1.28(m,8h),1.28
–
1.26(m,3h).
13
c nmr(100mhz,chloroform-d)δ172.46,171.88,170.45,169.28,168.89,166.80,152.36,151.92,151.01,137.71,136.35,136.26,135.73,131.13,130.70,125.17,118.37,117.82,115.34,112.47,104.99,66.88,58.72,55.61,53.32,50.67,49.34,47.67,45.86,37.80,33.06,31.47,29.67,29.21,28.89,27.59,26.51,25.29,24.50,22.78,14.83,14.15,10.49,9.62.hrms-esi(m/z):[m+h]
+
calcd for[c
44h57n10
o8]
+
853.4355;found 853.4352.
[0140]
其他系列ⅰ(2)化合物的制备方法同上。
[0141]
实施例7、末端为n-boc取代连接链为烷基链的vhl配体的制备
[0142]
以叔丁基(6-((s)-1-((2s,4r)-4-羟基-2-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨甲酰)吡咯烷-1-基)-3,3-二甲基-1-氧代丁烷-2-基)氨基)-6-氧代己基)氨基甲酸酯(34)的制备为例,通过下式反应得到。
[0143][0144]
称取化合物22(100mg,1.0eq)与相应的化合物33(57.2mg,1.1eq)与单口瓶中,加入溶剂dmf溶解,随后滴加dipea(116.3mg,4.0eq),搅拌数分钟后加入hatu(94.1mg,1.1eq),室温下反应1h。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步柱层析纯化得到相应中间体白色固体34,140mg,反应产率为97%。1h nmr(400mhz,chloroform-d)δ8.64(s,1h),7.63(d,j=7.7hz,1h),7.33(d,j=2.3hz,4h),6.69(d,j=8.3hz,1h),5.08
–
5.01(m,1h),4.65(t,j=8.0hz,1h),4.59(d,j=9.2hz,1h),4.45(s,1h),3.96(d,j=11.0hz,1h),3.67
–
3.58(m,1h),3.01(d,j=6.7hz,2h),2.46(s,3h),2.33
–
2.20(m,1h),2.20
–
2.10(m,2h),2.06(dd,j=16.9,8.6hz,1h),1.59
–
1.49(m,2h),1.42(d,j=7.0hz,3h),1.38(s,9h),1.25
–
1.20(m,2h),0.99(s,9h).
[0145]
其他末端为n-boc取代连接链为烷基链的vhl配体的制备方法同上。
[0146]
实施例8、系列ⅱprotac化合物的制备
[0147]
以6-乙基-n-(6-(s)-1-(2s,4r)-4-羟基-2-(s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨甲酰基)吡咯烷-1-基)-3,3-二甲基-1-氧代丁烷-2-基)氨基)-6-氧代己基)-3-(3-甲氧基-4-(4-甲基哌嗪-1-基)苯基)氨基)-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-甲酰胺(42a)的制备为例,通过下式反应得到。
[0148][0149]
称取相应的化合物34(70.0mg,1.0eq),加入dcm溶解,随后滴加过量tfa,室温下反应30min。tlc监测反应完全,减压蒸馏除去dcm与tfa,得到棕色油状液体35,无需进一步纯化,直接进行下一步反应。首先加入适量溶剂dmf使其溶解,滴加dipea(100mg,8.0eq)并搅拌数分钟,随后依次加入化合物36(45.5mg,1.1eq)与hatu(40.5mg,1.1eq),室温下反应30min。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到相应目标protac分子黄色固体x-9,77.5mg,反应产率为67%。1h nmr(400mhz,chloroform-d)δ10.89(s,1h),8.65(s,1h),7.79
–
7.71(m,1h),7.53(d,j=8.7hz,1h),7.52
–
7.46(m,1h),7.34(d,j=7.3hz,4h),6.86(t,j=2.8hz,1h),6.82(dd,j=9.3,5.1hz,1h),6.46
–
6.35(m,1h),5.05(q,j=6.8hz,1h),4.76
–
4.69(m,1h),4.67(d,j=
7.4hz,1h),4.59(d,j=8.8hz,1h),4.48(s,1h),4.20
–
4.16(m,1h),4.03
–
3.93(m,3h),3.83(s,3h),3.62(dd,j=11.0,3.8hz,1h),3.55
–
3.46(m,2h),3.38
–
3.31(m,2h),3.18
–
3.00(m,4h),2.75
–
2.65(m,4h),2.53
–
2.46(m,5h),2.42
–
2.30(m,4h),2.20
–
2.13(m,2h),2.10
–
2.00(m,3h),1.67
–
1.50(m,6h),1.45(d,j=6.7hz,3h),1.28
–
1.21(m,5h),1.01(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.41,171.73,170.07,167.55,152.42,151.60,150.51,150.41,148.33,143.29,136.01,135.95,131.60,130.73,130.33,129.49,126.46,117.92,113.13,111.98,104.68,69.77,66.93,58.80,57.39,56.78,55.63,55.30,50.83,48.77,47.67,46.07,45.86,38.81,38.66,36.29,36.02,35.41,33.12,30.31,29.72,28.89,26.56,26.50,25.36,24.60,23.69,22.97,22.21,16.07,14.08,10.71,9.63.hrms-esi(m/z):[m+h]
+
calcd for[c
53h76n11
o7s]
+
1010.5644;found 1010.5658.
[0150]
其他系列ⅱprotac化合物的制备方法同上。
[0151]
实施例9、末端为叔丁酯取代连接链为烷氧基链的吉列替尼衍生物ⅰ的制备
[0152]
以叔丁基2-(2-(4-(4-(3-氨甲酰-5-乙基-6-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-基)乙氧基)乙酸酯(41)的制备为例,通过下式反应得到。
[0153][0154]
步骤1:制备乙酸叔丁酯2-(2-(2-羟基乙氧基)乙氧基)
[0155][0156]
称取相应化合物37(6.0g,1.0eq)置于双口瓶中,氩气置换保持惰性气体保护环境,随后加入溶剂dmf溶解,在冰浴下缓慢分次加入nah(2.7g,1.2eq),室温下搅拌1h。随后冰浴下加入化合物38溴乙酸叔丁酯(11.0g,1.0eq),加毕,移去冰浴,室温下反应过夜。反应结束后缓慢加水淬灭反应,然后用ea与水萃取反应液,合并有机相并用无水na2so4干燥,减压蒸馏除去ea,经柱层析纯化得到化合物黄色油状液体39,0.7g,反应产率为6%。1h nmr(400mhz,chloroform-d)δ3.99(s,2h),3.72
–
3.67(m,6h),3.61
–
3.57(m,2h),1.44(s,9h).
[0157]
步骤2:制备2-(2-(对甲苯氧基)乙氧基)乙酸叔丁酯
[0158]
[0159]
称取相应化合物39(400mg,1.0eq)于单口瓶中,加入溶剂dcm溶解,随后依次加入对甲苯磺酰氯(380.8mg,1.1eq)、et3n(643.8mg,3.5eq)与dmap(13.3mg,0.06eq),室温下反应2h。tlc监测反应结束后用dcm及水萃取反应液,合并有机层并用无水na2so4干燥,进一步经柱层析纯化得到无色液体40,328.8mg,反应产率为48%。1h nmr(400mhz,chloroform-d)δ7.81
–
7.74(m,2h),7.33(d,j=8.1hz,2h),4.19
–
4.12(m,2h),3.97(s,2h),3.72
–
3.65(m,2h),3.66
–
3.62(m,2h),3.62
–
3.59(m,2h),2.43(s,3h),1.46(s,9h).
[0160]
步骤3:制备叔丁基2-(2-(4-(4-(3-氨甲酰-5-乙基-6-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-基)乙氧基)乙酸酯
[0161][0162]
称取相应化合物40(45.2mg,1.1eq)、k2co3(60.7mg,4.0eq)、ki(23.4mg,1.3eq)于单口瓶内,加入溶剂dmf溶解并搅拌数分钟,随后加入化合物9(50mg,1.0eq),加热至85℃反应过夜。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到黄色固体41,49.4mg,反应产率为68%。1h nmr(400mhz,chloroform-d)δ10.74(s,1h),7.49(d,j=4.5hz,1h),7.45(dd,j=8.6,2.3hz,1h),6.86(d,j=2.3hz,1h),6.82(d,j=8.6hz,1h),5.58(s,1h),4.78(d,j=7.3hz,1h),4.20
–
4.13(m,1h),4.02
–
3.98(m,2h),3.97
–
3.94(m,2h),3.82(s,3h),3.76(t,j=5.5hz,2h),3.70
–
3.67(m,2h),3.67
–
3.64(m,2h),3.52
–
3.45(m,2h),3.19
–
3.11(m,4h),2.96
–
2.85(m,4h),2.83(t,j=5.6hz,2h),2.49(q,j=7.3hz,2h),2.07
–
2.01(m,2h),1.60
–
1.52(m,2h),1.43(s,9h),1.35(t,j=7.4hz,3h).
[0163]
其他末端为叔丁酯取代连接链为烷氧基链的吉列替尼衍生物ⅰ的制备方法同上。
[0164]
实施例10、系列ⅲprotac化合物的制备
[0165]
以6-乙基-3-(4-(2-(2-((s)-1-(2s,4r)-4-羟基-2-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)氨甲酰)吡咯烷-1-基)-3,3-二甲基-1-氧代丁烷-2-基)氨基)-2-氧代乙氧基)乙基)哌嗪-1-基)-3-甲氧基苯基)氨基)-5-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-羧酰胺(x-19)的制备为例,通过下式反应得到。
[0166]
[0167]
称取相应化合物41(49.3mg,1.0eq),加入溶剂dcm溶解,随后加入过量tfa,室温下反应2h。反应结束后减压蒸馏得到棕色油状液体42,无需进一步纯化,直接用于下一步。加入溶剂dmf溶解化合物42,滴加dipea(58.1mg,6.0eq)后搅拌数分钟,随后依次加入化合物22(40.0mg,1.2eq)与hatu(31.3mg,1.1eq),室温下反应30min。tlc监测反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到黄色固体x-19,34mg,反应产率为44%。1h nmr(400mhz,chloroform-d)δ10.74(s,1h),8.67(s,1h),7.57(d,j=7.7hz,1h),7.53(d,j=4.6hz,1h),7.46(dd,j=8.6,2.3hz,1h),7.38(d,j=2.6hz,4h),7.35(s,1h),6.91(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),5.52(d,j=4.5hz,1h),5.12
–
5.04(m,1h),4.78
–
4.74(m,1h),4.70(d,j=7.3hz,1h),4.60(d,j=8.8hz,1h),4.24
–
4.14(m,1h),4.06
–
3.98(m,5h),3.85(s,3h),3.73
–
3.69(m,2h),3.68
–
3.62(m,6h),3.55
–
3.47(m,2h),3.13
–
3.04(m,4h),2.76
–
2.67(m,6h),2.55
–
2.49(m,5h),2.48
–
2.42(m,1h),2.10
–
2.03(m,3h),1.61
–
1.53(m,2h),1.48(d,j=6.9hz,3h),1.29(t,j=7.4hz,3h),1.08(s,9h).
13
c nmr(100mhz,cdcl3)δ171.31,170.35,170.29,169.97,152.39,151.91,151.02,150.35,148.37,143.34,136.24,135.78,131.65,130.71,130.67,129.50,126.42,117.84,112.64,112.52,105.06,71.20,70.47,70.31,69.86,68.92,66.91,58.64,57.72,57.03,56.78,55.66,53.89,50.84,48.85,47.66,45.95,35.84,35.47,33.12,29.69,26.52,24.54,22.35,16.10,10.53.hrms-esi(m/z):[m+h]
+
calcd for[c
52h74n11
o9s]
+
1028.5386;found 1028.5391.
[0168]
其他系列ⅲ与系列ⅳprotac化合物的制备方法同上。
[0169]
实施例11、末端为叔丁酯取代连接链为杂环基链的吉列替尼衍生物ⅰ的制备
[0170]
以叔丁基2-(4-(4-(3-氨甲酰-5-乙基-6-(四氢-2h-吡喃-4-基)氨基)吡嗪-2-基)氨基)-2-甲氧基苯基)哌嗪-1-基)乙基)哌嗪-1-基)乙酸酯(44)的制备为例,通过下式反应得到。
[0171][0172]
参考实施例9中的方法制备得到化合物43。称取化合物43(122.7mg)于单口瓶中,加入溶剂dcm溶解,加入过量tfa,室温下反应30min。反应结束后减压蒸馏除去多余tfa与溶剂,用nahco3溶解调节ph至9-10,用dcm萃取反应液,合并有机相并用无水na2so4干燥,减压蒸馏除去dcm即得到相应粗品化合物,进一步柱层析纯化得到脱boc中间体44,52.4mg,反应产率为50%。1h nmr(400mhz,chloroform-d)δ10.73(s,1h),7.51(d,j=4.5hz,1h),7.46(dd,j=8.6,2.3hz,1h),6.87(d,j=2.3hz,1h),6.83(d,j=8.6hz,1h),5.62(d,j=4.6hz,1h),4.67(d,j=7.3hz,1h),4.23
–
4.12(m,1h),4.03
–
3.96(m,2h),3.85(s,3h),3.54
–
3.45m,2h),3.16
–
2.99(m,4h),2.89(t,j=4.9hz,4h),2.75
–
2.65(m,4h),2.62
–
2.58(m,2h),2.57
–
2.53(m,2h),2.49(q,j=7.0,6.4hz,6h),2.08
–
2.02(m,2h),1.60
–
1.50(m,2h),1.27(t,j=7.4hz,3h).称取化合物44(52.4mg,1.0eq)与溴乙酸叔丁酯(18.0mg,1.0eq)于单口瓶中,加入溶剂dmf溶解后加入k2co3固体(51.0mg,4.0eq),加热至50℃反应2h。tlc监测
反应完全后,用ea(3
×
30ml)和水萃取反应液,合并有机相,有机相用饱和食盐水(2
×
40ml)洗涤以除去多余dmf,随后用无水na2so4干燥,减压蒸馏除去ea,进一步经柱层析纯化得到黄色固体45,16mg,反应产率为26%。1h nmr(400mhz,chloroform-d)δ10.75(s,1h),7.54
–
7.47(m,2h),6.90(d,j=2.3hz,1h),6.86(d,j=8.6hz,1h),5.30(s,1h),4.65(d,j=7.3hz,1h),4.25
–
4.16(m,1h),4.06
–
4.00(m,2h),3.87(s,3h),3.57
–
3.49(m,2h),3.13
–
3.05(m,6h),2.82
–
2.73(m,4h),2.71
–
2.57(m,12h),2.56
–
2.49(m,2h),2.12
–
2.06(m,2h),1.62
–
1.53(m,2h),1.47(s,9h),1.31(t,j=7.3hz,3h).
[0173]
实施例12、靶向降解flt3-itd突变蛋白的protac类化合物的制备与表征
[0174]
(1)表1中编号为x-2的化合物
[0175]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为46%。
[0176]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.67(s,1h),7.56(d,j=7.8hz,1h),7.53(d,j=4.6hz,1h),7.45(dd,j=8.6,2.3hz,1h),7.40
–
7.33(m,4h),6.91(d,j=2.3hz,1h),6.84(d,j=8.6hz,1h),6.60(d,j=9.0hz,1h),5.70(d,j=4.5hz,1h),5.12
–
5.06(m,1h),4.76
–
4.70(m,2h),4.64(d,j=9.0hz,1h),4.51(s,1h),4.23
–
4.14(m,1h),4.08
–
3.96(m,5h),3.85(s,3h),3.63(dd,j=11.2,3.6hz,1h),3.55
–
3.46(m,2h),3.16
–
3.30(m,4h),2.78
–
2.62(m,4h),2.54
–
2.47(m,5h),2.45
–
2.37(m,3h),2.26
–
2.17(m,2h),2.11
–
2.03(m,3h),1.67
–
1.61(m,2h),1.50
–
1.46(m,4h),1.48(d,j=6.9hz,3h),1.32
–
1.29(m,3h),1.05(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.58,171.95,170.41,170.05,152.37,151.92,151.01,150.40,148.36,143.30,136.07,135.86,131.62,130.75,129.51,126.46,117.90,112.59,112.49,105.02,69.72,66.90,58.79,58.34,57.45,56.95,55.66,53.29,50.61,48.79,47.65,45.68,36.18,35.99,35.46,34.46,33.09,31.91,29.68,29.35,27.06,26.56,26.07,25.39,24.53,22.69,22.25,16.09,14.83,14.15,10.51,9.32.hrms-esi(m/z):[m+h]
+
calcd for[c
52h74n11
o7s]
+
986.5488;found 986.5491.
[0177]
(2)表1中编号为x-3的化合物
[0178]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为60%。
[0179]1h nmr(400mhz,chloroform-d)δ10.74(s,1h),8.67(s,1h),7.63(d,j=7.9hz,1h),7.53(d,j=4.5hz,1h),7.46(dd,j=8.6,2.3hz,1h),7.38(s,4h),6.90(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),6.51(d,j=9.0hz,1h),5.68(d,j=4.5hz,1h),5.12
–
5.07(m,1h),4.77
–
4.70(m,2h),4.64(d,j=9.0hz,1h),4.51(s,1h),4.23
–
4.14(m,1h),4.08
–
3.98(m,3h),3.85(s,3h),3.65
–
3.61(m,1h),3.57
–
3.47(m,4h),3.18
–
3.04(m,4h),2.79
–
3.69(m,4h),2.55
–
2.48(m,5h),2.41
–
2.35(m,1h),2.24
–
2.18(m,2h),2.06(dd,j=13.1,4.2hz,3h),1.61(d,j=6.4hz,2h),1.59
–
1.52(m,4h),1.49(d,j=6.9hz,3h),1.43(dd,j=8.3,6.3hz,2h),1.33
–
1.29(m,5h),1.05(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.64,171.76,170.40,170.17,152.36,151.93,151.00,150.38,148.34,143.43,135.98,135.86,131.66,130.80,130.69,129.49,126.47,118.01,112.60,112.45,104.98,69.80,66.89,58.84,58.35,57.40,56.94,55.66,53.20,52.83,50.35,48.79,47.66,36.31,36.19,35.46,34.46,33.09,31.91,31.50,30.12,29.68,29.36,28.87,27.02,26.54,25.96,25.48,24.54,22.28,16.08,14.82,14.15,7.92.hrms-esi(m/z):[m+h]
+
calcd for[c
53h76n11
o7s]
+
1010.5644;found 1010.5665.
[0180]
(3)表1中编号为x-4的化合物
[0181]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为46%。
[0182]1h nmr(400mhz,chloroform-d)δ10.74(s,1h),8.66(s,1h),7.57(d,j=7.8hz,1h),7.52(d,j=4.6hz,1h),7.44(dd,j=8.6,2.3hz,1h),7.37(s,4h),6.90(d,j=2.3hz,1h),6.84(d,j=8.7hz,1h),6.48(d,j=9.0hz,1h),5.79(d,j=4.5hz,1h),5.12
–
5.05(m,1h),4.78
–
4.69(m,2h),4.64(d,j=9.0hz,1h),4.51(s,1h),4.23
–
4.14(m,1h),4.05
–
3.96(m,3h),3.85(s,3h),3.63(dd,j=11.1,3.9hz,1h),3.53
–
3.46(m,2h),3.18
–
3.00(m,4h),2.79
–
2.64(m,4h),2.54
–
2.46(m,5h),2.45
–
2.38(m,3h),2.22
–
2.15(m,2h),2.09
–
2.02(m,3h),1.62
–
1.50(m,6h),1.47(d,j=6.9hz,3h),1.33
–
1.25(m,9h),1.04(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.56,171.87,170.43,170.14,152.37,151.92,151.00,150.40,148.35,143.33,136.07,135.87,131.62,130.76,129.49,126.47,117.91,112.59,112.50,105.01,69.71,66.90,58.82,58.64,57.33,56.89,55.65,53.35,50.61,48.78,47.66,45.83,36.38,35.51,33.08,31.90,29.68,29.34,29.01,28.90,27.20,26.54,26.23,25.50,24.53,22.68,16.08,14.83,14.16,10.51.hrms-esi(m/z):[m+h]
+
calcd for[c
54h78n11
o7s]
+
1024.5801;found 1024.5806.
[0183]
(4)表1中编号为x-5的化合物
[0184]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为66%。
[0185]1h nmr(400mhz,chloroform-d)δ10.72(s,1h),8.67(s,1h),7.60(d,j=7.9hz,1h),7.52(d,j=4.6hz,1h),7.44(dd,j=8.5,2.3hz,1h),7.38(s,4h),6.90(d,j=2.3hz,1h),6.85(d,j=8.7hz,1h),6.48(d,j=8.9hz,1h),5.78
–
5.72(m,1h),5.14
–
5.05(m,1h),4.75(d,j=7.3hz,1h),4.70(t,j=7.9hz,1h),4.63(d,j=9.0hz,1h),4.49(d,j=5.5hz,1h),4.23
–
4.14(m,1h),4.07
–
3.98(m,3h),3.85(s,3h),3.63(dd,j=11.2,3.7hz,1h),3.55
–
3.46(m,2h),3.17
–
2.99(m,6h),2.74
–
2.58(s,4h),2.54
–
2.46(m 5h),2.43
–
2.35(m,3h),2.17(t,j=7.6hz,2h),2.10
–
2.03(m,3h),1.56(dd,j=12.0,4.3hz,4h),1.48(d,j=6.9hz,3h),1.30
–
1.27(m,5h),1.26
–
1.23(m,6h),1.04(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.73,171.84,170.42,170.09,152.38,151.93,151.03,150.42,148.37,143.31,136.18,135.81,131.62,129.51,126.49,117.91,112.60,112.54,105.05,69.81,66.91,58.81,58.74,57.38,56.84,55.66,53.50,53.38,50.70,48.79,47.66,36.45,35.99,35.45,33.10,31.92,31.51,30.12,29.69,29.29,29.13,29.09,27.42,26.54,25.64,24.53,22.69,22.23,16.09,14.83,14.15,10.52.hrms-esi(m/z):[m+h]
+
calcd for[c
55h80n11
o7s]
+
1038.5957;found 1038.5986.
[0186]
(5)表1中编号为x-6的化合物
[0187]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为63%。
[0188]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.67(s,1h),7.58(d,j=7.8hz,1h),7.52(d,j=4.5hz,1h),7.44(dd,j=8.6,2.3hz,1h),7.37(s,4h),6.90(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),6.48(d,j=8.9hz,1h),5.84(d,j=5.3hz,1h),5.09(t,j=7.2hz,1h),4.77(d,j=7.2hz,1h),4.70(t,j=7.8hz,1h),4.62(d,j=8.9hz,1h),4.51(s,1h),4.23
–
4.14(m,1h),4.05
–
3.96(m,3h),3.85(s,3h),3.64(dd,j=11.2,4.0hz,1h),3.53
–
3.47(m,2h),3.16
–
2.96(m,4h),2.77
–
2.63(m,4h),2.53
–
2.46(m,5h),2.45
–
2.37(m,
3h),2.17(t,j=7.6hz,2h),2.05(dd,j=13.7,3.8hz,3h),1.60
–
1.51(m,6h),1.47(d,j=6.9hz,3h),1.31
–
1.25(m,13h),1.04(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.65,171.84,170.45,170.14,152.38,151.93,151.01,150.43,148.34,143.33,136.14,135.84,131.62,130.78,130.75,126.49,117.92,112.58,105.03,69.79,66.91,58.87,58.75,57.37,56.83,55.65,53.38,50.67,48.77,47.66,38.84,36.07,35.50,33.07,29.67,29.41,29.33,29.20,28.95,27.49,25.70,24.52,23.95,22.96,22.23,16.09,14.08,10.52.hrms-esi(m/z):[m+h]
+
calcd for[c
56h82n11
o7s]
+
1052.6114;found 1052.6117.
[0189]
(6)表1中编号为x-7的化合物
[0190]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为44%。
[0191]1h nmr(400mhz,chloroform-d)δ10.71(s,1h),8.67(s,1h),7.56(d,j=7.8hz,1h),7.52(d,j=4.7hz,1h),7.45(dd,j=8.6,2.3hz,1h),7.38(d,j=1.7hz,4h),6.90(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),6.41(d,j=9.1hz,1h),5.65(d,j=4.6hz,1h),5.12
–
5.07(m,1h),4.75
–
4.68(m,2h),4.62(d,j=9.0hz,1h),4.52
–
4.49(m,1h),4.25
–
4.14(m,1h),4.07
–
3.97(m,3h),3.86(s,3h),3.63(dd,j=11.2,3.7hz,1h),3.55
–
3.47(m,2h),3.16
–
2.99(m,6h),2.73
–
2.65(m,4h),2.54
–
2.47(m,5h),2.42
–
2.37(m,3h),2.17(t,j=7.6hz,2h),2.10
–
2.04(m,3h),1.56(dd,j=12.5,4.4hz,4h),1.48(d,j=6.9hz,3h),1.31
–
1.25(m,15h),1.04(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.79,171.89,170.39,170.02,152.39,151.93,151.04,150.40,148.40,143.28,136.08,135.88,131.61,130.80,130.72,129.53,126.48,117.97,112.63,112.53,105.06,69.85,66.90,58.75,57.39,56.81,55.66,53.49,53.34,50.56,48.80,47.65,36.51,35.87,33.12,31.92,29.69,29.46,29.41,29.35,29.24,29.19,26.53,26.41,25.65,24.54,22.69,22.22.hrms-esi(m/z):[m+h]
+
calcd for[c
57h83n11
o7s]
+
1066.6270;found 1066.6302.
[0192]
(7)表1中编号为x-8的化合物
[0193]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为52%。
[0194]1h nmr(400mhz,chloroform-d)δ10.72(s,1h),8.68(s,1h),7.59(d,j=7.9hz,1h),7.53(d,j=4.5hz,1h),7.45(dd,j=8.5,2.3hz,1h),7.39(s,4h),6.91(d,j=2.3hz,1h),6.86(d,j=8.6hz,1h),6.44(d,j=8.9hz,1h),5.71(d,j=4.5hz,1h),5.10(p,j=7.0hz,1h),4.74(d,j=7.3hz,1h),4.68(d,j=8.0hz,1h),4.62(d,j=8.9hz,1h),4.50(s,1h),4.24
–
4.15(m,1h),4.08
–
3.99(m,3h),3.86(s,3h),3.63(dd,j=11.3,3.6hz,1h),3.55
–
3.47(m,2h),3.16
–
3.00(m,4h),2.76
–
2.64(m,4h),2.54
–
2.47(m,5h),2.45
–
2.36(m,3h),2.17(t,j=7.6hz,2h),2.12
–
2.03(m,3h),1.62
–
1.52(m,6h),1.49(d,j=6.9hz,3h),1.31
–
1.23(m,17h),1.05(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.87,171.84,170.40,170.06,152.39,151.92,151.04,150.43,148.38,143.27,136.23,135.78,131.60,130.80,130.69,129.52,126.49,117.90,112.59,112.54,105.04,69.86,66.91,58.80,57.39,56.83,55.65,53.41,50.76,48.80,47.65,36.52,35.90,35.38,33.11,29.69,29.54,29.52,29.49,29.43,29.28,29.24,27.60,26.64,26.53,25.68,24.54,22.21,16.09,10.51.hrms-esi(m/z):[m+h]
+
calcd for[c
58h85n11
o7s]
+
1080.6427;found 1080.6427.
[0195]
(8)表1中编号为x-10的化合物
[0196]
参照实施例8中的方法制备目标化合物,产物为黄色固体,产率为44%。
[0197]1h nmr(400mhz,chloroform-d)δ10.94(s,1h),8.67(s,1h),7.77(t,j=6.1hz,1h),7.58
–
7.50(m,2h),7.41
–
7.35(m,4h),6.88(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),6.28(d,j=8.8hz,1h),5.08(q,j=7.2hz,1h),4.72
–
4.64(m,2h),4.59(d,j=8.8hz,1h),4.50(s,1h),4.25
–
4.15(m,1h),4.05
–
3.98(m,3h),3.85(s,3h),3.62(dd,j=11.3,3.8hz,1h),3.58
–
3.49(m,2h),3.38(q,j=6.9hz,2h),3.18
–
3.01(m,4h),2.75
–
2.63(m,4h),2.51(d,j=4.3hz,5h),2.43(t,j=6.9hz,1h),2.39(s,3h),2.16(t,j=7.5hz,2h),2.11
–
2.05(d,j=15.3hz,3h),1.64
–
1.53(m,6h),1.48(d,j=6.9hz,3h),1.30
–
1.24(m,9h),1.03(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.60,171.71,170.08,167.51,152.42,151.58,150.50,150.43,148.35,143.29,136.18,135.73,131.60,130.77,130.26,129.50,126.49,118.01,113.25,111.89,104.62,69.80,66.94,58.82,57.36,56.77,55.64,55.22,50.64,48.77,47.68,45.90,38.97,36.43,36.02,35.43,33.14,31.91,29.88,29.68,29.09,28.98,26.86,26.51,25.56,24.58,22.69,22.20,16.08,14.16,10.67.hrms-esi(m/z):[m+h]
+
calcd for[c
55h80n11
o7s]
+
1038.5957;found 1038.5945.
[0198]
(9)表1中编号为x-11的化合物
[0199]
参照实施例8中的方法制备目标化合物,产物为黄色固体,产率为42%。
[0200]1h nmr(400mhz,chloroform-d)δ10.99(s,1h),8.66(s,1h),7.76(t,j=6.0hz,1h),7.58(dd,j=8.6,2.3hz,1h),7.50(d,j=7.8hz,1h),7.37(d,j=2.8hz,4h),6.86
–
6.82(m,2h),6.26(d,j=8.7hz,1h),5.10
–
5.05(m,1h),4.73
–
4.66(m,2h),4.58(d,j=8.8hz,1h),4.51
–
4.48(m,1h),4.24
–
4.15(m,1h),4.03
–
3.98(m,3h),3.84(s,3h),3.62(dd,j=11.1,3.9hz,1h),3.57
–
3.49(m,2h),3.40
–
3.35(m,2h),3.23
–
3.16(m,4h),2.83
–
2.97(m,4h),2.55
–
2.51(m,5h),2.50(s,3h),2.46
–
2.37(m,1h),2.14(t,j=7.6hz,2h),2.10
–
2.04(m,3h),1.64
–
1.51(m,6h),1.47(d,j=6.9hz,3h),1.29
–
1.24(m,13h),1.02(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.52,171.81,169.97,167.47,152.40,151.57,150.41,148.37,143.26,136.67,134.86,131.59,130.77,130.37,129.50,126.46,118.32,113.33,111.65,104.42,77.48,77.16,69.80,66.93,58.75,57.34,56.69,55.66,54.88,53.51,49.76,48.77,47.69,45.85,45.18,39.00,36.51,35.91,35.40,33.14,29.89,29.67,29.37,29.21,26.99,26.51,25.64,24.58,22.23,16.09,10.63,8.67.hrms-esi(m/z):[m+h]
+
calcd for[c
57h84n11
o7s]
+
1066.6270;found 1066.6302.
[0201]
(10)表1中编号为x-12的化合物
[0202]
参照实施例8中的方法制备目标化合物,产物为黄色固体,产率为47%。
[0203]1h nmr(400mhz,chloroform-d)δ10.99(s,1h),8.65(s,1h),7.75(t,j=6.0hz,1h),7.58(dd,j=8.6,2.3hz,1h),7.51(d,j=7.9hz,1h),7.36(d,j=1.9hz,4h),6.85
–
6.81(m,2h),6.28(d,j=8.8hz,1h),5.10
–
5.03(m,1h),4.75(d,j=7.3hz,1h),4.66(t,j=7.8hz,1h),4.57(d,j=8.8hz,1h),4.50
–
4.45(m,1h),4.22
–
4.13(m,1h),4.03
–
3.93(m,3h),3.82(s,3h),3.62(dd,j=11.2,4.1hz,1h),3.55
–
3.48(m,2h),3.39
–
3.34(m,2h),3.24
–
3.16(m,4h),3.00
–
2.84(m,4h),2.56
–
2.51(m,5h),2.49(s,3h),2.42
–
2.33(m,1h),2.12(t,j=7.6hz,2h),2.08
–
2.02(m,3h),1.63
–
1.50(m,6h),1.46(d,j=6.9hz,3h),1.28
–
1.21(m,17h),1.01(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.47,171.74,170.04,167.45,152.38,151.56,150.38,148.33,143.30,136.76,134.68,131.58,130.74,130.42,
129.48,126.45,118.36,113.31,111.58,104.37,77.55,77.23,76.91,69.78,66.93,58.79,57.33,56.69,55.65,54.82,49.59,48.75,47.69,45.89,45.05,38.98,36.52,35.44,33.11,29.88,29.50,29.47,29.43,29.29,29.24,27.00,26.51,25.68,24.56,22.22,16.08,10.61,8.65.hrms-esi(m/z):[m+h]
+
calcd for[c
59h88n11
o7s]
+
1094.6583;found 1092.6616.
[0204]
(11)表1中编号为x-13的化合物
[0205]
参照实施例5中的方法制备目标化合物,产物为黄色固体,产率为37%。
[0206]1h nmr(400mhz,chloroform-d)δ10.72(s,1h),8.67(s,1h),7.52(d,j=4.6hz,1h),7.48(t,j=6.0hz,1h),7.44(dd,j=8.6,2.3hz,1h),7.35(s,4h),6.92(d,j=2.3hz,1h),6.85(d,j=8.7hz,1h),6.41(d,j=9.0hz,1h),5.63(d,j=4.6hz,1h),4.74
–
4.69(m,2h),4.60(d,j=8.9hz,1h),4.57
–
4.51(m,2h),4.34(dd,j=15.0,5.3hz,1h),4.24
–
4.15(m,1h),4.07
–
3.98(m,3h),3.86(s,3h),3.64(dd,j=11.2,3.6hz,1h),3.55
–
3.48(m,2h),3.14
–
3.00(m,4h),2.72
–
2.60(m,4h),2.52
–
2.49(m,5h),2.48
–
2.43(m,1h),2.37(t,j=7.9hz,2h),2.23
–
2.13(m,3h),2.10
–
2.04(m,2h),1.63
–
1.54(m,4h),1.50(d,j=10.3hz,2h),1.31
–
1.27(m,9h),0.95(s,9h).
13
c nmr(100mhz,chloroform-d)δ173.66,171.74,171.07,170.36,152.39,151.91,151.04,150.37,148.38,138.18,136.31,135.74,131.64,130.84,130.65,129.46,128.04,117.82,112.63,112.56,105.07,69.80,66.91,58.79,57.30,56.93,55.66,53.48,50.89,47.65,46.02,43.17,36.41,36.29,35.31,33.13,29.69,29.00,28.85,27.23,26.43,25.45,24.54,16.07,10.51.hrms-esi(m/z):[m+h]
+
calcd for[c
53h76n11
o7s]
+
1010.5644;found 1010.5645.
[0207]
(12)表1中编号为x-15的化合物
[0208]
参照实施例6中的方法制备目标化合物,产物为黄色固体,产率为29%。
[0209]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),7.65(dd,j=8.5,7.3hz,1h),7.50(d,j=4.6hz,1h),7.46(dd,j=8.6,2.3hz,1h),7.42(d,j=7.2hz,1h),7.19(d,j=8.5hz,1h),6.89(d,j=2.3hz,1h),6.85(d,j=8.6hz,1h),5.60(d,j=4.6hz,1h),4.97
–
4.92(m,1h),4.74(d,j=7.2hz,1h),4.22
–
4.10(m,3h),4.04
–
3.97(m,2h),3.84(s,3h),3.55
–
3.46(m,2h),3.17
–
3.01(m,4h),2.89
–
2.64(m,7h),2.53
–
2.47(m,2h),2.46
–
2.41(m,2h),2.14
–
2.03(m,3h),1.91
–
1.82(m,2h),1.59
–
1.46(m,6h),1.39
–
1.31(m,6h),1.29
–
1.27(m,3h).
13
c nmr(100mhz,chloroform-d)δ171.89,170.45,168.94,167.18,165.78,156.64,152.37,151.92,151.02,136.48,136.16,135.81,133.76,130.72,118.94,117.86,117.03,115.62,112.50,112.39,104.93,69.51,66.89,58.73,55.62,53.29,50.69,49.12,47.68,45.87,33.05,31.49,29.68,29.39,29.11,28.77,27.51,26.44,25.88,24.50,22.69,14.83,10.49,9.32.hrms-esi(m/z):[m+h]
+
calcd for[c
44h58
n9o8]
+
840.4403;found 840.4427.
[0210]
(13)表1中编号为x-16的化合物
[0211]
参照实施例6中的方法制备目标化合物,产物为黄色固体,产率为37%。
[0212]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.86(s,1h),7.78(d,j=7.9hz,1h),7.63(d,j=7.4hz,1h),7.53(d,j=4.8hz,1h),7.46
–
7.39(m,2h),6.92(d,j=2.3hz,1h),6.83(d,j=8.7hz,1h),5.59(d,j=4.6hz,1h),4.99(dd,j=12.7,5.4hz,1h),4.74(d,j=7.2hz,1h),4.40
–
4.31(s,2h),4.23
–
4.13(m,1h),4.04
–
3.96(m,2h),3.84(s,3h),3.55
–
3.46(m,2h),3.17
–
2.96(m,4h),2.76
–
2.61(m,5h),2.53
–
2.39(m,6h),2.11
–
2.03(m,3h),1.80
–
1.69(m,2h),1.62
–
1.51(m,4h),1.41
–
1.34(m,2h),1.32
–
1.24(m,5h).
13
c nmr(100mhz,chloroform-d)δ172.30,172.00,170.42,169.15,152.38,151.95,151.04,136.15,135.80,134.11,133.29,132.58,130.82,126.26,117.88,112.54,105.07,66.88,58.25,55.67,53.28,52.07,50.61,47.68,36.43,34.50,33.09,31.92,29.70,26.93,26.05,25.34,24.53,23.11,10.50.hrms-esi(m/z):[m+h]
+
calcd for[c
42h55n10
o7]
+
811.4250;found 811.4273.
[0213]
(14)表1中编号为x-17的化合物
[0214]
参照实施例6中的方法制备目标化合物,产物为黄色固体,产率为43%。
[0215]1h nmr(400mhz,chloroform-d)δ10.72(s,1h),9.14(s,1h),7.74(d,j=7.6hz,1h),7.59(d,j=7.1hz,1h),7.52(s,1h),7.40(d,j=8.9hz,2h),6.90(s,1h),6.80(d,j=8.6hz,1h),5.83(s,1h),5.10
–
5.01(m,1h),4.87(d,j=6.8hz,1h),4.50
–
4.25(m,2h),4.14(s,1h),4.02
–
3.93(m,2h),3.80(s,3h),3.47(t,j=10.9hz,2h),3.19
–
3.02(m,4h),2.97(q,j=7.3hz,1h),2.92
–
2.70(m,4h),2.69
–
2.60(m,1h),2.53
–
2.41(m,5h),2.07
–
1.96(m,3h),1.72
–
1.61(m,2h),1.59
–
1.46(m,4h),1.33
–
1.18(m,11h).
13
c nmr(100mhz,chloroform-d)δ172.67,172.51,170.69,170.53,169.28,152.34,151.97,150.95,136.13,135.50,134.28,133.41,132.47,131.12,118.10,112.35,104.97,66.86,55.69,53.55,53.01,49.90,47.68,45.98,32.94,29.68,28.96,27.07,25.56,24.50,10.50,8.86.hrms-esi(m/z):[m+h]
+
calcd for[c
44h59n10
o7]
+
839.4563;found 839.4581.
[0216]
(15)表1中编号为x-18的化合物
[0217]
参照实施例6中的方法制备目标化合物,产物为黄色固体,产率为38%。
[0218]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.62(s,1h),7.68(t,j=6.1hz,2h),7.56
–
7.50(m,1h),7.49
–
7.43(m,2h),6.90(s,1h),6.85(d,j=8.7hz,1h),5.43
–
5.37(m,1h),5.17(dd,j=13.5,5.5hz,1h),4.72(d,j=7.3hz,1h),4.50(d,j=16.8hz,1h),4.35(d,j=16.6hz,1h),4.24
–
4.15(m,1h),4.03(d,j=11.3hz,2h),3.86(s,3h),3.53(t,j=11.5hz,2h),3.17
–
3.05(m,5h),2.88
–
2.71(m,4h),2.57
–
2.44(m,6h),2.18
–
2.07(m,3h),1.73(p,j=7.4hz,2h),1.62
–
1.52(m,4h),1.42
–
1.29(m,15h).
13
c nmr(100mhz,chloroform-d)δ172.48,172.36,170.59,170.41,169.23,152.34,151.96,151.04,136.03,135.84,134.44,133.22,132.54,130.84,128.93,126.42,120.58,117.92,112.58,112.49,105.04,66.88,62.51,58.45,55.66,53.14,51.76,50.45,47.65,46.72,45.84,36.74,33.06,32.58,31.61,29.70,29.32,29.24,29.18,27.35,26.11,25.68,24.54,23.33,10.50,9.40.hrms-esi(m/z):[m+h]
+
calcd for[c
46h63n10
o7]
+
867.4876;found 867.4902.
[0219]
(16)表1中编号为x-20的化合物
[0220]
参照实施例10中的方法制备目标化合物,产物为黄色固体,产率为49%。
[0221]1h nmr(400mhz,chloroform-d)δ10.72(s,1h),8.65(s,1h),7.67(d,j=7.7hz,1h),7.50(d,j=4.4hz,1h),7.42(dd,j=8.6,2.3hz,1h),7.38(d,j=4.5hz,1h),7.37
–
7.32(m,4h),6.89(d,j=2.3hz,1h),6.82(d,j=8.6hz,1h),5.77(d,j=4.4hz,1h),5.06(p,j=7.0hz,1h),4.77
–
4.69(m,2h),4.60(d,j=8.9hz,1h),4.21
–
4.12(m,1h),4.03
–
3.95(m,5h),3.83(s,3h),3.74
–
3.58(m,13h),3.52
–
3.45(m,2h),3.25
–
3.16(m,1h),3.09
–
3.01
(m,4h),2.74
–
2.65(m,4h),2.53
–
2.47(m,6h),2.42
–
2.34(m,1h),2.05
–
2.01(m,2h),1.60
–
1.50(m,2h),1.46(d,j=6.9hz,3h),1.26(t,j=7.4hz,3h),1.04(s,9h).
13
c nmr(100mhz,cdcl3)δ171.17,170.38,170.20,170.12,152.37,151.90,151.01,150.36,148.33,143.41,136.27,135.74,131.65,130.67,130.65,129.46,127.84,126.40,117.85,112.61,112.53,105.07,76.92,71.11,70.60,70.43,70.32,69.81,68.72,66.89,58.75,57.81,56.95,56.77,55.64,53.81,50.81,48.80,47.64,46.09,36.02,35.50,33.08,26.49,24.51,22.33,16.07,11.36,10.53.hrms-esi(m/z):[m+h]
+
calcd for[c
54h78n11o10
s]
+
1072.5648;found 1072.6564.
[0222]
(17)表1中编号为x-21的化合物
[0223]
参照实施例10中的方法制备目标化合物,产物为黄色固体,产率为16%。
[0224]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.69(s,1h),7.92(d,j=8.6hz,1h),7.55
–
7.50(m,2h),7.50
–
7.47(m,1h),7.43
–
7.36(m,4h),6.91(d,j=2.3hz,1h),6.86(d,j=8.6hz,1h),5.42(d,j=4.6hz,1h),5.08(q,j=7.2hz,1h),4.76(t,j=7.9hz,1h),4.69(d,j=7.3hz,1h),4.50(d,j=8.7hz,2h),4.25
–
4.18(m,1h),4.14(d,j=11.3hz,1h),4.06
–
4.00(m,2h),3.88(s,3h),3.62(dd,j=11.3,3.8hz,1h),3.57
–
3.49(m,2h),3.15
–
3.01(m,6h),2.77
–
2.69(m,4h),2.67
–
2.55(m,12h),2.54
–
2.51(m,5h),2.15
–
2.02(m,4h),1.62
–
1.54(m,2h),1.50(d,j=6.9hz,3h),1.30(t,j=7.4hz,3h),1.08(s,9h).
13
c nmr(100mhz,cdcl3)δ171.53,170.98,170.32,169.88,152.40,151.92,151.05,150.37,148.44,143.25,136.21,135.80,131.64,130.79,130.65,129.55,126.43,117.83,112.64,112.51,105.03,69.97,66.93,61.12,58.39,57.22,55.69,53.90,53.78,53.44,50.89,48.87,47.68,35.55,34.92,33.15,29.71,26.56,24.55,22.32,16.12,10.52.hrms-esi(m/z):[m+h]
+
calcd for[c
54h78n13
o7s]
+
1052.5862;found 1052.5852.
[0225]
(18)表1中编号为x-22的化合物
[0226]
参照实施例10中的方法制备目标化合物,产物为黄色固体,产率为45%。
[0227]1h nmr(400mhz,chloroform-d)δ10.73(s,1h),8.68(s,1h),7.97(d,j=8.5hz,1h),7.60(d,j=7.8hz,1h),7.52(d,j=4.6hz,1h),7.47(dd,j=8.6,2.3hz,1h),7.41
–
7.36(m,4h),6.91(d,j=2.3hz,1h),6.86(d,j=8.7hz,1h),5.54
–
5.48(m,1h),5.12
–
5.05(m,1h),4.77(t,j=7.8hz,1h),4.70(d,j=7.4hz,1h),4.49(d,j=8.6hz,1h),4.25
–
4.15(m,1h),4.15
–
4.10(m,1h),4.04
–
3.99(m,2h),3.87(s,3h),3.63(dd,j=11.3,4.2hz,1h),3.55
–
3.49(m,2h),3.14
–
3.03(m,4h),2.89
–
2.77(m,4h),2.71
–
2.62(m,4h),2.56
–
2.47(m,7h),2.44(t,j=6.8hz,2h),2.18(dd,j=31.8,10.9hz,2h),2.11
–
2.03(m,4h),1.74(t,j=11.6hz,2h),1.64
–
1.50(m,4h),1.49(d,j=7.0hz,3h),1.30(t,j=7.3hz,5h),1.08(s,9h).
13
c nmr(100mhz,cdcl3)δ171.61,171.39,170.36,169.89,152.38,151.93,151.04,150.44,148.41,143.33,135.99,135.87,131.67,130.71,129.53,126.44,117.98,112.64,112.47,105.01,69.97,66.91,58.36,57.24,55.95,55.68,54.29,53.10,50.33,48.86,47.67,45.14,34.89,33.63,33.15,32.68,26.54,24.55,22.33,16.10,10.51,8.70.hrms-esi(m/z):[m+h]
+
calcd for[c
55h78n12
o7s]
+
1051.5910;found 1051.5922.
[0228]
以上合成的本发明的目标化合物的化学结构见表1。表1中其他化合物通过上述方法均可制备得到。
[0229]
实施例13、靶向降解flt3-itd突变蛋白的protac类化合物的生物活性测试
[0230]
(1)靶向降解flt3-itd突变蛋白的protac类化合物细胞抑制活性测试:
[0231]
采用cck-8实验检测药物ic
50
值。实验中首先取对数生长期的细胞。与1000rpm下5min离心后,弃上清。用含10%fbs的完全培养基重悬细胞。随后进行细胞计数并调整细胞浓度后,以每孔10000个的密度接种于96孔板中。并调整药物浓度梯度为0,0.1,1,5,10,20,50,100,500,1000nm,每孔内培养基总体积为100μl,至少设置3个复孔,无细胞的孔用完全培养基作为空白对照,96孔板周边用无菌的pbs填充。在细胞培养的第72h时,向每孔内加入10μl cell counting kit 8(cck-8)溶液,将细胞混匀后继续放回细胞培养箱内培养。培养1-4h后,取出细胞(避免污染),使用多功能酶标仪检测450nm波长处的每孔吸光度(od)值,并计算药物ic
50
值。
[0232]
(2)靶向降解flt3-itd突变蛋白的protac类化合物细胞降解活性测试:
[0233]
通过流式细胞仪检测细胞表面flt3蛋白的表达。实验中取对数生长期的细胞,1000rpm下5min离心后,弃上清,用无菌的pbs重悬细胞。随后进行细胞计数并调整细胞浓度后,以5
×
105cells/孔的密度接种于六孔板中。调整药物浓度梯度为0,1,10,100nm,每孔总体积为2ml,至少设置3个复孔,置培养箱内孵育12h。1000rpm 5min离心沉淀细胞,弃上清。用pbs离心洗涤1-2次,弃上清,用50μl pbs重悬细胞,并加入适当浓度的流式抗体cd135,常温避光孵育30min。1000rpm 5min离心沉淀细胞,弃上清。每管加入400μl pbs重悬。过滤后,流式细胞检测仪上机检测凋亡率。
[0234]
本发明以吉列替尼与其衍生物9为对照,对所合成的化合物进行了细胞抑制活性(ic
50
)和蛋白降解活性测试,细胞抑制活性结果如表2所示,蛋白降解活性图1所示。其中molm-13细胞时携带flt3-itd突变的人源急性髓系白血病细胞株,所有活性结果均以nm计算。
[0235]
表2:本发明合成的部分化合物细胞抑制活性结果
[0236][0237]
从以上生物活性结果可以看出,大多数化合物具有极好的细胞抑制活性,ic
50
可达纳摩尔水平,且化合物x-22活性与对照药物吉列替尼相当。另一方面在降解活性测试中可以看到多数化合物尤其是基于带甲基的vhl配体的protac分子表现出优秀的蛋白降解能力,作为一类新型的降解剂可为aml的治疗提供新的思路。
[0238]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0239]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0240]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1