一种骨肉瘤类器官模型、构建方法及应用
1.本发明涉及医药领域,特别是涉及一种骨肉瘤类器官模型、构建方法及应用。
背景技术:
2.目前,肿瘤相关的生物医学研究主要依赖于体外培养的人体细胞或啮齿动物模型。虽然 利用体外培养细胞进行研究可以直接反映出药物的效应,但在生理学功能方面的反应则与人 体真实生理功能仍有明显不同。与之相比,动物模型能够模拟某一器官或多器官水平的生理 功能,但其局限性在于动物和人类生理功能固有的差异会使得部分对肿瘤有效的候选药物在 人体试验时面临失败的风险。生物仿生系统尤其是器官芯片是近年来出现的体外研究组织生 理,病理功能的重要模型。它是指建立在微流体芯片上的微型工程化仿生机体组织系统,可 以结合人体细胞体外模拟模型以及啮齿动物模型的优点,通过模拟人体血液循环系统的作用 培养人体组织,构建出与人体组织相似的组织结构。通过开发和利用这些微循环系统,可以 建立体外组织生理、病理疾病模型以理解生物学机制,并进行潜在药物的筛选。以上研究表 明这些微流控系统在医学领域的生物医学,药物和毒理学应用中具有巨大潜力。
3.尽管器官芯片在临床应用有着巨大的应用前景。现有的3d骨肉瘤器官芯片因为加工工 艺的影响,仍然不能微观地调控骨肉瘤基质的空间结构以及细胞分布等,也不能准确地调控 基质中氧及营养物质的交换,因此不能在微观水平上精确模拟骨肉瘤组织的高增殖活性、高 细胞密度以及强基质-细胞相互作用的特性,与体内活性骨肉瘤组织仍有一定差距。并且, 单一器官芯片目前只是单一的研究循环系统的机械刺激对于生理病理行为的影响,其大大忽 视了其他实质器官生物功能及代谢行为与肿瘤发生发展以及治疗的关系,因为不能很好的模 拟体内的生物进程。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种骨肉瘤类器官模型、构建方 法及应用。
5.本发明通过“3d生物打印技术”以及“类器官芯片模型”的结合应用,(1)在微流控 芯片上3d打印dosem-fibrin水凝胶支架负载病人骨肉瘤细胞和bmsc-ev,构建出可模拟 体内骨肉瘤基质微环境的成分-结构多级仿生的类器官动态培养模型。并通过3d多级仿生类 器官芯片筛选药物联用方案用于高增殖活性骨肉瘤的治疗潜力。
6.本发明通过在微流控芯片上3d打印骨组织脱细胞基质(dosem-fibrin)的水凝胶支架, 结合骨肉瘤细胞以及bmsc-ev构建出可模拟体内骨肉瘤高增殖及转移活性的多级仿生骨肉 瘤类器官动态培养模型。并探究多种抑制剂联合骨肉瘤一线化疗药物对于高增殖活性骨肉瘤 的治疗效果,明确本模型在骨肉瘤个性化诊治中的应用价值。
7.本发明将有助于深入了解生理、病理微环境中的理化成分及物理结构对骨肉瘤细胞增 殖、粘附行为的具体作用及其机制,明确基于3d生物打印构建的多级仿生肿瘤器官芯
片检 测平台用于骨肉瘤体外药物筛选的重要意义,并为目前全新的生物治疗、免疫治疗以及靶向 治疗提供更接近人体的临床前药物评价平台。
8.本发明第一方面提供一种骨肉瘤类器官模型,所述骨肉瘤模型类器官模型至少包括生物 支架和负载于生物支架上的骨肉瘤细胞和骨髓间充质干细胞来源的外泌体;所述生物支架是 用水凝胶制剂构造的纵横交错的立体结构,所述水凝胶制剂包括脱细胞基质和纤维蛋白。
9.本发明第二方面提供一种骨肉瘤类器官模型的构建方法,至少包括如下步骤:
10.将骨髓间充质干细胞来源的外泌体和骨肉瘤细胞负载于所述生物支架上,获得骨肉瘤类 器官模型;所述生物支架是用水凝胶制剂构造的纵横交错的立体结构,所述水凝胶制剂包括 脱细胞基质和纤维蛋白。
11.本发明第三方面提供一种微流控芯片,所述微流控芯片上包含:
12.类器官培养区,所述类器官培养区内含有前述的骨肉瘤类器官模型;
13.进液口,与所述类器官培养区连通,用于泵入流体;
14.出液口,与所述类器官培养区连通,用于排出流体;
15.微流道,用于连通类器官培养区、进液口和出液口。
16.本发明第四方面提供一种微流控芯片的制备方法,至少包括如下步骤:将前述的骨肉瘤 类器官置于类器官培养区;将流体通过进液口注入为微流道和类器官培养区,获得所述微流 控芯片。
17.本发明第五方面提供一种骨肉瘤模型类器官动态培养模型,所述动态培养模型包括前述 的微流控芯片和微流泵,所述微流泵与所述微流控芯片中的进液口和出液口连通,用于为微 流控芯片内的流体流动提供动力。
18.本发明第六方面提供前述的骨肉瘤类器官模型或前述的微流控芯片或前述的骨肉瘤模型 类器官动态培养模型在抗骨肉瘤药物筛选中的应用。
19.如上所述,本发明的一种骨肉瘤类器官模型、构建方法及应用,具有以下有益效果:
20.(1)本发明结合了目前国际上最为前沿的3d生物打印技术和类器官芯片筛选平台的优 点,又对其进一步深化和创新,首次使用dosem-fibrin水凝胶负载系统结合bmsc-ev,通 过使用3d生物打印技术在微流控芯片上一体化构建“成分-结构”多级仿生优化的骨肉瘤类 器官芯片,构建出可模拟体内骨肉瘤基质微环境的类器官动态培养模型,同时为后续生理及 病理性骨组织的体外3d培养也奠定了理想的模型基础。
21.(2)本发明以骨基质间充质干细胞外泌体(bmsc-ev)作为研究对象,创新性地探究 骨肉瘤基质微环境下bmsc-ev激活cxcl12/cxcr4信号轴调控骨肉瘤细胞增殖及侵袭的具 体作用机制。系统性地阐明了3d骨肉瘤类器官芯片相比较2d培养模型更好地模拟了体内骨 肉瘤基质-细胞相互作用下cxcl12/cxcr4的调控作用,揭示了该模型的潜在应用价值。此 外,本项目创新地深入揭示了bmsc通过分泌外泌体与基质成分共同影响骨肉瘤基质微环 境,调控骨肉瘤细胞的增殖及转移行为。
22.(3)本发明创新性地通过多级仿生类器官芯片研究cxcr4特异性抑制剂plerixafor联合 骨肉瘤一线化疗药物对于高增殖活性骨肉瘤的治疗效果,进一步验证3d打印多级仿生骨肉 瘤类器官芯片模拟体内药物作用的优势,为骨肉瘤个性化的多药物治
chip) 组与常规2d单细胞培养(2d mono)组的比较,通过使用mtt检测细胞活性得到细胞对于 不同药物的半数致死量(ic50)结果。
38.图11:本发明的技术路线图。
39.图12:本发明的应用方式流程图。
40.1-类器官培养区
41.2-进液口
42.3-出液口
43.4-微流道
44.5-盖板
45.6-底板
46.7-粘性薄膜
具体实施方式
47.3d生物打印技术构建微型肿瘤组织
48.首先,3d打印技术是一种构建组织生物支架的有效方式。相比较于其他3d培养模型, 其可以精确排布细胞与细胞外基质,控制局部组织微环境,进而可以构造出体内组织类似的 形态以及机械环境,模拟体内细胞与细胞,细胞与细胞外基质的相互作用。此外,其可以通 过将材料与细胞提前共混并通过挤出后规律性排布,精确控制支架内部孔隙率,以利于氧气 以及营养物质传输及代谢废物的交换,进而维持支架内部细胞的存活。近年来,构建生物水 凝胶负载干细胞作为打印墨水的3d生物打印活性支架在组织再生以及修复方向展现了较高 的潜力。其主要包括三个有机组成成分:功能性细胞,生物支架材料,以及负载的生物活性 成分。其中生物支架材料及其负载的生物活性成分的选择是此项技术的核心以及难点。负载 的生物活性成分方面。并且,通过借助3d生物打印技术特有的高精度加工工艺可以更好的 实现微型组织构建,进而更好的模拟组织微观的成分以及结构,以缓解传统组织芯片在此领 域的不足。
49.此外,3d生物打印技术在构建实体肿瘤模型方面也展现了其独特的优势。传统2d手段 构建肿瘤组织受限巨大,其原因在于二维单层细胞模型缺乏体内肿瘤组织天然微环境特征。 另一方面,在免疫功能低下的小鼠中建立的啮齿类动物荷瘤模型也不能很好的模拟人体内肿 瘤的发展和进。为了克服以上障碍,越来越多的研究开始使用基于人类癌细胞的体外3d肿 瘤模型以准确模拟人体癌症组织特征,进而研究其对于肿瘤细胞形态、增值、药物代谢、基 因表达以及蛋白合成的影响。相关技术例如多细胞球体技术、3d支架接种技术、水凝胶嵌入 技术、微流控芯片和细胞图案等也被开发用于3d体外肿瘤模型的构建。尽管这些研究揭示 了体外3d肿瘤模型的巨大应用潜力,但由于制造技术的限制,在上述大多数模型中仍然难 以模拟复杂的3d肿瘤微环境。而3d生物技术通过构建肿瘤细胞,细胞外基质(ecm)材料的 相互作用进而为研究疾病发病机制的研究和新药的发现提供更多可能性。3d打印支架相较于 传统的2d平面培养模型具有更高的肿瘤增值活性以及集落形成能力。3d生物打印技术可 以更好地模拟肿瘤细胞-细胞外基质(ecm)的相互作用,精确控制支架内部营养物质传输,更 精确地模拟体内高增殖活性肿瘤组织的病理微环境。
50.3d生物打印技术构建出可模拟体内骨肉瘤基质微环境的成分-结构多级仿生的类
器官动 态培养模型
51.但是,制备dosem脱细胞基质中涉及的一些化学制剂处理可能破坏基质微环境中的生物 活性蛋白,尤其是以骨髓间充质干细胞(bmsc)为代表的外泌体(bmsc-ev)以及信号分 子等,因此基于dosem-fibrin水凝胶构建的类器官芯片并不能很好地模拟基质中bmsc与 骨肉瘤细胞的相互作用。而bmsc,作为骨微环境中重要的组成成分,是骨髓中具有多向分 化潜力及免疫调控功能的细胞,已被研究证明参与肿瘤组织的增殖、迁移、肿瘤微环境的形 成、及与肿瘤细胞相互作用等,并且bmsc也被研究证实可通过分泌一系列细胞因子如il-6, vegf,tnf-a等,促进肿瘤细胞生长,转移以及免疫逃逸。其中干细胞分泌的外泌体 (bmsc-ev)作为分泌因子的主要负载媒介,是bmsc在胞外环境中分泌的直径40-100nm 的小泡。其中含蛋白质、脂质和核酸等。近年来,大量研究证实了bmsc-ev可影响肿瘤的 发生和进展,并且间充质干细胞也可以通过调控血管新生、稳定和成熟来调控肿瘤内血管的 形成并进一步促进肿瘤组织内部细胞的增殖。但是目前,对于骨髓微环境中bmsc-ev促进 骨肉瘤细胞生长及转移的具体作用形式以及机制尚不明确。为了更好地模拟基质中bmsc与 骨肉瘤细胞的相互作用,本发明将类器官芯片内部dosem-fibrin水凝胶中补充bmsc-ev成 分以观察细胞增殖能力以及细胞-基质的相互作用。
52.因此,本发明通过在微流控芯片上3d打印基于dosem-fibrin的水凝胶支架(结构仿生) 复合骨肉瘤细胞和bmsc-ev(成分仿生),可以构建出类似体内高增殖活性、强基质-细胞相 互作用的成分-结构多级仿生的骨肉瘤模型。相比较于2d培养模型,其可以更准确地模拟体 内骨肉瘤组织相关信号通路的表达,以及对下游增殖、粘附、迁移等细胞表型的影响(图6)。
53.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露 的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加 以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精 神下进行各种修饰或改变。
54.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定 的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案, 而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指 出,单数形式“一个”、“一”和“这个”包括复数形式。
55.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以 及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术 语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外, 如本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中 所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
56.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常 规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相 关领域的常规技术。
57.本发明所述的方法或应用场景均用于非诊断和治疗用途,例如可以用于基础研究。
58.本发明一实施例提供一种骨肉瘤类器官模型,所述骨肉瘤模型类器官模型至少包括生物 支架和负载于生物支架上的骨肉瘤细胞和骨髓间充质干细胞来源的外泌体(bmsc-ev);所 述生物支架是用水凝胶制剂构造的纵横交错的立体结构,所述水凝胶制剂包括脱细胞基质和 纤维蛋白。
59.优选的,所述脱细胞基质为骨肉瘤组织的脱细胞基质。
60.在一种实施方式中,所述骨肉瘤组织来源于人。
61.在一种实施方式中,所述纤维蛋白(fibrin)可以来源于牛,人,兔,大鼠等血浆或者细 菌提取物。
62.在一种实施方式中,可以利用纤维蛋白原和凝血酶反应生成纤维蛋白。凝血酶thrombin 可以来源于牛,人,兔,大鼠等血浆或者细菌提取物。例如可以使用纤维蛋白原fibrinogen frombovine plasma(f8630-10g,sigma)和凝血酶thrombin(t4648-1ku,sigma)反应生成纤维蛋白。
63.所述骨肉瘤细胞为活细胞。
64.在一种实施方式中,所述骨肉瘤细胞来源于人。例如,可以为mg63或者骨肉瘤患者的 骨肉瘤细胞。
65.在一种实施方式中,以水凝胶制剂的总量为基准计,所述脱细胞基质的浓度大于0且≤ 60mg/ml。例如,60mg/ml表示所述脱细胞基质dosem占据水凝胶制剂总量的浓度为 60mg/ml。可以为大于0且≤60mg/ml,大于0且≤50mg/ml,大于0且≤40mg/ml,大于0 且≤30mg/ml,大于0且≤20mg/ml,大于0且≤10mg/ml,10mg/ml-60mg/ml,10mg/ml
ꢀ‑
50mg/ml,10mg/ml-40mg/ml,10mg/ml-30mg/ml,10mg/ml-20mg/ml,20mg/ml
ꢀ‑
60mg/ml,20mg/ml-50mg/ml,20mg/ml-40mg/ml,20mg/ml-30mg/ml,30mg/ml
ꢀ‑
60mg/ml,30mg/ml-50mg/ml,30mg/ml-40mg/ml,40mg/ml-60mg/ml,40mg/ml
ꢀ‑
50mg/ml,或50mg/ml-60mg/ml。
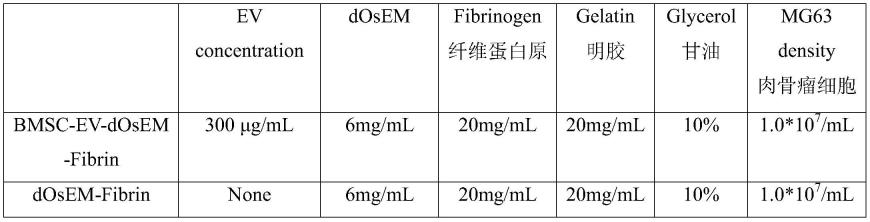
66.优选的,以水凝胶制剂的总量为基准计,所述脱细胞基质的浓度为6mg/ml。
67.在一种实施方式中,以水凝胶制剂的总量为基准计,所述纤维蛋白的浓度大于0且≤ 60mg/ml。60mg/ml表示所述纤维蛋白占据水凝胶制剂总量的浓度为60mg/ml。可以为,大 于0且≤60mg/ml,大于0且≤50mg/ml,大于0且≤40mg/ml,大于0且≤30mg/ml,大 于0且≤20mg/ml,大于0且≤10mg/ml;10mg/ml-60mg/ml,10mg/ml-50mg/ml,10mg/ml
ꢀ‑
40mg/ml,10mg/ml-30mg/ml,10mg/ml-20mg/ml;20mg/ml-60mg/ml,20mg/ml
ꢀ‑
50mg/ml,20mg/ml-40mg/ml,20mg/ml-30mg/ml;30mg/ml-60mg/ml,30mg/ml
ꢀ‑
50mg/ml,30mg/ml-40mg/ml;40mg/ml-60mg/ml,40mg/ml-50mg/ml或50mg/ml
ꢀ‑
60mg/ml。
68.优选的,以水凝胶制剂的总量为基准计,所述纤维蛋白的浓度为20mg/ml。
69.在一种实施方式中,以水凝胶制剂的总量为基准计,所述骨髓间充质干细胞来源的外泌 体的浓度大于0且≤300mg/ml。外泌体浓度是通过bca蛋白检测试剂盒(23227,theromofisher)计算(此方法为业内对外泌体浓度检测的金标准)。例如300mg/ml表示1ml 水凝胶制剂可负载300mg骨髓间充质干细胞来源的外泌体。可以为大于0且≤300mg/ml, 大于0且≤200mg/ml,大于0且≤100mg/ml,大于0且≤50mg/ml,大于0且≤10mg/ml, 大于0且≤1mg/ml,大于0且≤500μg/ml,大于0且≤300μg/ml,大于0且≤100μg/ml; 100μg/ml-300mg/ml,100μg/ml-200mg/ml,100μg/ml-100mg/ml,100μg/ml
ꢀ‑
50mg/ml,100μg/ml-10mg/ml,100μg/ml-1mg/ml,100μg/ml-500μg/ml,100μg/ml
ꢀ‑
300μg/ml,300μg/ml-300mg/ml,300
μg/ml-300mg/ml,300μg/ml-100mg/ml,300 μg/ml-50mg/ml,300μg/ml-10mg/ml,300μg/ml-1mg/ml,300μg/ml-500μg/ml,500 μg/ml-300mg/ml,500μg/ml-300mg/ml,500μg/ml-100mg/ml,500μg/ml-50mg/ml, 500μg/ml-10mg/ml,500μg/ml-1mg/ml;1mg/ml-300mg/ml,1mg/ml-200mg/ml, 1mg/ml-100mg/ml,1mg/ml-50mg/ml,1mg/ml-10mg/ml;10mg/ml-300mg/ml,10mg/ml
ꢀ‑
200mg/ml,10mg/ml-100mg/ml,10mg/ml-50mg/ml;100mg/ml-300mg/ml,100mg/ml
ꢀ‑
200mg/ml或200mg/ml-300mg/ml。
70.优选的,以水凝胶制剂的总量为基准计,所述骨髓间充质干细胞来源的外泌体的浓度为 300μg/ml。
71.在一种实施方式中,以水凝胶制剂的总量为基准计,所述骨肉瘤细胞的含量为大于0且 ≤8*107/ml。例如8*107/表示1ml水凝胶制剂可负载8*107个骨肉瘤细胞。
72.可以为大于0且≤8*107/ml,大于0且≤6*107/ml,大于0且≤4*107/ml,大于0且≤ 2*107/ml,大于0且≤1*107/ml;1*107/ml-8*107/ml,1*107/ml-6*107/ml,1*107/ml
ꢀ‑
4*107/ml,1*107/ml-2*107/ml;2*107/ml-8*107/ml,2*107/ml-6*107/ml,2*107/ml
ꢀ‑
4*107/ml;4*107/ml-8*107/ml,4*107/ml-6*107/ml或6*107/ml-8*107/ml。
73.优选的,以水凝胶制剂的总量为基准计,所述骨肉瘤细胞的含量为1*107/ml。
74.可选的,所述骨髓间充质干细胞来源的外泌体可以来源于动物。进一步的,为哺乳动物。 可选的,可以为啮齿类、灵长类、偶蹄类、人类等。例如,老鼠,兔子,猴子,猩猩,猿, 牛,猪,人等。
75.在一种实施方式中,所述水凝胶制剂中还包括明胶。
76.可选的,以水凝胶制剂的总量为基准计,所述明胶的浓度为大于0且≤60mg/ml。例如, 60mg/ml表示所述明胶占据水凝胶制剂总量的浓度为60mg/ml。可以为大于0且≤60mg/ml, 大于0且≤50mg/ml,大于0且≤40mg/ml,大于0且≤30mg/ml,大于0且≤20mg/ml,大 于0且≤10mg/ml,10mg/ml-60mg/ml,10mg/ml-50mg/ml,10mg/ml-40mg/ml,10mg/ml
ꢀ‑
30mg/ml,10mg/ml-20mg/ml,20mg/ml-60mg/ml,20mg/ml-50mg/ml,20mg/ml
ꢀ‑
40mg/ml,20mg/ml-30mg/ml,30mg/ml-60mg/ml,30mg/ml-50mg/ml,30mg/ml
ꢀ‑
40mg/ml,40mg/ml-60mg/ml,40mg/ml-50mg/ml,或50mg/ml-60mg/ml。
77.优选的,以水凝胶制剂的总量为基准计,所述明胶的浓度为20mg/ml。
78.在一种实施方式中,所述骨肉瘤模型类器官模型中还包括甘油。用于降低挤压引起的细 胞损伤。
79.可选的,以水凝胶制剂的总量为基准计,所述甘油的体积分数为大于0且≤30%。可以为 大于0且≤30%,大于0且≤20%,大于0且≤10%,10%-30%,10%-20%或20%-30%。
80.本发明通过构建骨肉瘤组织的脱细胞基质(decellularized osteosarcoma extracellularmatrix,dosem)(图4),并结合fibrin材料,构建了dosem-fibrin水凝胶,其后通过cck8 法对5种水凝胶alginate,gelma,hgp,collagen,dosem-fibrin进行细胞增殖活性的比较,验 证了制备的dosem-fibrin水凝胶可以更好地促进骨肉瘤细胞系(mg63细胞)的体外增殖。 并且相比较于传统3d培养的alginate水凝胶,dosem-fibrin水凝胶可以显著地提升骨肉瘤 细胞的粘附以及增殖活性rna-seq分析结果显示相比较于2d常规培养,dosem-fibrin水凝 胶可以显著促进骨肉瘤细胞增殖、粘附、基质-受体的相互作用。以上结
果初步证明了 dosem-fibrin水凝胶相比较于2d培养模型以及其他3d培养水凝胶模型,可以更真实地模拟 骨肉瘤细胞-基质间的相互作用,更显著地提升骨肉瘤细胞的活性以及增殖能力。
81.本发明发现,制备dosem脱细胞基质中涉及的一些化学制剂处理可能破坏基质微环境中 的生物活性蛋白,尤其是以骨髓间充质干细胞(bmsc)为代表的外泌体(bmsc-ev)以及 信号分子等,因此基于dosem-fibrin水凝胶构建的类器官芯片并不能很好地模拟基质中 bmsc与骨肉瘤细胞的相互作用。而bmsc,作为骨微环境中重要的组成成分,是骨髓中具 有多向分化潜力及免疫调控功能的细胞,已被研究证明参与肿瘤组织的增殖、迁移、肿瘤微 环境的形成、及与肿瘤细胞相互作用等,并且bmsc也被研究证实可通过分泌一系列细胞因 子如il-6,vegf,tnf-a等,促进肿瘤细胞生长,转移以及免疫逃逸。其中干细胞分泌的外泌 体(bmsc-ev)作为分泌因子的主要负载媒介,是bmsc在胞外环境中分泌的直径40-100nm 的小泡。其中含蛋白质、脂质和核酸。bmsc-ev可影响肿瘤的发生和进展,并且间充质干 细胞也可以通过调控血管新生、稳定和成熟来调控肿瘤内血管的形成并进一步促进肿瘤组织 内部细胞的增殖。对于骨髓微环境中bmsc-ev促进骨肉瘤细胞生长及转移的具体作用形式 以及机制尚不明确。为了更好地模拟基质中bmsc与骨肉瘤细胞的相互作用,本发明将类器 官芯片内部dosem-fibrin水凝胶中补充bmsc-ev成分以观察细胞增殖能力以及细胞-基质 的相互作用。
82.本发明一实施例提供骨肉瘤类器官模型的构建方法,至少包括如下步骤:
83.将骨髓间充质干细胞来源的外泌体和骨肉瘤细胞负载于所述生物支架上,获得骨肉瘤类 器官模型;所述生物支架是用水凝胶制剂构造的纵横交错的立体结构,所述水凝胶制剂包括 脱细胞基质和纤维蛋白。
84.可选的,所述水凝胶制剂所使用的溶剂可以为培养基、水或pbs缓冲液。
85.在一种实施方式中,以水凝胶制剂的总量为基准计,所述脱细胞基质的浓度大于0且≤ 60mg/ml。例如,60mg/ml表示所述脱细胞基质dosem占据水凝胶制剂总量的浓度为 60mg/ml。可以为大于0且≤60mg/ml,大于0且≤50mg/ml,大于0且≤40mg/ml,大于0 且≤30mg/ml,大于0且≤20mg/ml,大于0且≤10mg/ml,10mg/ml-60mg/ml,10mg/ml
ꢀ‑
50mg/ml,10mg/ml-40mg/ml,10mg/ml-30mg/ml,10mg/ml-20mg/ml,20mg/ml
ꢀ‑
60mg/ml,20mg/ml-50mg/ml,20mg/ml-40mg/ml,20mg/ml-30mg/ml,30mg/ml
ꢀ‑
60mg/ml,30mg/ml-50mg/ml,30mg/ml-40mg/ml,40mg/ml-60mg/ml,40mg/ml
ꢀ‑
50mg/ml,或50mg/ml-60mg/ml。
86.优选的,以水凝胶制剂的总量为基准计,所述脱细胞基质的浓度为6mg/ml。
87.在一种实施方式中,以水凝胶制剂的总量为基准计,所述纤维蛋白的浓度大于0且≤ 60mg/ml。60mg/ml表示所述纤维蛋白占据水凝胶制剂总量的浓度为60mg/ml。可以为,大 于0且≤60mg/ml,大于0且≤50mg/ml,大于0且≤40mg/ml,大于0且≤30mg/ml,大 于0且≤20mg/ml,大于0且≤10mg/ml;10mg/ml-60mg/ml,10mg/ml-50mg/ml,10mg/ml
ꢀ‑
40mg/ml,10mg/ml-30mg/ml,10mg/ml-20mg/ml;20mg/ml-60mg/ml,20mg/ml
ꢀ‑
50mg/ml,20mg/ml-40mg/ml,20mg/ml-30mg/ml;30mg/ml-60mg/ml,30mg/ml
ꢀ‑
50mg/ml,30mg/ml-40mg/ml;40mg/ml-60mg/ml,40mg/ml-50mg/ml或50mg/ml
ꢀ‑
60mg/ml。
88.优选的,以水凝胶制剂的总量为基准计,所述纤维蛋白的浓度为20mg/ml。
89.在一种实施方式中,以水凝胶制剂的总量为基准计,所述骨髓间充质干细胞来源
的外泌 体的浓度大于0且≤300mg/ml。外泌体浓度是通过bca蛋白检测试剂盒(23227, theromofisher)计算(此方法为业内对外泌体浓度检测的金标准)。例如300mg/ml表示1ml 水凝胶制剂可负载300mg骨髓间充质干细胞来源的外泌体。可以为大于0且≤300mg/ml, 大于0且≤200mg/ml,大于0且≤100mg/ml,大于0且≤50mg/ml,大于0且≤10mg/ml, 大于0且≤1mg/ml,大于0且≤500μg/ml,大于0且≤300μg/ml,大于0且≤100μg/ml; 100μg/ml-300mg/ml,100μg/ml-200mg/ml,100μg/ml-100mg/ml,100μg/ml
ꢀ‑
50mg/ml,100μg/ml-10mg/ml,100μg/ml-1mg/ml,100μg/ml-500μg/ml,100μg/ml
ꢀ‑
300μg/ml,300μg/ml-300mg/ml,300μg/ml-300mg/ml,300μg/ml-100mg/ml,300 μg/ml-50mg/ml,300μg/ml-10mg/ml,300μg/ml-1mg/ml,300μg/ml-500μg/ml,500 μg/ml-300mg/ml,500μg/ml-300mg/ml,500μg/ml-100mg/ml,500μg/ml-50mg/ml, 500μg/ml-10mg/ml,500μg/ml-1mg/ml;1mg/ml-300mg/ml,1mg/ml-200mg/ml, 1mg/ml-100mg/ml,1mg/ml-50mg/ml,1mg/ml-10mg/ml;10mg/ml-300mg/ml,10mg/ml
ꢀ‑
200mg/ml,10mg/ml-100mg/ml,10mg/ml-50mg/ml;100mg/ml-300mg/ml,100mg/ml
ꢀ‑
200mg/ml或200mg/ml-300mg/ml。
90.优选的,以水凝胶制剂的总量为基准计,所述骨髓间充质干细胞来源的外泌体的浓度为 300μg/ml。
91.在一种实施方式中,以水凝胶制剂的总量为基准计,所述骨肉瘤细胞的含量为大于0且 ≤8*107/ml。例如8*107/表示1ml水凝胶制剂可负载8*107个骨肉瘤细胞。
92.可以为大于0且≤8*107/ml,大于0且≤6*107/ml,大于0且≤4*107/ml,大于0且≤ 2*107/ml,大于0且≤1*107/ml;1*107/ml-8*107/ml,1*107/ml-6*107/ml,1*107/ml
ꢀ‑
4*107/ml,1*107/ml-2*107/ml;2*107/ml-8*107/ml,2*107/ml-6*107/ml,2*107/ml
ꢀ‑
4*107/ml;4*107/ml-8*107/ml,4*107/ml-6*107/ml或6*107/ml-8*107/ml。
93.优选的,以水凝胶制剂的总量为基准计,所述骨肉瘤细胞的含量为1*107/ml。
94.可选的,所述脱细胞基质采用以下方法获得:获取生物组织后进行脱细胞化,获得脱细 胞基质。
95.可选的,所述生物组织为骨肉瘤组织。
96.在一种实施方式中,所述骨肉瘤组织来源于人。
97.脱细胞化是指将从生物体组织中去除细胞而残存的支持组织。
98.在一种实施方式中,所述水凝胶制剂中还包括明胶。
99.可选的,以水凝胶制剂的总量为基准计,所述明胶的浓度为大于0且≤60mg/ml。例如, 60mg/ml表示所述明胶占据水凝胶制剂总量的浓度为60mg/ml。可以为大于0且≤60mg/ml, 大于0且≤50mg/ml,大于0且≤40mg/ml,大于0且≤30mg/ml,大于0且≤20mg/ml,大 于0且≤10mg/ml,10mg/ml-60mg/ml,10mg/ml-50mg/ml,10mg/ml-40mg/ml,10mg/ml
ꢀ‑
30mg/ml,10mg/ml-20mg/ml,20mg/ml-60mg/ml,20mg/ml-50mg/ml,20mg/ml
ꢀ‑
40mg/ml,20mg/ml-30mg/ml,30mg/ml-60mg/ml,30mg/ml-50mg/ml,30mg/ml
ꢀ‑
40mg/ml,40mg/ml-60mg/ml,40mg/ml-50mg/ml,或50mg/ml-60mg/ml。
100.优选的,以水凝胶制剂的总量为基准计,所述明胶的浓度为20mg/ml。
101.在一种实施方式中,所述骨肉瘤模型类器官模型中还包括甘油。用于降低挤压引起的细 胞损伤。
102.可选的,以水凝胶制剂的总量为基准计,所述甘油的体积分数为大于0且≤30%。
可以为 大于0且≤30%,大于0且≤20%,大于0且≤10%,10%-30%,10%-20%或20%-30%。
103.在一种实施方式中,所述骨肉瘤类器官模型采用3d打印制成。
104.如图1-1和图1-2所示,本发明一实施例提供一种微流控芯片,所述微流控芯片上包含:
105.类器官培养区1,所述类器官培养区1内含有前述的骨肉瘤类器官模型;
106.进液口2,与所述类器官培养区1连通,用于泵入流体。
107.出液口3,与所述类器官培养区1连通,用于排出流体。
108.微流道4,用于连通类器官培养区1、进液口2和出液口3。
109.所述微流控芯片内可以注入流体。所述流体可以为培养基。所述培养基一般选用a-mem 培养基(gibco)。
110.所述类器官培养取包含若干相互连通的腔室,前述骨肉瘤器官模型可注入到各个腔室中。
111.可选的,所述微流控芯片包括能够相互贴合的盖板5和底板6,所述类器官培养区1和 微流道4雕刻于底板6上。所述出液口3和/或进液口2雕可刻于底板或盖板上。所述盖板和 底板可以通过粘合剂连接。例如通过粘性薄膜7(dsf)连接。
112.优选的,所述盖板的材料和底板的材料不同。
113.可选的,所述底板也可以分为能够贴合的上底板和下底板,所述类器官培养区1和微流 道4雕刻于上底板上。所述上底板和下底板可以通过粘性薄膜7连接。
114.可选的,所述底板的材料可以为pmma(聚甲基丙烯酸甲酯)和/或玻璃。
115.可选的,所述盖板的材料为pdms(聚二甲基硅氧烷),有利于气体交换。
116.所述微流道的内径为为50μm-1cm。
117.如图1-3所示,本发明一实施例提供前述微流控芯片的制备方法,至少包括如下步骤:
118.将前述骨肉瘤类器官模型置于类器官培养区;将流体通过进液口注入为微流道和类器官 培养区,获得所述微流控芯片。
119.进一步的,还包括将以下步骤:将前述骨肉瘤类器官模型置于类器官培养区后,将盖板 和底板盖合。
120.前述骨肉瘤类器官模型可在非凝胶状态时注入到类器官培养区。
121.本发明一实施例提供骨肉瘤模型类器官动态培养模型,所述动态培养模型包括前述微流 控芯片和微流泵,所述微流泵与前述微流控芯片中的进液口和出液口连通,用于为微流控芯 片内的流体流动提供动力。
122.所述微流泵为微蠕动泵。
123.可选的,所述骨肉瘤模型类器官动态培养模型还包括储液器。所述储液器用于存放向进 液口输送的流体和存放出液口排放的流体。使得骨肉瘤模型类器官动态培养模型形成环形闭 合管路。
124.如图1和11所示,本发明提供前述的骨肉瘤类器官模型或微流控芯片或骨肉瘤模型类器 官动态培养模型在抗骨肉瘤药物筛选中的应用。
125.本发明所述的抗骨肉瘤药物筛选可以为单一的药物筛选或者药物组合物的筛选。
用imagej对细胞活性进行半定量分析。
161.结果如图9和10所示,通过本发明的骨肉瘤类器官芯片构建药物筛选平台,可明确 plerixafor与dox联用可显著增加dox对于高增殖活性的骨肉瘤细胞的杀伤效果。与常规2d 单细胞培养(2d mono)组相比,本发明的3d生物打印dosem-fibrin水凝胶支架的代谢 功能得到提升。
162.以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此 外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神 的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施 例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上, 各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的 范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1