一种耐铅的短小芽孢杆菌及其应用的制作方法
1.本发明涉及微生物领域,更具体地,涉及耐铅的短小芽孢杆菌及其应用。
背景技术:
2.随着工业社会的快速发展,生产步入工业化阶段,但重金属污染却日益严重。因此治理重金属污染问题成为了人类日益关注的焦点。其中土壤重金属污染治理也是其中一部分,土壤作为陆地生态系统的基础,是农业生产中不可替代的环境因子,也是食品安全和人体健康的重要保障,具有环境保护和维持生态平衡的重要作用。
3.土壤重金属污染是由于人类在生活生产中产生的有害物质投入到泥土中,而且这些有害物质在土壤中含量过度,使得土壤自身无法进行生物分解,有害物质通过多种途径在土壤中积累富集,导致土壤肥力下降,土壤无法进行自我修复,从而造成土壤质地恶化导致植物病变、水源恶化,通过食物链富集到人体内,且可能转化为毒性更强的金属有机化合物,危害人类的身体健康。所以,当前人们对重金属污染的土壤的改良和修复越来越重视。
4.其中铅污染是最严重的重金属污染之一,在数千年的人类文明进程中发挥积极作用的同时,也带来了严重的负面效应。近年来,工业“三废”、机动车辆使用含铅抗震剂汽油、污水灌溉以及农药和化肥的使用,使得铅对环境的污染不断加剧和蔓延,造成了植物、动物、微生物的铅毒害,并引起人类食物链中铅的含量不断提高。铅和其他重金属元素一样,在土壤中不被生物所分解,土壤被污染后对人体的危害极大,当铅摄入过多会引起人体急性中毒甚至死亡。
5.土壤中对铅的污染控制方法有理化法和生物法,但由于传统的物理化学治理方法都有一些不可避免的缺陷,例如,重金属处理不彻底,工程化程度小,成本高,还会造成二次污染。与传统的理化法相比,利用微生物降低土壤重金属毒性,具有高效、经济、不破坏环境等优点,已成为对重金属污染治理的一种有效策略。
技术实现要素:
6.本技术提供了一种耐铅菌,所述耐铅菌为短小芽孢杆菌bacillus pumilus,所述耐铅菌保藏于广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmcc no:62377。
7.本技术还提供了上述耐铅菌在铅污染土壤治理中的应用。
8.本技术的耐铅菌有较好地铅去除能力,能够用于铅污染土壤治理,具有成本低、效率高和不会产生二次污染等优点。
附图说明
9.图1示出了菌株mpeb0007673在mha固体培养基未加pb的生长情况。
10.图2示出了菌株mpeb0007673在mha固体培养基加pb的生长情况(pb
2+
浓度为2500mg/l)。
11.图3示出了菌株mpeb0007673在光学显微镜下形态特征。
12.图4示出了菌株mpeb000767316s rdna序列系统发育树。
13.图5示出了不同ph值下培养24h的菌株od值。
14.图6示出了不同温度下培养24h的菌株的od值。
15.图7示出了不同盐浓度下培养24h的菌株的od值。
16.图8示出了菌株mpeb0007673的生长曲线。
17.本发明的耐铅菌mpeb0007673,分类学名称为bacilluspumilus,于2022年4月14日保藏于广东省微生物菌种保藏中心(gdmcc),保藏号为:gdmcc no:62377;保藏地址为:广州市先烈中路100号大院59号楼5楼。
具体实施方式
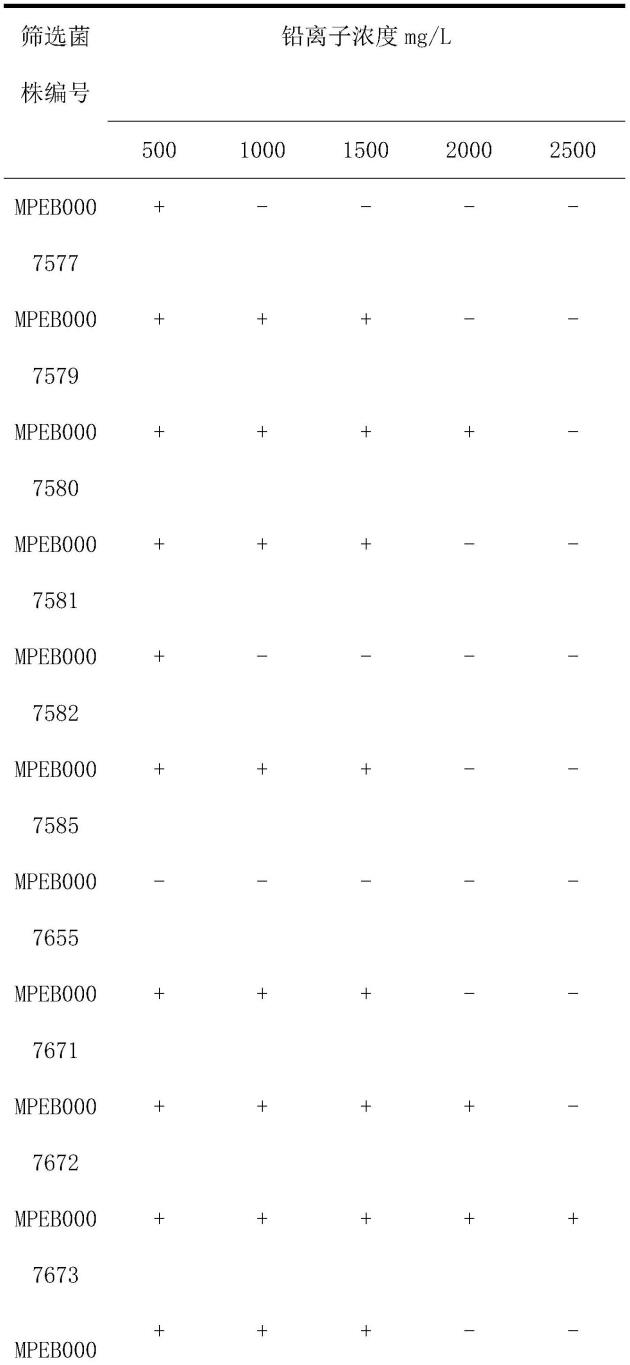
18.下面的实施例可以使本领域技术人员更全面地理解本发明,但不以任何方式限制本发明。
19.本技术从分离和筛选高耐受铅微生物的研究角度出发,从铅矿厂周围的土壤中分离筛选得到一株细菌,将筛选出的耐铅菌株进行生物学特性分析,得出耐铅菌的生长特性和规律,同时对铅的去除能力也进行了研究和探讨。
20.本发明分离所述的高度耐铅性菌株mpeb0007673分离方法包括如下步骤:
21.(1)取样:取河北省承德县南杖子村铅锌矿区周边农田土壤样品1g加至10ml无菌水中,35℃,150r/min振荡溶解。
22.(2)用接种环蘸取土壤溶解液,涂布在mha培养基(牛肉粉6g/l,可溶性淀粉1.5g/l,酸水解酪蛋白17.5g/l,琼脂17g/l,ph 7.3)上,温箱37度培养24小时。
23.(3)分别挑取单菌落接种至5ml mh肉汤培养基(mhb,牛肉粉2g/l,可溶性淀粉1.5g/l,酸水解酪蛋白17.5g/l,ph 7.4)中,35℃,150r/min振荡培养24h。
24.(4)耐铅微生物的筛选:吸取培养24h的样品40μl分别涂布在含有500mg/l、1000mg/l、1500mg/l、2000mg/l和2500mg/l铅离子培养基的平板上,30℃,培养24h。观察平板皿的菌生长情况,多次平板划线培养,直到培养基出现单个菌落为止。挑取在2500mg/l铅离子培养基平板上生长的单菌落接种至5ml mh肉汤培养基中,35℃,150r/min振荡培养24h。
25.菌株的筛选结果如下表1所示:
26.表1
27.[0028][0029]
注:“+”表示菌株的生长,
“–”
表示菌株不生长。
[0030]
图1示出了菌株mpeb0007673在mha固体培养基未加pb的生长情况。图2示出了菌株mpeb0007673在mha固体培养基加pb的生长情况(pb
2+
浓度为2500mg/l)。图3示出了菌株mpeb0007673在光学显微镜下形态特征。另外,菌株mpeb0007673的生长形态特征也参见如下表2所示。
[0031]
表2
[0032][0033]
图4示出了菌株mpeb000767316s rdna序列系统发育树,经过16srdna分析,菌株mpeb0007673在分类学上为短小芽孢杆菌bacillus pumilus。
[0034]
因此,经过分离纯化,筛选得到一株能在铅离子浓度为2500mg/l时能生长的耐铅菌株,菌株编号为mpeb0007673。菌株mpeb0007673在未加pb的培养基上菌落为白色,菌落大小为(3~4mm),在加pb的培养基上菌落为棕褐色,菌落更小,为(1~2mm);但在这两种情况下,菌株都呈边缘完整,隆起呈圆形,不透明,易挑取,为革兰氏阴性菌。根据16s rdna测序结果分析为短小芽孢杆菌(bacillus pumilus)。
[0035]
(5)各因素对菌株生长的影响
[0036]
①
不同ph值下菌株的生长情况:将菌株mpeb0007673分别接种至ph为3、4、5、6、7、8、9、10、11和12的5ml mh肉汤培养基(mhb,牛肉粉2g/l,可溶性淀粉1.5g/l,酸水解酪蛋白17.5g/l)中,35℃,150r/min振荡培养24h。24h后在od600nm下测菌液的吸光度,统计出od24h值,绘制吸光度与ph值的关系图。
[0037]
下表3示出了不同ph值下菌株的生长情况,重复两次实验取平均值。图5示出了不同ph值下培养24h的菌株od值。由表3和图5可知,菌株mpeb0007673适宜生长的ph值范围为5-9,最适宜的为6。
[0038]
表3
[0039][0040]
②
不同温度下菌株的生长情况:设置五个不同的温度环境,分别为20℃、25℃、30℃、35℃、40℃,将菌株mpeb0007673接种至5ml mh肉汤培养基(mhb,牛肉粉2g/l,可溶性淀粉1.5g/l,酸水解酪蛋白17.5g/l,ph6)中,各个温度,150r/min振荡培养24h。24h后在od600nm下测菌液的吸光度,统计出od24h值,绘制吸光度与温度的关系图。
[0041]
表4示出了不同温度下菌株的生长情况。图6示出了不同温度下培养24h的菌株的od值。
[0042]
表4
[0043][0044]
由表4和图6可知,菌株mpeb0007673适宜生长的温度范围为20-35℃,最适宜的为25-30℃。
[0045]
③
不同盐浓度下菌株的生长情况:将菌株mpeb0007673分别接种至盐浓度(采用的盐为nacl)为0.005、0.010、0.015、0.020、0.025和0.030mg/l的5ml mh肉汤培养基(mhb,牛肉粉2g/l,可溶性淀粉1.5g/l,酸水解酪蛋白17.5g/l,ph 6)中,35℃,150r/min振荡培养24h。24h后在od600nm下测菌液的吸光度,统计出od24h值,绘制吸光度与盐浓度的关系图。
[0046]
表5示出了不同盐浓度下菌株的生长情况。图7示出了不同盐浓度下培养24h的菌株的od值。
[0047]
表5
[0048][0049]
菌株mpeb0007673在盐浓度为0.005mg/l时菌株的吸光度最大,随着盐浓度的升高,菌株的生长能力逐渐降低,即菌株的耐盐能力比较强且相对稳定。
[0050]
④
菌株生长曲线的绘制
[0051]
将菌株mpeb0007673接种至40ml铅离子浓度为500mg/l的肉汤培养基中,温箱37℃,培养24h。然后取1ml转接至40ml铅离子浓度为1000mg/l的肉汤培养基中,温箱37℃,培养24h,每隔四小时取样测od600nm下测菌液的吸光度,统计出od24h值,绘制菌株生长曲线。
[0052]
图8示出了菌株mpeb0007673的生长曲线。菌株在16h左右达到生长顶峰,之后稍有降低并且保持相对稳定。
[0053]
(6)菌株对铅的去除效果
[0054]
①
菌种驯化:将菌株mpeb0007673接种至40ml铅离子浓度为500mg/l的肉汤培养基中,温箱37℃,培养24h。然后取1ml转接至40ml铅离子浓度为1000mg/l的肉汤培养基中,温箱37℃,培养24h。然后取1ml转接至40ml铅离子浓度为1500mg/l的肉汤培养基中,温箱37℃,培养24h。重复上述步骤,直至驯化浓度为3000mg/l。
[0055]
菌株去除能力的测定:上述每次转接时,分别取10ml于15ml离心管中,10000r/min离心10分钟,取3ml上清液,用spectraa220型原子吸收分光光度计测定上清中剩余铅的浓度,计算去除效率。
[0056]
细菌的吸附能力计算:菌株对重金属的去除效率r的计算方法:
[0057][0058]
其中,r为重金属的去除效率,c0为重金属的初始浓度(mg/l),ce为平衡时溶液中重金属的浓度(mg/l)。
[0059]
②
菌种正常培养:将菌株mpeb0007673接种至40ml铅离子浓度为500、1000、1500、2000、2500和3000mg/l的肉汤培养基中,温箱37℃,培养24h。24h后分别取10ml于15ml离心管中,10000r/min离心10分钟,取3ml上清液,用spectraa220型原子吸收分光光度计测定上清中剩余铅的浓度,计算菌株24h的去除效率。继续培养24h,24h后分别取10ml于15ml离心管中,10000r/min离心10分钟,取3ml上清液,用spectraa220型原子吸收分光光度计测定上清中剩余铅的浓度,计算48h的去除效率。
[0060]
表6示出了菌株对铅的去除能力。
[0061]
表6
[0062][0063]
由上可知,菌株mpeb0007673可在铅离子浓度为500~3000mg/l条件下去除铅离子,在铅离子浓度为2000mg
·
l-1
时去除效果最好,正常培养情况24h和48h对铅的去除率分别为82.31%和82.49%,逐浓度梯度依次驯化培养24h对铅的去除率为85.18%。该菌株未来可用于去除污染土壤中的铅元素。将高度耐铅菌株mpeb0007673制备成铅去除剂,能够大规模地应用在去除重金属污染土壤中。
[0064]
本领域技术人员应理解,以上实施例仅是示例性实施例,在不背离本发明的精神和范围的情况下,可以进行多种变化、替换以及改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1