一种重组产朊假丝酵母尿酸酶的纯化方法与流程
1.本发明涉及利用重组dna技术生产基因工程药物,具体涉及一种来源于产朊假丝酵母的尿酸酶重组蛋白的纯化方法,属于生物技术领域。
背景技术:
2.公开号为cn104342415a的发明专利《一种重组尿酸酶的制备方法》公开了一种适合大肠杆菌分泌表达重组产朊假丝酵母尿酸酶(uricase,ec1.7.3.3)的核苷酸序列及从该工程细胞纯化重组产朊假丝酵母尿酸酶的方法,但该专利中所涉及的纯化方法为实验室规模的方案,方案中所用的凝胶过滤层析纯化步骤,存在着上样量限制(一般为柱体积的2~5%左右),不易放大到工业化生产的规模,同时,此纯化方案无法彻底去除宿主细胞的dna,造成最终产品中外源dna超标,目前尚未有可以工业化应用的重组产朊假丝酵母尿酸酶制备的生产方法。
技术实现要素:
3.本发明根据工业化生产要求,提供一种重组产朊假丝酵母尿酸酶制备的生产方法。
4.该方法在菌体破碎后,首先采用聚乙烯亚胺(polyethyleneimine,pei)絮凝,去除宿主核酸,降低溶液粘度、宿主dna残留和后续层析的操作负荷,然后利用重组产朊假丝酵母尿酸酶与杂蛋白的理化性质差异,直接采用阴离子交换层析纯化,即可获得纯度比较高的重组蛋白,为了保证产品质量,又进行了阳离子交换层析,有效避免了产品中聚合体存在的风险,解决了原有工艺存在单位批次处理量小,生产周期长,部分产品质量指标不合格的缺点。本发明采用的技术方案,具体由以下步骤组成:
5.(1)菌体破碎:按质量体积比1∶5~50重悬于破菌缓冲液(1
×
pbs,ph7~8)中破碎,高速离心,得上清备用;菌体破碎可采取超声、均质以及溶菌酶等破菌方式;
6.(2)pei絮凝去除核酸:在(1)破菌离心上清中,加入终浓度为0.2~0.5%(v/v)的聚乙烯亚胺(mw70,000),搅拌絮凝后,离心收集上清备用;
7.(3)硫酸铵盐析浓缩:按照终浓度60~70%饱和硫酸铵要求,在(2)制备的上清中加入相应克重硫酸铵粉末,充分搅拌絮凝,待盐析结束后,离心得到蛋白沉淀并采用(4)缓冲液a复溶备用;
8.(4)阴离子交换层析;
9.缓冲液a的制备:25mmol/l tris-hcl,ph8.0;
10.缓冲液b的制备:25mmol/l tris-hcl、1mol/l氯化钠,ph8.0;
11.通过调整和控制平衡缓冲液及样品液的电导≥3.2ms/cm,采用缓冲液a进行填料平衡后,采取柱上直接流穿方式,收集流穿目的峰;
12.所述步骤(4)阴离子交换层析所用填料,可选择采用deae-sephrose、q-sepharose、deae-cellulose、deae-sephacel、q-cellulose或q-sephacel填料;
13.(5)阳离子交换层析;
14.填料平衡后,调整阴离子收集液的ph和电导后,直接上样,待冲洗至基线后,可进行线性或梯度洗脱;
15.所述步骤(5)阳离子交换层析填料,可采用cm-sephrose、sp-sepharose、cm-cellulose、cm-sephacel、sp-cellulose或sp-sephacel;
16.(6)置换缓冲液
17.采用sephadex g25脱盐柱进行缓冲液置换;
18.(7)制剂冻干;
19.根据成品配方,进行冻干前原液调配并分装,置于-80℃预冻2小时以上后,采用冷冻干燥机冷冻干燥。
20.优选的,步骤(4)中所述,阴离子交换层析优选q-sepharose ff。
21.优选的,步骤(4)中所述缓冲液a配方和样品液通过添加氯化钠控制电导在3.2~3.5ms/cm,这样即可能保证蛋白纯度又可避免内毒素和核酸被洗脱。
22.优选的,步骤(5)中所述,阳离子交换层析优选sp阳离子交换。
23.优选的,步骤(5)中所述,采用0~6%b线性洗脱,收集目的洗脱峰。
24.优选的,步骤(7)成品配方采用每毫升缓冲液(2.6~14.3克磷酸氢二钠/100ml纯化水)中含1.5mg重组尿酸氧化酶(uricase)、10.6mg甘露醇、15.9mg l-丙氨酸;
25.综上所述,本发明方案达到初步纯化的目的,层析处理量不再受5%上样量的限制。相比,整个生产周期缩短了30%,单支成本降低了40%,同样获得了高质量的产品,经检测,本发明制备的重组产朊假丝酵母尿酸酶电泳纯度可以达到95%以上,外源性dna残留量也大大减小,指标也符合了药典要求。与原发明相比,本发明处理量大、生产周期短、目的产物纯度高、部分产品质量指标得到了明显改进,整个工艺方案具有易于控制和规模化放大等特点。
附图说明
26.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
27.图1为重组蛋白表达图;
28.图1中,1:重组蛋白诱导前全菌蛋白;2:重组蛋白诱导3小时全菌蛋白;3:重组蛋白诱导7小时全菌蛋白;
29.图2为阴离子交换层析色谱图;
30.图3为阳离子交换层析色谱图;
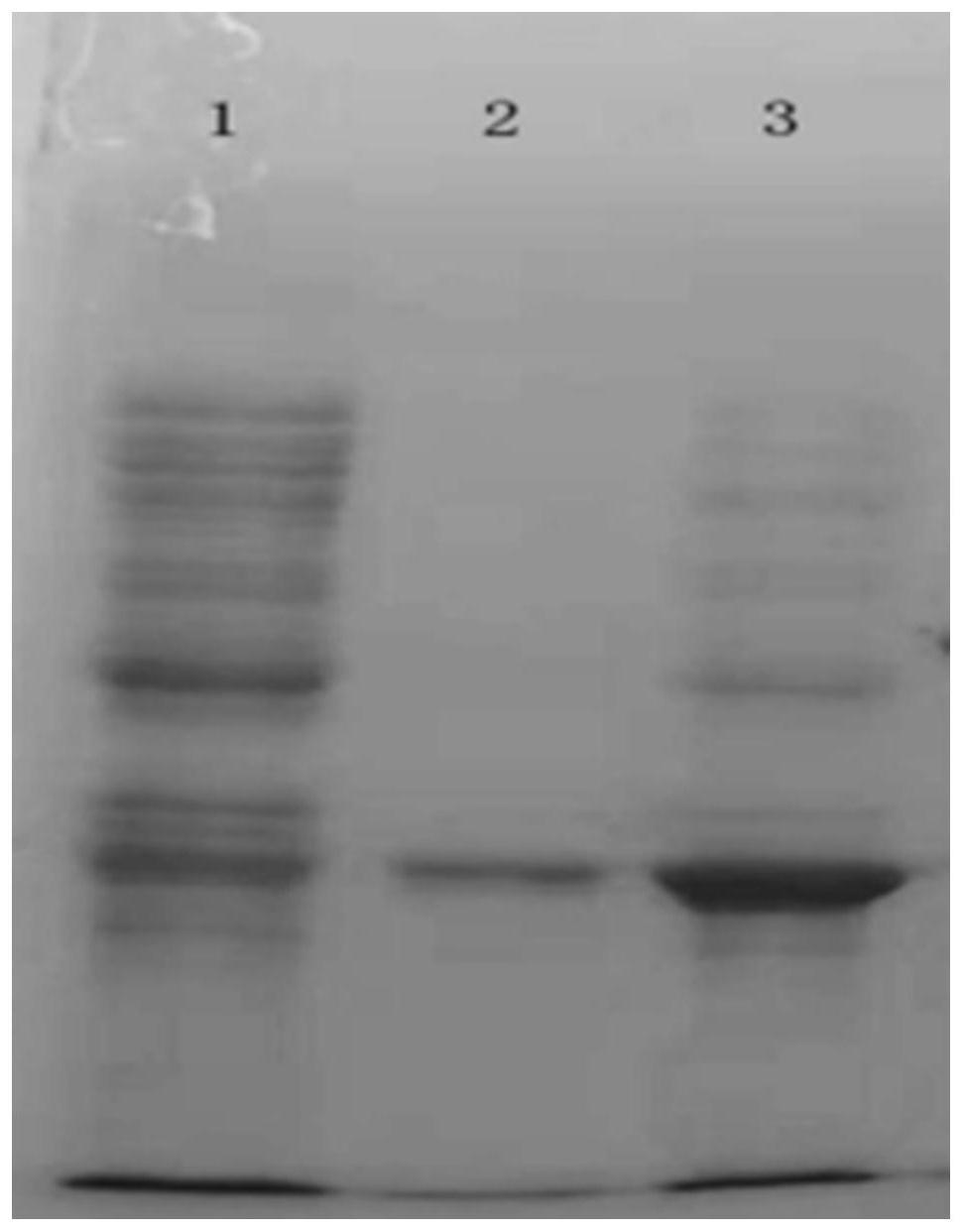
31.图4为阴离子交换层析目的峰sds-page(15%分离胶)图;
32.图4中,1:预染蛋白marker;2:阴离子交换层析蛋白峰1(流穿);3:阳离子交换层析蛋白峰2(洗脱);
33.图5为成品冻干粉复溶sds-page(12%分离胶)纯度分析图;
34.图5中,1:预染蛋白marker;2:冻干粉复溶样品。
具体实施方式
35.以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
36.实施例
37.参照专利cn104342415a提供的方法,发酵结束后,离心收集菌体,进行sds-page蛋白表达分析,见图1,由泳3可以看出重组蛋白有明显表达,并采用1
×
pbs缓冲液重悬清洗菌体一遍后,将菌泥冻存备用或直接处理。
38.(1)菌体破碎:
39.按菌体质量体积比1∶10(g(湿重)/ml)加入破碎缓冲液(1
×
pbs+1mmol/l dtt+1mmol/l pmsf、ph8.0),用高压均质机(ah2010,ats)在700~1,000bar的条件下破碎两遍,离心收集上清备用,注意整个操作过程要进行低温控制。
40.(2)pei絮凝去除核酸
41.5%聚乙烯亚胺(mw=70,000)母液的配制:取10ml pei(50%),用双蒸水或超纯水稀释至70ml,用浓盐酸调节ph至7.9。最后用双蒸水或超纯水定容至终体积为100ml。
42.在离心上清中,按照终浓度为0.2%(v/v)的加入量,加入5%聚乙烯亚胺母液,缓慢搅拌10~30min,8,000r/min离心30min,收集上清备用,下方大量絮状沉淀去掉。
43.(3)硫酸盐析浓缩
44.往上清中少量多次地加入相应量的硫酸铵(47克/100ml),使其达到70%的硫酸铵饱和度,溶解后静置过夜,8,000r/min离心30min,去除上清,用(4)阴离子交换缓冲液a液溶解沉淀,控制溶解液的电导处于3.2~3.5ms/cm,然后高速离心并经0.45μm微孔滤膜过滤,滤液备用。
45.(4)阴离子交换层析;
46.缓冲液a:25mmol/l tris-hcl,ph8.0
47.缓冲液b:25mmol/l tris-hcl、1mol/l氯化钠,ph8.0
48.先用缓冲液b冲洗q-sepharose ff(ge healthcare)柱10个柱体积,然后用缓冲液a进行平衡,直至电导和uv值基线稳定为止。然后将盐析复溶后的调配液上样,收集流穿液峰1,sds-page纯度见图4泳道2,然后再分别采用100%缓冲液b和0.1mol/l氢氧化钠清洗柱子,得到峰2及峰3。
49.(5)阳离子交换层析;
50.缓冲液a:20mmol/l磷酸氢二钠-磷酸二氢钾缓冲液,ph6.0;
51.缓冲液b:20mmol/l磷酸氢二钠-磷酸二氢钾缓冲液、1mol/l氯化钠,ph6.0。
52.先用缓冲液b冲洗tosoh sp-650m(toyopearl)柱10个柱体积,然后用缓冲液a进行平衡,直至电导和uv值基线稳定为止。将(3)收集的穿透液的ph调整为6.0,用等量的缓冲液a进行稀释,上样,层析过程见图3,峰1为流穿峰;峰2为采用0~6%缓冲液b的线性洗脱,经检测为目的峰,sds-page纯度见图4泳道3;峰3为100%缓冲液b洗脱峰,峰4为0.1mol/l氢氧化钠洗脱峰。
53.(6)置换缓冲液;
54.缓冲液配制:称量14.0克磷酸氢二钠,用纯水定容至100ml。
55.采用sephadex g25(ge healthcare)脱盐柱进行缓冲液置换。
56.(7)制剂冻干;
57.按每毫升成品中含1.5mg重组尿酸氧化酶(uricase)、10.6mg甘露醇、15.9mg l-丙氨酸进行冻干前原液调配,分装后,置于-80℃预冻2小时以上,然后用冷冻干燥机冻干,保存备用,取1支采用纯化水溶解后,进行产品蛋白纯度sds-page分析,纯度可达95%以上,见图5泳道2。
58.重组尿酸酶的活性测定
59.活性分析:
60.酶活定义:在30℃、ph8.9的条件下,每1μmol尿酸分解所需要的酶量,定义为一个活性单位。样品管:加入2ml 0.2μmol/ml尿酸贮存液,2.5ml三乙醇胺缓冲液(7.5g三乙醇胺,0.38g edta,定容至1l,ph8.9),30℃预热5min,加入1ml待测样品,30℃反应5min,加入0.5ml 3.5mol/l硫酸终止反应,292nm测定吸光度。试剂空白:样品管中加入2ml尿酸贮存液,2.5ml tea,30℃预热5min,加入与样品同体积的tea缓冲液,30℃反应5min,加入0.5ml 3.5mol/l硫酸终止反应,292nm测定吸光度。根据标准曲线及下面公式计算酶的活性:
[0061][0062]
(注:体积单位为ml,时间单位为min,浓度单位为mg/ml。),根据实验结果,冻干产品样品比活为29.82u/mg。
[0063]
外源性dna残留量测定
[0064]
根据专利提供技术方案分别制备尿酸酶冻干粉,然后按照《中国药典2015》通则3407“检测外源性dna残留量”的方法,试剂盒采用大肠杆菌宿主细胞dna残留检测试剂盒(sk030202e100,中检院生产),由斑点杂交试验检测结果可知,本发明方案产品的残留明显低于指示阳性斑点10ng/1.5mg,整体好于对照专利制备的产品(处于20~50ng/1.5mg),产品外源性dna残留量检测,指标合格。
[0065]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
[0066]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1