一种巴斯德毕赤酵母发酵溶胞物滤液、制备方法及应用与流程
1.本发明涉及一种巴斯德毕赤酵母发酵溶胞物滤液、制备方法及应用,属于化妆品原料技术领域。
背景技术:
2.胶原蛋白(collagen),在细胞迁移、细胞代谢、信号通路应答、细胞、组织、器官的正常生理功能的维护、调节及损伤修复方面有重要作用。作为重要的天然生物蛋白,有良好的生物相容性、生物活性和可降解性等独特功能特征,在化工、医药、食品、医学美容、化妆品等众多领域具有广阔的应用前景。以现代基因工程技术生产的重组人胶原蛋白,性质稳定,无动物源胶原的疾病隐患、免疫原性,工厂化生产不受原料来源限制,现已成为国家重点发展扶持的领域和资本关注的热点。目前,国内重组胶原蛋白生产企业发酵生产胶原蛋白最大的规模化生产线已达到20吨级,未来其生产规模、数量会继续扩大、上升。
3.重组胶原蛋白于毕赤酵母中表达时采用分泌表达,会产生巨量发酵菌体(一般发酵罐中20~30%体积为发酵菌体)作为废弃物需处理。酵母发酵工业中(例如啤酒生产、生物制药)产生的废弃物(废水、菌体等),均需要进行无害化处理后,满足相关的标准后方能排放,因为体量巨大,给企业环保设施处理能力带来了巨大的压力。现在,发酵废弃菌体已逐步开始进行了进一步的利用,如制备单细胞蛋白(蛋白质含量会有所降低)、发酵为酒精(利用发酵时产生的纤维质,于菌体本身意义不大)、开发为有机肥料用于农业生产(但需要进行一定处理,也需要较大场地)、用于生产其它的生物质能源、用于制作动物饲料、制备酵母提取物、酵母浸膏等、提取葡聚糖、制备酵母提取物等等。酵母发酵菌体有以上多种利用方式,但总体而言,处理后产品附加值有限、市场空间不大或可替代产品多,且对生产设备、生产场所、环境均有一定的要求,导致多数生产企业宁愿进行无害化处理后将菌体排放掉。
4.以微生物溶胞物、提取物作为化妆品原料已成为相关领域的热点。除去以上几种用途外,酵母菌体还可用于作为化妆品的原料,这是一种附加值高的处理方式。除了可以直接以酵母作为原料,还可制备成为酵母衍生物等多种形式的化妆品原料。
5.皮肤微生态是由细菌、真菌、病毒、螨虫和节肢动物等各种微生物与皮肤表面的组织、细胞各种分泌物、微环境等共同组成的生态系统。近年来,随着研究的深入,皮肤微生态也成为化妆品界关注的焦点。在化妆品应用上,微生态护肤也成为许多国际品牌公司产品开发的重点。如雅诗兰黛、兰蔻、欧莱雅、宝洁等国际品牌都陆续开发和推出相关产品,如宝洁旗下的sk-ii的“神仙水”,其核心原料pitera的成分即为半乳糖酵母样菌发酵产物滤液,可以通过促进紧密连接蛋白的表达和增加跨膜电阻来提高皮肤的屏障功能。而雅诗兰黛的明星产品“小棕瓶”、兰蔻的“小黑瓶”使用的核心原料均为二裂酵母发酵产物溶胞物,其成分为虽然名字中带有酵母,但本身并非酵母菌属,而是来源于双歧杆菌,为经培养、裂解菌体细胞得到代谢产物、细胞质成分、细胞壁组分及多种细胞器片段。此外,各大国际主流原料公司也纷纷聚焦于微生态护肤,相继推出各种后生元原料,如巴斯夫的relipidium,主要成分为水解酵母蛋白,具有恢复皮肤菌落平衡的功效;帝斯曼的oxy 229pf主要成分为酵母
菌溶胞物,它能够减少克氏棒状杆菌,从而缓解面部发红。
6.皮肤微生态、皮肤自身的物理屏障和皮肤免疫三者共同形成了机体的第一道防御体系,抵抗外界的各种理化因素的刺激,维持机体的正常功能。因此,皮肤屏障的完整对健康的皮肤有着重要意义,开发更安全有效的皮肤屏障修复原料也成为当下护肤品开发需要解决的问题。现有的化妆品屏障修复原料多针对角质层层面进行物理屏障的修复,缺少以改善皮肤微生态屏障和增强免疫屏障为出发点而开发的具有皮肤屏障修复作用的化妆品原料。
7.有皮肤屏障修复作用的化妆品原料开发中,巴斯德毕赤酵母来源的原料是欠缺的;并且现有酵母类化妆品的功效,多集中于保湿、抗衰防晒、美白等方面,以增强皮肤微生态屏障、免疫屏障、控制皮脂分泌为基本功效机理的原料也是欠缺的。
8.另外,胶原蛋白在医美、化妆品上的应用已被普遍接受,但表达重组胶原蛋白的巴斯德毕赤酵母发酵菌体用于制备化妆品原料,尤其是发酵溶胞物滤液,尚无先例,相关研发处于空白;相关产品的制备方式、功效研究也未见公开资料披露;以表达重组人胶原蛋白的巴斯德毕赤酵母制备的化妆品原料(尤其是发酵溶胞物滤液)是否可行、是否有更好、更多的功效也未见诸报道;重组胶原蛋白生产企业也未有相应的产品推出或专利、研究文献发表。
9.此外,在以酵母菌体制备提取物或溶胞物滤液或其它种类化妆品原料时,首先要完成的是酵母菌的破壁裂解,毕赤酵母细胞壁比较厚(70nm-200nm)且结构致密,机械强度大,常规的处理方式处理时间长、效率低,还有可能引物外源性物质(酶类)。对于规模化工业生产的产生发酵菌体而言:发酵菌体产生的周期短、体量大,较长的处理时间容易滋生有害菌体,产生内毒素等热原物质;规模化生产时菌体的破碎需要简单、稳定、高效,避免外源性物质导入(同时也利于控制成本)。另外,破碎后的毕赤酵母溶胞物是不溶性、可溶性成份混杂在一起的,如何进行有效的分离也需要一套有效处理方式。
技术实现要素:
10.本发明的目的在于,克服现有技术中存在的一些技术问题,主要是填补现有技术中“以表达重组胶原蛋白的巴斯德毕赤酵母制备发酵溶胞物滤液”这一产品、其制备方法、产品功效和应用方面的空白,解决现有技术中溶胞物滤液制备方法存在的处理时间长、效率低、有可能引入外源性物质等的技术问题。
11.为此,本发明提供一种巴斯德毕赤酵母发酵溶胞物滤液、制备方法及应用。
12.为达到上述技术目的,本发明首先提供一种发酵溶胞物滤液的制备方法,所述发酵溶胞物滤液由巴斯德毕赤酵母菌发酵后的菌体制备获得。
13.进一步的,所述巴斯德毕赤酵母菌为表达重组胶原蛋白的巴斯德毕赤酵母菌。
14.进一步的,所述表达重组胶原蛋白的巴斯德毕赤酵母菌选自保藏编号为cgmcc no.7189、cgmcc no.14057、cgmcc no.17147、cgmcc no.17150、cgmcc no.17148、cgmcc no.17149、cgmcc no.20626、cgmcc no.20627、cgmcc no.21891或cgmcc no.21892的菌株中的一种或多种。
15.其中,所述菌体为发酵产物进行固液分离后获得。
16.所述发酵溶胞物滤液的制备方法包括菌体稀释、高压均质裂解、离心及过滤。
17.进一步的,所述菌体稀释为以纯水稀释至质量浓度为5%~30%(w/w)的菌体悬液;优选的,所述菌体稀释为以纯水稀释至质量浓度为10%(w/w)的菌体悬液。
18.所述高压均质裂解为将所述菌体悬液以》100mpar的压力破碎1-3次后获得裂解液;优选的,所述高压均质裂解为将所述菌体悬液以1200mpar的压力破碎。
19.所述离心为将所述裂解液以10000g-20000g的速度离心,获得上清液。
20.所述过滤为将所述上清液以0.22μm孔径过滤,即得发酵溶胞物滤液。
21.本发明还提供所述制备方法制备得到的发酵溶胞物滤液,所述发酵溶胞物滤液中包括总蛋白、重组胶原蛋白、多糖、氨基酸、多种维生素。
22.根据本发明的实施例,以在发酵溶胞物滤液中所占质量体积分量计,总蛋白质含量占0.1~2.5%,优选为1%(10mg/ml);重组胶原蛋白含量为1~15μg/ml,一般在10μg/ml以上,优选为10-15μg/ml;多糖含量约在0.1-1.5mg/ml,优选为1mg/ml;氨基酸总量约0.2%~1%,优选0.6%~0.82%。
23.本发明所述发酵溶胞物滤液具有抗敏、舒缓、抗炎、防晒、调节皮肤微生态、控油、修复皮肤屏障的功效。
24.本发明还提供一种组合物,所述组合物中包括所述的发酵溶胞物滤液。
25.进一步的,所述组合物中发酵溶胞物滤液的含量为1-10wt%,优选的,含量为5wt%。
26.本发明还提供所述发酵溶胞物滤液、所述组合物在抗敏类、舒缓类、抗炎类、防晒类、调节皮肤微生态类、控油类、修复皮肤屏障类化妆品原料中的应用。
27.本发明还提供所述发酵溶胞物滤液、所述组合物在化妆品领域中的应用。所述化妆品包括抗敏类、舒缓类、抗炎类、防晒类、调节皮肤微生态类、控油类、修复皮肤屏障类产品。
28.其中所述修复皮肤屏障类包括增强皮肤微生态屏障、提高皮肤免疫屏障。
29.进一步的,所述抗敏、舒缓、抗炎主要包括能改善缓解角质层刺激症状、改善表皮组织损伤;降低炎症介质pge2分泌水平,缓解皮肤炎症反应,如降低皮肤中的血管通透性,从而缓解皮肤的泛红现象的产生;通过抑制trpv1蛋白表达的机制起到舒缓皮肤刺激的功效。
30.所述防晒表现为对紫外线吸收的能力。
31.所述调节皮肤微生态表现为通过提升抗菌肽和模式识别受体的表达,调节微生态,提升皮肤屏障,进而达到修护功效;巴斯德毕赤酵母发酵溶胞物滤液作用下,hbd1、hbd2、ll-37、tlr2蛋白含量显著上升。
32.所述控油表现为抑制皮肤脂滴合成。
33.本发明还提供一种化妆品,所述化妆品中包括所述的发酵溶胞物滤液,所述化妆品包括但不限于护肤精华液、面膜、面霜。
34.进一步的,所述化妆品中发酵溶胞物滤液的含量为1-10wt%,优选的,含量为5wt%。
35.根据本发明的实施例,本发明还提供一种护肤精华液,所述护肤精华液中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选为5wt%,还包括去离子水、甘油、丁二醇、甘油聚醚-26、edta-2na、透明质酸钠、尿囊素、甜菜碱、黄原胶、1,2-戊二醇。
36.本发明还提供一种面膜,所述面膜中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选为5wt%,还包括去离子水、甘油、edta-2na、透明质酸钠、黄原胶、卡波姆、ph调节剂、1,2-戊二醇、1,2-己二醇。
37.本发明还提供一种护肤面霜,所述面霜中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选为5wt%,还包括甘油、edta二钠、黄原胶、丙烯酰二甲基牛磺酸铵/vp共聚物、对羟基苯乙酮、1,2-己二醇、鲸蜡硬脂基葡糖苷/鲸蜡硬脂醇、鲸蜡硬脂醇、辛酸癸酸甘油三酯、氢化聚异丁烯、聚二甲基硅氧烷、去离子水。
38.本发明的有益效果:
39.(1)本发明首次实现了表达重组人胶原蛋白的巴斯德毕赤酵母发酵菌体制备化妆品原料,增加了一种重组人胶原蛋白发酵菌体的有效的、高附加值的利用途径,减轻了酵母发酵菌体带来的废弃物处理压力,变废为宝。
40.(2)本发明中的表达重组人胶原蛋白的巴斯德毕赤酵母发酵菌体制备溶胞物滤液,含有一定量的胶原蛋白,不用额外添加。
41.(3)本发明中发酵溶胞物滤液的制备方法为全程在线、自动化的制备工艺,以高压均质对毕赤酵母发酵菌体进行物理性破碎裂解,使用连续流离心机进行裂解后的固液分离,过滤后获得溶胞物滤液,制备过程快速高效、可规模化制备、不引物任何外来成份;同时整个制备工艺流程可实现全自动操作,物料为全自动在线式管道传输,洁净区内完成无菌过滤和灌装,可有效控制有害菌体的滋生。
42.(4)本发明制备的溶胞物滤液应用于化妆品无安全性问题,除去传统酵母来源化妆品原料功效外,同时具有了:通过促进抗菌肽的分泌,调节微生态平衡,增强皮肤微生态屏障的功效;通过抑制炎症因子表达,提高皮肤免疫屏障,舒缓皮肤的功效;控油、防晒功效;这些之前未曾见诸于“巴斯德毕赤酵母发酵溶胞物滤液”原料的效果,开拓了其用于制备化妆品的应用范围。
43.(5)制备的巴斯德毕赤酵母发酵溶胞物滤液,同时具有于皮肤微生态屏障和免疫屏障上双重屏障修复作用,一定程度上阐释了其应用于化妆品产生功效的机理。
44.(6)制备的巴斯德毕赤酵母发酵溶胞物滤液,除去上述功效外,还以实验验证了其同时具有降低细胞脂质分泌的作用,进一步开拓了其用于制备化妆品的应用范围(控油型化妆品)。
附图说明
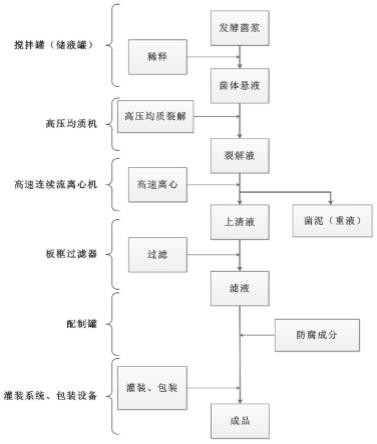
45.图1为本发明的发酵溶胞物滤液制备方法流程图。
46.图2为实施例中不同参数条件下高压匀质后毕赤酵母后的裂解液革兰氏染色的结果,图中,a1为100mpar条件下裂解3次后裂解液,b1为120mpar条件下裂解2次后裂解液,c1为150mpar条件下裂解2次后裂解液,d1为200mpar条件下裂解2次后裂解液。
47.图3为实施例1中制备的溶胞物滤液的sds-page(a,上样量10μl)图和wb图(b),图3b中,泳道1为溶胞物滤液,上样量10μl,泳道2为空白对照,泳道3为重组iii型人胶原蛋白,上样量2.5μg,泳道4为重组iii型人胶原蛋白,上样量1μg。
48.图4为实施例中计算样品中重组胶原蛋白浓度过程中拟合的标准曲线。
49.图5为实施例中计算样品中总蛋白含量过程中拟合的标准曲线及曲线方程。
50.图6为实施例中计算样品中多糖含量过程中拟合的标准曲线及曲线方程。
51.图7为实施例基于3d表皮皮肤模型培养后进行h&e染色后显微镜下的组织形态图,其中图a为空白对照,b为阴性对照,即sls处理组,c为阳性对照,即同时添加sls和0.01%地塞米松,d为实验组,即同时添加sls和2%滤液。
52.图8为实施例中pge2含量检测结果柱状图。
53.图9为实施例中辣椒素受体(trpv1)的免疫荧光检测结果。
54.图10为实施例中trpv1蛋白相对iod值柱状图。
55.图11为本发明得到的发酵溶胞物滤液及其不同倍数的稀释液紫外光区200-400nm波长紫外线率。
56.图12为基于3d表皮皮肤模型的hbd1蛋白染色结果。
57.图13为基于3d表皮皮肤模型的hbd1蛋白积分光密度(iod)值柱状图。
58.图14为基于3d表皮皮肤模型的hbd2蛋白染色结果。
59.图15为基于3d表皮皮肤模型的hbd2蛋白积分光密度(iod)值柱状图。
60.图16为基于3d表皮皮肤模型的tlr2蛋白染色结果。
61.图17为基于3d表皮皮肤模型的tlr2蛋白积分光密度(iod)值柱状图。
62.图18为基于3d表皮皮肤模型的ll-37蛋白染色结果。
63.图19为基于3d表皮皮肤模型的ll-37蛋白积分光密度(iod)值柱状图。
64.图20为脂滴合成油红o染色结果;图中标尺大小为50μm。
65.图21为脂滴积分光密度(iod)值柱状图。
66.图22为志愿者使用含巴斯德毕赤酵母发酵溶胞物滤液精华液效果图。
67.图23为志愿者使用含巴斯德毕赤酵母发酵溶胞物滤液面膜效果图。
68.图24为志愿者使用含巴斯德毕赤酵母发酵溶胞物滤液面霜效果图。
具体实施方式
69.为了使本领域技术人员更好的理解本发明的技术方案,下面对本发明的较佳实施例进行详细的阐述,但是如下实施例并不限制本发明的保护范围。
70.本发明的实施例中,没有多作说明的都是采用常规实验方法完成,实施例中所涉及过程没有多作说明的都是本领域技术人员根据产品说明书或本领域基础知识可以理解并且容易实现的,因此不再详细描述。
71.本发明中涉及的原料来源:
72.本发明中所涉及的发酵溶胞物制备原料菌株,均来自于本发明申请人单位,均已做相应的菌株保藏,均为表达重组胶原蛋白的专属的毕赤酵母工程菌,均保藏于中国微生物菌种保藏管理委员会普通微生物中心;包括公开号cn103102407b中保藏编号为cgmcc no.7189、公开号cn107090458a中保藏编号为cgmcc no.14057、公开号cn111004319a中的保藏编号为cgmcc no.17147、公开号cn110964099a中的保藏编号为cgmcc no.17150、公开号cn110606896b中的保藏编号为cgmcc no.17148、公开号cn110747198b中的保藏编号为cgmcc no.17149、公开号cn113185604b中的保藏编号为cgmcc no.20626与保藏编号为
cgmcc no.20627、公开号cn114106150a中的保藏编号为cgmcc no.21891与cgmcc no.21892的菌株。这些工程菌表达的重组人胶原蛋白在氨基端(n端)或羧基端(c端)有6
×
his-tag标签,利于检测。
73.除上述所列之外,其他产胶原蛋白的菌株,或普通酵母类溶胞物滤液中添加胶原蛋白,能达到本发明技术效果的,均在本发明保护范围之内。
74.巴斯德毕赤酵母工程菌表达生产重组人胶原蛋白为分泌表达:蛋白质被翻译后会进入内质网,切除信号肽后,再经高尔基体加工后分泌于胞外,翻译、加工、分泌是重组人胶原蛋白表达生产最后三个阶段,而在细胞大量表达蛋白质时,这三个阶段是同时进行的,所以虽然多数重组人胶原蛋白分泌于胞外,但毕赤酵母胞仍内有胶原蛋白留存。规模化发酵生产重组人胶原蛋白,一般发酵罐中20~30%体积为发酵菌体。在分批发酵结束后,会进行菌体与发酵液上清的菌液分离(多使用陶瓷膜或连续流离心机),产生含菌体浓度很高的菌浆,主要成份是水和湿菌体,湿菌体浓度可达到50%(w/w)左右,可用直接作为原料用于溶物滤液的制备。
75.本发明中所述的湿菌体浓度为(含水非干燥)菌体重量/悬浮菌体液体重量的比值,文中给出的具体情况下的计算方式、结果。
76.实施例1:溶胞物滤液的制备
77.酵母菌细胞壁较厚,结构比细菌细胞壁更为复杂,且性质稳定,可以在原生质体死亡或凋亡之后仍保持其结构和成分的完整性,已死亡的原生质体的生物膜系统功能丧失,溶酶体中的酶进入胞浆中大量分解胞质内、细胞核中的物质,各种小分子物质通过细胞壁后逸出,但大分子物质(如核酸、蛋白质等)只能待降解为小分子物质后才能通过细胞壁,而细胞壁受到的影响很小,仍能保持其完整性。这也是细胞破碎时酵母细胞与细菌、动物细胞一大不同点,即细胞破碎时,只有细胞壁彻底的裂解方能获得较为完全的溶胞物。
78.本发明选择使用高压力均质的方法可有效破碎酵母的细胞壁,这也是一种快速、高效、不引物外源物质的物理破碎方式。破碎后,对破碎液可使用高速连续流离心机进行裂解液中不溶物(细胞壁不溶性的葡聚糖、不溶性的蛋白质等)和可溶物进行分离。以公开号cn103102407b中保藏编号为cgmcc no.7189工程菌的发酵菌体为例,进行溶胞物滤液的制备。
79.(1)取发酵后的菌浆,12000rpm离心10min,称重法,测定其湿菌体/菌浆上清的湿菌体浓度。
80.(2)以纯水稀释菌浆,稀释得到湿菌体浓度为5%~30%(w/w)的菌体悬液,本实施例中优选10%湿菌体浓度(w/w)。
81.(3)将菌体悬液输入高压均质机(ah30-100 plus,安拓思纳米技术(苏州)有限公司),开启冷水系统制冷,控制破碎温度在4-10℃,以》100mpar的压力,破碎1-3次后即获得裂解液,本实施例中优选120mpar压力、破碎2次后即获得裂解液。
82.(4)将裂解液输入高速度连续流离心机(gq105b,佳毅(上海)机械设备有限公司),开启冷水系统制冷(控制温度在4-10℃),以10000g-20000g离心力离心,获得上清液,本实施例中优选10000g离心力。
83.(5)洁净车间内,将上清液输入板框过滤器系统(cw300-10,海宁市创伟过滤设备器材厂),以0.45μm的pp滤膜和0.22μmpes滤膜先后将上清液过滤,获得溶胞物滤液。
84.(6)加入少量防腐成分,根据需要选择是否稀释,灌装至产品包装中,为成品。
85.本实施例中对得到的发酵溶胞物滤液制备效果及制备过程中间产物进行了检测,具体的包括:
86.一、对步骤(3)中菌体裂解效果检测:
87.毕赤酵母菌体裂解的效果可以通过镜检的方式进行检测,可使用革兰氏染色方法(革兰氏染色试剂盒购自北京索莱宝科技有限公司)进行镜检,其原理也与革兰氏染色类似:结晶紫初染和碘液媒染后,在细胞壁内形成了不溶于水的结晶紫与碘的复合物,将细胞质染成紫色,酵母细胞壁比革兰氏阳性菌细胞壁更厚更致密,乙醇脱色处理时,因失水反而使网孔缩小,再加上它不含类脂,故乙醇处理不会出现缝隙,因此能把结晶紫与碘复合物牢牢留在壁内,所以细胞壁完整的情况下,其仍呈紫色。而如果酵母细胞壁破裂,经乙醇处理时,则会将结晶紫与碘复合物溶出脱色后仍呈无色,再经番红等红色染料复染后呈红色。革兰氏染色法染色后,细胞壁未破裂的呈紫色,细胞壁破裂的细胞(包括仍保持较完整的细胞形态类型)和从胞内释放的物质均被染成红色,高压匀质破碎产物整体在视野内形成均匀的红色背景。
88.实验方法步骤简述如下:
89.破碎前使用血球计数板对酵母细胞进行计数,总数计为c。
90.细胞破碎后,取破碎液,涂片,进行革兰氏染色:要求与普通革兰氏染色相同,注意涂布要均匀且不要厚,乙醇脱色时间要控制。相差显微镜或油镜观察,进行玻片计数,对每次观察下每个视野下紫色的细胞数(n1)和红色细胞数(n2)进行计数,更换玻片上不同位置以获取多个不同视野,重复多次。计算破壁后未破壁细胞的比例a=n1/(n1+n2),取平均值;
91.同样取细胞破碎后破碎液,高速离心后去上清,以稀释菌浆相同体积的纯水重悬沉淀,革兰氏染色或只以结晶紫染色,更利于观察,使用血球计数板进行计数(最好使用相差显微镜),计破碎后仍呈较完整细胞形态的酵母细胞总数目,计为c’。
92.破壁率计算,统计分析:
[0093][0094]
d(100%):破壁率;c:破碎前细胞数目;c’:破碎后细胞总数目;a:破壁后未破壁细胞的比例。
[0095]
酵母破碎时,以要求细胞壁破裂为最为根本的要求,革兰氏染色法是一种极为直观、有效的检测方法,清晰明确、分辨性高。以公开号cn103102407b中保藏编号为cgmcc no.7189工程菌的发酵菌体在不同破碎条件下破壁率为例得到:100mpar(3次):破壁率95.9%;120mpar(2次):破壁率97.3%;150mpar(2次):破壁率99.4%;200mpar(2次):破壁率99.5%,其破碎裂解效果如图2所示。120mpar破碎2次已完全可满足毕赤酵母的裂解需求。
[0096]
二、对本实施例中方法得到的溶胞物滤液中重组人胶原蛋白、总蛋白、多糖、氨基酸、维生素的检测
[0097]
本实施例所采用的工程菌表达的重组人胶原蛋白在氨基端(n端)或羧基端(c端)有6
×
his-tag标签,利于检测滤液中的胶原蛋白的检测可使用western blot进行直观的定性检测、使用elisa进行定量检测。以公开号cn103102407b中保藏编号为cgmcc no.7189工
程菌为例,采用发酵菌体10%湿菌体浓度制备的溶胞物滤液,进行相应检测。
[0098]
a.sds-page电泳及wb检测结果:
[0099]
取制备的溶胞物滤液,以未转入表达胶原蛋白基因的空白巴斯德毕赤酵母菌(购自赛默飞世尔科技(中国)有限公司)制备溶胞物滤液为空白对照,进行sds-page电泳及western blot检测,结果如下:
[0100]
图3a为以10%湿菌体浓度制备的溶胞物滤液进行sds-page电泳图,从上到下分布着不同的大小的蛋白质;图3b为以10%湿菌体浓度制备的溶胞物滤液western blot结果(anti-his,抗体购自生工生物工程(上海)股份有限公司,小鼠抗his单克隆抗体,货号d199987),从图3b(ecl化学发光显色,全自动化学发光图像分析系统tanon 5200将蛋白质分子质量标准合成于图像)中可以看到,6
×
his标签可检测到抗6
×
his标签的条带,目的条带大小均与公开号cn103102407b的专利中所表达的重组iii型人胶原蛋白纯化冻干品的电泳中分子量一致,说明溶胞物滤液含有重组iii型人胶原蛋白,而空白对照(未转入表达胶原蛋白基因的空白巴斯德毕赤酵母菌裂解制备的溶胞物滤液)则无任何条带显现。
[0101]
b.elisa检测5d胶原蛋白含量检测:
[0102]
取以10%湿菌体浓度制备的溶胞物滤液进行elisa检测,同时取纯化后的重组iii型人胶原蛋白冻干海绵进行elisa标准曲线制定,以未转入表达胶原蛋白基因的空白巴斯德毕赤酵母菌制备溶胞物滤液为空白对照,使用间接elisa法,实验步骤简述如下:
[0103]
(1)以pbs梯度稀释溶胞物滤液(10、100倍),加入酶标板中,同时以pbs溶解及梯度稀释公开号cn103102407b的专利中所表达的重组iii型人胶原蛋白纯化冻干品样品,也加入酶标板中,4℃静置过夜。
[0104]
(2)弃酶标板中液体,以pbs稀释的5%脱脂奶粉溶液(购自生工生物工程(上海)股份有限公司,这里为质量体积比,如5g的脱脂奶粉溶解于100ml的pbs中),37℃中封闭处理2小时。
[0105]
(3)弃酶标板中液体,pbs清洗两次后,加入5%脱脂奶粉溶液稀释一抗(anti-his,抗体购自生工生物工程(上海)股份有限公司,小鼠抗his单克隆抗体,货号d199987)溶液,稀释比例为1:5000,37℃中静置1小时。
[0106]
(4)弃酶标板中液体,pbs清洗两次后,加入5%脱脂奶粉溶液稀释hrp标记的二抗(购自生工生物工程(上海)股份有限公司,小鼠抗his单克隆抗体配套的二抗,货号d199987)溶液,稀释比例为1:2000,37℃中静置1小时。
[0107]
(5)弃酶标板中液体,pbs清洗两次后,加入tmb显色液(tmb显色p0209-100ml,碧云天生物),待出现明显蓝色后,加入终止液(p0215-100ml,碧云天生物),于酶标仪(varioskan
tm lux多功能酶标仪-vl0l0td0,赛默飞世尔科技(中国)有限公司)读取450nm的吸光度值。
[0108]
(6)graphpad prism 5对标准曲线进行拟合,进行数据处理,计算样品中重组胶原蛋白浓度。拟合的标准曲线如图4所示,横坐标是胶原蛋白浓度的对数,纵坐标是450nm的吸光度值。曲线拟合方程为:
[0109]
y=0.0007221+(1.372-0.0007221)/(1+10^((-0.1103-x)*1.341)))
[0110]
其中,y是蛋白质浓度,x是检测到样品的450nm的吸度光值。
[0111]
不同浓度的溶胞物滤液elisa检测结果(450nm吸光度值)如下:
[0112]
表1.不同浓度的溶胞物滤液elisa检测450nm吸光度值
[0113]
稀释倍数/10100溶胞物滤液吸光度值0.23790.41200.1375空白对照吸光度值0.00250.00360.0037
[0114]
从曲线拟合上分析,较好的检测范围为od450范围约在0.25~1.25之间。实验组中可以有效计算的是ddh2o为破碎液离心上清稀释10倍后elisa实验od450值。溶胞物滤液中重组iii型人胶原蛋白浓度为11.44μg/ml。总体而言,10%湿菌体浓度制备的溶胞物滤液,重组胶原蛋白含量约为10~15μg/ml,当然随着湿菌体浓度的增长,重组人胶原蛋白含量也会升高。而未转入表达胶原蛋白基因的空白巴斯德毕赤酵母菌制备溶胞物滤液的od450则基本处于检测有效范围下限之外,检测不到胶原蛋白。
[0115]
c.溶胞物滤液中总蛋白含量的检测
[0116]
实验方法参考《中华人民共和国药典》(2020版)蛋白质含量测定法中第五法:考马斯亮蓝法(bradford法)进行总蛋白质含量的检测。溶胞物滤液以公开号为cn103102407b的专利中cgmcc no.7189工程菌的发酵菌体,0.2%~20%湿菌体浓度制备,bradford蛋白浓度测定试剂购自碧云天生物(p0006),实验步骤简述如下:
[0117]
(1)以纯水稀释蛋白标准(5mg/ml bsa)至0、0.125、0.25、0.5、0.75、1、1.5mg/ml。
[0118]
(2)取5μl不同浓度蛋白标准加到96孔板的蛋白标准孔中,同时取5μl溶胞物滤液样品到96孔板的样品孔中。
[0119]
(3)各孔加入250μl g250染色液。
[0120]
(4)用酶标仪(varioskan
tm lux多功能酶标仪-vl0l0td0,赛默飞世尔科技(中国)有限公司)测定595nm吸光度值。
[0121]
(5)处理数据,根据标准曲线和使用的样品体积计算出样品中的蛋白浓度。标准曲线及曲线方程如图5所示。0.2%~20%湿菌体浓度制备的溶胞物滤液中总蛋白含量(mg/ml)结果如表2:
[0122]
表2.0.2%~20%湿菌体浓度制备的溶胞物滤液中总蛋白含量(mg/ml)
[0123][0124]
bradford法中标准曲线的斜率(r2)》0.98,随着制备溶胞物滤液时湿菌体浓度的增加,溶胞物滤液中总蛋白含量随之增加,为0.192~26.9mg/ml,当湿菌体浓度在10%以上时,溶胞物滤液中总蛋白含量均大于10mg/ml(》1%),最高可达到到25mg/ml(2.5%)以上,而多次以10%菌浓度裂解生产的滤液中总蛋白含量一般为10~15mg/ml。也根据实际情况选取《中华人民共和国药典》(2020版)蛋白质含量测定法中其它方法比如bca法、双缩脲法、凯氏定氮法进行总蛋白含量的检测。
[0125]
d.溶胞物滤液中多糖含量的检测
[0126]
参考文献“金凤慈与闵莉静,苯酚-硫酸法测定百合多糖中糖含量.科技信息,2011(10)”第127-128页中的方法,溶胞物滤液以公开号cn103102407b的专利中cgmcc no.7189工程菌的发酵菌体10%-20%湿菌体浓度制备,检测多糖含量。
[0127]
实验步骤简述如下:
[0128]
(1)甘露糖标准液(0.1mg/ml)的制备:精密称取105℃干燥至恒重的甘露糖500mg置于500ml容量瓶中,加水溶解并稀释至刻度摇匀,得1mg/ml的储备溶液,备用。用10ml移液管移取上溶液10ml,定容至100ml,得0.1mg/ml的甘露糖标准液。
[0129]
(2)85%的苯酚溶液的制备:将苯酚用水浴锅加热至45度,取85ml的苯酚溶液,溶于15ml的水中,待溶解完,得到85%的苯酚溶液。放入冰箱4度冰箱,避光保存。长期使用。
[0130]
5%的苯酚溶液的制备:取出85%的苯酚水浴45度加热溶解,取1ml的溶液,再溶解于16ml纯水中既得5%的苯酚溶液。避光保存,现配先用。
[0131]
(3)标准样品制备与标准曲线绘制:精确吸取甘露糖标准液(0.1mg/ml),按照表3进行配制。加入苯酚液0.5ml和(快速,精密加入)浓硫酸2.5ml,混匀20秒,在80℃水浴下放置30min后,冷却,于波长490nm处测定吸光度值。以空白(空白)参比实验,以吸光度值为纵坐标,甘露糖浓度为横坐标绘制标准曲线,建立标准曲线回归方程。
[0132]
表3.标准样品的配制和检测
[0133][0134]
(4)待测样品检测,方法同上。
[0135]
(5)多糖含量的计算:
[0136]
将测得样品的吸光度带入标准曲线方程。得到相应的多糖溶度,再除以样品溶胞物滤液中多糖的溶度,既得多糖的含量。
[0137][0138]
w:样品多糖的含量;w1:在标准曲线回归方程式下,计算得到的多糖的溶度;w2:样品溶胞物滤液中多糖的溶度。
[0139]
标准曲线及曲线方程如图6所示:
[0140]
所制备得到溶胞物滤液中多糖含量(mg/ml)如下:
[0141]
制备溶胞物滤液时的湿菌体浓度(w/w)为10%时,多糖含量达到1.15mg/ml;湿菌体浓度15%时,多糖含量达到1.45mg/ml;湿菌体浓度20%时,多糖含量达到1.59mg/ml。综合其他浓度时检测结果可知,一般溶胞物滤液中的多糖含量在1-1.6mg/ml。
[0142]
e.溶胞物滤液中氨基酸、维生素含量的检测
[0143]
溶胞物滤液以公开号cn103102407b中cgmcc no.7189工程菌的发酵菌体10%湿菌体浓度制备。以“gb 5009.89-2016食品安全国家标准食品中烟酸和烟酰胺的测定”第二法、“gb 5009.85-2016食品安全国家标准食品中维生素b2的测定”第一法、“gb 5009.124-2016食品安全国家标准食品中氨基酸的测定”、“gb 5413.20-2013食品安全国家标准婴幼儿食品和乳品中胆碱的测定”第二法、“gb 5009.270-2016食品安全国家标准食品中肌醇的测
定”第二法、“gb 5009.154-2016食品安全国家标准食品中维生素b6的测定”第一法、“gb 5009.210-2016食品安全国家标准食品中泛酸的测定”第一法、“gb 5009.211-2014食品安全国家标准食品中叶酸的测定”、“gb 5009.259-2016食品安全国家标准食品中生物素的测定”检测溶胞物滤液中氨基酸、维生素的含量,委托上海天祥质量技术服务有限公司检测完成并出具检测报告。
[0144]
检测结果如表4所示。
[0145]
表4.溶胞物滤液中氨基酸、微生物检测结果
[0146][0147]
结果显示,以10%湿菌体浓度制备的的溶胞滤液中含有多种维生素b族、氨基酸,氨基酸总量可达到约0.82%,作为原料可为化妆品提供丰富的活性物质成份。
[0148]
三、对得到的溶胞物滤液的安全性检测
[0149]
a.残留dna的检测
[0150]
溶胞物滤液中的dna主要是巴斯德毕赤酵母基因组dna残留,以pcr-荧光探针法检测以10%菌浓度制备的溶胞物滤液中的dna,委托湖州申科生物技术有限公司完成并出具检测报告。基本过程简述如下,实验过程中相关试剂无特殊说明均为湖州申科生物技术有限公司生产或或市售可购买得到:
[0151]
(1)含有溶胞物滤液样品进行稀释后,以磁珠法纯化;
[0152]
(2)以巴斯德毕赤酵母特异性的引物和探针(毕赤酵母残留dna检测试剂盒(pcr-荧光探针法),购自湖州申科生物技术有限公司sk030205p100),对溶胞物滤液样品中dna的特异性片段进行体外扩增(定量pcr仪fqd-96a,linegene 9600plus定量pcr系统);
[0153]
(3)在pcr扩增过程中,特异性探针会从模板dna上释放出来,随之利用荧光定量
pcr仪就能检测出荧光信号,荧光信号数据通过pcr仪所具有的检测软件进行分析。
[0154]
检测结果如下:
[0155]
表5.溶胞物滤液残留dna检测结果
[0156][0157]
表中,
[0158]
检测均值:检测值的平均值。cv:cv(coefficient of variance),标准差与均值的比率,统计学中常用于表征变异系数的,两个cv的含义都是一样的。加标量:指的加入的标准品的量。加标检测均值:加入标准品、参照品检测值的平均值。
[0159]
结果可见,本发明制备的溶胞物滤液中的dna含量检测为31.4μg/ml,低于生物药品中要求的dna残留量,处于安全范围。
[0160]
b.重金属、甲醇含量等的检测
[0161]
依据《化妆品安全技术规范》2015版第四章1.6和2.22第一法相关检测方法,对溶胞物滤液中重金属、甲醇含量进行检测,委托苏州海关综合技术中心完成并出具检测报告。
[0162]
检测结果如下表6所示:
[0163]
表6.溶胞物滤液重金属、甲醇检测结果
[0164]
项目结果单位技术要求检测结果方法检出浓度单项评判铅mg/kg≤10<0.030.03符合砷mg/kg≤2<0.0010.001符合汞mg/kg≤1<0.0010.001符合镉mg/kg≤5<0.0010.001符合甲醇mg/kg≤2000<2525符合
[0165]
结果可见,本发明制备的溶胞物滤液中重金属、甲醇含量,结果均符合安全性要求,本发明中溶胞物滤液为化妆品原料,在实际产品的配制使用中,会产生实际的稀释效果,不存在安全性问题。
[0166]
c.微生物限度的检测
[0167]
依据《化妆品安全技术规范》2015版中微生物限度检测方法,对溶胞物滤液进行微生素限度的检测,委托苏州海关综合技术中心完成并出具检测报告,结果均符合安全性要求,检测结果如下表7所示,结果可见,本发明制备的溶胞物滤液中微生物结果均符合要求。
[0168]
表7.溶胞物滤液微生物检测结果
[0169][0170][0171]
d.毒理学检测
[0172]
依据《化妆品安全技术规范》2015版中毒理学试验方法,对溶胞物滤液进行毒理学安全性评价,委托宁波海关技术中心完成检测并出具检测报告。
[0173]
检测结果统计如下表8所示,表中所列实验方法均为《化妆品安全技术规范》中规定的常规方法,实验均在宁波海关技术中心完成。结果可见,本发明制备的溶胞物滤液中毒理学检测结果均符合要求,安全性有保障。
[0174]
表8.溶胞物滤液毒理学安全性检测结果
[0175][0176]
(1)急性经口毒性试验
[0177]
受试样品处理:称取5.0806g样品(即本发明制备的溶胞物滤液)置于烧杯中取少量纯水将样品混匀后转入20ml容量瓶内,以少量纯水多次冲洗烧杯一并转入容量瓶中,加入纯水定容至刻度线,充分摇匀后转入样品管标识备用,样品现配现用。灌胃体积2.0ml/100g
·
bw。
[0178]
实验动物:6周龄spf级icr小鼠(上海杰思捷实验动物有限公司)10只,雌雄各半(雌性动物未孕和未曾产仔),体重控制在18.5g~21.4g(同性别体重不超过均值的
±
20%)
[0179]
试验前动物在屏障环境动物房(屏障环境、23.0℃~23.8℃、相对湿度为40.8%~59.7%)中适应8天(co60辐照鼠料,江苏省协同医药生物工程有限责任公司;一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用),染毒前动物禁食过夜。
[0180]
试验开始后,采用一次限量法,灌胃剂量为5080.6mg/kg。染毒后继续禁食3小时,每天观察中毒症状或行为变化,每周称重一次。观察并记录染毒过程和观察期内动物的中毒和死亡情况,观察周期14天,观察期结束后,处死存活动物并进行大体解剖。
[0181]
检测结果:
[0182]
实验动物在染毒14天内未见任何中毒症状和中毒死亡;雌雄动物的体重未见异常。实验观察结束,对受试动物进行大体解剖检查也未见异常变化。ld50>5080.6mg/kg,详细结果如下:
[0183]
表9.急性经口毒性试验结果
[0184][0185]
可见,在本试验条件下,受试样品对icr小鼠的急性经口ld50>5000mg/kg。根据急性经口毒性分级,该样品属于实际无毒级。
[0186]
(2)急性经皮毒性试验
[0187]
受试样品处理:用原样品溶胞物滤液测试。
[0188]
实验动物:8周龄spf级sd大鼠(上海杰思捷实验动物有限公司)10只,雌雄各半(雌性动物未孕和未曾产仔),体重控制在201.2g~218.2g。
[0189]
试验前动物在屏障环境动物房(屏障环境、22.0℃~22.9℃、相对湿度为45.8%~55.5%)中适应7天(co60辐照鼠料,江苏省协同医药生物工程有限责任公司;一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用,染毒前动物不禁食,自由饮水。
[0190]
试验开始后,采用一次限量法,染毒剂量为2500mg/kg。试验期间动物单笼饲养。染毒前体重范围201.2g~218.2g,计算10%的体表面积为31.3cm2~33.1cm2。试验前24小时,剃除动物背部染毒区域的被毛,备皮区域为5cm
×
7cm。称取每只动物所需受试样量为0.5g,均匀涂敷于备皮区域,然后用一层薄胶片覆盖,再用无刺激胶布固定,防止动物舔食,封闭接触24小时后取下固定物和覆盖物,用水洗去皮肤上残留的受试样品。观察并记录染毒过程和观察期内动物的中毒和死亡情况,每周称重一次,观察周期为14天,观察期结束后,处死存活动物并进行大体解剖。
[0191]
试验结果:实验动物在染毒14天内未见任何中毒症状和中毒死亡;雌雄动物的体重未见异常。实验观察结束,对受试动物进行大体解剖检查也未见异常变化。ld50>2500mg/kg。结果见下表10。
[0192]
表10.急性经皮毒性试验结果
[0193][0194]
可见,在本试验条件下,受试样品对sd大鼠的急性经皮ld50>2180mg/kg,根据急性皮肤毒性分级,该样品为微毒级。
[0195]
(3)急性皮肤刺激性试验
[0196]
受试样品处理:用原样品溶胞物滤液测试。
[0197]
实验动物:普通级新西兰兔4只(嘉善县惠民街道生旺家庭农场);雌雄各半(雌性动物选用未孕和未曾产仔);体重控制在2.27kg~2.98kg。
[0198]
试验前动物在实验动物房环境中至少适应3d,单笼饲养,饲养环境温度:22.8℃~23.6℃,相对湿度:52.9%~61.4%4;饲养饲料实验兔配合饲料(维持型,桐乡市东方饲料有限责任公司);一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用。
[0199]
实验方法:试验前约24h将实验动物背部脊柱两侧被毛剪掉,去毛范围各约3cm
×
3cm。取受试样品0.5ml直接涂在一侧去毛皮肤上,涂抹面积为2.5cm
×
2.5cm,然后用二层纱布(2.5cm
×
2.5cm)和一层玻璃纸覆盖,再用无刺激性胶布和绷带加以固定。另一侧皮肤作为对照。封闭试验4h后用温水清除残留受试样品。于清除受试样品后的1h、24h、48h和72h观察涂抹部位皮肤反应,进行皮肤反应评分,并根据24h、48h和72h各观察时点最高积分均值,进行刺激强度分级。
[0200]
试验结果:试验期间,实验动物均未出现异常症状,各观察时点(24h、48h和72h)最
高皮肤刺激积分均值为0.00。在本试验条件下,受试样品对家兔急性皮肤刺激性为:无刺激性。
[0201]
表11.急性皮肤刺激性试验结果
[0202][0203]
(4)多次皮肤刺激性试验
[0204]
受试样品处理:用原样品溶胞物滤液测试。
[0205]
实验动物:普通级新西兰兔4只(嘉善县惠民街道生旺家庭农场);雌雄各半(雌性动物选用未孕和未曾产仔);体重控制在2.34kg~2.92kg。
[0206]
试验前动物在实验动物房环境中至少适应3d,单笼饲养,饲养环境温度:22.0℃~23.9℃,相对湿度:40.5%~58.6%;饲养饲料实验兔配合饲料(维持型,桐乡市东方饲料有限责任公司);一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用。
[0207]
实验方法:试验前约24h将实验动物背部脊柱两侧被毛剪掉,去毛范围各为3cm
×
3cm。涂抹面积2.5cm
×
2.5cm。取受试样品0.5ml涂抹在一侧去毛皮肤上,另一侧去毛皮肤作为对照,每天涂抹1次,连续涂抹14d。从第二天开始,每次涂抹前剪毛,用温水清除残留受试样品。一小时后观察结果。
[0208]
试验结果:试验期间,实验动物均未出现异常症状,14天内每天每只动物平均积分为0.00。详见下表12。在本试验条件下,受试样品对家兔多次皮肤刺激性为无刺激性。
[0209]
表12.多次皮肤刺激性试验结果
[0210][0211]
(5)急性眼刺激性试验
[0212]
受试样品处理:用原样品溶胞物滤液测试。
[0213]
实验动物:普通级新西兰兔3只(嘉善县惠民街道生旺家庭农场);雌雄各半(雌性动物选用未孕和未曾产仔);体重控制在2.40kg~2.61kg。
[0214]
试验前动物在实验动物房环境中至少适应3d,单笼饲养,饲养环境温度:23.0℃~24.1℃,相对湿度:49.8%~60.7%;饲养饲料:实验兔配合饲料(维持型,桐乡市东方饲料有限责任公司);一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用。
[0215]
试验方法:在试验开始前的24h内对试验动物的两只眼睛进行检查(包括使用2%荧光素钠溶液检查)。有眼睛刺激症状、角膜缺陷和结膜损伤的动物不能用于试验。轻轻拉开家兔一侧眼睛的下眼睑,将受试样品0.1ml滴入结膜囊中,使上、下眼睑被动闭合1s,以防止受试样品丢失。另一侧眼睛不处理作自身对照。滴入受试样品后24h内不冲洗眼睛。在滴入受试样品后1h、24h、48h、72h以及第4d和第7d对动物眼睛进行检查。如果72h未出现刺激反应,即可终止试验。
[0216]
试验结果:试验期间,实验动物未出现异常症状,动物个体积分均值均为0.00。详见下表13。在本试验条件下,受试样品对家兔急性眼刺激性为:无刺激性。
[0217]
表13.急性眼刺激性试验结果
[0218][0219]
*动物个体积分均值指的是每只动物在三个不同观察时间(24h、48h和72h)角膜、虹膜、结膜充血和结膜水肿四方面的平均积分(即每只动物的24h、48h和72h评分之和除以观察时点数3)。
[0220]
(6)皮肤光毒性试验
[0221]
受试样品处理:用原样品胞溶物滤液测试。阳性对照:8-甲氧基补骨脂(批号:l630v07;北京百灵威科技有限公司),溶剂:无水乙醇,浓度:0.05%;用量:2.4000mg。
[0222]
实验动物:普通级荷兰种豚鼠试验组和阳性对照组各6只(余姚市泗门镇建飞实验兔养殖场);雌雄不限(雌性动物选用未孕和未曾产仔);体重控制在261.2g~272.4g。
[0223]
试验前动物在实验动物房环境中至少适应3d。饲养环境温度:23.3℃~24.0℃;相对湿度:49.5%~56.7%;饲养饲料:豚鼠配合饲料(维持型,苏州安慕飞生物科技有限公司);一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)。经饮水嘴直接供动物自由饮用。
[0224]
试验方法:照射剂量:10000mj/cm2,平均光强度:15.1mw/cm2[0225]
照射时间计算公式为:
[0226][0227]
注:1mw/cm2=1mj/cm2/sec
[0228]
在uva-toxi光毒仪里输入上述照射剂量和平均光强度后,按计算公式得出照射时间为00:10:64(即照射时间为664s);
[0229]
试验步骤:试验前动物在实验动物房环境中至少适应3d。试验前约24h,将动物脊柱两侧皮肤去毛,试验部位皮肤需完好,无损伤及异常。备4块去毛区,每块去毛面积约为2cm
×
2cm。将动物固定,按《化妆品安全技术规范》(2015年版)第六章7皮肤光毒性试验表1所示,在动物去毛区1和2涂敷0.2ml受试样品。30min后,左侧(去毛区1和3)用铝箔复盖,胶带固定,右侧用uva进行照射。结束后分别于1h、24h、48h和72h观察皮肤反应,根据《化妆品安全技术规范》(2015年版)第六章7皮肤光毒性试验表2判定每只动物皮肤反应评分。阳性对照组按同样方法进行。
[0230]
试验结果:试验期间,实验动物均未出现异常症状,各观察时点的动物积分均为0,根据皮肤刺激反应分级,该受试样品未见皮肤光毒性。阳性对照物对豚鼠皮肤光毒性试验结果见下表14,受试样品对豚鼠皮肤光毒性试验结果见表15。在本试验条件下,受试样品对豚鼠皮肤光毒性试验结果:未见皮肤光毒性。
[0231]
表14.阳性对照物对豚鼠皮肤光毒性试验结果
[0232][0233]
注:表头中1、2、3、4为《化妆品安全技术规范》(2015年)第六章7、皮肤光毒性试验之图1所示试验区。
[0234]
表15.受试样品对豚鼠皮肤光毒性试验结果
[0235][0236]
注:表头1、2、3、4为《化妆品安全技术规范》(2015年)第六章7、皮肤光毒性试验之图1所示试验区。
[0237]
(7)皮肤变态反应试验
[0238]
受试样品处理:用原样品胞溶物滤液测试。阳性对照:α-己基肉桂醛(批号:lv30v28;北京百灵威科技有限公司);溶剂:无水乙醇(分析纯,批号:20210119,国药集团化学试剂有限公司)、丙酮(分析纯,批号:20170918,国药集团化学试剂有限公司)、millipore
纯水。
[0239]
诱导浓度:60%,取3.6mlα-己基肉桂醛与2.4ml 80%乙醇溶液混匀配制得到;激发浓度:30%,取3.0mlα-己基肉桂醛与7.0ml 80%丙酮溶液混匀配制得到;用量:6.6ml。
[0240]
实验动物:普通级荷兰种豚鼠(余姚市泗门镇建飞实验兔养殖场);试验组和阳性对照组各20只,阴性对照组10只;雌雄不限(雌性动物未孕和未曾产仔);体重控制在257.8g~273.4g。
[0241]
试验前动物在实验动物房环境中至少适应3d。饲养环境温度:22.5℃~24.1℃;相对湿度:43.4%~61.9%;饲料饲料:豚鼠配合饲料(维持型,苏州安慕飞生物科技有限公司),一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)。经饮水嘴直接供动物自由饮用。
[0242]
试验方法:试验前约24h,将豚鼠背部左侧去毛,去毛范围约为6cm2。
[0243]
诱导接触:将0.2ml受试样品涂在试验组动物2cm
×
2cm去毛皮肤上,以二层纱布和一层玻璃纸覆盖,再以无刺激胶布封闭固定6h。第7d和第14d以同样方法重复一次。阳性对照组用60%α-己基肉桂醛溶液同法操作,阴性对照组除不给予受试样品外与试验组同法操作。
[0244]
激发接触:末次诱导后14d,将0.2ml受试样品涂于试验组和阴性对照组豚鼠背部右侧2cm
×
2cm去毛区(接触前24h脱毛),然后用二层纱布和一层玻璃纸覆盖,再以无刺激胶布固定6h。阳性对照组用30%α-己基肉桂醛溶液同法操作。激发接触结束后24h和48h观察皮肤反应,评分并判定致敏强度。
[0245]
试验结果:试验期间,实验动物均未出现异常症状,各观察时点的致敏率均为0%。见表16、表17。在本试验条件下,受试样品对豚鼠皮肤变态反应试验结果为:未见皮肤变态反应。
[0246]
表16.试验动物体重汇总表
[0247]
组别动物数(只)起始体重(g)终止体重(g)阴性对照10262.2
±
3.1316.3
±
5.1受试样品组20265.6
±
4.7327.5
±
12.0阳性对照20286.6
±
5.0368.9
±
5.8
[0248]
表17.受试样品或阳性对照对豚鼠皮肤变态反应试验结果(bt法)
[0249][0250]
注:在皮肤反应强度栏中填写皮肤反应积分为0、1、2、3
……
时,表示发生反应的动物数占受试动物数的比例;表中的原样指的是本发明制备的溶胞物滤液。
[0251]
(8)细菌回复突变试验
[0252]
受试样品处理:以无菌纯水为溶剂分别配制成各剂量组浓度。
[0253]
阴性对照:无菌纯水、二甲基亚砜(dmso,无色澄清液体)
[0254]
阳性对照:
[0255]
(1)不加s9(购买,美国moltox):
[0256]
敌克松(dexon):批号:g1063485;生产厂家:德国dr.enrenstorfer gmbh公司;溶剂:无菌纯水;浓度:500μg/ml;用量:0.1ml/皿;
[0257]
叠氮钠(sa):批号:20120615;生产厂家:上海埃彼化学试剂有限公司;溶剂:无菌纯水;浓度:15μg/ml;用量:0.1ml/皿。
[0258]
(2)加s9:
[0259]
2-氨基芴(2-af):批号:c11449586;生产厂家:上海麦克林生化科技有限公司;溶剂:二甲基亚砜(dmso);浓度:100μg/ml;用量:0.1ml/皿;
[0260]
1,8-二羟基蒽醌(1,8-dhq):批号:c10429233;生产厂家:上海麦克林生化科技有限公司;溶剂:dmso;浓度:500μg/ml;用量:0.1ml/皿;
[0261]
环磷酰胺(cp):批号:k1812016;生产厂家:阿拉丁试剂(上海)有限公司;溶剂:无菌纯水;浓度:2000μg/ml;用量:0.1ml/皿。
[0262]
实验菌株:鼠伤寒沙门氏菌株(ta97a、ta98、ta100、ta102和ta1535),购自美国moltox公司,经鉴定,试验菌株符合标准要求。
[0263]
试验步骤:选择12.5μl/皿、25.0μl/皿、50.0μl/皿和100.0μl/皿四个剂量组,同时设空白对照、溶剂对照(阴性对照)、阳性诱变剂对照和无菌对照组。菌株经增菌培养制得增菌液后进行平板掺入。实验时,将含0.5mmol/l组氨酸、0.5mmol/l生物素溶液的2.0ml顶层培养基分装于试管中,于45℃水浴保温,然后每管依次加入增菌液0.1ml、受试样品0.1ml和磷酸盐缓冲液0.5ml或者s9混合液0.5ml(需代谢活化时),充分混匀,迅速倾入底层培养基上,转动平板,使其分布均匀。水平放置待冷凝固化后,将平板翻转,倒置于37℃培养箱中孵育48h。阳性诱变剂对照、溶剂对照、空白对照和无菌对照也依此法操作。计数每皿回变菌落数。
[0264]
记录受试物各剂量组、空白对照(自发回变)、溶剂对照以及阳性诱变剂对照的每皿回变菌落数,并求平均值和标准差。
[0265]
试验结果:标准平板掺入试验结果见表18。溶剂对照(阴性对照)结果表明在不添加试验菌株鼠伤寒沙门氏菌条件下,各组均无菌落生长,可用于试验;空白对照和阳性诱变剂对照组的回复突变菌落数在可被接受的范围内,本试验有效;
[0266]
本试验条件下,受试物各剂量组在加与不加代谢活化系统平板掺入法检测的回复菌落数均未超过溶剂对照组的2倍以上,也未呈现剂量反应关系。
[0267]
表18.鼠伤寒沙门氏菌回复突变试验结果(个/皿,x
±
s)
[0268]
[0269][0270]
(9)体内哺乳动物细胞微核试验
[0271]
受试样品处理:样品溶胞物滤液以纯水为溶剂配制成各剂量组溶液。
[0272]
阴性对照:纯水
[0273]
阳性对照:环磷酰胺(批号:f1812016;品牌:阿拉丁;溶剂:纯水;浓度:3mg/ml)
[0274]
实验动物:spf级icr小鼠(上海杰思捷实验动物有限公司)30只,雌雄各半(雌性动物未孕和未曾产仔),体重控制在25.0g~27.4g,同性别体重不超过均值的
±
20%。
[0275]
试验前动物在屏障环境动物房(屏障环境、22.8℃~23.5℃、相对湿度为51.6%~57.8%)中检疫期为4天(co60辐照鼠料,江苏省协同医药生物工程有限责任公司;一级ro超滤水(加入次氯酸钠,将水中游离氯含量控制在2-3ppm除菌)经饮水嘴直接供动物自由饮用,染毒前动物不禁食,自由饮水。
[0276]
试验方法:剂量设置:设受试物组、阴性对照组(纯水)和阳性对照组(60mg/kg环磷酰胺)。根据预试验结果,受试物组的终浓度设定为1000mg/kg、2000mg/kg、5000mg/kg。
[0277]
给药方式:经口灌胃;给药体积:20ml/kg
·
bw。
[0278]
试验步骤:动物染毒采用经口灌胃30h染毒法,即两次染毒间隔24h,第二次染毒后6h取材。用颈椎脱臼法处死动物,取股骨。剥除肌肉,擦净血污。切断股骨两端,暴露骨髓腔。用注射器吸取0.1ml小牛血清,冲洗骨髓腔用冲洗液常规涂片,晾干或热风吹干。将已干的涂片,在甲醇中固定10min。用姬姆萨应用液染色15min,然后用清水冲洗,晾干。阳性与阴性对照组的操作程序同试验组。选择细胞分布均匀、完整、着色适当的区域。在油镜下计数含
微核的pce(嗜多染红细胞)数。pce呈灰蓝色,nce(成熟红细胞)呈粉红色。每只动物计数2000个pce中含有的微核数。微核细胞率(mn
‰
)指含有微核的pce数,以千分率表示。1个pce中出现有2个或多个微核,仍按1个计数。采用波松分布u检验或其他适当的显著性试验方法,对各组间的微核率进行比较。
[0279]
试验结果:试验结果表明与阴性对照组比较,阳性对照组小鼠骨髓中含微核的嗜多染细胞数显著升高(p《0.05),而各受试物组的嗜多染红细胞微核率与阴性对照组比较,差异无统计学意义(p》0.05)。
[0280]
在本试验条件下,该受试物体内哺乳动物红细胞微核试验结果为阴性,该样品为非致突变剂。急性毒性检测(急性经口毒性试验检测无毒,急性经皮毒性试验检测微毒性)、皮肤刺激性/腐蚀性、皮肤致敏性、皮肤光毒性及遗传毒性等多项检测结果表明滤液具有良好的毒理学安全性。
[0281]
表19.微核试验微核率统计结果
[0282][0283]
注:与阴性对照组比较,p<0.05。微核率和pce/nce以小鼠为单位统计,表示为均值
±
标准差。
[0284]
e.人体皮肤斑贴试验
[0285]
依据《化妆品安全技术规范》2015版中人体安全性检验方法,对溶胞物滤液进行人体皮肤斑贴试验,委托英格尔检测技术服务(上海)有限公司完成并出具检测报告。
[0286]
共选取33名受试者进行了测试,试验结果显示32名受试者在去除受试物斑试器后0.5h、24h、48h,评分等级均为0,均未出现皮肤反应;1名受试者在去除受试物斑试器后24h,评分等级为1,具体实验结果见下表20所示。
[0287]
表20.溶胞物滤液皮肤封闭型斑贴试验测试结果
[0288][0289]
表21.皮肤封闭型斑贴试验皮肤反应分级标准
[0290][0291]
参照《化妆品技术审评要点》中的规定,30例受试者中出现1级皮肤不良反应的人数不得多于5例(不含5例),具体分级标准见上表21。结果显示,本次测试结果符合规定的安全性要求,据此认为,本发明制备的溶胞物滤液应用于人体是安全的。
[0292]
综上所述,本发明制备所得的巴斯德毕赤酵母发酵溶胞物滤液,根据《化妆品安全技术规范》中的方法进行重金属含量、甲醇含量、微生物限度、安全毒理学、人体皮肤斑贴试验检测,同时进行了残留dna检测,证明其安全性符合应用于化妆品的要求。
[0293]
实施例2:发酵溶胞物滤液的功效性检测
[0294]
本实施例中,以实施例1中制备的溶胞物滤液为例,进行多项功效性评测。
[0295]
一、舒缓功效检测
[0296]
表皮作为分隔机体与外界环境的组织,除了作为物理屏障外,角质形成细胞能接受外界“危险信号”刺激并转化传递给皮肤内免疫细胞预警,形成皮肤的免疫屏障,皮肤免疫屏障功能调节紊乱会导致皮肤炎症性反应,引发皮肤问题和疾病。皮肤接触刺激性较强的一些化妆品或紫外线等,会导致皮肤屏障发生临床型的急性损伤,导致皮肤干燥,出现红斑现象。阴离子表面活性剂十二烷基硫酸钠(sodium lauryl sulfate,sls)具有双亲性(亲水性和亲脂性)特征,在较大浓度下接触皮肤后能够损伤皮肤屏障,尤其是屏障中的脂质成分以及细胞膜。因此本实验以体外重组的表皮模型为研究对象,采用sls刺激造成损伤模型,再用实施例1的得到的溶胞物滤液进行处理,以相关炎症因子和组织形态变化为指标,通过检测组织形态、炎性介质pge2以及辣椒素受体trpv-1的含量的变化来评价本发明制备的溶胞物滤液的舒缓功效,委托陕西博溪通用检测科技有限公司进行检测并出具检测报告。
[0297]
实验方案如下表22所示。
[0298]
表22.溶胞物滤液舒缓功效检测分组及检测方法
[0299][0300]
(1)根据上表22测试方案,将模型转移到6孔板中(提前添加0.9ml模型培养液),在6孔板上标注测试组编号。
[0301]
(2)nc和pc组表面添加25μl浓度为0.2%的sls溶液,样品组表面添加12.5μl浓度为0.4%的sls溶液和12.5μl相应浓度的样品工作液(即本发明制备的溶胞物滤液),将样品
均匀分布于模型表面,置于co2培养箱(37℃,5%co2)中孵育24h。
[0302]
(3)孵育结束后,用无菌pbs溶液清洗模型表面残留的受试物,用无菌棉签轻轻拭去模型内、外残留液体。
[0303]
(4)炎性介质(pge2)测试:给药孵育24h后,收集3d表皮皮肤模型培养液于ep管中,收集完后将用于elisa检测的样品置于-80℃冰箱冷冻保存,根据pge2 elisa试剂盒的操作说明书进行检测分析。
[0304]
(5)组织形态测试:取用于组织形态检测的模型(即按表22处理的表皮模型),用4%的多聚甲醛进行固定处理,固定24h后,将模型环切取下,进行h&e染色检测,显微镜下拍照观察,采集图片并分析。
[0305]
(6)辣椒素受体(trpv1)测试:取用于检测的模型(即按表22处理的表皮模型),用4%的多聚甲醛进行固定处理,固定24h后,将模型环切取下,进行辣椒素受体(trpv1)的免疫荧光检测,显微镜下拍照观察,采集图片并分析。
[0306]
结果统计分析:应用graphpad prism作图,结果表示为mean
±
sd;各组间比较采用t-test统计分析;统计分析均为双尾。p《0.05认为具有显著差异,p《0.01认为具有极显著差异。
[0307]
组织形态检测结果分析:
[0308]
组织形态测试结果如图7所示,图7为滤液培养结束后表皮模型进行h&e染色后显微镜下的组织形态图,其中图7a为空白对照,7b为阴性对照,即sls处理组,7c为阳性对照,即同时添加sls和0.01%地塞米松,7d为实验组,即同时添加sls和2%滤液。
[0309]
组织形态是经过he染色后的组织微观生理学结构分析,通过模型组织学形态,可以看出不同处理条件下皮肤屏障的变化情况,当经sls刺激引起损伤后,皮肤屏障变得疏松,活细胞层厚度降低,通过添加活性物进行处理后的形态变化,判断是否具有改善这种损伤的效用。组织形态检测结果显示,与空白组相比,经sls刺激后的阴性组模型细胞数量减少,排列紊乱,角质层疏松,出现空泡现象,说明本次测试刺激条件有效。与阴性组相比,阳性对照组模型活角质层疏松和空泡情况明显改善,说明本次阳性对照检测有效。而与阴性组相比,2%巴斯德毕赤酵母发酵溶胞物滤液处理后角质层疏松程度和和空泡有明显改善,说明体外条件下2%的滤液有助于缓解因sls化学刺激引起的刺激反应,改善刺激产生的表皮组织损伤。
[0310]
pge2测试结果分析:
[0311]
pge2测试结果如表23所示,pge2含量检测结果柱状图如图8所示。
[0312]
表23.溶胞物滤液中pge2含量检测结果汇总表
[0313][0314]
备注:用t-test方法进行统计分析时,与bc组相比,显著性以#表示,p-value<0.05表示为#,p-value<0.01表示为##;与nc组相比,显著性以*表示,p-value<0.05表示为*,p-value<0.01表示为**。
[0315]
实验结果显示,与bc组相比,nc组的pge2分泌水平极显著升高,表明sls刺激可以极显著提高pge2的分泌量,说明本次测试sls刺激条件有效。与nc组相比,pc组的pge2分泌水平极显著降低,表明本次阳性对照检测有效。与nc组相比,2%巴斯德毕赤酵母发酵溶胞物滤液的pge2分泌水平极显著降低。
[0316]
前列腺素类在炎症反应中扮演着极为重要的角色,其中最熟知的为pge2。pge2也是目前已知在哺乳动物体内合成最多、分布最为广泛的pg。皮肤中pg主要来源是角质形成细胞,角质形成细胞主要合成的pg包括pge2、pgf2a和pgd2。
[0317]
皮肤的炎症反应常常伴有以下一个到数个重要的临床特征:红斑、肿胀、发热或局部皮温升高、疼痛、瘙痒,部分可伴有鱗屑。而出现的炎症反应在皮肤上的四大表现症状(红、肿、热、痛)都与pge2密切相关:pge2具有扩张和舒张血管的作用,表现为皮肤潮红;在组胺及激肽等物质的协同作用下,引起血管通透性的增加,而致组织局部红、肿,可致局部发热,进入血液的pge2也可与下丘脑的受体结合引发体温中枢的改变,从而引起全身发热;此外,pge2可以刺激神经末梢引起疼痛。在创伤过程中,pge2作为一种炎症介质通过多个途径参与炎症反应的发生和发展。pge2是强烈的血管扩张剂,使血流减慢,促进了白细胞的贴壁、粘附。此外,pge2作为前炎症介质也可介导如il-6等其他炎症介质及炎症因子的产生。实验表明2%巴斯德毕赤酵母发酵溶胞物滤液的能显著降低pge2分泌水平,说明本发明所述的发酵溶胞物滤液可能通过介导炎症介质pge2的分泌缓解皮肤炎症反应,如降低皮肤中的血管通透性,从而缓解皮肤泛红现象的产生。
[0318]
trpv1测试结果分析:
[0319]
ttrpv1免疫荧光检测结果显示,与bc组相比,nc组模型trpv1的荧光强度显著上升,说明本次测试刺激条件有效。与nc组相比,pc组模型trpv1的荧光强度显著降低,说明本次阳性对照检测有效。与nc组相比,样品浓度为2%的巴斯德毕赤酵母发酵溶胞物滤液处理组模型trpv1的荧光强度显著降低。trpv1免疫荧光检测结果如图9所示,trpv1数据结果如表24所示,trpv1蛋白相对iod值柱状图如图10所示。
[0320]
表24.trpv1数据结果汇总表
[0321][0322]
备注:用t-test方法进行统计分析时,与bc组相比,显著性以#表示,p-value<0.05表示为#,p-value<0.01表示为##;与nc组相比,显著性以*表示,p-value<0.05表示为*,p-value<0.01表示为**。
[0323]
实验数据显示,与bc组相比,nc组的trpv1蛋白含量显著上升,说明本次测试刺激条件有效。与nc组相比,pc组的trpv1蛋白含量显著下降,说明本次阳性对照检测有效。与nc组相比,2%巴斯德毕赤酵母发酵溶胞物滤液作用后的trpv1蛋白含量显著下降。说明滤液可通过抑制trpv1蛋白表达的机制起到舒缓炎症的作用。
[0324]
瞬时受体电位香草酸亚型1(transient receptor potential vanilloid type 1,trpv1),也称辣椒素受体,是表达于外周初级传入神经元上的重要伤害感受器,参与急性
炎症痛敏的形成。是一种可高效介导ca
2+
流入的阳离子通道,广泛分布于神经元、免疫细胞、多种脏器上皮细胞及角质形成细胞等细胞中。研究发现,trpv1通道可以被多种刺激所激活,如各种物理和化学刺激因素:高温环境(温度≥43℃)、低ph值(酸性环境)、电压、摩尔渗透压浓度、内源性和外源性香草类物质,如辣椒素等。当trpv1被激活后,钙离子通道开放,钙离子内流,胞质内钙离子浓度升高,引起神经元及其纤维释放神经肽如p物质、神经激肽a、降钙素基因相关肽、血管活性肠肽和兴奋性氨基酸,如谷氨酸、天门冬氨酸。在皮肤上,trpv1表达于皮肤感觉神经、角质形成细胞及肥大细胞,激活的trp通道不但介导温度感知和调节,而且还参与痛痒觉以及皮肤神经源炎症的发生,因此,trp通道已成为治疗炎症性皮肤病和瘙痒的重要分子靶标。故本次试验选择trpv1作为靶分子,通过测定其在表皮模型上化学刺激作用下表达量的变化来评价滤液对炎症的舒缓作用。
[0325]
二、紫外线吸收效果检测
[0326]
对本发明得到的发酵溶胞物滤液及其不同倍数的稀释液(纯水稀释)进行紫外光区(200-400nm)吸光度扫描(varioskan
tm lux多功能酶标仪-vl0l0td0,赛默飞世尔科技(中国)有限公司),换算成透过率后,计算为吸收率,结果如图11所示。
[0327]
紫外线一般分为uvc区(200-280nm)、uvb区(280-320nm)和uva区(320-400nm)。到达地球表面的紫外线98%为uva,穿透性最强,可直达真皮层,是皮肤晒黑的主因;另外,只有不足2%为uvb,是造成皮肤晒伤与红斑的主要元凶,而uvc虽一般被臭氧层吸收,但短波紫外线对人体危害性最大,长期照射会造成皮肤癌。试验结果显示,本发明的发酵溶胞物滤液对uvc区平均吸收率接近100.00%,对uvb的平均吸收率》95%,对uva区的平均吸收率》80%。
[0328]
随着稀释倍数的增加,稀释后的溶胞物滤液对紫外线吸收能力也在下降,50%浓度的滤液在uvc区的吸收率并未明显降低,但在uvb区、uva区对紫外线的吸收率明显下降,但均在在40%以上;25%浓度的溶胞物滤液,对uvc区平均吸收率》90%,对uvb的平均吸收率随着紫外线波长的增加从89%下降至65%,对uva区平均吸收率》27%;稀释10倍的溶胞物滤液,对uvc区平均吸收率》90%,对uvb的平均吸收率紫外线波长的增加从87%下降至34%,对uva区平均吸收率》20%;随着稀释倍数的增加其对紫外线吸收的效果逐渐降低,但稀释至1%时,对uvc区平均吸收率》60%,对uvb的平均吸收率也维持在20%左右。未来最有可能使用的5%的稀释浓度,对uvc区平均吸收率可达到74%-99%,对uvb的平均吸收率随着紫外线波长的增加从67%下降至23%,对uva区平均吸收率》15%。
[0329]
结果表明,本发明的发酵溶胞物滤液可吸收绝大部分的中短波紫外线,有效抵御紫外线对皮肤的伤害。溶胞物滤液的防晒效果与氨基苯甲酸酯及其衍生物、水杨酸酯及其衍生物、肉桂酸酯类和樟脑类衍生物等常用uvb吸收剂的作用相类似,稀释后的溶胞物滤液也能对一定波长范围内紫外线具有良好的防晒护肤作用。
[0330]
三、调节微生态结果分析
[0331]
本实施例中基于3d表皮皮肤模型通过检测hbd1、hbd2、ll-37、tlr2蛋白变化,评价待测样品对皮肤抗菌肽及toll样受体蛋白水平表达量的作用。此项测试委托陕西博溪通用检测科技有限公司进行检测并出具检测报告。
[0332]
(1)试验方法:
[0333]
根据下表25测试方案将模型转移到6孔板中(提前添加0.9ml相应分组的
epigrowth培养液),在6孔板上标注测试组编号。
[0334]
表25.溶胞物滤液调节微生态检测方法
[0335][0336]
样品组表面添加相应浓度的工作液于6孔板中,置于co2培养箱(37℃、5%co2)中孵育24h。孵育结束后,用装有无菌pbs溶液的洗瓶清洗模型表面残留的受试物,用无菌棉签拭去模型内、外残留液体。取用于免疫组化检测的模型,进行免疫组化测试。结果统计应用graphpad prism作图,结果表示为mean
±
sd。各组间比较采用t-test统计分析。统计分析均为双尾。p《0.05认为具有显著差异,p《0.01认为具有极显著差异。
[0337]
(2)检测结果
[0338]
a.hbd1结果分析
[0339]
各组hbd1蛋白染色结果见图12,图片中红色箭头所指的棕褐色部分为hbd1蛋白,棕褐色越深表明hbd1蛋白含量越高。hbd1相对iod值汇总表如表26所示,hbd1积分光密度(iod)值柱状图如图13所示。
[0340]
表26.hbd1相对iod值汇总表
[0341]
组别相对iod平均值sdp-valuebc1.000.10/pc(1,25(oh)2vd3)6.260.380.000##巴斯德毕赤酵母发酵溶胞物滤液(0.5%)3.790.360.000**巴斯德毕赤酵母发酵溶胞物滤液(1.0%)5.340.160.000**
[0342]
结果可见,与bc组相比,pc(1,25-二羟基维生素d3)组的hbd1蛋白含量显著上升,说明本次测试阳性对照有效。与bc组相比,样品巴斯德毕赤酵母发酵溶胞物滤液-0.5%、巴斯德毕赤酵母发酵溶胞物滤液-1.0%的hbd1蛋白含量显著上升。
[0343]
b.hbd2结果分析
[0344]
各组hbd2蛋白染色结果见图14,图片中红色箭头所指的棕褐色部分为hbd2蛋白,棕褐色越深表明hbd2蛋白含量越高。hbd2相对iod值汇总表如表27所示,hbd1积分光密度(iod)值柱状图如图15所示。
[0345]
表27.hbd2相对iod值汇总表
[0346]
组别相对iod平均值sdp-valuebc1.000.10/pc(1,25(oh)2vd3)8.760.240.000##巴斯德毕赤酵母发酵溶胞物滤液(0.5%)4.210.200.000**巴斯德毕赤酵母发酵溶胞物滤液(1.0%)6.790.230.000**
[0347]
结果可见,与bc组相比,pc(1,25-二羟基维生素d3)组的hbd2蛋白含量显著上升,说明本次测试阳性对照有效。与bc组相比,样品巴斯德毕赤酵母发酵溶胞物滤液-0.5%、巴
斯德毕赤酵母发酵溶胞物滤液-1.0%的hbd2蛋白含量显著上升。
[0348]
c.tlr2结果分析
[0349]
各组tlr2蛋白染色结果见图16,图片中红色箭头所指的棕褐色部分为tlr2蛋白,棕褐色越深表明tlr2蛋白含量越高。tlr2相对iod值汇总表如表28所示,tlr2积分光密度(iod)值柱状图如图17所示。
[0350]
表28.tlr2相对iod值汇总表
[0351]
组别相对iod平均值sdp-valuebc1.000.10/pc(1,25(oh)2vd3)1.750.240.007##巴斯德毕赤酵母发酵溶胞物滤液(0.5%)1.380.040.004**巴斯德毕赤酵母发酵溶胞物滤液(1.0%)1.730.200.005**
[0352]
结果可见,与bc组相比,pc(1,25-二羟基维生素d3)组的tlr2蛋白含量显著上升,说明本次阳性对照检测有效。与bc组相比,浓度为0.5%和1.0%的巴斯德毕赤酵母发酵溶胞物滤液作用后均能使tlr2蛋白含量显著上升。
[0353]
d.ll-37结果分析
[0354]
各组ll-37蛋白染色结果见图18,图片中红色箭头所指的棕褐色部分为ll-37蛋白,棕褐色越深表明ll-37蛋白含量越高。ll-37相对iod值汇总表如表29所示,ll-37积分光密度(iod)值柱状图如图19所示。
[0355]
表29.ll-37相对iod值汇总表
[0356]
组别相对iod平均值sdp-valuebc1.000.13/pc(1,25(oh)2vd3)1.580.020.001##巴斯德毕赤酵母发酵溶胞物滤液(0.5%)1.620.040.001**巴斯德毕赤酵母发酵溶胞物滤液(1.0%)2.300.080.000**
[0357]
结果可见,与bc组相比,pc(1,25-二羟基维生素d3)组的ll-37蛋白含量显著上升,说明本次阳性对照检测有效。与bc组相比,0.5%和1.0%浓度的巴斯德毕赤酵母发酵溶胞物滤液均能使ll-37蛋白含量显著上升。
[0358]
皮肤微生态是由细菌、真菌、病毒、螨虫和节肢动物等各种微生物与皮肤表面的组织、细胞各种分泌物、微环境等共同组成的生态系统。皮肤微生物、宿主及外环境三者相互作用构成了皮肤微生态平衡。研究表明,角质形成细胞通过表达抗菌多肽(antimicrobial peptides,amps),直接杀死外来入侵的微生物群系,同时又为常驻菌提供了赖以生息的友好场所。常驻菌能直接释放amps,作用于病原微生物。例如,表皮葡萄球菌可分泌防御素、细菌素、ll-37、reg3a等抗菌肽。常驻菌也能通过分泌amps,调节宿主的免疫应答。人体内存在于皮肤的抗菌肽主要属于两大家族:防御素类和cathelicidin类。防御素类根据其结构的不同分为α-防御素和β-防御素,其中hbd1和hbd2属于β-防御素。ll-37是发现的唯一存在于人体中的cathelicidin类抗菌肽。另一方面,可通过激活多种模式识别受体如tlr2(toll样受体2),识别外源性微生物,激活免疫应答来清除病原微生物。本试验基于3d表皮皮肤模型与对照组相比,巴斯德毕赤酵母发酵溶胞物滤液在0.5%和1.0%浓度下,hbd1、hbd2、tlr2、ll-37蛋白含量显著上升,且随着滤液浓度的增大,相关目标蛋白的表达
量也呈正相关递增,说明本发明制备的巴斯德毕赤酵母发酵溶胞物滤液可通过提升抗菌肽的表达,调节微生态,提升皮肤屏障,进而达到修护功效。
[0359]
四、控油功效检测
[0360]
本实施例中是基于皮脂腺细胞,通过检测样品作用后皮脂腺细胞的脂滴含量,评价待测样品的控油功效,委托陕西博溪通用检测科技有限公司进行检测并出具检测报告。
[0361]
(1)实验方法
[0362]
本实施例中对控油功效的检测,试验设置空白组、阳性对照组和样品组,具体的如下表30所示。
[0363]
表30.控油功效检测方案
[0364][0365]
检测方法简述如下:
[0366]
按3.5e个/孔的接种密度接种sz95细胞至24孔板爬片,培养箱(37℃、5%co2)中孵育过夜。
[0367]
根据表29测试方案,待24孔板中细胞铺板率达到60%~70%时,进行分组给药,每孔加样1ml,每组设3个复孔。给药完成后将24孔板放置在培养箱(37℃、5%co2)中培养72h,培养期间进行每天换液和给药。
[0368]
油红o染色:吸弃旧液,用pbs清洗细胞1次,每孔加入500μl油红o工作液(1μg/ml),避光染色15min(孵育箱37℃孵育),pbs洗涤2次。
[0369]
荧光显微镜拍照观察:在ex:450nm-500nm,em:515nm-560nm检测,200倍镜下拍照观察。
[0370]
结果统计分析:应用graphpad prism作图,结果表示为mean
±
sd。各组间比较采用t-test统计分析。统计分析均为双尾。p《0.05认为具有显著差异,p《0.01认为具有极显著差异。
[0371]
(2)检测结果
[0372]
脂滴合成油红o染色结果如图20所示,脂滴合成油红o染色结果数据汇总如表31所示。脂滴积分光密度(iod)值柱状图如图21所示。
[0373]
表31.脂滴合成油红o染色结果数据汇总表
[0374][0375]
备注:用t-test方法进行统计分析时,pc组、样品组与bc组相比,显著性以*表示,p-value<0.05表示为*,p-value<0.01表示为**。
[0376]
试验结果显示,与bc组相比,pc组脂滴合成明显减少,说明本次阳性对照有效;与bc组相比,样品巴斯德毕赤酵母发酵溶胞物滤液在0.05%和0.15%的浓度下,细胞脂滴合成明显减少,说明本发明制备的巴斯德毕赤酵母发酵溶胞物滤液在0.05%和0.15%的浓度下,均有减少脂滴合成的作用。
[0377]
皮脂分泌过多是引发多种皮肤问题例如痤疮的主要因素,皮脂腺细胞会合成大量的油脂并以脂滴形式分泌到细胞外,影响细胞功能,导致多种皮肤问题产生,脂滴量的多少是衡量控油程度的主要指标。基于皮脂腺细胞sz95,与对照组相比,样品巴斯德毕赤酵母发酵溶胞物滤液在0.05%和0.15%的浓度下,脂质含量均显著下降;说明本发明制备的巴斯德毕赤酵母发酵溶胞物滤液可通过降低脂滴合成达到控油功效。
[0378]
实施例3:本发明的巴斯德毕赤酵母发酵溶胞物滤液应用实例
[0379]
本实施例中,以本发明的巴斯德毕赤酵母发酵溶胞物滤液为原料,制备了护肤精华液、面膜、护肤面霜,以便更直观的说明本发明发酵溶胞物滤液的应用优势,但本发明的发酵溶胞物滤液不限于用于这几种产品,本发明的巴斯德毕赤酵母发酵溶胞物滤液还可用于制备其他化妆品。
[0380]
(1)护肤精华液
[0381]
以公开号cn103102407b中保藏编号为cgmcc no.7189工程菌的发酵菌体10%湿菌体浓度制备溶胞物滤液为例,制备一种护肤精华液,各原料如下所列的质量分数配制,总质量百分比之和为100%,各成份配比如下所示,优选巴斯德毕赤酵母发酵溶胞物滤液添加比例为5%进行制备。
[0382]
所述护肤精华液中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选5wt%,还包括甘油4wt%、丁二醇4wt%、甘油聚醚-26 2wt%、edta-2na 0.02wt%、透明质酸钠0.05wt%、尿囊素0.15wt%、甜菜碱2wt%、黄原胶0.25wt%、1,2-戊二醇5wt%,其他为去离子水。
[0383]
所述护肤精华液的制备方法:精确称取各组分原料;室温下,将去离子水、甘油、丁二醇、甘油聚醚-26混合均匀,再将尿囊素、甜菜碱加入其中,溶解混合均匀,升温至70-75℃,加入透明质酸钠、黄原胶,搅拌至完全溶解;降温至40℃以下,加入巴斯德毕赤酵母发酵溶胞物滤液,搅拌均匀;100目滤布过滤,并分装于按压式真空瓶中,即得护肤精华液。
[0384]
(2)面膜
[0385]
以公开号cn103102407b中保藏编号为cgmcc no.7189工程菌的发酵菌体5%湿菌体浓度制备溶胞物滤液为例,制备一种护肤面膜液,各原料按如下所示的质量分数配制,总质量百分比之和为100%,各成份配比如瞎所示,优选巴斯德毕赤酵母发酵溶胞物滤液添加比例为5%进行制备。
[0386]
所述面膜中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选5wt%,还包括甘油8wt%、edta-2na 0.02wt%、透明质酸钠0.05wt%、黄原胶0.1wt%、卡波姆0.12wt%、ph调节剂适量(优选0.12wt%,一般调节至中性)、1,2-戊二醇4wt%、1,2-己二醇0.5wt%,其他为去离子水。
[0387]
制备方法:
[0388]
精确称取各组分原料,备用;室温下,取部分去离子水与卡波姆预先在容器中分散搅拌均匀;取另一容器,将余下去离子水、甘油、edta-2na、透明质酸钠、黄原胶、精氨酸、1,
2-戊二醇、1,2-己二醇,70-75℃下充分溶解,混合均匀;降温至55-60℃,将预先分散好的卡波姆投入上述混合物中,混合搅拌均匀;降温至40-50℃,加入ph调节剂,混合搅拌均匀;降温至35-40℃,加入巴斯德毕赤酵母发酵溶胞物滤液,搅拌均匀;100目滤布过滤,得面膜液,搭配纯棉膜布,灌装于面膜铝箔袋中,即得护肤面膜。
[0389]
(3)护肤面霜:
[0390]
以公开号cn103102407b中保藏编号为cgmcc no.7189工程菌的发酵菌体5%湿菌体浓度制备溶胞物滤液为例,制备一种护肤面霜,各原料按如下所示质量分数配制,总质量百分比之和为100%,各成份配比如下所示,优选巴斯德毕赤酵母发酵溶胞物滤液添加比例为5%进行。
[0391]
所述面霜中包括发酵溶胞物滤液,所述发酵溶胞物滤液含量为1-10wt%,优选5wt%,记为d相;还包括甘油5wt%、edta二钠0.02wt%、黄原胶0.15wt%、丙烯酰二甲基牛磺酸铵/vp共聚物0.6wt%、对羟基苯乙酮0.5wt%、1,2-己二醇0.5wt%,其他为去离子水,混合为a相;鲸蜡硬脂基葡糖苷/鲸蜡硬脂醇3wt%、鲸蜡硬脂醇3wt%、辛酸癸酸甘油三酯4wt%、氢化聚异丁烯3wt%、聚二甲基硅氧烷1wt%,混合为b相;ph调节剂为c相,一般调节至中性。
[0392]
制备方法:
[0393]
将a相各组分投入至水相锅中,加热到80-85℃,混合搅拌均匀;再将b相各组分投入至水相锅中,加热到80-85℃,混合搅拌均匀;然后将b相加入a相均质5分钟;搅拌冷却到60℃加入c相;待冷却到35-40℃,加入d相,搅拌均匀得到护肤面霜。
[0394]
对得到的产品进行人群测试实验:
[0395]
选取90位志愿者(均为自述皮肤易泛红、易受刺激皮肤者),年龄在20-45岁之间,随机分成3组,分别使用上述含有巴斯德毕赤酵母溶胞物滤液的产品,即护肤精华液、面膜、护肤面霜,并参照上述配方制备不添加滤液的样品作为空白对照,其中a组使用精华液,每天早晚2次洁面后涂抹于面部;b组使用面膜,每周使用2次,贴敷于面部10-15min;c组使用护肤霜,每天早晚2次洁面后涂抹于面部,其中受试者左脸使用本发明所述的精华液、面膜或面霜产品,右脸使用不含有滤液的对照品,使用4周,在此期间不使用其他同类护肤产品,在第28天对上述样品缓解皮肤泛红、缓解皮肤刺激的使用效果进行自我评估。
[0396]
评分标准:
[0397]
皮肤状态无改善,甚至加重,得0分;皮肤泛红、易受刺激无改善,但也没有加重,得1分;皮肤泛红、易受刺激轻微改善,但效果不明显,得2分;皮肤泛红、易受刺激得到改善,得3分;皮肤泛红、易受刺激明显改善,得4分。
[0398]
测试结果各产品的平均分为:护肤精华液为3.25分,面膜为3.47分,护肤面霜为3.52分。反馈结果显示:含有巴斯德毕赤酵母溶胞物滤液的产品实施例均无任何刺激反应,并且有志愿者反应相较于空白对照,脸部皮肤泛红现象明显缓解。受试者面部局部照片如图22-24所示,图22为使用护肤精华液前后的对比照,图23为使用面膜前后的对比照,图24为使用护肤面霜前后的对比照,结果分析表明,本技术产品在舒缓皮肤和缓解皮肤泛红方面有较好的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1