一种提高NK细胞慢病毒转导效率的方法
一种提高nk细胞慢病毒转导效率的方法
技术领域
1.本发明属于细胞转导技术领域,具体涉及一种提高nk细胞慢病毒转导效率的方法。
背景技术:
2.目前,以免疫检查点抑制剂为代表的肿瘤免疫治疗为部分肿瘤患者带来显著生存获益,然而大部分患者对其反应不佳或存在原发性抵抗
1.。因此,全球正在加快研发各种新的免疫治疗手段。嵌合抗原受体(chimeric antigen receptor,car)免疫细胞,作为一种基因工程化免疫细胞治疗方法,能够精准、快速、高效地杀灭肿瘤,成为一种极具前景的新型肿瘤免疫治疗方法
2.。目前,经car修饰的t细胞(car-t)已经在血液恶性肿瘤中获得惊人的疗效,然而,因肿瘤特异性抗原靶点的选择、受限的肿瘤内浸润、肿瘤内免疫抑制性微环境、肿瘤细胞异质性这些因素限制了基于car的基因工程化免疫细胞在恶性实体瘤治疗中的临床应用
3.。car-nk细胞因为具有更高安全性、多重靶细胞杀伤途径、易制备通用型细胞产品等独特生物学优势使它具有更广阔前景及巨大临床价值的免疫治疗手段
4.。然而,当前car-nk细胞的临床转化应用仍然面临基因修饰难度大的问题
4.。因此,研发一套能够高效进行nk细胞基因修饰的技术是当前car-nk细胞实现有效临床转化应用的技术瓶颈。
3.当前,有多种外源基因导入办法,包括慢病毒、逆转录病毒、腺病毒、转座子技术及各种瞬时表达技术等。目前针对原代nk细胞的临床研究(包括新英格兰医学杂志最新报道的car-nk细胞临床研究
5.)几乎用的是逆转录病毒或者瞬时表达技术
4.;然而,逆转录病毒更容易导致宿主基因插入突变,这种风险很大程度上限制了其临床应用
6.。慢病毒是比较理想的基因导入技术,可将外源基因整合至宿主基因组高效稳定地表达,且导致宿主基因插入突变的风险低。目前基因转导所用慢病毒通常使用vsv-g作为包膜蛋白,因为vsv-g包膜蛋白对多种物种和细胞类型具有广泛的取向性。然而,nk细胞是天然免疫细胞,对慢病毒存在天然的抵抗及清除机制,慢病毒对nk细胞的转导效率通常仅有3%左右,远远无法满足临床的需求。
4.参考文献:
5.[1]kim tk,vandsemb en,herbst rs,chen l.adaptive immune resistance at the tumour site:mechanisms and therapeutic opportunities.nat rev drug discov 2022.
[0006]
[2]rafiq s,hackett cs,brentjens rj.engineering strategies to overcome the current roadblocks in car t cell therapy.nat rev clin oncol 2020,17(3):147-167.
[0007]
[3]larson rc,maus mv.recent advances and discoveries in the mechanisms and functions of car t cells.nat rev cancer 2021,21(3):145-161.
[0008]
[4]xie g,dong h,liang y,ham jd,rizwan r,chen j.car-nk cells:a promising cellular immunotherapy for cancer.ebiomedicine 2020,59:102975.
[0009]
[5]liu e,marin d,banerjee p,macapinlac ha,thompson p,basar r,nassifkl,overman b,thall p,kaplan m,nandivada v,kaur i,nunez ca,cao k,daher m,hosing c,cohen en,kebriaei p,mehta r,neelapu s,nieto y,wang m,wierda w,keating m,champlin r,shpall ej,rezvani k.use of car-transducednatural killer cells in cd19-positive lymphoid tumors.n engl j med 2020,382(6):545-553.
[0010]
[6]carlsten m,childs rw.genetic manipulation ofnk cells for cancer immunotherapy:techniques and clinical implications.front immunol 2015,6:266.
技术实现要素:
[0011]
有鉴于此,本发明的目的在于提供一种提高nk细胞慢病毒转导效率的方法,可达到50%以上的转导效率。
[0012]
本发明提供了一种提高nk细胞慢病毒转导效率的方法,包括以下步骤:
[0013]
1)构建含编码baev糖蛋白序列的慢病毒包装质粒;
[0014]
2)构建含car结构序列的慢病毒表达质粒;
[0015]
3)将步骤1)中所述含baev糖蛋白的慢病毒包装质粒、步骤2)中含car结构序列的慢病毒表达质粒和pcmv-dr8.9质粒在转染试剂作用下转染细胞,经培养收集表达baev糖蛋白和car的慢病毒;
[0016]
4)将步骤3)中所述表达baev糖蛋白和car的慢病毒转导nk细胞,得到表达car的nk细胞;
[0017]
步骤1)和步骤2)之间没有时间顺序的限制。
[0018]
优选的,步骤4)所述nk细胞包括原代nk细胞和nk92细胞株。
[0019]
优选的,所述原代nk细胞包括记忆样nk细胞。
[0020]
优选的,所述记忆样nk细胞的诱导方法,包括将原代nk细胞在含细胞因子的nk扩增培养基中进行刺激;所述细胞因子包括10ng/ml rhil-12、50ng/ml rhil-15和50ng/ml rhil-18。
[0021]
优选的,步骤4)中所述转导的方法为用moi=10的病毒滴度转导106个nk细胞。
[0022]
优选的,步骤1)中所述构建含编码baev糖蛋白序列的慢病毒包装质粒的方法,将密码子优化的编码baev糖蛋白序列通过同源重组技术插入pcmv质粒中,所述密码子优化的编码baev糖蛋白序列如核苷酸序列如seq id no:1所示。
[0023]
优选的,步骤2)中所述构建含car结构序列的慢病毒表达质粒的方法,将car结构序列插入phiv-egfp质粒的xbai/clai位点处。
[0024]
优选的,所述car结构序列依次包括anti-cd-19scfv,cd8α铰链区、nkg2d跨膜区、2b4胞浆区;
[0025]
所述car结构序列如核苷酸序列如seq id no:2所示。
[0026]
优选的,步骤2)中所述含baev糖蛋白的慢病毒包装质粒、含car结构序列的慢病毒表达质粒和pcmv-dr8.9质粒的质量比为3:10:5。
[0027]
本发明提供了所述方法制备的表达car的nk细胞在制备杀伤肿瘤药物中的应用。
[0028]
本发明提供了一种提高nk细胞慢病毒转导效率的方法,本发明通过构建含编码baev糖蛋白序列的慢病毒包装质粒,使包装的慢病毒baev胞膜糖蛋白能特异性结合nk细胞
膜上的asct2,从而提高nk细胞慢病毒转导效率。结果显示baev慢病毒对nk92细胞株及外周血来源的nk细胞可达到50%以上的转导效率。
[0029]
进一步的,本发明具体限定了nk细胞为记忆样nk细胞实验表明。记忆样nk细胞上asct2蛋白的表达量比常规nk细胞显著上调,鉴于包装的慢病毒baev胞膜糖蛋白特异性结合nk细胞膜上的asct2,从而进一步提高了原代nk细胞的慢病毒转导效率。实验表明,慢病毒对于nk92细胞的转导效率可达到90%以上。
附图说明
[0030]
图1为慢病毒表面包膜蛋白vsvg蛋白替换成baev糖蛋白示意图;
[0031]
图2为流式检测慢病毒转导jurkat细胞前后病毒滴度检测结果,其中横坐标是gfp荧光强度,纵坐标为apc标记的protein-l用于检测nk92细胞表面car的表达;
[0032]
图3为流式检测nk92细胞转导效率结果,左图为未转导细胞,右图为表达cd19-car与gfp的慢病毒转导的nk92细胞,横坐标是gfp荧光强度,纵坐标为apc标记的protein-l用于检测nk92细胞表面car的表达;
[0033]
图4为流式检原代nk细胞转导效率结果,其中原代nk细胞转导cd19-car慢病毒后,流式细胞技术检测car表达阳性nk细胞的比例,左图为未转导病毒的nk92细胞作为阴性对照,右图为表达;
[0034]
图5为记忆样nk细胞检测结果,其中a为分选出nk细胞后,检测cd3、cd56的表达结果;b为利用细胞因子对原代nk细胞进行短期预刺激12h产生细胞因子诱导的“记忆样”(cytokine-induced memory-like)nk(cimnk)细胞;c为流式检测细胞因子刺激产生的“记忆样”nk细胞上asct2的表达;
[0035]
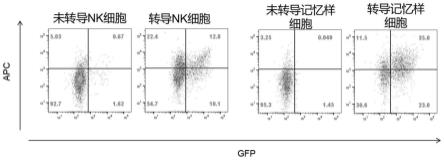
图6为流式检原代记忆样nk细胞转导效率结果,左边两图为常规培养的原代nk细胞,右边两图为细胞因子刺激产生的“记忆样”原代nk细胞,未转导car慢病毒的原代nk细胞作为阴性对照,表达car-gfp的原代nk细胞上car表达用apc标记的protein-l(纵坐标)进行检测。
具体实施方式
[0036]
本发明提供了一种提高nk细胞慢病毒转导效率的方法,包括以下步骤:
[0037]
1)构建含编码baev糖蛋白序列的慢病毒包装质粒;
[0038]
2)构建含car结构序列的慢病毒表达质粒;
[0039]
3)将步骤1)中所述含baev糖蛋白的慢病毒包装质粒、步骤2)中含car结构序列的慢病毒表达质粒和pcmv-dr8.9质粒在转染试剂作用下转染细胞,经培养收集表达baev糖蛋白和car的慢病毒;
[0040]
4)将步骤3)中所述表达baev糖蛋白和car的慢病毒转导nk细胞,得到表达car的nk细胞;
[0041]
步骤1)和步骤2)之间没有时间顺序的限制。
[0042]
本发明构建含编码baev糖蛋白序列的慢病毒包装质粒。
[0043]
在本发明中,所述构建含编码baev糖蛋白序列的慢病毒包装质粒的方法,优选将密码子优化的编码baev糖蛋白序列通过同源重组技术插入pcmv质粒中,所述密码子优化的
编码baev糖蛋白序列如核苷酸序列如seq id no:1所示。所述pcmv质粒购自addgene公司。所述同源重组利用gibson同源重组试剂盒(neb)进行。构建后,还优选对构建的质粒通过dna测序进行验证。
[0044]
本发明构建含car结构序列的慢病毒表达质粒。
[0045]
在本发明中,所述构建含car结构序列的慢病毒表达质粒的方法,优选将car结构序列插入phiv-egfp质粒的xbai/clai位点处。所述car结构序列优选依次包括anti-cd-19scfv,cd8α铰链区、nkg2d跨膜区、2b4胞浆区。其中anti-cd-19scfv的核苷酸序列如seq id no:3所示。所述cd8α铰链区参见ncbi reference sequence:nm_001768。所述nkg2d跨膜区参见ncbi reference sequence:nm_007360.3。所述2b4胞浆区参见ncbi reference sequence:nm_001166663.1。所述car结构序列如核苷酸序列如seq id no:2
[0046]
(5
’‑
atggccctccctgtcaccgccctgctgcttccgctggctcttctgctccacgccgctcggcccgaaattgtgatgacccagtcacccgccactcttagcctttcacccggtgagcgcgcaaccctgtcttgcagagcctcccaagacatctcaaaataccttaattggtatcaacagaagcccggacaggctcctcgccttctgatctaccacaccagccggctccattctggaatccctgccaggttcagcggtagcggatctgggaccgactacaccctcactatcagctcactgcagccagaggacttcgctgtctatttctgtcagcaagggaacaccctgccctacacctttggacagggcaccaagctcgagattaaaggtggaggtggcagcggaggaggtgggtccggcggtggaggaagccaggtccaactccaagaaagcggaccgggtcttgtgaagccatcagaaactctttcactgacttgtactgtgagcggagtgtctctccccgattacggggtgtcttggatcagacagccaccggggaagggtctggaatggattggagtgatttggggctctgagactacttactactcttcatccctcaagtcacgcgtcaccatctcaaaggacaactctaagaatcaggtgtcactgaaactgtcatctgtgaccgcagccgacaccgccgtgtactattgcgctaagcattactattatggcgggagctacgcaatggattactggggacagggtactctggtcaccgtgtccagcaccactaccccagcaccgaggccacccaccccggctcctaccatcgcctcccagcctctgtccctgcgtccggaggcatgtagacccgcagctggtggggccgtgcatacccggggtcttgacttcgcctgcgattcaaacctattcgtagctagttggatagcagtaatgattattttccgtatcggaatggccgtagctatcttctgctgcttcttttttccaaggagaaagaggaaggagaagcagtcagagaccagtcccaaggaatttttgacaatttacgaagatgtcaaggatctgaaaaccaggagaaatcacgagcaggagcagacttttcctggaggggggagcaccatctactctatgatccagtcccagtcttctgctcccacgtcacaagaacctgcatatacattatattcattaattcagccttccaggaagtctggaagcaggaagaggaaccacagcccttccttcaatagcactatctatgaagtgattggaaagagtcaacctaaagcccagaaccctgctcgattgagccgcaaagagctggagaactttgatgtttattcccgcgtgaaattcagccgcagcgcagatgctccagcctacaagcaggggcagaaccagctctacaacgaactcaatcttggtcggagagaggagtacgacgtgctggacaagcggagaggacgggacccagaaatgggcgggaagccgcgcagaaagaatccccaagagggcctgtacaacgagctccaaaaggataagatggcagaagcctatagcgagattggtatgaaaggggaacgcagaagaggcaaaggccacgacggactgtaccagggactcagcaccgccaccaaggacacctatgacgctcttcacatgcaggccctgccgcctcgg-3’)所示。所述car结构序列委托华大基因公司合成。所述phiv-egfp质粒购自addgene公司。anti-cd-19scfv的核苷酸序列如seq id no:3(5
’‑
gaaattgtgatgacccagtcacccgccactcttagcctttcacccggtgagcgcgcaaccctgtcttgcagagcctcccaagacatctcaaaataccttaattggtatcaacagaagcccggacaggctcctcgccttctgatctaccacaccagccggctccattctggaatccctgccaggttcagcggtagcggatctgggaccgactacaccctcactatcagctcactgcagccagaggacttcgctgtctatttctgtcagcaagggaacaccctgccctacacctttggacagggcaccaagctcgagattaaaggtggaggtggcagcggaggaggtgggtccggcggtggaggaag
ccaggtccaactccaagaaagcggaccgggtcttgtgaagccatcagaaactctttcactgacttgtactgtgagcggagtgtctctccccgattacggggtgtcttggatcagacagccaccggggaagggtctggaatggattggagtgatttggggctctgagactacttactactcttcatccctcaagtcacgcgtcaccatctcaaaggacaactctaagaatcaggtgtcactgaaactgtcatctgtgaccgcagccgacaccgccgtgtactattgcgctaagcattactattatggcgggagctacgcaatggattactggggacagggtactctggtcaccgtgtccagc-3’)所示。所述插入的方法优选采用xbai/clai双酶切分别处理car结构序列和phiv-egfp质粒,得到的car结构片段和线性化phiv-egfp质粒进行连接,经鉴定,得到含car结构序列的慢病毒表达质粒。所述xbai/clai双酶切的反应体系优选为按照xbai/clai限制性内切酶试剂(neb)说明书),所述xbai/clai双酶切的反应条件优选参照xbai/clai限制性内切酶试剂(neb)说明书完成。所述连接优选采用t4连接酶进行。所述t4连接酶连接的反应体系优选按照t4连接酶试剂(neb)说明书完成。所述t4连接酶连接的反应条件优选为体系均按照t4连接酶试剂(neb)说明书完成。所述鉴定的方法优选为dna测序(华大基因公司)。
[0047]
构建质粒完成后,本发明将所述含baev糖蛋白的慢病毒包装质粒、含car结构序列的慢病毒表达质粒和pcmv-dr8.9质粒在转染试剂作用下转染细胞,经培养收集表达baev糖蛋白和car的慢病毒。
[0048]
在本发明中,所述含baev糖蛋白的慢病毒包装质粒、含car结构序列的慢病毒表达质粒和pcmv-dr8.9质粒的质量比优选为3:10:5。所述转染试剂优选为trnast(mirus)。本发明对所述转染的方法没有特殊限制,采用本领域所熟知的转染方法即可。所述培养的方法先培养48~72h后收集上清,经超速离心,收集病毒用无血清dmem重悬,经过12培养,再次收集病毒。对收集的病毒检测car结构的表达。所述超速离心的转速优选为25000rpm,所述超速离心的时间优选为2h。所述超速离心的温度优选为4℃。所述检测car结构的表达的方法优选为取1μl病毒液转导106个jurkat细胞(常温离心1000g,1h),培养72h后用流式细胞术检测car的表达。所述用流式细胞术检测car的表达的方法优选为利用生物素化的protein l作为一抗(genscript),apc偶联的链酶亲和素作为二抗(bd biosciences)标记细胞,流式细胞技术检测car的表达,计算慢病毒滴度。
[0049]
得到表达baev糖蛋白和car的慢病毒后,本发明将所述表达baev糖蛋白和car的慢病毒转导nk细胞,得到表达car的nk细胞。
[0050]
在本发明中,所述转导的方法优选为用moi=10的病毒滴度处理106个nk细胞,离心后培养。所述离心的条件优选为在30~34℃、1000g/h下离心55~65min。所述培养的温度优选为37℃。所述培养的时间优选为70~75h,更优选为72h。所述培养用培养基优选为nk细胞扩增培养基(nk macs medium,miltenyi biotec公司)。
[0051]
在本发明中,所述nk细胞优选包括原代nk细胞和nk92细胞株。所述原代nk细胞的分离方法优选为利用nk细胞分选试剂盒(stem cells)从健康人的外周血中分选出原代nk细胞。所述分选的方法根据所述nk细胞分选试剂盒的说明即可。所述nk细胞分选试剂盒购自stem cells公司。
[0052]
在本发明中,所述原代nk细胞优选包括记忆样nk细胞。所述记忆样nk细胞的诱导方法,优选包括将原代nk细胞在含细胞因子的nk扩增培养基中进行刺激;所述细胞因子包括10ng/ml rhil-12、50ng/ml rhil-15和50ng/ml rhil-18。
[0053]
在本发明中,培养结束后,采用流式细胞仪检测car结构的表达情况。结果表明,所
述方法制备的表达car的nk细胞能够稳定表达car结构,并且转导效率可达90%以上。
[0054]
鉴于制备的nk细胞能够高效表达car结构,提供nk细胞对肿瘤的杀伤性,因此本发明提供了所述方法制备的表达car的nk细胞在制备杀伤肿瘤药物中的应用。
[0055]
下面结合实施例对本发明提供的一种提高nk细胞慢病毒转导效率的方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0056]
实施例1
[0057]
一种baev慢病毒的制备方法
[0058]
1)构建baev慢病毒包装质粒的方法,见图1,具体步骤如下:
[0059]
经密码子优化的baev dna片段由华大基因公司合成,通过同源重组技术将baev dna片段整合进pcmv质粒(来自addgene公司),baev dna片段序列如下:
[0060]5’‑
atgggtttcactacgaaaattatctttctgtataatctggtactcgtatatgcgggtttcgacgatcccaggaaagcgatcgaacttgtccagaagagatacgggaggccctgtgactgcagcggagggcaagtatcagaacccccctctgatcgggtcagccaagttacttgcagcggcaaaacagcttacctgatgccggatcagagatggaaatgcaaatccatacccaaggacaccagtccgagtggaccattgcaggaatgtccgtgtaatagttaccaatcaagcgtccattcaagttgctacacgtcataccagcaatgtcgctcaggaaataaaacctattatacggcgacactgcttaaaacccaaacgggtggcacctctgatgttcaggttctcggaagtacgaataagttgattcagagtccctgcaacggtatcaaaggccagtcaatttgttggtctacgacagcgcctatccatgtgagtgacggcggtgggccgttggatacaacacgaataaaaagtgtacagcggaaacttgaggagatacacaaagccctctaccccgagcttcagtaccatcccctggccatccctaaggtcagggacaatctcatggtagacgctcaaaccctcaacatcctcaatgccacctacaatctcttgttgatgtctaacacaagcttggtagatgactgctggctctgtcttaaattgggccctccgactcccctcgctatacccaacttccttctgtcatacgtaacgcgcagctccgacaacatatcatgtctgataatcccgccgttgcttgtgcagcccatgcagttctctaacagctcctgcttgttcagtccatcttataattcaacagaagaaattgatttgggccatgtagctttcagtaactgtacatcaataactaacgtcactggccccatctgcgccgtgaacggttctgtcttcctctgcggcaacaatatggcttatacatacttgccaactaactggaccggtctgtgtgtattggccacgctgttgcctgacatagatataatccctggcgacgaacccgtccctatcccagccatcgaccattttatttatcgccccaagcgcgcgattcagtttatccctctgctcgctgggttgggcattacggctgcttttactacgggggctaccggccttggagtgtccgttacccaatatacgaaactgtccaatcaattgatttcagacgtgcaaatcttgagctctactatccaggatctgcaggaccaggtagactctctggcggaagtcgtcttgcaaaatcggcgggggttggatctgctgaccgccgagcagggcggcatctgtcttgctcttcaagaaaaatgctgtttttacgtgaacaaatcaggtattgtaagagataaaataaaaactttgcaagaagagctcgaaaggaggcggaaagacctggcgtctaatcctctgtggactggcctgcaggggctcctcccctatttgctgccctttcttggtccgctcctgactttgttgctgctcctgactattgggccatgcatcttcaatcgactcaccgcgttcatcaatgataaactcaacataatccacgctatgtga-3’(seq id no:1)。
[0061]
2)cd19-car-nk-gfp重组表达质粒的构建方法
[0062]
car结构包含anti-cd-19scfv,cd8α铰链区(ncbi登录号:nm_001768)、nkg2d跨膜区(ncbi登录号:nm_007360.3)、2b4胞浆区(ncbi登录号:nm_001166663.1,car结构序列由华大基因公司合成。骨架质粒phiv-egfp(来自addgene)和上述合成的car片段分别用xbai(neb)与clai(neb)双酶切后,将酶切后的car片段和线性化phiv-egfp质粒用t4连接酶(neb)连接,得到cd19-car-nk-gfp重组质粒。
[0063]
3)病毒制备及滴度测定
[0064]
准备293t细胞,将细胞种到15cm培养皿中,长到约100%密度时包装病毒;
[0065]
将baev包装质粒(6μg)和pcmv-dr8.9(10μg)(来自addgene)与表达质粒(phiv-cd19-car-nk-gfp)(20μg),加入一管含2.5ml opti-mem培养基的离心管中,静置5min。将促转染试剂trnast(mirus)加入另一管含2.5ml opti-mem培养基的离心管中,静置5min。然后将两管溶液混合,静置30min。将上述混合物,逐滴均匀加入含293t细胞的15cm培养皿中。48h与72小时后收集上清,超速离心(25000rpm,4℃,2h)后,用无血清dmem重悬离心后的病毒沉淀。12h后,收集重悬病毒,得到baev慢病毒。
[0066]
实施例2
[0067]
取1μl实施例1制备的baev病毒液转导106个jurkat细胞(常温离心1000g,1h)。72h后用流式检测car的表达,具体操作如下:利用生物素化的protein l作为一抗(genscript),apc偶联的链酶亲和素作为二抗(bd biosciences)标记细胞,流式细胞技术检测car的表达,计算慢病毒滴度。
[0068]
结果见图2。图2显示1μl baev病毒液转导106个jurkat细胞后有11.9%的jurkat细胞成功表达car及gfp,计算病毒滴度:1
×
106×
11.9%
×
103=1.19
×
108tu/ml。
[0069]
实施例3
[0070]
取实施例1制备的baev病毒液,根据慢病毒滴度,按moi=10的滴度转导106个nk92细胞,离心(1000g/h,32℃,60min)后置于孵箱中培养。培养3天后利用流式细胞技术检测转导效率,即gfp阳性细胞的比例。同时设置未转导baev病毒的nk92细胞为对照。
[0071]
结果见图3。cd19-car慢病毒对于nk92细胞的转导效率可达到60%以上。
[0072]
实施例4
[0073]
baev慢病毒转导原代nk细胞的方法
[0074]
1.分离健康志愿者的外周血,利用nk细胞分选试剂盒(stem cells)分选出原代nk细胞;
[0075]
2.取实施例1制备的baev病毒液,根据慢病毒滴度,按moi=10的滴度转导106个原代nk细胞,离心(1000g/h,32℃,60min)后置于孵箱中培养。培养3天后利用流式细胞技术检测转导效率,即gfp阳性细胞的比例。同时设置未转导baev病毒的原代nk细胞为对照。
[0076]
如图4所示,baev慢病毒对原代nk细胞的转导效率,即gfp阳性细胞比例为27%。
[0077]
实施例5
[0078]
一种“记忆样”原代nk细胞的制备方法
[0079]
从人pbmcs中分选出nk细胞后,利用nk细胞分选试剂盒(stem cells)分选出原代nk细胞,采用流式细胞检测检测cd3cd56的表达,筛选双阳表达的细胞为nk细胞(见图5中a);利用细胞因子rhil-12(10ng/ml)(peprotech)、rhil-15(50ng/ml)、rhil-18(50ng/ml)对原代nk细胞在nk扩增培养基(美天旎公司)中预刺激12h,诱导得到“记忆样”(cytokine-inducedmemory-like,ciml)nk细胞(流程见图5中b)。asct2的表达利用兔抗人asct2单克隆抗体(clone d7c12,cell signaling technology)作为一抗以及fitc标记的山羊抗兔二抗(ab97199,abcam)进行检测。
[0080]
检测结果如图5中c,提示细胞因子刺激后诱导的“记忆样”nk细胞上asct2的表达显著升高。
[0081]
实施例6
[0082]
baev慢病毒转导“记忆样”原代nk细胞的方法
[0083]
取实施例1制备的baev病毒液,根据慢病毒滴度,按moi=10,转导“记忆样”nk细胞,具体方法同实施例5记载。3天后利用流式检测转导效率。同时设置经baev慢病毒转导前后的常规原代nk细胞为对照。
[0084]
结果见图6。常规原代nk细胞经baev慢病毒转导后转导效率为22.9%;而转导baev慢病毒的“记忆样”原代nk细胞转导效率达到58%。因此,细胞因子刺激产生的“记忆样”原代nk细胞可显著提高慢病毒转导效率。
[0085]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1