一种家蚕Bmp53基因的shRNA及其应用
一种家蚕bmp53基因的shrna及其应用
技术领域
1.本发明涉及一种rna干扰技术领域,尤其涉及一种家蚕bmp53基因的shrna及其应用。
背景技术:
2.rna干扰(rna interference,rnai)是指在进化过程中高度保守的、由双链rna(double-stranded rna,dsrna)诱发的、同源mrna高效特异性降解的现象。当细胞中导入与内源性mrna编码区同源的双链rna时,该mrna发生降解而导致基因表达沉默。rnai具有高度的序列专一性和有效的干扰,可以特异地将特定的基因沉默,从而使基因功能丧夫或基因表达量降低,因此rnai可以作为功能基因组学的一种强有力的研究工具。家蚕是鳞翅目模式昆虫,研究其关键性状基因功能可为鳞翅目害虫的防治提供坚实的理论基础。作为研究基因功能的有力工具,rnai在家蚕细胞和个体的应用多为dsrna直接干涉,效果不稳定且作用时间短暂,应用受到较大限制。
3.慢病毒是逆转录病毒的一种,作为基因治疗载体发展起来。利用慢病毒构建的shrna载体,与化学合成的sirna和基于瞬时表达载体构建的shrna相比,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到宿主基因组上,进行持久的稳定表达。plko.1是一种复制缺陷型慢病毒载体,不仅可以作为常规rnai载体使用,也可被包装成慢病毒颗粒,感染细胞。重组载体进入细胞后整合到基因组,便可以稳定表达shrna,且具有puromycin抗性,在后续实验中便于通过puromycin筛选稳定整合shrna的细胞系。
4.目前,利用慢病毒plko.1构建shrna载体还未有应用于家蚕研究的报道,在家蚕中还未发现长效稳定的干扰载体,这对于家蚕基因功能的研究进展造成了一定的阻碍。
技术实现要素:
5.发明目的:本发明的第一目的是提供一种可以干涉家蚕bmp53基因的shrna;
6.本发明的第二目的是提供包含所述shrna的表达盒、重组载体、重组病毒、重组细胞或重组菌;
7.本发明的第三目的是提供包含所述shrna的重组载体的构建方法;
8.本发明的第四目的是提供一种由所述shrna干涉家蚕bmp53基因的方法。
9.技术方案:为了解决上述技术问题,本发明提供了一种家蚕bmp53基因的shrna,包括正义链和反义链,shrna正义链的核苷酸系列选自seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5或seq id no:6中所示的一种或几种,shrna反义链的核苷酸序列如seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11或seq id no:12中所示的一种或几种。
10.以下为设计shrna的基本原则:
11.(1)从起始密码atg下游25个核苷酸后开始,寻找21个核苷酸,排列模式符合aa
(n19)。如果没有符合上述模式的序列,可以寻找符合nar(n17)ynn这种排列模式。n为任一核苷酸,r为嘌呤,y为嘧啶;
12.(2)gc含量为36%~52%;
13.(3)正义链3’端稳定性较低,在15~19核苷酸位置,至少有一个a或t;
14.(4)避免靶向内含子;
15.(5)避免21个核苷酸内有连续4个或更多重复的核苷酸,尤其避免重复的t,因为重复的t可以导致rna聚合酶ⅲ转录终止。
16.为避免脱靶效应,利用ncbi的blast程序进行同源性搜索的同时,设计了6条序列靶向bmp53基因,一是为了测试比较shrna的敲降效率,二是为了避免脱靶。
17.本发明内容还包括含有所述shrna的表达盒、重组载体、重组细胞或重组菌。
18.本发明内容还包括所述shrna、包含所述shrna的表达盒、重组载体、重组病毒、重组细胞或重组菌在干涉家蚕bmp53基因中的应用。
19.优选的,所述重组载体为plko.1-puro载体,所述重组载体也可以为其他的慢病毒载体。
20.本发明内容还包括含有所述shrna的重组载体的构建方法,包括以下步骤:
21.(1)将所述shrna插入克隆载体;
22.(2)筛选阳性克隆载体即为重组载体。
23.本发明还包括所述的重组病毒的获得方法,包括以下步骤,将所述重组载体和pspax2、pmd2.g质粒包装成病毒颗粒转染细胞即得。
24.本发明内容还包括一种由shrna干涉家蚕bmp53基因的方法,包括以下步骤,用所述重组病毒感染家蚕。
25.有益效果:与现有技术相比,本发明具有如下显著优点:(1)公开了由慢病毒介导的靶向基因shrna干扰家蚕功能基因表达的方法,设计有效干扰家蚕功能基因复制的靶向shrna,并通过慢病毒载体插入供体细胞基因组,获得有效阻止基因表达并具有感染能力的家蚕细胞系,而后用病毒液注射家蚕,从而实现个体水平有效持续的基因敲降;(2)采用体外构建能够表达shrna的载体,然后转入细胞内转录shrna的策略,不仅对基因表达抑制效果明显,且稳定整合表达载体的细胞并应用到个体水平,开发了家蚕乃至鳞翅目昆虫基因功能研究的新工具,并以期用于害虫生物防治。
附图说明
26.图1为plko.1-puro酶切胶图;
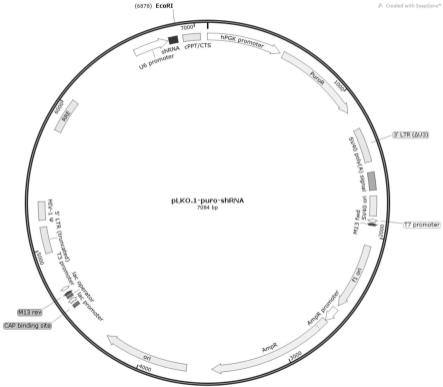
27.图2为plko.1-puro-shrna载体示意图;
28.图3为bmn细胞感染病毒后状态;
29.图4为慢病毒载体plko.1-puro介导的rna干扰在家蚕细胞的基因敲降效果;
30.图5为慢病毒载体plko.1-puro介导的rna干扰在家蚕个体的基因敲降效果;
31.图6为家蚕个体感染病毒后生长发育情况。
具体实施方式
32.下面结合附图对本发明的技术方案作进一步说明。
33.一、设计靶向bmp53基因的shrna序列
34.以家蚕凋亡调控基因bmp53(genbank:hm773025.1)为靶基因,使用在线软件block-it
tm rnai designer筛选合适的含有21个碱基的靶序列。为避免脱靶效应,利用ncbi的blast程序进行同源性搜索的同时,设计了6条序列,一是为了测试比较shrna的敲降效率,二是为了避免脱靶。
35.二、合成shrna
36.确定的6个靶序列,将靶序列插入如下基本骨架,序列如表1所示。
37.正义链:
[0038]5’
ccgg-21个碱基(靶序列)-ctcgag-21个反向互补碱基序列-tttttg 3’[0039]
反义链:
[0040]5’
aattcaaaaa-21个碱基(靶序列)-ctcgag-21个反向互补碱基序列3’[0041]
表1
[0042]
[0043][0044]
三、将shrna序列克隆入plko.1-puro载体
[0045]
1、实验试剂
[0046]
agei(neb,#r0552s),ecori(neb,#r0101s),buffer 2(neb,#b7002s),solution i(takara,d6022),plko.1-puro克隆载体(addgene plasmid,货号8453),琼脂糖凝胶纯化回收试剂盒(sangon,货号b518131-0100),sanprep柱式pcr产物纯化试剂盒(上海生工,
b518141-0100),1.5ml微型离心管(sangon,货号f601620-0010)。
[0047]
2、寡核苷酸退火
[0048]
合成的寡核苷酸溶解至终浓度为20μm,按如下反应体系分别配制6个反应体系。在2l大烧杯内准备1500ml100℃热水,温度约95℃~100℃,将反应的微型离心管用浮漂置入烧杯中。烧杯置于实验台上缓慢降至室温,4h后取出微型离心管。
[0049]
退火反应体系如下:
[0050][0051]
3、酶切plko.1-puro克隆载体
[0052]
第一步:用agei酶切,37℃水浴孵育2h。反应体系如下:
[0053][0054]
第二步:pcr产物纯化试剂盒纯化酶切反应产物,35μl h2o洗脱。
[0055]
第三步:纯化产物用ecori酶切,37℃水浴孵育2h。反应体系如下:
[0056][0057]
1%琼脂糖凝胶电泳分离酶切后载体,如图1所示,agei和ecori双酶切质粒大小约7000bp。切胶回收,30μl h2o洗脱。
[0058]
第四步:连接和转化
[0059]
按照如下反应体系进行连接反应:
[0060][0061][0062]
25℃孵育1h后转化,转化按如下步骤操作:上述得到的连接液10μl加入100μldh5a感受态细胞,冰上放置30min,42℃水浴90s,然后冰上放置2min,加500μl无抗生素液体lb在37℃下摇床摇1h,800rpm离心2min,留100ul菌液重悬涂板,于37℃培养箱过夜培养。
[0063]
以agei和ecori酶切未连接shrna的plko.1-puro空载作为对照,对照仅有1~2个克隆,连接shrna 1-6的plko.1-puro-shrna载体克隆密集。
[0064]
第五步:阳性克隆测序鉴定
[0065]
酶切鉴定得到阳性克隆后,shrna 1-6载体各挑取3个克隆通过测序验证。测序引物为5
’‑
acgtgaagaatgtgcgagac-3’,从而获得如图2所示能表达shrna的阳性克隆,图示标记为插入载体的shrna,每个shrna大小为21bp。
[0066]
四、制备病毒质粒
[0067]
将plko.1-puro-shrna 1-6载体分别和pspax2、pmd2.g质粒,转染hek293t细胞包装病毒,获得plko.1 shrna 1-6病毒,以plko.1-puro空载包装病毒作为对照。
[0068]
载体包装病毒具体步骤如下:
[0069]
第一步:在六孔板种植适量hek-293t细胞,在dmem高糖培养基中培养,培养基体积2ml。
[0070]
第二步:在hek-293t细胞种植24h后转染,转染试剂为entranstertm-h4000。dna:h4000用量比为1:2.5。转染方法如下:在1.5ml无菌微型离心管内准备500μl dmem培养基,加入plko.1-shrna 1-6,pspax2,pmd2.g质粒各2μg,震荡混匀;同时在另一1.5ml无菌微型离心管内准备500μl dmem培养基,加入转染试剂15μl;上述离心管室温静置10min后,将两离心管中的转染试剂和载体混合,室温静置20min;将转染试剂和dna复合物加入第一步的hek-293t细胞培养皿,轻晃混匀,放入5%co2培养箱继续培养。
[0071]
第三步:将第二步转染的hek-293t细胞过夜培养后换用新鲜dmem高糖培养基。
[0072]
第四步:48h后收集第三步的dmem高糖培养基4000rpm离心15min,收获病毒,继续加入2ml新鲜培养基,24h后再次以同样方法收获病毒。将两次收获的病毒液混合,用0.45μm的针头滤器过滤去除hek-293t细胞。病毒液分装后冻存于-80℃。
[0073]
plko.1-puro空载包装病毒步骤同上。
[0074]
五、病毒感染家蚕细胞
[0075]
为了测试慢病毒对细胞生长是否会产生致命性伤害,用plko.1-puro空载包装的病毒感染bmn细胞,同时用正常无任何处理的bmn细胞作为对照。如图3所示normal bmn为正常生长的细胞,整齐饱满椭圆形,lentivirus-infected bmn为plko.1-puro空载包装的病毒感染细胞,会对细胞生长有一定的影响,但是细胞适应病毒感染后能繁殖传代。
[0076]
第一步:种植细胞。在六孔板种植适量本实验室保存家蚕卵巢细胞(bmn),培养基为含胎牛血清的tc-100新鲜培养基,培养基体积为2ml。
[0077]
第二步:感染。在第一步bmn细胞种植24h后,换不含tc-100的无血清培养基,每孔加入2μl polybrene和0.5ml经两次收集冻存的病毒液,在孵育8h后换含胎牛血清的tc-100新鲜培养基。
[0078]
第三步:48h后收获慢病毒,继续加入2ml含胎牛血清的tc-100新鲜培养基,24h后再次收获病毒。将两次收获的病毒液混合,4℃短暂保存。再次加入含胎牛血清的tc-100新鲜培养基,利用5μg/ml puromycin筛选细胞,孵育72h提取rna,反转录后定量分析基因敲降效率。如图4所示。感染后对比慢病毒质粒空载对照(mock),shrna1-6均对bmp53表达起到显著的敲降效果,其中plko.1-shrna2和plko.1-shrna5效果最佳。
[0079]
6、病毒感染家蚕个体
[0080]
选取步骤5中敲降效率最高的plko.1-shrna2和plko.1-shrna5病毒液和plko.1-puro病毒液空载对照(mock),各取5ml,加入放置有5ml 20%糖垫的超速离心管中,配平后25000rpm在4℃下超速离心2h。完成后去上清,用500ul pbs悬浮,加pbs定容到10ml称重配
平,接着继续以35000rpm在4℃下超速离心1h,用300ul pbs4℃过夜悬浮,得到富集病毒液置于-20℃冰箱备用。为探究bmp53对变态发育的影响,等待家蚕生长至5龄第6天,每头腹部第三与第四体节节膜处用10μl微量注射器注射5μl富集病毒,观察家蚕变态发育情况,取血淋巴定量检测敲降效果。如图5所示,选取两个在细胞水平敲降效果最明显的plko.1-shrna2和plko.1-shrna5,在个体水平同样具有较明显的敲降效果。同时选取同批次(5龄第6天)未经任何处理的家蚕作为正常对照(normal),待正常对照化蛹后为所有处理拍照。如图6所示,家蚕个体感染慢病毒空载对照(mock),生产发育速度明显减缓,两个在细胞上作用最明显的
[0081]
plko.1-shrna2和plko.1-shrna5慢病毒感染家蚕,家蚕生长发育进程较慢病毒组加快。鉴于bmp53基因仍然在一定程度上影响变态发育,这为研究bmp53等基因在变态发育调控中的功能提供了一个工具。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1