用于生产具有IGGFC结构域的融合蛋白的方法与流程
用于生产具有igg fc结构域的融合蛋白的方法
1.本技术是申请号为201680059726.x、申请日为2016年10月14日、发明名称为“用于生产具有igg fc结构域的融合蛋白的方法”的专利申请的分案申请。
技术领域
2.本发明涉及一种用于生产具有人免疫球蛋白g(igg)fc结构域的融合蛋白的方法,所述融合蛋白特别是其中血管内皮生长因子(vegf)受体的可溶性细胞外结构域与人免疫球蛋白g(igg)fc结构域融合的蛋白(例如,阿柏西普)。
背景技术:
3.血管内皮生长因子(vegf)是增加血管生成和血管通透性的重要因子。特别地,vegf在肿瘤细胞中过表达,因此促进异常的血管生成和肿瘤增殖(oncogene,2004,23,1745-1753)。此外,据报道,除了肿瘤发生之外,异常的血管生成与其它疾病重要地相关。在通过vegf的机制中,异常的血管生成与眼科疾病的湿性黄斑变性、糖尿病性视网膜病和视网膜静脉阻塞性黄斑水肿等有关(j.korean med.assoc.,2014,57,7,614-623)。
4.作为这些眼科疾病的治疗剂,已经使用了哌加他尼钠(pegaptanib,rna适体)、雷珠单抗(ranibizumab,单克隆igg抗体片段(fab))和贝伐单抗(bevacizumab,单克隆igg抗体),并且在2011年,阿柏西普(与igg1 fc融合的vegfr1和vegfr2)在美国被批准作为用于湿性黄斑变性的治疗剂(biol.ther.,2012,2,3,1-22;drug design development therapy,2013,3,7,711-722)。
5.由于对这些治疗性重组蛋白的需求日益增加,通过改进细胞选择,培养基优化和培养过程控制,已经做出了许多努力来改善细胞生长、活力和蛋白生产和质量。通过细胞培养产生的许多蛋白和多肽是由通过在预定温度或ph下使用分批或补料分批方法培养细胞预定时间,然后分离细胞以生产细胞的方法而制得的。因此,产量和质量可能受细胞培养条件的影响。需要一种能够通过调节和优化与蛋白生产相关的细胞培养条件而增加所产生的蛋白量,抑制错误折叠/聚集蛋白的生成,或抑制蛋白的脱酰胺化体或所生成的取代/缺失的氨基酸衍生物来预防动物细胞培养物中安全问题的方法(例如免疫原性和纯化过程的并发症)。
技术实现要素:
6.技术问题
7.为了解决上述问题而设计了本发明,并提供了用于增加蛋白表达水平的igg fc融合蛋白的生产方法。
8.本发明的另一个目的是提供一种用于制备靶标蛋白的方法,该方法包括:通过上述生产方法培养生产靶标蛋白的细胞。
9.本发明的另一个目的是提供一种药物组合物,其包括通过上述制备方法制备的治疗性蛋白和药学上可接受的载体。
10.然而,本发明要解决的技术问题不限于上述问题,并且本领域技术人员可以从以下描述中清楚地理解未提及的其它问题。
11.技术方案
12.为了解决上述问题,证实了本发明通过优化产生融合蛋白的细胞的培养条件以提高具有igg fc结构域的融合蛋白的生产率和质量。具体而言,证实了通过在典型的培养温度(35.0℃至38.0℃)下培养细胞预定时间,然后在28.0℃至35.0℃的降低培养温度下培养细胞,增加了融合蛋白的生产率,并抑制了融合蛋白聚集体的生成,基于该事实完成了本发明。
13.为了实现这些目的,本发明提供了一种用于生产其中血管内皮生长因子(vegf)受体的可溶性细胞外结构域与人免疫球蛋白g(igg)fc结构域融合的蛋白的方法,其中,在28.0℃或更高且低于35.0℃的降低温度下培养细胞以提高融合蛋白的表达水平。
14.根据本发明的优选示例性实施方式,通过该方法制备的融合蛋白可以是聚集体减少的融合蛋白。
15.根据本发明的优选示例性实施方式,细胞培养可以是大规模细胞培养。
16.根据本发明的另一种优选的示例性实施方式,细胞培养可以是选自由分批培养、重复分批培养、补料分批培养、重复补料分批培养、连续培养和灌注培养组成的组中的任一种。
17.根据本发明的另一种优选的示例性实施方式,细胞培养可以是补料分批细胞培养。
18.根据本发明的另一种优选的示例性实施方式,细胞可以是哺乳动物细胞。
19.根据本发明的另一种优选的示例性实施方式,哺乳动物细胞可以是cho细胞。
20.根据本发明的另一种优选的示例性实施方式,cho细胞可以是选自由dg44、dxb-11、k-1和cho-s组成的组中的任一种的细胞系。
21.根据本发明的另一种优选的示例性实施方式,从培养起始日至温度变化的培养温度可以是包含在33.0℃至小于38.0℃的温度范围内的温度。
22.根据本发明的另一种优选的示例性实施方式,温度可以降低至30.0℃至34.0℃。
23.根据本发明的另一种优选的示例性实施方式,从培养起始日至温度变化的培养周期可以是1至5天。
24.根据本发明的另一种优选的示例性实施方式,温度降低后的培养周期可以是2至15天。
25.根据本发明的另一种示例性实施方式,在权利要求1中,温度变化前的培养周期和温度变化后的培养周期之和可以为3天或更多。
26.根据本发明的另一种优选的示例性实施方式,vegf受体的可溶性细胞外结构域可以包括第一vegf受体的免疫球蛋白样结构域2和第二vegf受体的免疫球蛋白样结构域3。
27.根据本发明的另一种优选的示例性实施方式,所生产的蛋白可以是治疗性蛋白。
28.本发明还提供了一种用于制备靶标蛋白的方法,该方法包括:通过上述生产方法培养生产靶标蛋白的细胞。
29.根据本发明的一种优选的示例性实施方式,该方法可以另外包括从其中培养生产靶标蛋白的细胞的培养肉汤中回收靶标蛋白的过程。
30.根据本发明的另一种优选的示例性实施方式,靶标蛋白可以是治疗性蛋白。
31.本发明还提供了一种药物组合物,其包括通过上述制备方法制备的治疗性蛋白和药学上可接受的载体。
32.然而,本发明要解决的技术问题不限于上述问题,并且本领域技术人员可以从以下描述中清楚地理解未提及的其它问题。
33.有益效果
34.通过另外包括在降低的培养温度下培养生产具有igg fc结构域的融合蛋白的细胞的步骤,本发明增加了细胞生长和细胞活力,增加融合蛋白的表达水平,并抑制聚集体产生,因此增加了融合蛋白的生产率并提高了质量,使得可以大量制备和提供融合蛋白。
附图说明
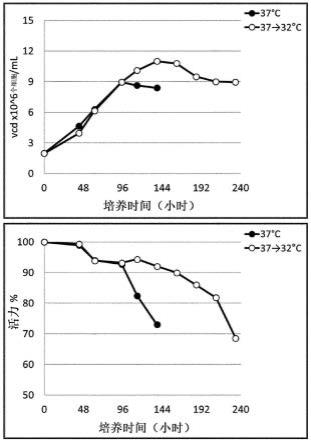
35.图1是根据产生阿柏西普的细胞的培养温度分析细胞生长和细胞活力变化的图。
36.图2是显示随着时间(x轴;培养时间[天])产生阿柏西普的累积活细胞数(y轴;ivc[归一化109细胞
×
天/l])且归一化为ivc的图。
[0037]
图3是显示根据产生阿柏西普的细胞的培养温度的比生产率变化的图。
[0038]
图4是通过高效液相色谱法(hplc)根据产生阿柏西普的细胞的培养温度分析表达水平变化的图。
[0039]
图5是根据产生阿柏西普的细胞的低培养温度分析细胞生长和细胞活力变化的图。
[0040]
图6是通过hplc根据产生阿柏西普的细胞的低培养温度分析表达水平变化的图。
[0041]
图7是在2l生物反应器中根据产生阿柏西普的细胞的培养温度分析细胞生长和细胞活力变化的图。
[0042]
图8是显示在2l生物反应器中随着时间(x轴;培养时间[天])产生阿柏西普的累积活细胞数(y轴;ivc[归一化109细胞
×
天/l])且归一化为ivc的图。
[0043]
图9是显示在2l生物反应器中根据产生阿柏西普的细胞的培养温度的比生产率变化的图。
[0044]
图10是通过蛋白a-hplc在2l生物反应器中根据产生阿柏西普的细胞的培养温度分析表达水平变化的图。
[0045]
图11是通过高效液相凝胶色谱法(se-hplc)在2l生物反应器中根据产生阿柏西普的细胞的培养温度分析聚集蛋白变化的图。
具体实施方式
[0046]
在下文中,将更详细地描述本发明。
[0047]
如上所述,由于对治疗性重组蛋白的需求增加,通过改进细胞选择、培养基优化和培养过程控制,已经做出了许多努力来改善细胞生长、活力和蛋白生产和质量,并且需要一种能够通过调节和优化与蛋白生产相关的细胞培养条件而增加所产生的蛋白量,抑制错误折叠/聚集蛋白的生成,或抑制蛋白的脱酰胺化体或所生成的取代/缺失的氨基酸衍生物来预防动物细胞培养物中安全问题的方法(例如免疫原性和纯化过程的并发症)。
[0048]
因此,本发明人通过证实具有免疫球蛋白g(igg)fc结构域的融合蛋白的生产率增
加并且当在典型培养温度(35.0℃至38.0℃)下培养细胞预定时间,然后在28.0℃至35.0℃的降低培养温度下培养细胞时,可抑制融合蛋白聚集体的生成,并且通过提供具有igg fc结构域的融合蛋白的生产方法(其中细胞培养中蛋白的表达水平增加),已经发现了解决上述问题的方法。通过进行在降低的培养温度下培养生产具有igg fc结构域的融合蛋白的细胞的步骤,根据本发明的生产具有igg fc结构域的融合蛋白的方法增加了细胞生长和细胞活力,增加了融合蛋白的表达水平,并抑制了聚集体生成,因此增加了融合蛋白的生产率并提高了质量,使得可以大量制备和提供融合蛋白。
[0049]
本说明书中使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的相同含义。
[0050]
在本发明中,“具有igg fc结构域的融合蛋白”是指与作为人igg的非可变区的fc区结合的蛋白。在这种情况下,在本发明中,“蛋白”是指通过肽键连接的数个或更多个氨基酸的聚合物。
[0051]
在本发明中,作为“氨基酸聚合物”,可以使用人vegf受体1和人vegf受体2,并且优选使用vegf受体1和vegf受体2的细胞外结构域。
[0052]
在本发明中,“fc区”是抗体的非可变区,可以使用人igg1、igg2、igg3和igg4,优选使用igg1的fc区。
[0053]
本发明提供了一种用于生产其中血管内皮生长因子(vegf)受体的可溶性细胞外结构域与人igg fc结构域融合的蛋白的方法,其中,在28.0℃或更高且低于35.0℃的降低温度下培养细胞以提高融合蛋白的表达水平。
[0054]
在生产融合蛋白的方法中,细胞培养可以是大规模细胞培养,并且作为细胞培养方法,可以使用通常使用的细胞培养方法。例如,细胞培养方法可以是但不限于选自由分批培养、重复分批培养、补料分批培养、重复补料分批培养、连续培养和灌注培养组成的组中的任一种或多种。
[0055]“分批培养”是这样一种培养方法,其中向培养基中加入少量种子培养肉汤,并在其中增殖细胞而不向其中添加新鲜培养基或在培养期间排出培养肉汤。“连续培养”是在培养期间连续添加培养基并且培养肉汤也连续排出的培养方法。此外,灌注培养也是一种类型的连续培养。由于“补料分批培养”是分批培养和连续培养之间的中间体,所以补料分批培养也称为半分批培养,其中在培养期间连续或依次添加培养基,补料分批培养是如在连续培养中一样进行培养肉汤的连续排出但细胞不流出的培养方法。在本发明中,可以使用任何上述培养方法,优选使用补料分批培养或连续培养,特别优选使用补料分批培养。
[0056]
在本发明中,为了表达fc融合蛋白,可以使用任何类型的细胞而没有限制,只要细胞是能够不断表达融合蛋白的稳定细胞系即可,并且优选地,细胞是哺乳动物细胞。更优选地,可以使用通常使用的动物培养细胞例如cho细胞、hek细胞、cos细胞、3t3细胞、骨髓瘤细胞、bhk细胞、hela细胞或vero细胞等,特别地,当细胞用于大量表达fc融合蛋白的目的时,cho细胞是优选的。此外,为了制备所需的蛋白,特别优选的是适于引入所需基因的细胞,如dhfr-cho细胞(proc.natl.acad.sci.usa,1980,77,4216-4220),其是缺少dhfr基因的cho细胞,或cho k-1细胞(proc.natl.acad.sci.usa,1968,60,1275)。作为cho细胞,特别地,dg44细胞系、dxb-11细胞系、k-1细胞系或cho-s细胞系是优选的,k-1细胞系是特别优选的,并且将载体引入到宿主细胞中可以通过例如磷酸钙法、deae葡聚糖法、电穿孔法或脂转染
法的方法来实施。
[0057]
在根据本发明生产蛋白的方法中,其中将vegf受体的可溶性细胞外结构域与人igg fc结构域融合,作为从起始至温度变化进行培养的温度,通常用于培养的温度可以根据细胞的类型选择。例如,通常用于培养哺乳动物细胞的温度范围可以是33.0℃至小于38.0℃,并且特别优选是37.0℃。在本发明的一种优选的示例性实施方式中,在培养起始日至温度变化的37.0℃下培养过表达重组阿柏西普的细胞。
[0058]
在本发明中,温度变化的时间由靶标蛋白的表达水平确定。具体而言,可以通过进行实施例3所示的实验来确定温度变化的最佳时间,但由于最终细胞密度根据所使用的细胞类型或培养条件而不同,所以最终细胞密度为约1
×
106个细胞/ml至约1
×
108个细胞/ml通常是优选的。
[0059]
本发明提供了一种用于在为了制备融合蛋白而培养其中引入编码蛋白的基因的cho细胞时提高每细胞生产率并抑制生成聚集体的方法,其中,在从培养起始日1天至5天的典型培养温度下培养细胞,然后降低培养温度。温度变化至培养结束的周期通常为1日-30日,优选为2日-15日。温度变化前的培养周期和温度变化后的培养周期之和可以为3天或更多。具体而言,通过培养生产融合蛋白的细胞来生产融合蛋白的方法的特征在于,在典型培养温度下培养细胞预定时间,然后在降低的温度下连续培养细胞。在此,典型培养温度通常为33.0℃至38.0℃,该温度是适合来源于恒温动物的细胞的细胞增殖温度,最通常为37.0℃。
[0060]
在根据本发明生产蛋白的方法中,其中将vegf受体的可溶性细胞外结构域与人igg fc结构域融合,降低的培养温度是指低于典型培养温度的温度范围,并根据靶标蛋白的表达水平确定最佳降低的培养温度。因此,在本发明中,如实施例2中所述进行实验以得到其中最大程度地表达靶标蛋白的最佳降低的培养温度范围。尽管如实施例2中通过实验可以发现最佳变化的温度,但由于最终细胞密度根据细胞的类型或培养条件而不同,所以最佳降低的培养温度可以优选为28.0℃至35.0℃,并且更优选为30.0℃至34.0℃。
[0061]
在根据本发明生产蛋白的方法中,其中将vegf受体的可溶性细胞外结构域与人igg fc结构域融合,vegf受体的可溶性细胞外结构域可以包括第一vegf受体的免疫球蛋白样结构域2和第二vegf受体的免疫球蛋白样结构域3。具体而言,通过本发明的生产方法生产的蛋白可以是治疗性蛋白。
[0062]
在本发明的一种优选的示例性实施方式中,将从培养起始日至温度变化的培养温度设定为37.0℃以培养过表达重组阿柏西普的细胞3天,直至培养瓶中细胞的密度达到8x106个细胞/ml。此后,细胞按照表1中的供应时间表在32.0℃的降低培养温度下进行补料分批培养。
[0063]
如图1中所示,在比典型培养温度更低的温度下在培养瓶中生长的细胞表现出比在37.0℃下连续培养的细胞(对照)更高的活力,并且培养时间相应地延长,因此,蛋白的表达水平如图4所示增加。相反地,如图2和3所示,在比典型培养温度更低的温度下在培养瓶中生长的细胞不影响ivc数量和蛋白表达的总量(pv=培养体积
×
表达水平),使得比生产率不增加。
[0064]
在本发明的另一种优选的示例性实施方式中,将过表达重组阿柏西普的细胞在培养起始日至温度变化的37.0℃的温度下培养2天,直至培养瓶中的细胞密度达到8x106个细
胞/ml。此后,细胞按照表1中的供应时间表在30.0℃、32.0℃或34.0℃的降低培养温度下进行补料分批培养。
[0065]
如图5所示,在培养瓶中培养温度低至34.0℃的培养中的细胞浓度与其它温度下的细胞浓度相比增加了,但是如图6所示,在培养温度低至32.0℃的培养中的蛋白表达水平增加是最高的。
[0066]
在本发明的另一种优选的示例性实施方式中,将从培养起始日至温度变化的培养温度设定为37.0℃以培养过表达重组阿柏西普的细胞1天或2天,直至生物反应器中细胞的密度达到4x106个细胞/ml或8
×
106个细胞/ml。此后,细胞按照表1中的供应时间表在32.0℃的降低培养温度下进行补料分批培养。生物反应器中培养肉汤的ph值根据待培养的细胞而不同,但通常ph值可以为6.8至7.6,优选6.8至7.4。此外,生物反应器中培养肉汤中的溶解氧(do)通常为20%至60%,优选30%至50%,更优选40%。
[0067]
与培养瓶培养(锥形瓶)不同,通过使用生物反应器在典型培养温度(37.0℃)下,然后在低于典型培养温度的培养温度下培养细胞至细胞密度为8
×
106个细胞/ml,不会影响vc数量,如图8所示。然而,如图9所示,由于蛋白表达总量(pv=培养体积
×
表达水平)的增加,比生产率增加。如图7所示,培养周期增加,因此,蛋白的表达水平增加,如图10所示。此外,如图11所示,证实了生成较少的聚集体,并且单体纯度增加。
[0068]
因此,根据本发明的生产具有igg fc结构域的融合蛋白的方法可以通过优化细胞培养条件而增加生产具有igg fc结构域的融合蛋白的细胞的生长和活力,以增加融合蛋白的生产率。
[0069]
此外,根据本发明的生产具有igg fc结构域的融合蛋白的方法可以通过改进培养哺乳动物细胞的方法而增加融合蛋白的生产率并抑制影响融合蛋白质量的聚集生成,以提供质量提高的融合蛋白。
[0070]
本发明的方法的特征在于在通过培养生产所需蛋白的细胞而制备融合蛋白时提高所需蛋白的生产率并抑制聚集成分生成。因此,该方法可以有助于提高阿柏西普的生产率,并且通过抑制聚集成分生成改进纯化过程,所述阿柏西普是其中抗-vegf受体的配体结合部分与igg1的fc区融合的蛋白。
[0071]
本发明还提供了一种用于制备靶标蛋白的方法,该方法包括:通过上述生产方法培养生产靶标蛋白的细胞。
[0072]
根据本发明的用于生产靶标蛋白的方法可以另外包括从其中培养生产靶标蛋白的细胞的培养肉汤中回收靶标蛋白的过程。
[0073]
通过用于制备靶标蛋白的方法制备的靶标蛋白可以是治疗性蛋白,并且制备的治疗性蛋白可以作为药物组合物与药学上可接受的载体一起提供。
[0074]
本发明的药物组合物可以通过使用除活性成分之外的药学上合适的和生理上可接受的佐剂而制备,可以使用例如赋形剂、崩解剂、甜味剂、粘合剂、涂层剂、溶胀剂、润滑剂、滑爽剂或增香剂的可溶性试剂作为佐剂。除了用于施用的活性成分之外,本发明的药物组合物可以通过另外包含一种或多种药学上可接受的载体来配制。在配制成液体溶液的组合物中,作为适于灭菌和活体的药学上可接受的载体,可以使用盐水溶液、灭菌水、林格溶液、缓冲盐水溶液、白蛋白注射液、葡萄糖溶液、麦芽糖糊精溶液、甘油、乙醇及其至少一种的混合物,并且如果需要,可以添加其它典型的添加剂,如抗氧化剂、缓冲溶液和抑菌剂。此
外,组合物可以通过另外包括稀释剂、分散剂、表面活性剂、粘合剂、润滑剂而配制成注射剂型(例如水溶液、悬浮液和乳剂)、丸剂、胶囊剂、颗粒剂或片剂。
[0075]
根据所制备的治疗性蛋白的类型,本发明的药物组合物可以通过各种途径施用于包括人在内的哺乳动物。例如,药物组合物可以口服或非口服施用,并且非口服施用方法可以是但不限于静脉内、肌内、动脉内、髓内、硬膜内、心内、经皮、皮下、腹膜内、鼻内、肠内、局部、舌下、直肠或玻璃体内施用。
[0076]
本发明的药物组合物的合适施用量可以根据诸如制剂方法,施用方法,患者的年龄、体重、性别或疾病状况,饮食,施用时间,施用途径,排泄速率和反应敏感性等因素而变化,并且具有普通技术的医生可以容易地确定和规定对于期望的治疗或预防有效的施用量。
[0077]
在下文中,将通过本发明的实施例更详细地描述本发明。然而,提供这些实施例是为了举例说明本发明,而本发明的范围并不限于此。
[0078]
制备例
[0079]
表达重组阿柏西普的载体和细胞系的制备
[0080]
通过使用从psghv0(genbank登录号af285183)中除去shgh、his标签和tev位点的修饰载体将重组阿柏西普克隆成融合蛋白,并通过使用蛋白的固有信号序列在细胞外分泌重组阿柏西普。
[0081]
此外,引入gs系统作为用于构建恒定表达融合蛋白的细胞系(稳定细胞系)的选择性标记,为此,将小鼠谷氨酰胺合成酶基因插入到载体中。为了增加表达水平,将kozac序列另外插入到信号序列中。然后,通过将如此制备的克隆引入到cho-k1细胞系(atcc,cat.ccl-61)并选择甲硫氨酸磺酰亚胺(msx)而获得稳定的细胞系。然而,本领域技术人员可以根据给定的情况适当地选择典型使用的载体和细胞系并相应地应用它们。
[0082]
实施例1
[0083]
证实在降低的温度下培养对细胞状态和iggfc融合蛋白生产的影响
[0084]
将在制备例中制备的过表达重组阿柏西普的细胞在相同浓度和条件下接种到两个125ml锥形瓶中的补充有植物来源的水解蛋白的培养基中,并在37.0℃的co2培养箱中振荡培养。通过分批培养使细胞生长,然后当细胞浓度为约8
×
106个细胞/ml时,通过将温度降低至32.0℃进行补料分批培养。实验条件的供应时间表汇总于下表1中。将补料分批进料的体积描述为生物反应器中培养起始体积的百分比。通过每天从培养中取出细胞样品来测量活细胞数量、细胞活力、表达和比生产速率的水平。“累积活细胞数”或“总活细胞(ivc)”是指在培养过程中活细胞的平均密度乘以培养周期。当生产的蛋白量与培养过程中存在的活细胞数量成比例时,使用累积活细胞密度来估计在培养过程中生产蛋白的量。通过使用细胞密度测试测量活细胞数量来计算ivc,其中活细胞用台盼蓝染色并在显微镜下测量,并且归一化为ivc。通过计算所有实验条件下测定的收获日期累积活细胞密度的算术平均值来确定ivc。通过蛋白a-hplc测量表达水平,并计算比生产率。
[0085]
[表1]
[0086]
实验条件37.0℃37.0
→
32.0℃第2天2.86%2.86%第3天2.86%2.86%
第4天2.86%2.86%第5天2.86%2.86%第6天2.86%2.86%第7天2.86%2.86%第8天2.86%2.86%
[0087]
结果,由于在125ml锥形瓶中在低温下培养的细胞不影响ivc数量和表达蛋白的总量(pv=培养体积
×
表达水平),所以比生产率没有增加(图2和3)。然而,当细胞在低温下生长时,由于更高的细胞活力(图1),培养周期和表达水平增加(图4)。
[0088]
实施例2
[0089]
鉴定基于igg fc融合蛋白表达水平的最佳温度变化
[0090]
将在制备例中制备的过表达重组阿柏西普的细胞在相同浓度和条件下接种到三个125ml锥形瓶中的补充有植物来源的水解蛋白的培养基中,并在37.0℃的co2培养箱中振荡培养。通过分批培养使细胞生长,然后当细胞浓度为约8
×
106个细胞/ml时,分别在30.0℃、32.0℃或34.0℃的降低温度下进行补料分批培养。实验条件的供应时间表如实施例1的表1中所述。如实施例1中所述测量细胞的各种状态。
[0091]
结果,对于在34.0℃的低温下培养的细胞,细胞浓度的增加是最高的,而活力没有任何变化(图5)。然而,与其它温度下的表达水平相比,在32.0℃的低温下培养的细胞的表达水平是最高的(图6)。
[0092]
实施例3
[0093]
生物反应器证实实验
[0094]
将在制备例中制备的过表达重组阿柏西普的细胞在new brunswick scientific(nbs)生物反应器中接种到植物来源的补料培养基中,并在6.8至7.4的ph值和80rpm的速率下搅拌。当生物反应器在第1天或第2天达到4
×
106个细胞/ml或8
×
106个细胞/ml的细胞浓度时,通过将温度从37.0℃变为32.0℃而培养细胞。实验条件的供应时间表如实施例1的表1中所述。如实施例1中所述测量细胞的各种状态。
[0095]
结果,与125ml锥形瓶培养不同,当培养温度降低至8
×
106个细胞/ml时,所培养的细胞不影响ivc数量,由于所表达的蛋白总量(pv=培养体积
×
表达水平)的增加,比生产速率增加,并且由于培养周期的增加,表达水平增加(图7至10)。通过蛋白a柱从在上述温度条件下培养的样品中分离蛋白并通过se-hplc分析。根据se-hplc分析所得到的结果计算单体比率,并计算聚合物杂质的聚集体与低分子杂质的碎片的比例。作为实验的结果,可以证实,在降低的温度培养中,生成较少的聚集体,因此,单体纯度增加(图11)。
[0096]
这些结果证明,通过根据本发明的用于生产其中vegf受体的可溶性细胞外结构域与人igg fc结构域融合的蛋白的方法,由于抑制聚集体生成,作为融合蛋白代表的阿柏西普可以高质量地生产,并且由于通过在降低温度下培养的表达水平的显著增加,生产率也可以增加。
[0097]
在通过细胞培养生产融合蛋白时,同时满足蛋白质量和生产率的培养条件根据蛋白的类型而不同,因此需要许多试验和错误才找到最佳条件。如实施例中所证明的,根据本发明的用于生产融合蛋白的方法被优化用于生产其中vegf受体与人igg fc结构域的可溶性细胞外结构域融合的蛋白(例如阿柏西普),并且当蛋白的类型变化时,相应蛋白的生产
率和质量可能显著变化。因此,当要生产的靶标蛋白的类型变化时,基本上需要重建最佳条件以提高质量和生产率并验证最佳条件的过程。
[0098]
本发明的上述描述是为了说明的目的而提供的,并且本发明所属领域的技术人员将理解,本发明可以容易地修改为其它特定形式而不改变本发明的技术精神或本质特征。因此,应该理解的是,上述实施例在所有方面仅是说明性的而不是限制性的。
[0099]
工业适用性
[0100]
如本发明所提供的生产其中vegf受体的可溶性细胞外结构域与人igg fc结构域融合的蛋白的方法另外包括在降低的培养温度下培养生产融合蛋白的细胞的步骤,从而通过增加细胞生长和细胞活力来提高融合蛋白生产率,并通过抑制融合蛋白聚集体的生成来提高质量,因此可以大量制备和提供融合蛋白。
[0101]
此外,通过本发明的生产方法生产的蛋白是治疗性蛋白,可以用于提供适合于治疗性目的的药物组合物,因此在工业上是高度适用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1