RAD51抑制剂化合物的晶型及其应用的制作方法
rad51抑制剂化合物的晶型及其应用
1.本发明要求2021年8月19日向中国国家知识产权局提交的,专利申请号为202110956569.5,发明名称为“rad51抑制剂化合物的晶型及其应用”的在先申请的优先权。上述在先申请的全文通过引用的方式结合于本发明中。
技术领域
2.本发明涉及医药领域,特别是涉及作为rad51抑制剂的化合物的晶型,其相应的制备方法、包含所述晶型的药物组合物,以及所述晶型或包含所述晶型的药物组合物在制备用于预防或治疗相关药理学病症的药物中的用途。
背景技术:
3.rad51是真核生物基因。这个基因编码的蛋白质是rad51蛋白家族的一员,它能够帮助修复dna双链断裂。rad51家族成员与细菌reca、古菌rada和酵母rad51同源。从酵母到人类,这种蛋白质在大多数真核细胞中高度保守。在人类中,rad51是一种含有339个氨基酸组成的蛋白质,拥有dna依赖性atp激酶活性。在dna双链断裂(double strand breaks,dsbs)修复过程中,它对同源重组起着重要作用。rad51参与将断裂序列与未受损的同源序列之间的相互转移,使受损区域得以重新合成。
4.dna损伤反应对于维持细胞基因组稳定性和细胞存活发挥着重要作用。dna双链断裂是dna损伤最严重的形式。同源重组修复是体内参与dsbs损伤修复的重要机制之一,其中rad51是体内参与同源重组性dna修复的关键因子。rad51在人类的多种肿瘤组织中高表达,如乳腺癌、非小细胞肺癌、前列腺癌等,与肿瘤的转移和恶化相关(klein et al.,dna repair(amst).2008may 3;7(5):686-693)。如何有效下调肿瘤组织中的rad51的水平,降低肿瘤细胞的dna损伤修复能力,从而提高肿瘤治疗的疗效具有潜在的临床应用价值。
5.同源重组在dna损伤修复中具有多重作用,包括修复dna双链断裂以及恢复由dna交联剂引起的dna复制阻断的损伤。同源重组通过定位dna的同源片段并从同源模板中复制缺失的遗传信息来修复dna双链断裂。大量研究表明,同源重组在维持基因组稳定性方面至关重要。研究表明,细胞中促进同源重组修复的蛋白质的缺陷与某些dna损伤治疗的敏感性相关。这种敏感作用对dna交联化疗药物和电离辐射尤为显著(takata et al.,mol cell biol.2001apr;21(8):2858-2866;godthelp et al.,nucleic acids res.2002may15;30(10):2172-2182)。
6.最近有研究小组证明,可以通过对同源重组的部分抑制进一步提高细胞对dna损伤疗法的敏感性。比如,使用对应于另一个旁系同源蛋白的合成肽可以抑制xrcc3(rad51的旁系同源蛋白)。该合成肽使得中华仓鼠卵巢(cho)细胞对顺铂更加敏感,并且抑制了dna损伤所导致的rad51foci的形成(connell et al.,cancer res.2004may 1;64(9):3002-3005)。
7.因此,鉴于dna同源重组修复的相关蛋白的缺陷可以提高细胞对dna损伤治疗的敏感性,需要开发能够抑制rad51活性的小分子。目前cyteir therapeutics,inc.发表了三篇
有关rad51抑制剂的化合物专利申请(wo2019014315a1、wo2019051465a1和wo2020186006a1)。
技术实现要素:
8.pct/cn2021/076939(申请日2021年2月19日)描述了反式-n-[4-[5-[4-[(5-甲基-1h-吡唑-3-基)氨基]-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(化合物(i))
[0009][0010]
本发明提供了理化性质或药学性质优异的化合物(i)的溶剂合物的晶型,以及其盐或共晶的晶型。
[0011]
本发明提供了化合物(i)溶剂合物,其中所述溶剂合物选自水合物。
[0012]
在可选实施方案中,所述化合物(i)溶剂合物为一水合物。
[0013]
在可选实施方案中,所述化合物(i)一水合物为结晶形式。
[0014]
在可选实施方案中,所述结晶形式的化合物(i)一水合物为晶型a,所述晶型a以衍射角2θ表示的x-射线粉末衍射图谱,在7.06
±
0.2
°
、9.83
±
0.2
°
、11.19
±
0.2
°
、14.06
±
0.2
°
、17.64
±
0.2
°
、18.09
±
0.2
°
、18.39
±
0.2
°
、20.25
±
0.2
°
、20.71
±
0.2
°
、21.12
±
0.2
°
、22.12
±
0.2
°
、22.41
±
0.2
°
、24.23
±
0.2
°
、24.85
±
0.2
°
、25.68
±
0.2
°
、27.08
±
0.2
°
处有衍射峰。
[0015]
在可选实施方案中,所述晶型a,以衍射角2θ表示的x-射线粉末衍射图谱,在7.06
±
0.2
°
、9.83
±
0.2
°
、11.19
±
0.2
°
、14.06
±
0.2
°
、14.59
±
0.2
°
、14.92
±
0.2
°
、15.85
±
0.2
°
、17.64
±
0.2
°
、18.09
±
0.2
°
、18.39
±
0.2
°
、20.25
±
0.2
°
、20.71
±
0.2
°
、21.12
±
0.2
°
、22.12
±
0.2
°
、22.41
±
0.2
°
、23.08
±
0.2
°
、24.23
±
0.2
°
、24.85
±
0.2
°
、25.68
±
0.2
°
、26.65
±
0.2
°
、27.08
±
0.2
°
、28.99
±
0.2
°
、30.34
±
0.2
°
、30.73
±
0.2
°
、32.03
±
0.2
°
、32.14
±
0.2
°
、33.80
±
0.2
°
、37.53
±
0.2
°
处有衍射峰。
[0016]
在可选实施方案中,所述晶型a,以衍射角2θ表示的x-射线粉末衍射图谱,在7.06
±
0.2
°
、9.83
±
0.2
°
、11.19
±
0.2
°
、14.06
±
0.2
°
、14.59
±
0.2
°
、14.92
±
0.2
°
、15.59
±
0.2
°
、15.85
±
0.2
°
、16.92
±
0.2
°
、17.64
±
0.2
°
、18.09
±
0.2
°
、18.39
±
0.2
°
、18.75
±
0.2
°
、19.70
±
0.2
°
、20.25
±
0.2
°
、20.18
±
0.2
°
、20.71
±
0.2
°
、22.01
±
0.2
°
、21.12
±
0.2
°
、22.02
±
0.2
°
、22.12
±
0.2
°
、22.41
±
0.2
°
、23.08
±
0.2
°
、23.75
±
0.2
°
、24.23
±
0.2
°
、24.85
±
0.2
°
、25.68
±
0.2
°
、26.22
±
0.2
°
、26.65
±
0.2
°
、27.08
±
0.2
°
、28.26
±
0.2
°
、28.59
±
0.2
°
、28.99
±
0.2
°
、29.31
±
0.2
°
、29.74
±
0.2
°
、30.34
±
0.2
°
、30.73
±
0.2
°
、31.72
±
0.2
°
、32.03
±
0.2
°
、32.14
±
0.2
°
、32.50
±
0.2
°
、33.21
±
0.2
°
、33.80
±
0.2
°
、35.12
±
0.2
°
、34.45
±
0.2
°
、35.52
±
0.2
°
、36.39
±
0.2
°
、37.10
±
0.2
°
、37.53
±
0.2
°
、37.91
±
0.2
°
、39.68
±
0.2
°
处有衍射峰。
[0017]
在可选实施方案中,所述晶型a以衍射角2θ表示的x-射线粉末衍射图谱基本上如
图1所示。
[0018]
在可选实施方案中,所述晶型a具有在137.09
±
5.0℃下的峰值的dsc谱图。
[0019]
在可选实施方案中,所述晶型a的dsc谱图如图2所示。
[0020]
在可选实施方案中,所述结晶形式的化合物(i)一水合物晶型a通过单晶衍射结构分析确定属于单斜晶系,p 1 21 1空间群,其晶胞参数和晶胞体积为:1空间群,其晶胞参数和晶胞体积为:α=90
°
,β=91.764(5)
°
,γ=90
°
,
[0021]
本发明还提供了制备前述任一项化合物(i)一水合物的方法一,包括:将化合物(i)加入溶剂(i)中,溶解,溶清后,析晶,即得。
[0022]
在可选实施方案中,所述方法一中溶剂(i)选自乙醇/水、乙腈/水、1,4-二氧六环/水、2-甲基四氢呋喃/水、乙酸甲酯/水、乙酸乙酯/水、4-甲基-2-戊酮/水、二氯甲烷/水体系中的一种或多种,优选乙醇/水、乙腈/水或1,4-二氧六环/水体系,更优选95%乙醇、80%乙醇、体积比为1:1的1,4-二氧六环水溶液或体积比为1:1的乙腈水溶液。
[0023]
在可选实施方案中,所述方法一中溶剂(i)的体积(ml)为化合物重量(g)的1~30倍,优选5~15倍,更优选5~12倍。
[0024]
在可选实施方案中,所述方法一中的溶解方式为室温溶解或加热溶解。
[0025]
在可选实施方案中,所述方法一中采用加热溶解的方式,所述加热温度为50~80℃,例如可以是70~75℃,也可以是71℃或75℃。
[0026]
在可选实施方案中,所述方法一中采用室温溶解的方式,且可选地采用超声辅助溶清。
[0027]
在可选实施方案中,所述方法一中的析晶方式为室温下析晶或冷却析晶。
[0028]
本发明还提供了制备前述任一项化合物(i)一水合物的方法二,包括:将化合物(i)加入良溶剂中,溶解后,再向其中加入反溶剂,析出晶体,即得。
[0029]
在可选实施方案中,所述方法二中的良溶剂选自2-丁酮、正丙醇、四氢呋喃或乙酸中的一种或多种。
[0030]
在可选实施方案中,所述方法二中的反溶剂选自水。
[0031]
在可选实施方案中,所述方法二中良溶剂的体积(ml)为化合物重量(g)的1~50倍,优选5~30倍,更优选5~20倍;所述良溶剂与反溶剂的体积比为1:(0.5~20),优选为1:(0.5~15),更优选为1:(0.5~5)。
[0032]
在可选实施方案中,所述方法二的溶解方式为室温溶解或加热溶解。
[0033]
在可选实施方案中,所述方法二中采用室温溶解的方式。
[0034]
本发明还提供了化合物(i)与有机酸的盐或共晶晶型,所述有机酸选自甲磺酸、对甲苯磺酸或草酸。
[0035]
在可选实施方案中,所述化合物(i)与有机酸的盐或共晶晶型为甲磺酸盐或共晶晶型。
[0036]
本发明提供了化合物(i)甲磺酸盐或共晶晶型b,所述晶型b以衍射角2θ表示的x-射线粉末衍射图谱,在8.61
±
0.2
°
、9.83
±
0.2
°
、10.56
±
0.2
°
、11.46
±
0.2
°
、13.82
±
0.2
°
、14.34
±
0.2
°
、18.77
±
0.2
°
、19.48
±
0.2
°
、19.72
±
0.2
°
、21.25
±
0.2
°
、25.54
±
0.2
°
、26.85
±
0.2
°
、27.62
±
0.2
°
处有衍射峰。
[0037]
在可选实施方案中,所述晶型b,以衍射角2θ表示的x-射线粉末衍射图谱,在8.61
±
0.2
°
、9.83
±
0.2
°
、10.56
±
0.2
°
、11.46
±
0.2
°
、13.82
±
0.2
°
、14.34
±
0.2
°
、18.37
±
0.2
°
、18.77
±
0.2
°
、19.48
±
0.2
°
、19.72
±
0.2
°
、20.58
±
0.2
°
、21.25
±
0.2
°
、22.00
±
0.2
°
、22.83
±
0.2
°
、23.48
±
0.2
°
、23.89
±
0.2
°
、24.55
±
0.2
°
、25.54
±
0.2
°
、26.85
±
0.2
°
、27.62
±
0.2
°
、28.73
±
0.2
°
处有衍射峰。
[0038]
在可选实施方案中,所述晶型b,以衍射角2θ表示的x-射线粉末衍射图谱,在8.61
±
0.2
°
、9.83
±
0.2
°
、10.56
±
0.2
°
、11.46
±
0.2
°
、13.82
±
0.2
°
、14.34
±
0.2
°
、16.35
±
0.2
°
、16.96
±
0.2
°
、17.25
±
0.2
°
、17.62
±
0.2
°
、17.99
±
0.2
°
、18.37
±
0.2
°
、18.77
±
0.2
°
、19.48
±
0.2
°
、19.72
±
0.2
°
、20.05
±
0.2
°
、20.58
±
0.2
°
、20.90
±
0.2
°
、21.25
±
0.2
°
、21.80
±
0.2
°
、22.00
±
0.2
°
、22.25
±
0.2
°
、22.83
±
0.2
°
、23.48
±
0.2
°
、23.89
±
0.2
°
、24.55
±
0.2
°
、24.87
±
0.2
°
、25.54
±
0.2
°
、25.90
±
0.2
°
、26.16
±
0.2
°
、26.85
±
0.2
°
、27.08
±
0.2
°
、27.62
±
0.2
°
、28.07
±
0.2
°
、28.73
±
0.2
°
、29.05
±
0.2
°
、29.46
±
0.2
°
、31.32
±
0.2
°
处有衍射峰。
[0039]
在可选实施方案中,所述晶型b,以衍射角2θ表示的x-射线粉末衍射图谱基本上如图5所示。
[0040]
在可选实施方案中,所述晶型b具有在188.76
±
5.0℃下的峰值的dsc谱图。
[0041]
在可选实施方案中,所述晶型b的dsc谱图如图6所示。
[0042]
本发明提供了化合物(i)甲磺酸盐或共晶晶型c,所述晶型c以衍射角2θ表示的x-射线粉末衍射图谱,在6.49
±
0.2
°
、8.30
±
0.2
°
、8.76
±
0.2
°
、11.47
±
0.2
°
、13.94
±
0.2
°
、15.28
±
0.2
°
、16.27
±
0.2
°
、17.59
±
0.2
°
、18.96
±
0.2
°
、19.84
±
0.2
°
、20.83
±
0.2
°
、21.08
±
0.2
°
、21.87
±
0.2
°
、22.88
±
0.2
°
、24.17
±
0.2
°
、25.03
±
0.2
°
、25.81
±
0.2
°
处有衍射峰。
[0043]
在可选实施方案中,所述晶型c,以衍射角2θ表示的x-射线粉末衍射图谱,在6.49
±
0.2
°
、8.30
±
0.2
°
、8.76
±
0.2
°
、11.47
±
0.2
°
、12.93
±
0.2
°
、13.94
±
0.2
°
、15.28
±
0.2
°
、16.27
±
0.2
°
、16.66
±
0.2
°
、16.98
±
0.2
°
、17.59
±
0.2
°
、18.16
±
0.2
°
、18.96
±
0.2
°
、19.84
±
0.2
°
、20.83
±
0.2
°
、21.08
±
0.2
°
、21.38
±
0.2
°
、21.87
±
0.2
°
、22.37
±
0.2
°
、22.88
±
0.2
°
、24.17
±
0.2
°
、25.03
±
0.2
°
、25.41
±
0.2
°
、25.81
±
0.2
°
、26.37
±
0.2
°
、27.25
±
0.2
°
、28.05
±
0.2
°
、29.01
±
0.2
°
处有衍射峰。
[0044]
在可选实施方案中,所述晶型c,以衍射角2θ表示的x-射线粉末衍射图谱,在3.27
±
0.2
°
、6.49
±
0.2
°
、8.30
±
0.2
°
、8.76
±
0.2
°
、10.40
±
0.2
°
、11.47
±
0.2
°
、12.66
±
0.2
°
、12.93
±
0.2
°
、13.94
±
0.2
°
、15.28
±
0.2
°
、16.27
±
0.2
°
、16.66
±
0.2
°
、16.98
±
0.2
°
、17.59
±
0.2
°
、18.16
±
0.2
°
、18.96
±
0.2
°
、19.44
±
0.2
°
、19.57
±
0.2
°
、19.84
±
0.2
°
、20.17
±
0.2
°
、20.40
±
0.2
°
、20.83
±
0.2
°
、21.08
±
0.2
°
、21.38
±
0.2
°
、21.87
±
0.2
°
、22.37
±
0.2
°
、22.88
±
0.2
°
、23.50
±
0.2
°
、24.17
±
0.2
°
、24.68
±
0.2
°
、25.03
±
0.2
°
、25.41
±
0.2
°
、25.81
±
0.2
°
、26.37
±
0.2
°
、27.25
±
0.2
°
、28.05
±
0.2
°
、29.01
±
0.2
°
、29.36
±
0.2
°
、30.38
±
0.2
°
、31.32
±
0.2
°
、35.15
±
0.2
°
、37.13
±
0.2
°
、39.74
±
0.2
°
处有衍射峰。
[0045]
在可选实施方案中,所述晶型c,以衍射角2θ表示的x-射线粉末衍射图谱基本上如图7所示。
[0046]
在可选实施方案中,所述晶型c具有在182.87
±
5.0℃下的峰值的dsc谱图。
[0047]
在可选实施方案中,所述晶型c的dsc谱图如图8所示。
[0048]
在可选实施方案中,所述化合物(i)与有机酸的盐或共晶晶型为对甲苯磺酸盐或共晶晶型。
[0049]
本发明提供了化合物(i)对甲苯磺酸盐或共晶晶型d,所述晶型d以衍射角2θ表示的x-射线粉末衍射图谱,在4.47
±
0.2
°
、5.99
±
0.2
°
、6.01
±
0.2
°
、8.76
±
0.2
°
、12.20
±
0.2
°
、16.51
±
0.2
°
、17.42
±
0.2
°
、21.04
±
0.2
°
、25.06
±
0.2
°
、26.57
±
0.2
°
、29.08
±
0.2
°
、38.51
±
0.2
°
处有衍射峰。
[0050]
在可选实施方案中,所述晶型d,以衍射角2θ表示的x-射线粉末衍射图谱,在4.47
±
0.2
°
、5.99
±
0.2
°
、6.01
±
0.2
°
、8.76
±
0.2
°
、12.20
±
0.2
°
、13.22
±
0.2
°
、16.51
±
0.2
°
、17.42
±
0.2
°
、17.64
±
0.2
°
、18.02
±
0.2
°
、18.36
±
0.2
°
、18.71
±
0.2
°
、21.04
±
0.2
°
、22.11
±
0.2
°
、22.93
±
0.2
°
、24.05
±
0.2
°
、24.49
±
0.2
°
、25.06
±
0.2
°
、25.79
±
0.2
°
、26.57
±
0.2
°
、28.58
±
0.2
°
、29.08
±
0.2
°
、29.48
±
0.2
°
、30.08
±
0.2
°
、31.10
±
0.2
°
、32.87
±
0.2
°
、38.51
±
0.2
°
处有衍射峰。
[0051]
在可选实施方案中,所述晶型d,以衍射角2θ表示的x-射线粉末衍射图谱基本上如图9所示。
[0052]
在可选实施方案中,所述晶型d具有在190.97
±
5.0℃下的峰值的dsc谱图。
[0053]
在可选实施方案中,所述晶型d的dsc谱图如图10所示。
[0054]
在可选实施方案中,所述化合物(i)与有机酸的盐或共晶晶型为草酸盐或共晶晶型。
[0055]
本发明提供了化合物(i)草酸盐或共晶晶型e,所述晶型e以衍射角2θ表示的x-射线粉末衍射图谱,在6.94
±
0.2
°
、9.43
±
0.2
°
、10.19
±
0.2
°
、14.00
±
0.2
°
、16.09
±
0.2
°
、16.74
±
0.2
°
、20.13
±
0.2
°
、20.50
±
0.2
°
、20.81
±
0.2
°
、21.54
±
0.2
°
、24.37
±
0.2
°
、27.40
±
0.2
°
处有衍射峰。
[0056]
在可选实施方案中,所述晶型e,以衍射角2θ表示的x-射线粉末衍射图谱,在6.94
±
0.2
°
、9.43
±
0.2
°
、10.19
±
0.2
°
、12.11
±
0.2
°
、14.00
±
0.2
°
、16.09
±
0.2
°
、16.74
±
0.2
°
、18.67
±
0.2
°
、19.35
±
0.2
°
、20.13
±
0.2
°
、20.50
±
0.2
°
、20.81
±
0.2
°
、21.54
±
0.2
°
、22.17
±
0.2
°
、23.21
±
0.2
°
、24.37
±
0.2
°
、26.45
±
0.2
°
、27.40
±
0.2
°
、29.18
±
0.2
°
、30.55
±
0.2
°
处有衍射峰。
[0057]
在可选实施方案中,所述晶型e,以衍射角2θ表示的x-射线粉末衍射图谱,在3.48
±
0.2
°
、6.94
±
0.2
°
、9.43
±
0.2
°
、10.19
±
0.2
°
、10.81
±
0.2
°
、12.11
±
0.2
°
、12.28
±
0.2
°
、12.82
±
0.2
°
、13.01
±
0.2
°
、13.33
±
0.2
°
、14.00
±
0.2
°
、14.49
±
0.2
°
、15.10
±
0.2
°
、15.38
±
0.2
°
、16.09
±
0.2
°
、16.74
±
0.2
°
、17.86
±
0.2
°
、18.32
±
0.2
°
、18.67
±
0.2
°
、18.98
±
0.2
°
、19.35
±
0.2
°
、20.13
±
0.2
°
、20.50
±
0.2
°
、20.81
±
0.2
°
、21.54
±
0.2
°
、22.17
±
0.2
°
、23.21
±
0.2
°
、24.37
±
0.2
°
、24.98
±
0.2
°
、25.98
±
0.2
°
、26.18
±
0.2
°
、26.45
±
0.2
°
、27.40
±
0.2
°
、28.85
±
0.2
°
、29.18
±
0.2
°
、29.66
±
0.2
°
、30.55
±
0.2
°
、33.16
±
0.2
°
处有衍射峰。
[0058]
在可选实施方案中,所述晶型e,以衍射角2θ表示的x-射线粉末衍射图谱基本上如图11所示。
[0059]
在可选实施方案中,所述晶型e具有在207.66
±
5.0℃下的峰值的dsc谱图。
[0060]
在可选实施方案中,所述晶型e的dsc谱图如图12所示。
[0061]
本发明还涉及一种药物组合物,其包含前述任一项所述的化合物(i)一水合物、化合物(i)的盐或共晶晶型,以及药学上可接受的辅料。
[0062]
本发明还涉及由前述任一项所述的化合物(i)一水合物、化合物(i)的盐或共晶晶型制备而成的药物组合物。
[0063]
本发明还涉及前述任一项所述的化合物(i)一水合物、化合物(i)的盐或共晶晶型在制备用于预防或治疗已知或可显示抑制rad51会产生有益效应的疾病或病症的药物的用途。
[0064]
本发明还涉及一种预防或治疗已知或可显示抑制rad51会产生有益效应的疾病或病症的方法,其包括给予所需的个体治疗有效量的前述任一项所述的化合物(i)一水合物、化合物(i)的盐或共晶晶型,或前述包含所述化合物(i)一水合物、化合物(i)的盐或共晶晶型的药物组合物。
[0065]
本发明所述的已知或可显示抑制rad51会产生有益效应的疾病或病症包括但不限于肿瘤(如淋巴瘤、乳腺癌、非小细胞肺癌、前列腺癌等)和自身免疫病(如风湿性关节炎、炎症性肠炎和系统性红斑狼疮)等。
[0066]
本发明的药物组合物中含有的化合物(i)一水合物、化合物(i)的盐或共晶晶型的治疗有效量选自0.01mg/kg到50mg/kg体重,以单独或分开剂量的形式。
[0067]
本发明的化合物(i)一水合物、化合物(i)的盐或共晶晶型或包含所述化合物(i)一水合物、化合物(i)的盐或共晶晶型的药物组合物的典型给药途径包括但不限于口服、直肠、局部、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。
[0068]
在可选的实施方案中,药物组合物是口服形式。对于口服给药,可以通过将活性化合物与本领域熟知的药学上可接受的辅料混合,来配制该药物组合物。这些辅料能使本发明的化合物被配制成片剂、丸剂、锭剂、糖衣剂、胶囊剂、液体、凝胶剂、浆剂、悬浮剂等,用于对患者的口服给药。
[0069]
可以通过常规的混合、填充或压片方法来制备固体口服组合物。例如,可通过下述方法获得:将所述的活性化合物与固体辅料混合,任选地碾磨所得的混合物,如果需要则加入其它合适的辅料,然后将该混合物加工成颗粒,得到了片剂或糖衣剂的核心。适合的辅料包括但不限于:粘合剂、稀释剂、崩解剂、润滑剂、助流剂、甜味剂或矫味剂等。
[0070]
术语定义和说明
[0071]
除非另有说明,本发明中所用的术语具有下列含义,本发明中记载的术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中的定义等,可以彼此之间任意组合和结合。一个特定的术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照本领域普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
[0072]
术语“溶剂合物”是指由溶质的一个或多个分子和溶剂的一个或多个分子形成的络合物或聚集体。溶剂合物通常具有基本上固定的溶质和溶剂的摩尔比。此术语还包括笼型化合物,包括具有水的笼型化合物。代表性的溶剂包括例如水、甲醇、乙醇、异丙醇、乙酸等。当溶剂为水时,形成的溶剂合物为水合物。
[0073]
术语“约”在本发明中用于指近似地、在
……
左右、大略地或大约。当术语“约”与数字范围结合使用时,通过扩大所陈述的数字范围的上下限值来对该范围来进行修饰。除非
另作说明,否则术语“约”在本文中用于以10%偏差的数字值修饰所陈述的值的上限和下限。
[0074]
除非另作说明,否则术语“包括(comprise)”、“含有(comprise)”或“包含(comprise)”及其英文变体例如comprises或comprising应理解为开放的、非排他性的意义,即“包括但不限于”。
[0075]
本发明中提到的“可选实施方案”或“实施方案”是指在至少一实施方案中包括与该实施方案所述的相关的具体参考要素、结构或特征。因此,在本发明中不同位置出现的短语“可选实施方案”或“实施方案”不必全部指同一实施方案。此外,具体要素、结构或特征可以任何适当的方式在一个或多个实施方案中结合。
[0076]
本发明所述室温是指20
±
5℃。
[0077]
本发明中所述的范围“m~n”表示m到n之间的任意实数组合的缩略表示,其中m和n都是实数。例如,数值范围“5~20”表示本文中已经列出了其中的5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20;“5~10”表示本文中已经列出了其中的5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10,“5~10”只是这些数值组合的缩略表示。
[0078]
本发明中所述的“x-射线粉末衍射图谱”为使用cu-kα辐射测量得到。
[0079]
本发明中所述的“x-射线粉末衍射图谱或xrpd图谱”是指根据布拉格公式2d sinθ=nλ(式中,d为晶面间距,θ为衍射角,λ为入射x射线的波长,衍射的级数n为任何正整数,一般取一级衍射峰,n=1),当x射线以掠角θ(入射角的余角,又称为布拉格角)入射到晶体或部分晶体样品的某一具有d点阵平面间距的原子面上时,就能满足布拉格方程,从而测得了这组x射线粉末衍射图。
[0080]
对于同种化合物的同种晶型,其xrpd图谱的峰位置在整体上具有相似性,相对强度误差可能较大。还应指出的是,在混合物的鉴定中,由于含量下降等因素会造成部分衍射线的缺失,此时,无需依赖高纯试样中观察到的全部衍射峰,甚至一个衍射峰也可能对给定的晶体而言是特征性的。
[0081]
本发明中所述的“2θ或2θ角度”是指衍射角,θ为布拉格角,单位为
°
或度。
[0082]
本领域技术人员认识到对于同一化合物的给定结晶形式的xrpd峰位置和/或强度的测量数据将在误差范围内变化。本发明中的2θ值涵盖了适当的误差范围,通常该误差范围是由
“±”
表示。例如,本发明中用具体角度值
±
0.2
°
表示的2θ值即代表其中的具体角度值具有
±
0.2
°
的误差浮动范围,即7.06
±
0.2
°
2θ表示2θ在6.86至7.26范围内。取决于样品制备技术、应用于仪器的校准技术、人类操作偏差等,本领域技术人员认识到对于xrpd衍射角的适当的误差范围可为
±
0.2
°
、
±
0.15
°
、
±
0.1
°
、
±
0.05
°
或更小,且峰强度允许一定的可变性。当用于描述xrpd图时,术语“基本上相同”或“基本上如
……
所示”是指包括至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的衍射角在
±
0.2
°
2θ的标准偏差范围内的衍射峰的图。
[0083]
由于本领域技术人员认识到对于同一化合物的给定结晶形式的dsc谱图的测量数据将在误差容限内变化。单峰峰值(以摄氏度表示)允许适当的误差范围。通常,误差范围是由
“±”
表示。对于同种化合物的同种晶型,在连续的分析中,热转变温度和熔点误差典型地在
±
5.0℃之内。例如,“137.09
±
5.0℃”的峰值表示在132.09℃至142.09℃范围内。取决于
样品制备技术、应用于仪器的校准技术、人类操作偏差等,本领域技术人员认识到对于单峰峰值的适当的误差范围可为
±
5.0、
±
4.0、
±
3.0、
±
2.0或更小。
[0084]
本发明中所述干燥温度一般为20℃~100℃,优选25℃-70℃,更优选40℃~60℃,可以常压干燥,也可以减压干燥。优选地,干燥在减压下干燥。
[0085]
对于本领域技术人员而言,由于晶体缺陷、测量误差等因素,本发明化合物与酸分子、溶剂合物中的溶剂分子的摩尔比测定存在一定程度的误差,一般而言,
±
10%均属于合理误差范围内。随其所用之处的上下文而有一定程度的误差变化,该误差变化不超过
±
10%,优选
±
5%。
[0086]
术语“药学上可接受的辅料”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的那些辅料。合适的辅料是本领域技术人员熟知的,例如碳水化合物、蜡、水溶性和/或水可膨胀的聚合物、亲水性或疏水性材料、明胶、油、溶剂、水等。
[0087]
本发明的盐型和/或晶型也可以是同位素标记的。本发明还包括与本文中记载的那些相同的,但一个或多个原子被原子量或质量数不同于自然中通常发现的原子量或质量数的原子置换的同位素标记的本发明化合物。可结合到本发明化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,诸如分别为2h、3h、
11
c、
13
c、
14
c、
13
n、
15
n、
15
o、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
123
i、
125
i和
36
cl等。
[0088]
某些同位素标记的本发明化合物(例如用3h及
14
c标记的那些)可用于化合物和/或底物组织分布分析中。氚化(即3h)和碳-14(即
14
c)同位素对于由于它们易于制备和可检测性是尤其优选的。正电子发射同位素,诸如
15
o、
13
n、
11
c和
18
f可用于正电子发射断层扫描(pet)研究以测定底物占有率。通常可以通过与公开于下文的方案和/或实施例中的那些类似的下列程序,通过同位素标记试剂取代未经同位素标记的试剂来制备同位素标记的本发明化合物。
[0089]
此外,用较重同位素(诸如氘(即2h))取代可以提供某些由更高的代谢稳定性产生的治疗优点(例如增加的体内半衰期或降低的剂量需求),并且因此在某些情形下可能是优选的,其中氘取代可以是部分或完全的,部分氘取代是指至少一个氢被氘取代。
[0090]
术语“个体”是哺乳动物。在部分实施方案中,所述个体是小鼠。在部分实施方案中,所述个体是人。
[0091]
术语“治疗”一般是指获得需要的药理和/或生理效应。该效应部分或完全稳定或治愈疾病和/或由于疾病产生的副作用,可以是治疗性的。本发明中的“治疗”涵盖了对患者疾病的任何治疗,包括:(a)抑制疾病的症状,即阻止其发展;或(b)缓解疾病的症状,即导致疾病或症状退化。
[0092]
术语“有效量”意指(i)治疗或预防特定疾病、病况或障碍,(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状,或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的本发明化合物的用量。构成“治疗有效量”的本发明化合物的量取决于该化合物、疾病状态及其严重性、给药方式以及待被治疗的哺乳动物的年龄而改变,但可例行性地由本领域技术人员根据其自身的知识及本公开内容而确定。
[0093]
术语“施用”表示使用本领域技术人员已知的多种方法和递送系统中的任一种,向主体物理引入包含治疗剂的组合物。
[0094]
本发明实验所用仪器的测试条件:
[0095]
1、单晶x-射线结晶学测量
[0096]
(1)设备名称:单晶衍射仪
[0097]
检测器型号:bruker d8 advance
[0098]
光源:ga kα
[0099]
波长:1.34139
[0100]
(2)设备名称:偏振光显微镜
[0101]
仪器型号:奥林巴斯bx53
[0102]
光源:led
[0103]
目镜倍数:10倍
[0104]
2、x-射线粉末衍射谱(x-ray powder diffraction,xrpd)
[0105]
仪器型号:bruker d8 focus
[0106]
射线:cu kα,kα11.54060;kα21.54439
[0107]
kα1/kα2:2
[0108]
狭缝(
°
):2.5
[0109]
扫描方式:θ/2θ,扫描范围:3-40
°
[0110]
停留时间(秒):0.12
[0111]
扫描步长(
°
2θ):0.01
[0112]
电压:40kv,电流:40ma
[0113]
3、差示扫描量热仪(differential scanning calorimeter,dsc)
[0114]
仪器型号:ta dsc2500
[0115]
吹扫气:氮气
[0116]
样品盘:铝盘,非密封压盖
[0117]
方法:线性升温
[0118]
升温速率:10℃/min
[0119]
温度范围:30℃~设置终点温度
[0120]
4、热重分析仪(thermogravimetric analysis,tga)
[0121]
仪器型号:ta tga55
[0122]
吹扫气:氮气
[0123]
样品盘:铂金,敞口
[0124]
方法:线性升温
[0125]
升温速率:10℃/min
[0126]
温度范围:30℃~设置终点温度
[0127]
5、动态水分吸附仪(dynamic vapour sorption,dvs)
[0128]
检测采用dvs intrinsic。
[0129]
本发明提供的化合物(i)一水合物、化合物(i)的盐或共晶晶型纯度高、稳定性好,同时其还具有制备方法简便、结晶条件温和、结晶度高、稳定性好和不易吸湿等优点,适合制备成为所期望的药物组合物。
[0130]
本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术
上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
[0131]
本发明具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本发明的化学变化及其所需的试剂和物料。为了获得本发明的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
附图说明
[0132]
图1为化合物(i)一水合物晶型a的xrpd图谱;
[0133]
图2为化合物(i)一水合物晶型a的dsc图谱;
[0134]
图3为化合物(i)一水合物晶型a的tga图谱;
[0135]
图4为化合物(i)一水合物晶型a的单晶的x射线单晶衍射图谱;
[0136]
图5为化合物(i)甲磺酸盐或共晶晶型b的xrpd图谱;
[0137]
图6为化合物(i)甲磺酸盐或共晶晶型b的dsc图谱;
[0138]
图7为化合物(i)甲磺酸盐或共晶晶型c的xrpd图谱;
[0139]
图8为化合物(i)甲磺酸盐或共晶晶型c的dsc图谱;
[0140]
图9为化合物(i)对甲苯磺酸盐或共晶晶型d的xrpd图谱;
[0141]
图10为化合物(i)对甲苯磺酸盐或共晶晶型d的dsc图谱;
[0142]
图11为化合物(i)草酸盐或共晶晶型e的xrpd图谱;
[0143]
图12为化合物(i)草酸盐或共晶晶型e的dsc图谱。
具体实施方式
[0144]
以下结合实施例或试验例更详细地解释本发明,本发明中的实施例或试验例仅用于说明本发明的技术方案,并非限定本发明的实质和范围。
[0145]
化合物的结构是通过核磁共振(nmr)和/或质谱(ms)来确定的。nmr位移(δ)以10-6
(ppm)的单位给出。nmr的测定是用bruker av-400型核磁共振仪,测定溶剂为氘代二甲基亚砜(dmso-d6)等,内标为四甲基硅烷(tms)。
[0146]
实施例中的反应进程的监测采用薄层色谱法(tlc),反应所使用的展开剂、纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂体系包括:a:二氯甲烷/甲醇体系,b:正己烷/乙酸乙酯体系,c:石油醚/乙酸乙酯体系,溶剂的体积比根据化合物的极性不同而进行调节,也可以加入少量的三乙胺或醋酸等碱性或酸性试剂进行调节。
[0147]
本发明所用试剂可通过商业途径获得。本发明中使用的所有溶剂均是市售的,无需进一步纯化即可使用。
[0148]
除非另作说明,混合溶剂表示的比例是体积混合比例。
[0149]
除非另作说明,否则%是指质量百分比wt%。
[0150]
化合物经手工或软件命名,市售化合物采用供应商目录名称。
[0151]“ic
50”指半数抑制浓度,指达到最大抑制效果一半时的浓度;dmf:n,n-二甲基甲酰胺;boc2o:二碳酸二叔丁酯;meoh:甲醇;nbs:n-溴代丁二酰亚胺;dcm:二氯甲烷;mcpba:间氯过氧苯甲酸;b2pin2:双联频哪醇硼酸酯;pd(amphos)cl2:二氯双[二叔丁基-(4-二甲基氨基苯基)膦]钯(ii);koac:醋酸钾;thf:四氢呋喃;pd(dppf)cl2:[1,1-双(二苯基膦)二茂铁]二氯化钯(ii);tfa:三氟乙酸;tbuono:亚硝酸叔丁酯;mecn:乙腈;brettephos pd g3:
甲烷磺酸(2-二环己基膦)-3,6-二甲氧基-2,4,6-三异丙基-1,1-联苯)(2-氨基-1,1-联苯-2-基)钯(ii);tsoh:对甲苯磺酸。
[0152]
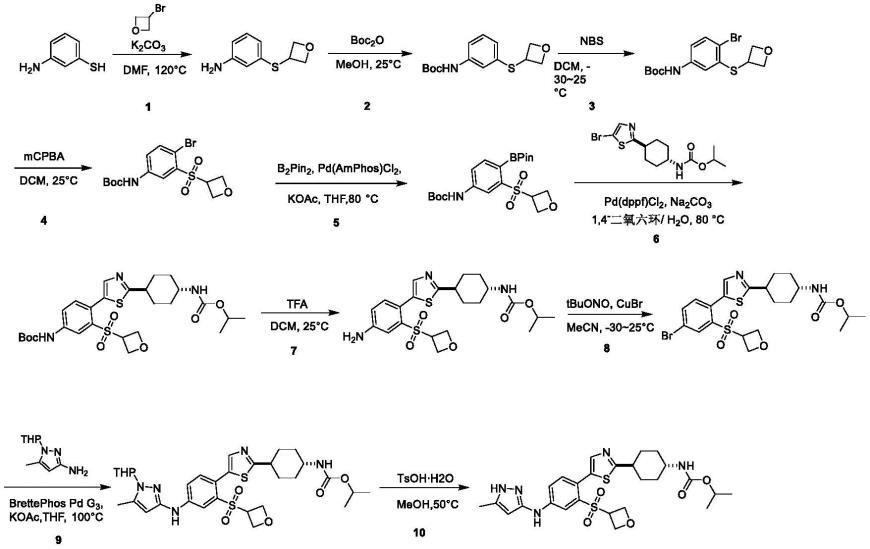
实施例1:反式-n-[4-[5-[4-[(5-甲基-1h-吡唑-3-基)氨基]-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(化合物(i))的合成
[0153][0154]
合成方法:
[0155][0156]
步骤1:3-(氧杂环丁-3-基硫烷基)苯胺的合成
[0157]
将3-氨基苯硫酚(1g,7.99mmol)溶于dmf(20ml)中,加入碳酸钾(1.10g,7.99mmol)和3-溴氧杂环丁烷(1.42g,10.4mmol)。反应液于120℃搅拌反应24小时。lcms检测反应完毕。将反应液减压浓缩至干,然后柱层析纯化(二氧化硅,石油醚:乙酸乙酯=1:1)得到标题化合物(400mg)。
[0158]
ms m/z(esi):182.1[m+h]
+
;
[0159]
步骤2:n-(3-氧杂环丁-3-基硫烷基苯基)氨基甲酸叔丁酯的合成
[0160]
将3-(氧杂环丁-3-基硫烷基)苯胺(400mg,2.21mmol)溶于甲醇(5ml)中,加入boc2o(4.82g,22.1mmol,5.07ml),反应液于25℃搅拌反应16小时。lcms检测反应完毕。将氨水(20ml)加入到反应液中,反应液于0℃搅拌反应2小时。将二氯甲烷(20ml)加入反应液萃取3次,有机相减压浓缩至干,然后柱层析纯化(二氧化硅,石油醚:乙酸乙酯=20:1)得到标题化合物(400mg)。
[0161]
ms m/z(esi):226.0[m+h-t-bu]
+
;
[0162]
步骤3:n-[4-溴-3-(氧杂环丁-3-基硫烷基)苯基]氨基甲酸叔丁酯的合成
[0163]
将n-(3-氧杂环丁-3-基硫烷基苯基)氨基甲酸叔丁酯(350mg,1.24mmol)溶于二氯甲烷(5ml)中,然后在-30℃下将溶于二氯甲烷(5ml)的nbs(243.54mg,1.37mmol)慢慢滴入反应液。反应液25℃搅拌反应16小时。lcms检测反应完毕。反应液减压浓缩至干,经柱层析纯化(二氧化硅,石油醚:乙酸乙酯=10:1)得到标题化合物(250mg)。
[0164]
ms m/z(esi):304.0,306.0[m+h-t-bu]
+
;
[0165]1h nmr(400mhz,dmso-d6)δ=9.53(s,1h),7.48(d,j=8.8hz,1h),7.30(dd,j=2.3,8.5hz,1h),7.05(d,j=2.0hz,1h),5.09(t,j=6.7hz,2h),4.57-4.45(m,3h),1.48(s,9h).
[0166]
步骤4:n-[4-溴-3-(氧杂环丁-3-基磺酰基)苯基]氨基甲酸叔丁酯的合成
[0167]
将n-[4-溴-3-(氧杂环丁-3-基硫烷基)苯基]氨基甲酸叔丁酯(250mg,694μmol)溶于二氯甲烷(5ml)中,加入mcpba(479mg,2.78mmol)。反应液25℃搅拌反应16小时。lcms检测反应完毕。减压浓缩至干,加入饱和碳酸钠(30ml)和二氯甲烷(30ml*3)进行萃取,有机相用无水硫酸钠进行干燥,过滤,滤液减压浓缩至干,然后薄层色谱纯化(二氧化硅,石油醚:乙酸乙酯=3:1)得到标题化合物(150mg)。
[0168]
ms m/z(esi):336.0,338.0[m+h-t-bu]
+
;
[0169]
步骤5:n-[3-(氧杂环丁-3-基磺酰基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基]氨基甲酸叔丁酯的合成
[0170]
将n-[4-溴-3-(氧杂环丁-3-基磺酰基)苯基]氨基甲酸叔丁酯(150mg,382μmol)和b2pin2(388mg,1.53mmol)溶于四氢呋喃(2ml)中,在氮气保护下加入pd(amphos)cl2(27.1mg,38.2μmol)和乙酸钾(75.1mg,765μmol)。反应液80℃搅拌反应16小时。lcms检测反应完毕。反应液减压浓缩至干,经薄层色谱纯化(二氧化硅,石油醚:乙酸乙酯=3:1)得到标题化合物(130mg)。
[0171]
ms m/z(esi):438.1[m+h]
+
;
[0172]
步骤6:反式-n-[4-[5-[4-(叔丁氧基羰基氨基)-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯的合成
[0173]
将n-[3-(氧杂环丁-3-基磺酰基)-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基]氨基甲酸叔丁酯(127mg,288μmol)和反式-n-[4-(5-溴噻唑-2-基)环己基]氨基甲酸酯(100mg,288μmol)溶于水(0.5ml)和二氧六环(5ml)中,然后在通氮气条件下加入pd(dppf)cl2(23.5mg,28.8μmol)和碳酸钠(61.1mg,576μmol)。反应液80℃搅拌反应16小时。lcms检测反应完毕。反应液减压浓缩至干,经薄层色谱纯化(二氧化硅,石油醚:四氢呋喃=3:1)得到标题化合物(80mg)。
[0174]
ms m/z(esi):580.2[m+h]
+
;
[0175]
步骤7:反式-n-[4-[5-[4-氨基-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯的合成
[0176]
将反式-n-[4-[5-[4-(叔丁氧基羰基氨基)-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(80mg)溶于二氯甲烷(4ml)中,加入三氟乙酸(616mg,5.40mmol,400μl)。反应液25℃搅拌反应3小时。lcms检测反应完毕。减压浓缩至干。加入饱和碳酸钠5ml,往反应液中加入二氯甲烷(3ml*3),有机相用无水硫酸钠进行干燥,过滤,滤液减压浓缩至干,得到标题化合物(60.0mg)。
[0177]
ms m/z(esi):480.2[m+h]
+
;
[0178]
步骤8:反式-n-[4-[5-[4-溴-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯的合成
[0179]
将反式-n-[4-[5-[4-氨基-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(50mg,104μmol)溶于乙腈(2ml)中,在-30℃加入亚硝酸叔丁酯(32.3mg,313μmol,37μl),反应液25℃搅拌反应1小时。将溴化亚铜(37.39mg,260.63μmol)在-30℃加入到反应液,反应液25℃搅拌反应15小时。lcms检测反应完毕。减压浓缩至干。加入饱和氯化铵50ml,往反应液中加入二氯甲烷(30ml*3),有机相用无水硫酸钠干燥,过滤,滤液减压浓缩至干,经薄层色谱纯化(二氧化硅,石油醚:四氢呋喃=2:1)得到标题化合物(30.0mg)。
[0180]
ms m/z(esi):543.1,545.1[m+h]
+
;
[0181]
步骤9:反式-n-[4-[5-[4-[(5-甲基-1-四氢吡喃-2-基-吡唑-3-基)氨基]-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]-环己基]氨基甲酸异丙酯的合成
[0182]
将反式-n-[4-[5-[4-溴-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(25.0mg,46.0μmol)和5-甲基-1-四氢吡喃-2-基-吡唑-3-胺(9.17mg,50.6μmol)溶于四氢呋喃(2ml)中,加入brettephos pd g3(4.17mg,4.60μmol)和乙酸钾(9.03mg,92.0μmol)。反应液于100℃搅拌反应2小时。lcms检测反应完毕。往反应液中加入乙酸乙酯(3ml*3)和5ml水,有机相用无水硫酸钠进行干燥,过滤,滤液减压浓缩至干,然后经薄层色谱纯化(二氧化硅,石油醚:四氢呋喃=2:1)得到标题化合物(25.0mg)。
[0183]
ms m/z(esi):644.4[m+h]
+
;
[0184]
步骤10:反式-n-[4-[5-[4-[(5-甲基-1h-吡唑-3-基)氨基]-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯的合成
[0185]
将反式-n-[4-[5-[4-[(5-甲基-1-四氢吡喃-2-基-吡唑-3-基)氨基]-2-(氧杂环丁-3-基磺酰基)苯基]噻唑-2-基]环己基]氨基甲酸异丙酯(25.0mg,38.8μmol)溶于甲醇(1ml)中,加入一水合对甲苯磺酸(33.4mg,194μmol)。反应液50℃搅拌反应1小时。lcms检测反应完毕。反应液减压浓缩至干,往反应液中加入二氯甲烷(3ml*3)和5ml饱和碳酸氢钠溶液,有机相用无水硫酸钠进行干燥,过滤,滤液减压浓缩至干,经薄层色谱纯化(二氧化硅,二氯甲烷/甲醇=15/1)得到标题化合物(2.36mg)。
[0186]
ms m/z(esi):560.0[m+h]
+
;
[0187]1h nmr(400mhz,dmso-d6)δ=11.92(br s,1h),9.14(s,1h),8.19(br s,1h),7.63(d,j=5.4hz,2h),7.33(d,j=8.3hz,1h),7.04(br d,j=8.0hz,1h),5.65(s,1h),4.78-4.70(m,1h),4.67-4.60(m,2h),4.55-4.48(m,3h),3.33(br s,1h),2.92(s,1h),2.21(s,3h),2.13(br d,j=11.8hz,2h),1.92(br d,j=10.8hz,2h),1.56(br dd,j=2.3,12.5hz,2h),1.40-1.28(m,2h),1.17(d,j=6.3hz,6h).
[0188]
实施例2:化合物(i)一水合物晶型a的制备
[0189]
将化合物(i)(120mg)加入10ml圆底烧瓶,加入95%乙醇(1ml),搅拌并加热至71℃,溶清后保温搅拌10min,然后停止加热自然降温,室温搅拌过夜,析出固体,抽滤,滤饼室温真空干燥得白色固体(96mg,hplc纯度99.57%)。
[0190]
该结晶样品的xrpd图谱见图1,其dsc图谱见图2,tga图谱见图3,dsc峰值在137.09℃附近,其xrpd衍射峰位置如下表1所示。
[0191]
表1
[0192][0193]
[0194][0195]
可通过如下方法制备化合物(i)晶型a的单晶:将化合物(i)(10.0mg)放入5ml塑料离心管中,加入乙腈:水=1:1的混合溶液3.2ml,超声使固体溶清。溶液经0.22微米微孔滤膜过滤至5ml离心管中,离心管口用封口膜封口,用针头在瓶口处扎6个小孔,室温放置3天,析出晶体,制得。经x-粉末衍射检测确定其为前述晶型a。
[0196]
对所得单晶进行单晶x-射线衍射数据收集并解析其单晶结构。其单晶结构数据如表2所示。单晶的x射线单晶衍射图谱如图4所示。单晶结构解析确定所述晶型a为一水合物晶型,且确定了化合物(i)的绝对构型。
[0197]
表2单晶结构数据
[0198]
[0199][0200]
实施例3:化合物(i)一水合物晶型a的制备
[0201]
将化合物(i)(120mg)加入80%乙醇水溶液(1ml),搅拌并加热至71.2℃,溶清后缓慢降温至50℃有固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0202]
实施例4:化合物(i)一水合物晶型a的制备
[0203]
将化合物(i)(50mg)加入1,4-二氧六环水(体积比1:1)溶液(0.6ml)中,搅拌并加热至75℃,溶清后缓慢降温至65℃有固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0204]
实施例5:化合物(i)一水合物晶型a的制备
[0205]
将化合物(i)(10mg)加入2-丁酮(200μl)中,搅拌溶解后再向其中加入水(100μl),继续搅拌至固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0206]
实施例6:化合物(i)一水合物晶型a的制备
[0207]
将化合物(i)(10mg)加入正丙醇(400μl)中,搅拌溶解后再向其中加入水(300μl),继续搅拌至固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0208]
实施例7:化合物(i)一水合物晶型a的制备
[0209]
将化合物(i)(10mg)加入四氢呋喃(50μl)中,搅拌溶解后再向其中加入水(100μl),继续搅拌至固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0210]
实施例8:化合物(i)一水合物晶型a的制备
[0211]
将化合物(i)(10mg)加入乙酸(100μl)中,搅拌溶解后再向其中加入水(100μl),继续搅拌至固体析出,抽滤,滤饼室温真空干燥即得,经x-粉末衍射检测为晶型a。
[0212]
实施例9:化合物(i)甲磺酸盐或共晶晶型b的制备
[0213]
将化合物(i)(20mg)加入2-丁酮(400μl)中,室温搅拌溶清,加入甲磺酸乙醇溶液(通过将34.7mg甲磺酸溶解于200μl乙醇制得)(20μl),室温搅拌60h,有固体析出,抽滤后滤饼于室温下真空干燥,得白色粉末状固体(hplc纯度99.44%)。
[0214]
该结晶样品的xrpd图谱见图5,其dsc图谱见图6,dsc峰值在188.76℃附近,其xrpd衍射峰位置如以下表3所示。
[0215]
表3
[0216]
[0217][0218]
实施例10:化合物(i)甲磺酸盐或共晶晶型c的制备
[0219]
将化合物(i)(20mg)加入乙腈(1200μl)中,室温下搅拌溶清,然后加入甲磺酸乙醇
溶液(通过将34.7mg甲磺酸溶解于200μl乙醇制得)(20μl),室温搅拌60h,有固体析出,抽滤后滤饼于室温下真空干燥,得白色粉末状固体(hplc纯度99.74%)。
[0220]1h nmr(400m hz,dmso-d6)δ9.32(s,1h),8.14(br s,1h),7.68-7.61(m,2h),7.36(d,j=8hz,1h),7.05(br d,j=8hz,1h),5.78(s,1h),4.79-4.73(m,1h),4.66-4.63(m,2h),4.56-4.51(m,3h),3.30-2.92(m,1h),2.42(s,3h),2.24(s,3h),2.13(br d,j=12hz,2h),1.92(br d,j=12hz,2h),1.60-1.54(m,2h),1.40-1.31(m,2h),1.17(d,j=6.3hz,6h).
[0221]
该结晶样品的xrpd图谱见图7,其dsc图谱见图8,dsc峰值在182.87℃附近,其xrpd衍射峰位置如以下表4所示。
[0222]
表4
[0223]
[0224][0225]
实施例11:化合物(i)对甲苯磺酸盐或共晶晶型d的制备
[0226]
将化合物(i)(20mg)加入乙酸乙酯(1500μl)中,室温下搅拌溶清,然后加入对甲苯磺酸乙醇溶液(通过将76.3mg对甲苯磺酸加入200μl乙醇超声溶解制得)(20μl),室温搅拌过夜,有固体析出,抽滤后滤饼于室温下真空干燥,得白色粉末状固体。
[0227]
该结晶样品的xrpd图谱见图9,其dsc图谱见图10,dsc峰值在190.97℃附近,其xrpd衍射峰位置如以下表5所示。
[0228]
表5
[0229][0230][0231]
实施例12:化合物(i)草酸盐或共晶晶型e的制备
[0232]
将化合物(i)(20mg)加入乙腈(1200μl)中,室温下搅拌溶清,然后加入草酸乙醇溶液(通过将22.7mg草酸加入200μl乙醇超声溶解制得)(20μl),室温搅拌过夜,有固体析出,抽滤后滤饼于室温下真空干燥,得白色粉末状固体。
[0233]
该结晶样品的xrpd图谱见图11,其dsc图谱见图12,dsc峰值在207.66℃附近,其xrpd衍射峰位置如以下表6所示。
[0234]
表6
[0235]
[0236][0237]
测试试验例1:人淋巴瘤细胞daudi增殖抑制试验
[0238]
试验原理简介:将待测rad51抑制剂与癌细胞共孵育一段时间后,采用基于细胞内atp含量定量检测的细胞增殖计数方法来测量待测化合物对细胞增殖的影响。
[0239]
材料与细胞:daudi细胞购于atcc;胎牛血清、1640培养基和青霉素-链霉素购于gibco公司(美国),96孔板购于康宁公司(美国),cell-titer glo试剂购于普洛麦格公司(美国)。
[0240]
细胞培养:daudi细胞用含10%胎牛血清+1%青霉素-链霉素的1640培养液,于37℃、5%co2条件下培养。处于对数生长期细胞方可用于实验。
[0241]
细胞增殖活性检测:利用cell-titer glo试剂检测化合物对daudi细胞株增殖的抑制活性。调整细胞浓度接种96孔板,置于37℃、5%co2条件下培养24小时。将化合物粉末用100%dmso溶解至10mm溶液,取10μl化合物溶液转移至含有20μl dmso溶液96孔化合物板中进行3倍稀释,连续稀释10个梯度。然后从相应孔中取2μl化合物对应加到含有78μl完全培养基的96孔中间化合物稀释板中,混匀,1000转/分离心1分钟。最后从96孔中间化合物稀释板对应孔中吸取、转移10μl化合物溶液至含有90μl完全培养基的细胞培养板相应孔中,dmso终浓度为0.25%。实验另设阴性对照组和阳性对照组,分别作为bottom和top。阴性对照组未种细胞,仅加入同体积培养基,其他操作与实验组一致;阳性对照组正常种细胞,但
不加测试化合物,仅加同体积的dmso,其他操作与实验组一致。置于37℃、5%co2条件下继续培养3天。加入cell-titer glo试剂,检测细胞活性。
[0242]
数据分析:
[0243]
计算化合物抑制百分数(%compound inhibition)并拟合化合物ic
50
;
[0244]
化合物抑制百分数(%compound inhibition)=1-100%*(signal-bottom)/(top-bottom)
[0245]
signal指实验组的信号值,bottom指阴性对照组的平均信号值,top指阳性对照组的平均信号值。
[0246]
实验结果:
[0247]
待测化合物相应的抗daudi细胞增殖活性具体见表7。
[0248]
表7化合物(i)对daudi细胞的增殖抑制活性
[0249]
化合物daudi抗增殖活性ic
50
(μm)实施例10.004
[0250]
测试试验例2:人胚肺细胞wi-38增殖抑制试验
[0251]
试验原理简介:将待测rad51抑制剂与人胚肺细胞共孵育一段时间后,采用基于细胞内atp含量定量检测的细胞增殖计数方法来测量待测化合物对细胞增殖的影响。
[0252]
材料与细胞:wi-38细胞购于atcc;胎牛血清、1640培养基和青霉素-链霉素购于gibco公司(美国),96孔板购于康宁公司(美国),cell-titer glo试剂购于普洛麦格公司(美国)。
[0253]
细胞培养:wi-38细胞用含10%胎牛血清+1%青霉素-链霉素的emem培养液,于37℃、5%co2条件下培养。处于对数生长期细胞方可用于实验。
[0254]
细胞增殖活性检测:利用cell-titer glo试剂检测化合物对wi-38细胞株增殖的抑制活性。调整细胞浓度接种96孔板,置于37℃、5%co2条件下培养24小时。将化合物粉末用100%dmso溶解至10mm溶液,取10μl化合物溶液转移至含有20μl dmso溶液96孔化合物板中进行3倍稀释,连续稀释10个梯度。然后从相应孔中取2μl化合物对应加到含有78μl完全培养基的96孔中间化合物稀释板中,混匀,1000转/分离心1分钟。最后从96孔中间化合物稀释板对应孔中吸取、转移10μl化合物溶液至含有90μl完全培养基的细胞培养板相应孔中,dmso终浓度为0.25%。实验另设阴性对照组和阳性对照组,分别作为bottom和top。阴性对照组未种细胞,仅加入同体积培养基,其他操作与实验组一致;阳性对照组正常种细胞,但不加测试化合物,仅加同体积的dmso,其他操作与实验组一致。置于37℃、5%co2条件下继续培养3天。加入cell-titer glo试剂,检测细胞活性。
[0255]
数据分析:
[0256]
计算化合物抑制百分数(%compound inhibition)并拟合化合物ic
50
;
[0257]
化合物抑制百分数(%compound inhibition)=1-100%*(signal-bottom)/(top-bottom)
[0258]
signal指实验组的信号值,bottom指阴性对照组的平均信号值,top指阳性对照组的平均信号值。
[0259]
实验结果:
[0260]
待测化合物相应的抗wi-38细胞增殖活性具体见表8。
[0261]
表8化合物(i)对wi-38细胞的增殖抑制活性
[0262]
化合物wi-38抗增殖活性ic
50
(μm)实施例119.5
[0263]
在测试试验例1和测试试验例2条件下,化合物(i)对daudi细胞展现出了较强的增殖抑制活性,对wi-38细胞展现出了较弱的增殖抑制活性,并且对daudi细胞和wi-38细胞的增殖抑制活性还表现出一定的选择性。
[0264]
测试试验例3:化合物在肝微粒体中的代谢稳定性试验
[0265]
一、试验材料及仪器
[0266]
1.肝微粒体来源:人肝微粒体(corning 452117),cd-1小鼠肝微粒体(xenotech m1000)
[0267]
2.na2hpo4(天津市光复精细化工研究所20180130)
[0268]
3.kh2po4(天津市光复精细化工研究所20180920)
[0269]
4.mgcl2(天津市光复精细化工研究所20191216)
[0270]
5.nadph(solarbio 1216c022)
[0271]
6.阳性对照化合物维拉帕米(sigma mkbv4993v)
[0272]
7.ab sciex triple quad 4000液质联用仪
[0273]
二、试验步骤
[0274]
1.100mm磷酸缓冲液(pbs)的配制:称取7.098g na2hpo4,加入500ml纯水超声溶解,作为溶液a。称取3.400g kh2po4,加入250ml纯水超声溶解,作为溶液b。将a溶液放置在搅拌器上缓慢加入b溶液直到ph值达到7.4配制成100mm的pbs缓冲液。
[0275]
2.反应体系的配制
[0276]
按以下表9配制反应体系:
[0277]
表9反应体系配制信息
[0278][0279]
3.将反应体系置于37℃水浴中预孵育10分钟。向反应体系中加入40μl 10mm nadph溶液(nadph由100mm的磷酸缓冲液溶解),nadph的最终浓度为1mm。用40μl磷酸缓冲液代替nadph溶液作为阴性对照。阴性对照的作用是排除化合物自身化学稳定性的影响。
[0280]
4.在反应体系中加入4μl 100μm(溶媒为dmso)的本发明化合物和阳性对照化合物维拉帕米启动反应,化合物的最终浓度为1μm。
[0281]
5.在0.5、15、30、45和60分钟,涡旋振荡器充分混匀后,分别取出50μl孵育样品,用4倍的含有内标的冰乙腈终止反应。样品在3220g转速下离心45分钟。离心结束后转移90μl上清液到进样板,加入90μl超纯水混匀,用于lc-ms/ms分析。
[0282]
所有的数据均通过microsoft excel软件进行计算。通过提取离子图谱检测峰面积。通过对母药消除百分比的自然对数与时间进行线性拟合,检测母药的体外半衰期(t
1/2
)。
[0283]
体外半衰期(t
1/2
)通过斜率计算:
[0284]
in vitro t
1/2
=0.693/k
[0285]
经上述公式计算得到的t
1/2
值见表10。
[0286]
表10化合物在肝微粒体中的半衰期
[0287][0288]
测试试验例4:化合物的血浆蛋白结合率测定
[0289]
一、试验材料及仪器
[0290]
1.cd-1小鼠血浆(bioivt)
[0291]
2.na2hpo4(sigma s5136-500g)
[0292]
3.nah2po4(sigma s3139-500g)
[0293]
4.nacl(sigma s5886-ikg)
[0294]
5.96孔平衡透析板(htdialysis llc,gales ferry,ct,htd96b),平衡透析膜(mwco12-14k,#1101)
[0295]
6.阳性对照化合物华法林
[0296]
7.abi qtrap 5500液质联用仪
[0297]
二、试验步骤
[0298]
1.浓度为100mm磷酸钠盐和150mm nacl的缓冲液的配制:用超纯水配制浓度为14.2g/l na2hpo4和8.77g/l nacl的碱性溶液,用超纯水配制浓度为12.0g/l nah2po4和8.77g/lnacl的酸性溶液。用酸性溶液滴定碱性溶液至ph值为7.4配制成浓度为100mm磷酸钠盐和150mm nacl的缓冲液。
[0299]
2.透析膜的准备:将透析膜浸泡在超纯水中60分钟以便将膜分离成两片,然后用20%乙醇浸泡20分钟,最后用透析所用缓冲液浸泡20分钟。
[0300]
3.血浆的准备:将冷冻的血浆迅速在室温下解冻,然后将血浆在4℃、3220g下离心10分钟去除凝块,并将上清收集到新的离心管中。测定和记录血浆的ph值,使用ph值为7-8的血浆。
[0301]
4.含化合物的血浆样品的配制:用dmso稀释10mm的本发明化合物或阳性对照化合物的储备液得到200μm的工作液。597μl小鼠血浆中加入3μl 200μm的化合物工作液得到终浓度为1μm的血浆样品。
[0302]
5.平衡透析步骤:按照操作说明将透析装置组装起来。在透析膜的一侧加入120μl含1μm化合物的血浆样品,另一侧加入等体积的透析液(磷酸盐缓冲液)。试验设双样本。封上透析板,放入孵育装置,在37℃、5%co2及约100rpm转速下孵育6小时。孵育结束后,去除封膜,从每个孔的缓冲液和血浆侧吸取50μl到新板的不同孔中。在磷酸盐缓冲液样品中加入50μl空白血浆,在血浆样品中加入等体积的空白磷酸盐缓冲液,然后加入300μl含内标的乙腈沉淀蛋白。涡旋5分钟,在4℃、3220g下离心30分钟。取100μl上清液至进样板,加入100μl超纯水混匀,用于lc-ms/ms分析。
[0303]
测定化合物在缓冲液侧和血浆侧的峰面积。计算化合物的血浆蛋白结合率公式如下:
[0304]
%游离率=(缓冲液侧的化合物峰面积与内标峰面积比值/血浆侧的化合物峰面积与内标峰面积比值)*100%
[0305]
%结合率=100%-%游离率
[0306]
所有的数据均通过microsoft excel软件进行计算。计算得到的本发明化合物的血浆蛋白结合率值见表11。
[0307]
表11化合物(i)在cd-1小鼠血浆中的蛋白结合率值
[0308]
化合物%结合率实施例198.8%
[0309]
测试试验例5:药代动力学评价
[0310]
实验材料:
[0311]
cb17-scid小鼠购自北京维通利华实验动物技术有限公司;
[0312]
dmso、hp-β-cd(羟丙基-β-环糊精)、peg400(聚乙二醇400)、vitamin e tpgs(d-α-生育酚聚乙二醇1000琥珀酸酯)购自sigma;
[0313]
乙腈购自merck(usa)。
[0314]
实验方法:
[0315]
雌性cb17-scid小鼠6只(20-30g,4-6周),随机分成2组,每组3只。第1组尾静脉注射给予化合物,溶媒5%二甲基亚砜和95%的羟丙基-β-环糊精(10%,w/v)水溶液,第2组口服给予相应剂量的化合物,溶媒30%聚乙二醇400和70%的d-α-生育酚聚乙二醇1000琥珀酸(10%,w/v)水溶液。动物实验前正常喂食喂水。每组小鼠于给药前及给药后0.083(仅静脉注射组)、0.25、0.5、1、2、4、6、8和24h进行静脉采血。收集的全血样品置于k2edta抗凝管中,离心5min后(4000rpm,4℃)取血浆待测。
[0316]
取小鼠血浆样品10μl,加入150μl乙腈溶剂(其中含内标化合物)沉淀蛋白,涡旋0.5min后,离心(4700rpm,4℃)15min,上清液用含0.05%(v/v)fa的水稀释2倍,于lc-ms/ms系统(ab sciex triple quad 6500+)进行定量检测。在测定样品浓度时随行cb17-scid小鼠血浆标准曲线和质控样品。对10x稀释样品,取2μl样品加入18μl的空白血浆,涡旋0.5min后,加入300μl乙腈溶剂(其中含内标化合物)沉淀蛋白,其余处理步骤同不稀释样品。
[0317]
pk测试结果如下表12所示。
[0318]
表12化合物(i)的小鼠pk数据
[0319][0320]
测试试验例6:饱和溶解度测定
[0321]
实验仪器:回旋式水浴恒温振荡器(太仓文尔惠金,型号dshz-300a);高效液相色谱仪(安捷伦1260)
[0322]
实验方法:
[0323]
1、水中饱和溶解度测定:称取待测样品过量,加入5ml超纯水,置于回旋式水浴恒温振荡器中以每分钟140转的转速在37.5℃下振摇,并分别于1h和24h取样进行hplc检测,按外标法测定其浓度。
[0324]
2、不同ph条件下的饱和溶解度测定:称取待测样品过量,加入不同ph值(ph1.0、ph2.2、ph4.5、ph6.8、ph8.0)的缓冲液中,置于回旋式水浴恒温振荡器中以每分钟140转的转速在37.5℃下振摇,并分别于0.5h、1h、2h和24h取样进行hplc检测,按外标法测定其浓度。
[0325]
实验结果:待测样品的饱和溶解度结果分别如表13和表14所示。其中,在水中饱和溶解度测定中,虽然晶型b和晶型c在1h时具有较高的溶解度,但在16h取样检测样品在溶液体系中的稳定性时,通过xrpd确认晶型b和晶型c均已转化为晶型a。
[0326]
表13待测样品的水中饱和溶解度
[0327][0328]
表14晶型a在不同ph下的饱和溶解度
[0329][0330]
实验结论:所述晶型a在酸性条件下溶解度较好。
[0331]
测试试验例7:影响因素试验
[0332]
将化合物(i)和晶型a敞口平摊放置,分别考察在加热(60℃)、光照(4500lux)、加速(40℃,75%rh)和高湿(92.5%rh)条件下的稳定性。结果如表15所示。
[0333]
表15影响因素试验结果
[0334][0335]
测试试验例8:吸湿性研究
[0336]
(1)实验仪器:动态水吸附仪dvs intrinsic;
[0337]
(2)实验条件:分别取样品(适量)置于dvs样品盘内进行测试。
[0338]
(3)dvs参数:
[0339]
温度:25℃;
[0340]
平衡:dm/dt=0.002/min
[0341]
rh(%)测试梯级:10%
[0342]
rh(%)测试梯级范围:0%-90%-0%。
[0343]
吸湿性评价标准(依据《中国药典》2015年版四部中“9103药物引湿性指导原则”中引湿性特征描述与引湿性增重的界定):
[0344]
吸湿性分类吸湿增重*(δw%)潮解吸收足量水分形成液体极具吸湿性15%≤δw%有吸湿性2%≤δw%《15%略有吸湿性0.2%≤δw%《2%无或几乎无吸湿性δw%《0.2%
[0345]
*在25
±
1℃和80
±
2%rh下的吸湿增重。
[0346]
(4)实验结果:
[0347]
实施例1样品(化合物(i))在80.0%rh条件下,吸湿增重为3.04%,有吸湿性。
[0348]
实施例2样品(化合物(i)一水合物晶型a)在80.0%rh条件下,吸湿增重为0.04%,无或几乎无吸湿性。
[0349]
(5)实验结论:化合物(i)一水合物晶型a无或几乎无吸湿性,且明显优于化合物
(i)。
[0350]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1