靶向TP53基因的sgRNA及其应用
靶向tp53基因的sgrna及其应用
技术领域
1.本发明属于生物技术领域,涉及靶向tp53基因的sgrna及其应用。
背景技术:
2.tp53基因是一种重要的抑癌基因,其编码的p53蛋白有五个功能域:分别是转录激活功能域(tad)、富含脯氨酸功能域(prd)、dna结合功能域(dbd)、寡聚功能域(td)、羧基端调控区(ctd)。控制着调控细胞周期、dna修复和细胞凋亡的基因表达,在维持和保护基因组稳定性有关键作用。tp53基因的缺失或突变与肿瘤有关联,tp53突变影响其蛋白质结构、折叠和稳定性,从而影响其dna结合能力和生理活性,tp53基因突变导致其肿瘤抑制功能失去或促进肿瘤的发生发展,在人类中约50%的肿瘤中存在tp53基因缺失或者突变,如肝癌、大肠癌、乳腺癌、口咽癌、卵巢癌、前列腺癌、白血病等。同时tp53突变也是人类遗传病李弗梅尼综合征(li-fraumeni syndrome,lfs)的发病原因,lfs的特征是发生一系列的早发性癌症,包括肺癌、胰腺癌、白血病等。在肿瘤细胞中约70%tp53的突变为错义突变,错义突变常发生在dna结合域(dbd)里,dbd里每个密码子都发现tp53突变,但突变主要落在6个突变热点内,分别是氨基酸残基r175、g245、r248、r249、r273和r282,即热点突变主要在第5、7、8外显子上。
3.因此tp53的基因敲除对肿瘤动物模型的建立有重要意义,tp53基因敲除建立的肿瘤动物模型目前已有许多,其中非人灵长类动物中也有tp53基因敲除的动物模型,本发明主要针对肿瘤中常发生突变的外显子7、8上进行敲除,有可能为非人灵长类动物的各种肿瘤模型提供新的有效方法。
技术实现要素:
4.为了克服现有技术的不足,本发明的目的在于提供一种靶向敲除tp53基因的sgrna,其中tp53基因来自食蟹猴。
5.本发明的另一目的在于提供一种食蟹猴tp53基因敲除的方法,该方法为食蟹猴胚胎上的基因敲除方法,该基因敲除方法敲除食蟹猴tp53基因,进而有可能为制造非人灵长类肿瘤动物模型提供新的有效方法。
6.本发明通过设计、构建、筛选,最终提供靶向食蟹猴tp53基因的两个高效sgrna及其靶位点序列,提供一种既可能获得单一位点突变,也可能实现两条sgrna位点之间大片段的食蟹猴tp53基因敲除的方法,为建立非人灵长类肿瘤模型提供思路。
7.为实现上述目的,本发明采取的技术方案为:一种靶向敲除tp53基因的sgrna,其特征在于,所述sgrna为tp53-sgrna 2-7和tp53-sgrna 5-8,其核苷酸序列如下所示:
8.tp53-sgrna 2-7:5
’‑
ccggttcatgccgcccatgc(agg)-3’;
9.tp53-sgrna 5-8:5
’‑
ggcaaggctcccctttcttg(cgg)-3’。
10.其中,括号内为pam位点ngg,sgrna识别位点。
11.本发明提供所述的靶向敲除tp53基因的sgrna在tp53基因敲除领域中的应用。
12.本发明还提供一种食蟹猴tp53基因敲除的方法,包括如下步骤:体外合成所述的靶向敲除tp53基因的sgrna,与cas9 mrna混合注射入食蟹猴胚胎,得到tp53基因敲除的食蟹猴胚胎。
13.作为本发明所述的食蟹猴tp53基因敲除的方法,其中的一种优选实施方式,所述体外合成靶向敲除tp53基因的sgrna的具体操作步骤如下:
14.(1)根据权利要求1所述的靶向敲除tp53基因的sgrna,设计合成引物x,然后以px459载体为模板进行pcr扩增,得到转录dna模板;
15.(2)将步骤(1)制得的转录dna模板进行体外转录,得到所述sgrna。
16.优选的,所述的引物x的核苷酸序列如下所示:
17.tp53-sgrna 2-7-fp:taatacgactcactatag ccggttcatgccgcccatgcgttttagagctagaaatagc;
18.tp53-sgrna 2-7-rp:agcaccgactcggtgccactt;
19.tp53-sgrna 5-8-fp:taatacgactcactatag ggcaaggctcccctttcttggttttagagctagaaatagc;
20.tp53-sgrna 5-8-rp:agcaccgactcggtgccactt。
21.与现有技术相比,本发明的有益效果为:
22.(1)本发明针对食蟹猴tp53基因提供了2个高效的敲除靶点。
23.(2)本发明经敲除效果检测鉴定,能有效在食蟹猴胚胎上实现tp53基因的敲除,为建立非人灵长类肿瘤动物模型奠定了坚实基础。
附图说明
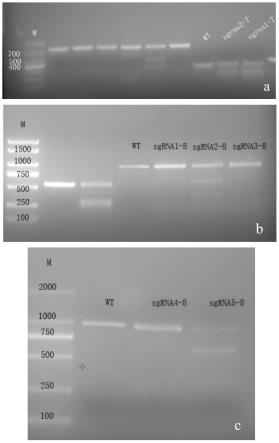
24.图1是sgrna体外靶位点活性检测酶切结果图;其中,a:tp53-sgrna 1-7、tp53-sgrna 2-7;b:tp53-sgrna 1-8、tp53-sgrna 2-8、tp53-sgrna 3-8;d:tp53-sgrna 4-8、tp53-sgrna 5-8;wt:野生型;m:maker;
25.图2是突变型胚胎测序峰图,其中a为tp53-sgrna 2-7的两个突变胚胎测序图;b为tp53-sgrna 5-8的两个突变胚胎测序图;wt为野生型胚胎测序图。
具体实施方式
26.为更好地说明本发明的目的、技术方案和优点,下面将结合具体附图和实施例对本发明作进一步说明。实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
27.实施例1食蟹猴tp53基因靶点效率检测
28.1、设计靶点
29.针对食蟹猴p53基因(基因id为nc_052270.1)的mrna确立靶序列;根据食蟹猴tp53基因的mrna序列(gttggttctgactgtaccaccatccactacaactacatgtgtaacagttcctgcatgggcggcatgaaccggaggcccatccttaccattatcacactggaagactccaggtcagaagccatgtgccaccctgcacactggcctgctgtgccccagcctctgcttgcctctgacccctgggcccacctcttactgatttctaccatactactacccatccgcctctcatcacatccccagtggggaatctccttactgttcccactcggttttcttttctctggctttgggacccgttacctgtgacttctcgtccacctacctagagctggagcttaggctccagaaaggacaagggtggttgg
gagtagatggagcctgtttttttaaatgggacaggtaggacgtgatttccttactgcctcctgcttctctcttcctatcctgagtagtggtaatctactgggacggaacagctttgaggtgcgagtttgtgcctgtcctgggagagaccggcgcacagaggaagagaatttccgcaagaaaggggagccttgccaccagctgccccctgggagcactaagcgag),共设计7个靶序列,这7个靶序列如下:
30.tp53-sgrna1-7:5'-tgtaacagttcctgcatggg(cgg)-3';
31.tp53-sgrna2-7:5'-ccggttcatgccgcccatgc(agg)-3';
32.tp53-sgrna1-8:5'-tctgtgcgccggtctctccc(agg)-3'
33.tp53-sgrna2-8:5
’‑
gtgcgagtttgtgcctgtcc(tgg)-3’;
34.tp53-sgrna3-8:5'-agagaatttccgcaagaaag(tgg)-3'
35.tp53-sgrna4-8:5'-aattctcttcctctgtgcgc(cgg)-3'
36.tp53-sgrna5-8:5'-ggcaaggctcccctttcttg(cgg)-3'。
37.2、提取野生型食蟹猴血液的dna作为模板,在第七、八外显子设计合成针对上述靶点所在基因片段的引物,进行pcr扩增,纯化,得到用于酶切的dna片段;其中扩增引物序列分别如下所示:
38.tp53-f7:5'-cctcccctgcttgccaca-3';
39.tp53-r7:5'-ctggggatgtgatgagaggc-3';
40.tp53-f8:5'-gcctcccctgcttgcc-3';
41.tp53-r8:5'-atgccccaattgcaggtaca-3'。
42.3、体外转录合成sgrna
43.根据步骤1上述7个靶点设计合成扩增引物,以px459载体为模板,进行pcr扩增(扩增体系见表1),纯化,得到转录dna模板,进一步通过转录(转录体系见表2)、纯化,得到sgrna,其中,扩增引物的核苷酸序列如下所示:
44.t7-sgrna-f:
45.taatacgactcactatagnnnnnnnnnnnnnnnnnnnngttttagagctagaaatagc;
46.sgrna-pcr-r:agcaccgactcggtgccactt;
47.其中,nnnnnnnnnnnnnnnnnnnn为sgrna序列。
48.表1 pcr扩增体系
[0049][0050]
表2 sgrna体外转录体系
[0051][0052]
4、sgrna体外活性检测
[0053]
按照表3的体外靶位点活性检测体系,所用的sgrna为步骤3中转录出的产物,37℃反应1h,加3μl 6
×
dna loading buffer,采用浓度为2%的琼脂糖凝胶电泳检测酶切产物,部分结果如图1所示,7个sgrna扩增后,多数没有条带,代表没有活性,而sgrna1-7、sgrna2-7、sgrna2-8、sgrna5-8有活性。
[0054]
表3体外靶位点活性检测体系
[0055][0056]
实施例2食蟹猴胚胎tp53基因的敲除
[0057]
1、体外合成sgrna的
[0058]
(1)根据实施例检测活性,选择sgrna1-7、sgrna2-7、sgrna2-8、sgrna5-8设计合成引物,其中,引物的核苷酸序列如下所示:
[0059]
t7-sgrna-f:
[0060]
5'-taatacgactcactatagnnnnnnnnnnnnnnnnnnnngttttagagctagaaatagc-3';
[0061]
sgrna-pcr-r:5'-agcaccgactcggtgccactt-3';
[0062]
以px459载体为模板,t7-sgrna-f和sgrna-pcr-r作为扩增引物,进行pcr扩增,得到转录dna模板,其中pcr扩增体系同表1。
[0063]
(2)步骤(1)制得的转录dna模板通过转录、纯化后,得到sgrna,其中,转录体系同表2。
[0064]
(3)注射载体后胚胎的发育情况
[0065]
用胚胎显微操作技术分别将sgrna1-7、sgrna2-7、sgrna2-8、sgrna5-8:50ng/μl(混合后终浓度)和cas9mrna(市购)100ng/μl(混合后终浓度)混合分别注射进5枚食蟹猴胚胎,观察注射后胚胎发育情况。
[0066]
(4)验证胚胎靶位点敲除情况
[0067]
将5枚胚胎进行dnasgrna敲除情况检验。从测序情况可明确地知道tp53-sgrna 2-7、tp53-sgrna 5-8在胚胎中工作,且工作效率较高(分别为4/5、5/5),图2为两个胚胎目的基因敲除情况。
[0068]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1