一种分子标志物在制备肝癌检测或疗效评价产品中的应用
1.本发明涉及生物技术领域,具体涉及一种分子标志物在制备肝癌检测或疗效评价产品中的应用。
背景技术:
2.原发性肝癌(plc)被列为世界第七大最常见的癌症,其中肝细胞恶性转化引起的肝细胞癌(hcc)约占原发性肝癌(plc)的75%。肝内胆管癌是另一种主要的plc,起源于胆管细胞,占肝恶性肿瘤的12-15%。由于这些肝恶性肿瘤的侵略性,原发性肝癌已经成为癌症死亡的第四大最常见原因。据统计超过90%的hcc病例发生在慢性肝病的背景下,任何病因引起的肝硬化都是hcc的高危因素,包括慢性饮酒,糖尿病或肥胖相关的非酒精性脂肪性肝炎(nash)以及hbv或hcv感染。hcc是肝硬化患者的主要死亡原因,每年hcc发生率为1-6%。由于公共卫生措施的改善,肝癌的危险因素目前正在转变,许多地区慢性hbv和hcv感染的流行率正在下降,而肥胖、糖尿病和代谢综合征等相关的疾病已经成为许多低风险国家中导致肝癌发病率上升的主要因素。一些社会人口学特征与肝癌有关,其中老龄化是一个强烈的危险因素,报告显示相关发病率最高人群的是年龄70岁以上的人。此外,肝癌还具有很强的男性优势(男女比例为2-3:1),这可能与男性中危险因素的聚集以及性激素的差异有关。尽管已经取得了诊断,外科技术和肝移植方面的进展,但是迄今为止,肝癌患者的长期生存仍然很差。相关数据显示肝癌的预后与疾病进展分期密切关联:极早期(巴塞罗那分期0期,bclc 0)和早期(bclc a)肝癌患者在接受了积极的手术治疗后,5年生存率分别接近90%和50%-70%;然而中晚期肝癌患者的五年生存率仅为14%。因此,有效的肝癌的早期诊断和早期治疗措施是提升肝癌患者预后的关键因素之一。
3.尽管肝癌的早诊、早治十分必要,但在临床上,早期诊断仍面临许多难以逾越的困境。首先,早期肝癌缺乏特异性的症状,导致早期肝癌患者的入院率低。约2/3的肝癌患者首次诊断即为进展期肝癌,失去了手术治疗的机会;其次,临床上现有的肝癌筛查手段存在缺陷。肝脏超声的诊断效率受到肿瘤大小、操作者主观判断、复查频率和仪器精度等因素影响,因此只有不到半数的早期肝癌患者能在超声检查中被发现。甲胎蛋白(afp)是临床广泛应用的肝癌标志物,但其对早期肝癌的检出率仅为66%。尽管大多数hcc在影像学中具有特征性特征,但约有10%的肿瘤(直径高达1-2cm的肿瘤中高达30%)具有非典型表现,缺乏hcc的影像学特征。此外,由于术后复发的发生率很高,肝癌根治性切除术后的预后仍然不令人满意。因此识别转移性肝癌的早期诊断和预后生物标志物对于克服这些对人类健康的持续挑战至关重要。
技术实现要素:
4.本发明的目的在于提供一种分子标志物在制备肝癌检测或疗效评价产品中的应用,该分子标志物能够快捷、简单、准确的实现肝癌的辅助诊断。
5.为了实现本发明的上述目的,特采用以下技术方案:
6.本发明第一方面提供一种用于检测或疗效评价肝癌的分子标志物,其特征在于,所述分子标志物包括hsa_circ_0002490、hsa_circ_0005197和hsa_circ_0101802中的至少一种,所述hsa_circ_0002490的核酸序列如seq id no:1所示;所述hsa_circ_0005197的核酸序列如seq id no:2所示;所述hsa_circ_0101802的核酸序列如seq id no:3所示。
7.本发明第二方面提供一种上述分子标志物在制备肝癌检测或疗效评价产品中的应用。
8.优选地,所述产品包括但不限于试剂盒。
9.本发明第三方面提供一种用于肝癌检测或疗效评价的产品,其特征在于,所述产品包括用于扩增与分子标志物互补的cdna的扩增引物;
10.所述分子标志物包括hsa_circ_0002490、hsa_circ_0005197和hsa_circ_0101802中的至少一种,所述hsa_circ_0002490的核酸序列如seq id no:1所示;所述hsa_circ_0005197的核酸序列如seq id no:2所示;所述hsa_circ_0101802的核酸序列如seq id no:3所示。
11.优选地,所述产品还包括rna提取试剂。
12.优选地,所述hsa_circ_0002490对应的上游扩增引物和下游扩增引物分别如seq id no:4、seq id no:5所示;
13.所述hsa_circ_0005197对应的上游扩增引物和下游扩增引物分别如seq id no:6、seq id no:7所示;
14.所述hsa_circ_0101802对应的上游扩增引物和下游扩增引物分别如seq id no:8、seq id no:9所示。
15.本发明第四方面还提供一种hsa_circ_0005197和/或hsa_circ_0101802的sirna在制备治疗肝癌药物中的应用。
16.优选地,所述hsa_circ_0101802的sirna序列如下:
17.正义链序列如seq id no:10所示,反义链序列如seq id no:11所示;或,正义链序列如seq id no:12所示,反义链序列如seq id no:13所示。
18.本发明第五方面提供一种用于治疗肝癌的药物,所述药物包括hsa_circ_0005197和/或hsa_circ_0101802的sirna。
19.优选地,所述hsa_circ_0101802的sirna序列如下:
20.正义链序列如seq id no:10所示,反义链序列如seq id no:11所示;或,正义链序列如seq id no:12所示,反义链序列如seq id no:13所示。
21.与现有技术相比,本发明的有益效果至少包括:
22.本发明分子标志物与肝癌存在相关关系,其能够快捷、简单、准确的实现肝癌的辅助诊断,为肝癌的诊断及疗效评价指标选取提供基础;此外,本发明分子标志物还能够作为肝癌药物治疗靶点。
23.本发明采用的扩增引物具有优异的特异性,能够稳定的扩增分子标志物,提高分子标志物的检测准确性。
附图说明
24.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体
实施方式或现有技术描述中所需要使用的附图作简单地介绍。在所有附图中,类似的元件或部分一般由类似的附图标记标识。附图中,各元件或部分并不一定按照实际的比例绘制。
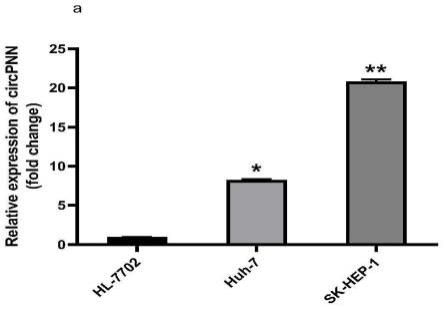
25.图1为本发明实施例1中circpnn在肝癌细胞中的表达水平的柱状图;
26.图2为本发明实施例1中circptpn12在肝癌细胞中的表达水平的柱状图;
27.图3为本发明实施例1中circfcho2在肝癌细胞中的表达水平的柱状图;
28.图4为本发明实施例2中沉默circpnn表达后荧光显微镜下观察转染成功的细胞结果;
29.图5为本发明实施例2中沉默circpnn表达后pcr检测circpnn表达水平的柱状图;
30.图6为本发明实施例2中沉默circpnn表达后细胞增殖能力的柱状图;
31.图7为本发明实施例2中沉默circpnn表达后sk-hep-1细胞凋亡流式分析结果;
32.图8为本发明实施例2中沉默circpnn表达后sk-hep-1细胞凋亡率的柱状图;
33.图9为本发明实施例2中western blot检测caspase-3蛋白显影结果;
34.图10为本发明实施例2中western blot检测caspase-3蛋白表达水平的柱状图。
具体实施方式
35.下面将结合实施例对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只作为示例,而不能以此来限制本发明的保护范围。
36.需要注意的是,除非另有说明,本技术使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。
37.目前,肝脏超声的诊断效率受到肿瘤大小、操作者主观判断、复查频率和仪器精度等因素影响,因此只有不到半数的早期肝癌患者能在超声检查中被发现。甲胎蛋白(afp)是临床广泛应用的肝癌标志物,但其对早期肝癌的检出率仅为66%。尽管大多数hcc在影像学中具有特征性特征,但约有10%的肿瘤(直径高达1-2cm的肿瘤中高达30%)具有非典型表现,缺乏hcc的影像学特征。此外,由于术后复发的发生率很高,肝癌根治性切除术后的预后仍然不令人满意。因此识别转移性肝癌的早期诊断和预后生物标志物对于克服这些对人类健康的持续挑战至关重要。
38.有鉴于此,本发明实施例提供一种用于检测或疗效评价肝癌的分子标志物,其特征在于,所述分子标志物包括hsa_circ_0002490、hsa_circ_0005197和hsa_circ_0101802中的至少一种,
39.其中,hsa_circ_0002490的核酸序列如seq id no:1所示,具体为:
40.gugugucacggggucccagcccugucagccuuggaaaucaggauaccuuaccuguggcaguugcccuuacagaaucuguuaaugccuacuuuaaaggagcagaucccaccaaguguauugugaagaucacuggugauaugacaaugucauuuccaaguggaauuauuaaagucuucaccagcaauccaacuccagcuguguugugcuucagggugaaaaauaucagcagacuagagcagauucuuccaaaugcacagcuuguguucag;
41.hsa_circ_0005197的核酸序列如seq id no:2所示,具体为:
42.uugaucacagccgaguuaaauugacauuaaagacuccuucacaagauucagacuauaucaaugcaaauuuuauaaagggcgucuaugggccaaaagcauauguagcaacucaaggaccuuuagcaaauacaguaauagauuuuuggaggaugauaugggaguauaauguugugaucauuguaauggccugccgagaauuugagaugggaaggaaaaaaug
ugagcgcuauuggccuuuguauggagaagaccccauaacguuugcaccauuuaaaauuucuugugaggaugaacaagcaagaacagacuacuucaucaggacacucuuacuugaauuucaaaau;
43.hsa_circ_0101802的核酸序列如seq id no:3所示,具体为:
44.caaaagcggcgccaggaaauugaacaaaaacuugaaguucaggcagaagaagagagaaagcagguugaaaaugaaaggagagaacuguuugaagagaggcgugcuaaacagacagaacugcggcuuuuggaacagaaaguugagcuugcgcagcugcaagaagaauggaaugaacauaaugccaaaauaauuaaauauauaagaacuaagacaaagccccauuuguuuuauauuccuggaagaauguguccagcuacccaaaaacuaauagaagagucacagagaaaaaugaacg。
45.本发明分子标志物与肝癌存在相关关系,其中,hsa_circ_0005197和hsa_circ_0101802与肝癌正相关,hsa_circ_0002490与肝癌负相关;上述分子标志物能够快捷、简单、准确的实现肝癌的辅助诊断,为肝癌的诊断及疗效评价指标选取提供基础;此外,本发明分子标志物还能够作为肝癌药物治疗靶点。
46.本发明另一实施例还提供一种上述分子标志物在制备肝癌检测或疗效评价产品中的应用。
47.进一步地,上述产品包括但不限于试剂盒。
48.本发明又一实施例提供一种用于肝癌检测或疗效评价的产品,该产品包括用于扩增与分子标志物互补的cdna的扩增引物;
49.上述分子标志物包括hsa_circ_0002490、hsa_circ_0005197和hsa_circ_0101802中的至少一种,其中,hsa_circ_0002490的核酸序列如seq id no:1所示。
50.进一步地,该产品还包括rna提取试剂。
51.进一步地,hsa_circ_0002490对应的上游扩增引物如seq id no:4所示,具体为ctgtgttgtgcttcagggtg;下游扩增引物如、seq id no:5所示,具体为tgacacacctgaacacaagc;
52.hsa_circ_0005197对应的上游扩增引物如seq id no:6所示,具体为caaaatttgatcacagccgagt;下游扩增引物如seq id no:7所示,具体为gcccatagacgccctttataa;
53.hsa_circ_0101802对应的上游扩增引物如seq id no:8所示,具体为agaatgtgtccagctaccca;下游扩增引物如seq id no:9所示,具体为caaaagccgcagttctgtct。
54.本发明上述扩增引物具有优异的特异性,能够稳定的扩增上述分子标志物,进而有效提高分子标志物的检测准确性。
55.本发明实施例还提供一种hsa_circ_0005197和/或hsa_circ_0101802的sirna在制备治疗肝癌药物中的应用。
56.进一步地,hsa_circ_0101802的sirna序列如下:
57.正义链序列如seq id no:10所示,具体为gagaaaaaugaacgcaaaa(tt),反义链序列如seq id no:11所示,具体为uuuugcguucauuuuucuc(tt);或,正义链序列如seq id no:12所示,具体为aaugaacgcaaaagcggcg(tt),反义链序列如seq id no:13所示,具体为cgccgcuuuugcguucauu(tt)。
58.本发明上述sirna能够抑制hsa_circ_0101802在细胞中的表达水平,进而能够抑制肝癌细胞的增殖,达到治疗肝癌的目的。
59.本发明实施例又提供一种用于治疗肝癌的药物,该药物包括hsa_circ_0005197和/或hsa_circ_0101802的sirna。
60.进一步地,hsa_circ_0101802的sirna序列如下:
61.正义链序列如seq id no:10所示,具体为gagaaaaaugaacgcaaaa(tt),反义链序列如seq id no:11所示,具体为uuuugcguucauuuuucuc(tt);或,正义链序列如seq id no:12所示,具体为aaugaacgcaaaagcggcg(tt),反义链序列如seq id no:13所示,具体为cgccgcuuuugcguucauu(tt)。
62.以下通过具体实施例对本发明的技术方案作进一步详细说明。
63.实施例1
64.本实施例为人肝癌细胞系及人正常肝细胞系中circpnn(hsa_circ_0101802)、circfcho2(hsa_circ_0002490)及circptpn12(hsa_circ_0005197)的表达:
65.人正常肝细胞系hl-7702细胞使用rpmi-1640培养基+10%fbs胎牛血清(fbs);而huh-7使用dmem培养基+10%fbs;sk-hep-1使用从中国科学院典型培养物保藏委员会细胞库(上海)购买的专门培养液。以上细胞均在37℃,co2饱和湿度为5%的细胞孵箱中培养,贴壁生长。
66.(1)细胞复苏
67.从液氮罐或-80℃超低温冰箱,迅速在37℃水浴锅中来回晃动,使细胞快速融化。在超净台内用1ml移液枪将冻存管的细胞悬液转入15ml的离心管吹打混匀,1000rpm离心5min。在超净工作台中弃掉上清,加入1ml培养液重悬细胞吹打混匀。将细胞悬液转移至培养瓶,再加入5ml培养液,轻轻摇动使细胞在培养瓶底部均匀分布。倒置显微镜下观察细胞状态。标记好细胞信息、日期以及培养人信息,置于二氧化碳培养箱中进行培养。
68.(2)细胞换液
69.镜下观察细胞生长状态,根据需要1-3天换一次细胞培养基。在超净工作台中,用1ml的移液器细胞瓶中的培养液,用1
×
pbs缓冲液将细胞洗涤2-3遍,然后加入5ml新的含10%fbs的细胞培养液。
70.(3)细胞传代
71.镜下观察细胞,达到80%-90%时要进行传代培养。在超净工作台中,用1ml的移液器吸除旧的培养基,接着用1
×
pbs将细胞洗涤2-3遍,然后加入1.5ml 0.25%的胰蛋白酶溶液。放倒培养瓶,轻轻左右摇晃,使胰酶充分接触细胞,置于二氧化碳培养箱消化3分钟。倒置显微镜下观察,待细胞全部消化成球状,从贴壁变为漂浮后,加入2.0ml培养液终止消化。低速离心机1000rpm,5分钟,室温离心,弃上清,加入1ml的完全培养基吹打,重悬细胞,按1:3比例接种到新的培养瓶中,补充培养液到5ml,标记好后放细胞孵箱中培养。
72.(4)细胞冻存
73.前期操作如细胞传代。将fbs与dmso按体积比为4:1混合配制成细胞冻存液。将消化下的细胞放入10ml离心管中,1000rpm离心5min。离心后加入细胞冻存液重悬并吹打混匀转移至细胞无菌冻存管,每管1.6ml,将管口封好,标记清楚细胞种类以及冻存日期。将冻存管按4℃30min,-20℃30min,-80℃超低温冰箱24小时梯度降温冻存,最后再放入液氮中长期冻存。
74.(5)细胞rna提取
75.吸去培养基后,pbs冲洗1次,加入500μl trizol室温静置5分钟,将trizol转移至新的1.5mlep管后,加入100μl氯仿充分混匀至乳糜状后静置10分钟。4℃12000g离心15分钟取上层清澈液体入新的1.5ml离心管;加入与上清等体积-20℃预冷的异丙醇混匀,在室温静置20分钟(或-80℃过夜),4℃12000g离心10分钟弃上清;加入500μl预冷的75%乙醇,混匀后4℃8500g离心5分钟弃上清,室温下干燥5至10分钟,待酒精完全挥发后加入10μl rnase-,dnase-free water,测量rna浓度及纯度。
76.(6)逆转录反应
77.根据rna浓度测量结果,用无酶水将总rna稀释至500ng/μl,按照takara rr037a逆转录试剂盒说明书操作,全程在冰上配制逆转录反应溶液(表1)。配制后立即将溶液放入pcr仪中进行逆转录,逆转录反应条件为37℃15min,85℃5s。反应结束得到总cdna测量浓度,可储存在-80℃的冰箱,或立即进行实时荧光定量pcr。
78.表1逆转录反应液的配制
[0079][0080]
(7)实时荧光定量pcr
[0081]
避光,全程操作在冰上进行,根据takara rr820a试剂盒说明书,按表2配制实时荧光定量pcr(qrt-pcr)反应液,可根据cdna浓度进行适当稀释,反应体系为每孔20μl,至少3个复孔。
[0082]
表2 qrt-pcr反应液的配制
[0083][0084]
扩增反应的条件为:95℃30s(预变性)
→
(95℃5s,60℃30s)
×
40cycles
→
荧光融解得到融解曲线。在stage 2中每个循环结束时,仪器会自动收集并分析每个样品的荧光强度。
[0085]
(8)实时荧光pcr数据处理
[0086]
反应结束后,核对目的基因的溶解曲线,溶解温度等信息。提取样本的ct值,使用log 2-δδct(δct=ct目的基因-ct内参基因,δδct=δct肝细细胞-δct正常人肝细胞)法进行基因差异表达水平的相对定量分析,同时设立u6为内参基因。数据分析使用graphpad premier 9软件,统计学分析采用单因素方差检验。
[0087]
(9)结果
[0088]
人肝癌细胞系及人正常肝细胞系中circpnn(hsa_circ_0101802)、circfcho2(hsa_circ_0002490)及circptpn12(hsa_circ_0005197)的表达结果如表3~5所示;表达柱状图如图1~3所示;
[0089]
表3 circpnn在肝癌细胞中的表达(x土sd,n=3)
[0090][0091]
vs hl-7702,*p《0.05,**p《0.01;
[0092]
表4 circptpn12在肝癌细胞中的表达(x土sd,n=3)
[0093][0094]
vs hl-7702,***p《0.001
[0095]
表5 circfcho2在肝癌细胞中的表达(x土sd,n=3)
[0096][0097]
vs hl-7702,*p《0.05,**p《0.01
[0098]
由表3~表5以及附图1~3可知:
[0099]
与人正常肝细胞系hl7702相比(fc值为1.000
±
0.045),circfch02在肝癌细胞中均呈现低表达(fc值分别为0.785
±
0.039、0.036
±
0.004,p《0.05);circpnn在肝癌细胞系中呈现高表达(fc值分别为:hl-7702 0.950
±
0.010、huh-7 8.206
±
0.118、sk-hep-1 20.822
±
0.288,p《0.05);circptpn12在肝癌细胞中也表达上调(fc值分别为hl-7702:1.100
±
0.027、huh-7:1288.420
±
13.664、sk-hep-1:1321.599
±
15.921,p《0.05);可见,上述分子标志物与肝癌存在相关关系,能够作为肝癌检查和疗效评价的标志物。
[0100]
实施例2
[0101]
本实施例为沉默肝癌细胞sk-hep-1中circpnn(hsa_circ_0101802)对细胞生物学行为的影响:
[0102]
(1)实验分组
[0103]
①
sirna-1组:转染时加入circpnn-sirna-1(序列为seq id no:10和seq id no:
11)/慢病毒复合物。
②
sirna-2组:转染时加入circpnn-sirna-2(序列为seq id no:12和seq id no:13)/慢病毒复合物。
③
空白对照组:未进行任何干预措施的肝癌细胞。
[0104]
(2)细胞转染
[0105]
取生长状态良好、对数生长期的sk-hep-1肝癌细胞用胰蛋白酶消化、离心、培养液重悬后计数,调整细胞浓度,以1.0
×
105个/ml的密度接种至6孔板,放置于co2孵箱中培养至细胞密度达70%-80%;吸弃旧培养基,用pbs冲洗细胞2次。使用完全培养基将25
×
病毒感染液稀释至1
×
,每孔加入500μl稀释好的1
×
病毒感染液。根据说明书推荐,进行转染时moi=30,每孔加入浓度为1
×
108tu/ml的circpnn-sirna-病毒复合物15μl。轻轻晃动培养板,充分混匀放置于培养箱孵育8小时后更换新鲜培养液,继续培养24小时,待下一步实验需要。
[0106]
(3)检测转染效率
[0107]
转染24h后先置于荧光显微镜下观察转染效率,观察结果如图4所示,然后提取细胞总rna,对提取的总rna进行反转录,qrt-pcr检测circpnn的表达水平。
[0108]
由图4可知,荧光显微镜下可见sirna-1和sirna-2组转染成功后绿色荧光细胞。
[0109]
circpnn的表达水平检测结果如表6所示,柱状图如图5所示;
[0110]
表6沉默后pcr检测circpnn表达水平变化(n=3)
[0111][0112]
vs control group,*p《0.05,**p《0.01
[0113]
由表6以及附图5可知:
[0114]
转染sirna-1和sirna-2至人肝癌细胞sk-hep-1后,pcr结果提示sk-hep-1细胞内control组1.005土0.386;sirna-1组0.366土0.041,与control组比相对表达水平量下降(p《0.01);sirna-2组0.449土0.023,与control组比相对表达水平量下降(p《0.01),与sirna-1组比相对表达水平量增高(p》0.05)。
[0115]
(4)cck8检测转染后细胞增殖
[0116]
取转染成功后的sk-hep-1细胞,胰酶消化,离心,制备成浓度为2.0
×
104个/ml的细胞悬液。96孔板按照实验分组每孔加入100μl细胞悬液,每组3个重复空。为防止细胞培养基蒸发对实验结果造成干扰,周围的空白孔加入pbs。将96孔板放入细胞培养箱,培养24h后取出,每孔加入10μl cck8试剂。96孔板放回细胞培养箱,2小时后在酶标仪上测定每孔的吸光度。细胞增值率=(实验组od值/control组od值);
[0117]
结果如表7所示,柱状图如图6所示;
[0118]
表7沉默circpnn后细胞增殖能力变化(n=3)
[0119][0120]
vs control group,*p《0.05,**p《0.01;vs sirna-1 group,
#
p《0.05,
##
p《0.01
[0121]
由表7以及图6可知:
[0122]
control组102.280土5.399;sirna-1组49.259土2.272,与control组比细胞增殖率下降(p《0.01);sirna-2组82.628土4.013,与control组比细胞增殖率下降(p《0.01),与sirna-1组比细胞增殖率增高(p《0.01)。
[0123]
(5)流式细胞术检测细胞凋亡
[0124]
取空白对照组、实验组sirna转染的sk-hep-1细胞,制备单细胞悬液,调整细胞密度,以2
×
105个/ml接种于6孔板,用无血清dmem培养液培养48h,用胰蛋白酶消化细胞,完全培养基终止消化,收集细胞消化液,离心,,离心收集,弃上清液后用pbs重悬,将上述细胞悬液离心,弃上清液,加入100μl1
×
loading buffer缓冲液轻轻重悬细胞并转移至流式管中;加入5μl annexin v和5μl 7-aad,轻轻混匀室温避光孵育15min(冰上),再加入400μl 1
×
loading buffer缓冲液并利用流式细胞仪检测分析;结果判定:左下象限q3显示活细胞,左上象限q1为坏死细胞,右上象限q2为晚期凋亡细胞,右下象限q4为早期凋亡细胞。细胞总凋亡率=(q2+q4)%。
[0125]
沉默circpnn表达后sk-hep-1细胞凋亡流式分析结果如图7所示;沉默circpnn表达后sk-hep-1细胞凋亡率如表8所示,柱状图如图8所示;
[0126]
表8沉默circpnn表达后sk-hep-1细胞凋亡率(n=3)
[0127][0128]
vs control group,*p《0.05,**p《0.01;vs sirna-1 group,
#
p《0.05,
##
p《0.01
[0129]
由表8以及图7~8可知,control组4.800土0.608;sirna-1组27.133土0.751,与control组比细胞凋亡率升高(p《0.01);sirna-2组16.633土0.404,与control组比凋亡率升高(p《0.01),与sirna-1组比凋亡率下降(p《0.01)。
[0130]
(6)western blot检测细胞内蛋白表达
[0131]
蛋白样品的制备及含量的测定
[0132]
①
收集生长状态良好的细胞,经过前述细胞培养、传代,接种至6孔细胞培养板中,察看细胞成长状态良好,汇合度约80%,用预冷的pbs漂洗两次,常规消化收集细胞,分组移至3个1.5ml ep管中。
②
每个ep管中加入复合细胞裂解液300μl(25
×
蛋白酶抑制剂12μl+100
×
pmsf 3μl+10
×
磷酸酶抑制剂30μl+ripa补足体积至300μl),冰上震荡裂解30min。
③
ep管移至高速冷冻离心机中离心,4℃、12000rpm、20min,吸取ep管中上清,弃沉淀,得到细
胞总蛋白。
[0133]
配制sds-page凝胶
[0134]
根据实验所需蛋白的分子量,依据试剂盒说明配制合适浓度的分离胶和浓缩胶,配胶时,注意有无漏胶现象,注意分离胶与浓缩胶之间避免产生气泡。
[0135]
上样
[0136]
将电泳装置放入电泳槽中,加入电泳液超出胶平面,拔出梳子,根据测定的蛋白质浓度,取相同质量的蛋白质样品依照次序分别加入各孔中,上样量一般在25μl,加样时注意使样品加到孔底,避免产生气泡,避免溢出蛋白到电泳液中影响实验结果,根据目的蛋白的分子量在最外侧两孔加入适当型号的预染蛋白分子marker。
[0137]
电泳
[0138]
采用恒压法:浓缩胶电泳时设置80v,30min;分离胶时设置120v,溴酚蓝到达胶底部时电泳停止。
[0139]
转膜
[0140]
选取孔径大小合适的pvdf膜,根据蛋白分子量所在胶的宽度剪取合适大小的膜,并做好标记,浸泡于甲醇中;在电泳槽中取出已经分离的蛋白质凝胶板,根据预染蛋白分子量标记,将目的蛋白与内参分离,并置于转膜板上,覆盖上相对应的pvdf膜,注意将pvdf膜完全覆盖于分离胶表面,覆盖过程中避免产生气泡。按照“红对红,黑对黑”的原则放入转膜槽中,并注意转膜板放置方向。使用恒压转膜,120v电压转膜90min。转膜槽放置于冰水中,并保持持续低温。
[0141]
封闭
[0142]
将pvdf膜放置于tbst中洗涤5min,用5%bsa溶液封闭,将pvdf膜放于封闭液中,放于摇床上室温封闭1h;
[0143]
—抗孵育
[0144]
于封闭液中取出pvdf膜,将其放入tbst中洗涤5min x3次,洗涤完毕后,将pvdf膜放入稀释好的一抗溶液中,4℃摇床过夜;
[0145]
二抗孵育
[0146]
将pvdf膜与稀释好的一抗溶液置于摇床上室温复温1h,从一抗稀释液中取出pvdf膜,放于tbst中,室温下摇床5minx4次,选取辣根过氧化物酶标山羊抗兔或山羊抗鼠的二抗,按照一定比例加入到含有5%的tbs中,摇匀,将pvdf膜放入二抗稀释液中,室温下置于摇床上孵育1h
[0147]
显影
[0148]
二抗孵育完毕后,将条带放于tbst中洗涤5minx3次,将发光液:稳定液按照1:1的比例配制ecl显影液,将膜放入tanon5200显影并拍照保存;拍照结果如图9所示;
[0149]
western blot检测caspase-3蛋白表达水平如表9所示,柱状图如图10所示;
[0150]
表9 western blot检测caspase-3蛋白表达水平(n=3)
[0151][0152]
vs control group,*p《0.05,**p《0.01;vs sirna-1 group,
#
p《0.05,
##
p《0.01
[0153]
由表9以及图9~10可知:
[0154]
control组0.553土0.067;sirna-1组1.237土0.110,与control组比c3蛋白表达水平升高(p《0.01);sirna-2组0.957土1.102,与control组比c3蛋白表达水平升高(p《0.01),与sirna-1组比c3蛋白表达水平下降(p《0.05)。
[0155]
统计学分析
[0156]
所有数据均为3次独立实验结果,统计分析应用spss 25.0软件。正态分布计量资料结果以平均值
±
标准误(x
±
sd)表示,组间差异比较采用单因素方差分析,p《0.05认为差异有统计学意义。
[0157]
综上,本发明分子标志物与肝癌存在相关关系,其能够快捷、简单、准确的实现肝癌的辅助诊断,为肝癌的诊断及疗效评价指标选取提供基础;此外,本发明分子标志物还能够作为肝癌药物治疗靶点。
[0158]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1