多能干细胞分化成肠中肠内胚层细胞的制作方法
1.本发明涉及一种基于细胞的治疗病症诸如糖尿病的领域。具体地,本发明涉及细胞分化,包括引导人多能干细胞分化,以生成肠中肠内胚层细胞群。本发明提供细胞或细胞群以及产生用于表达肠中肠内胚层的标记特征的细胞的方法。
背景技术:
2.关于肠促胰岛素激素作用机制的知识的进展以及在干细胞阶段和内分泌细胞阶段两者处对肠分化的理解的进步已引起对开发适于植入的肠促胰岛素激素产生细胞的来源的兴趣。一种方法是从多能干细胞诸如人胚胎干细胞(“hesc”)或经诱导的多能干细胞(“ips”)产生功能性肠内分泌l或k细胞。
3.来自肠l细胞的胰高血糖素类肽1(glp-1)或来自肠k细胞的葡萄糖依赖性促胰岛素多肽(gip)的产生/分泌对糖尿病的治疗具有有益效果。肠促胰岛素对糖尿病(第1型和第2型)的治疗具有系统性效果(unger,j.,curr diab rep.,2013;13(5):663-668)。有益效果可包括扩增以下许多方面:beta(β)细胞功能和数量、抑制胰高血糖素分泌、提高周边代谢组织的胰岛素敏感性、减少肝脏糖异生,以及减少食欲。已鉴定两类基于肠促胰岛素的治疗剂用于治疗糖尿病(glp-1受体激动剂和二肽基肽酶4(dpp-4)抑制剂)。然而,目前没有基于肠促胰岛素的细胞治疗方案,其将涵盖用于改善的和有效的基于glp1的糖尿病治疗的内源和细胞指示物。此外,目前的基于肠促胰岛素的疗法不受循环血糖水平的调节,并且因此提供非生理调节的glp产生。
4.在脊椎动物胚胎发育中,多能细胞可在被称为原肠胚形成的过程中产生包括三个胚层(外胚层、中胚层和内胚层)的细胞群。间充质组织来源于中胚层并且尤其由经表达的1(hand1)的基因心脏和神经嵴衍生物以及叉头框f1(foxf1)标记。组织(诸如甲状腺、胸腺、胰腺、肠和肝脏)将从内胚层经由中间阶段发育而来。该过程中的中间阶段为形成定形内胚层。到原肠胚形成为止,内胚层划被分成可通过对一组因子的表达来识别的前-后域,该一组因子唯一地标记内胚层的前前肠、后前场、中肠和后场区。
5.对特定转录因子(“tf”)的表达的水平可用于指定组织的身份,如grapin-botten等人,趋势遗传学(trends genet),2000;16(3):124-130中所述的。foxa2标记沿前后轴的整个内胚层。在定形内胚层转化成原肠管期间,肠管变得被分区成广泛的域,该广泛的域可通过限制性基因表达模式在分子水平上进行观察。前前肠通过对sox2的高表达大致标记,并且涵盖器官域,诸如甲状腺,肺和食道。中肠(包括十二指肠、回肠、空肠)和后肠(包括结肠)通过对尾型同源盒2(cdx2)的高表达来标记。sox2-cdx2边界出现在中后部前肠内,附加tf在该中后部前肠内标记特定器官域。后前场内的经分区的胰腺域显示出对pdx1的极高表达,但对cdx2和sox2的表达极低。ptf1a在胰腺组织中被高度表达。低pdx1表达连同高cdx2表达标记十二指肠域。由特定同源盒(hox)基因对肠内胚层进行图案化。例如,hoxc5在中肠内胚层细胞中优先表达。此外,对hoxa13和hoxd13的表达被限制于后肠内胚层细胞。alb基因或白蛋白1蛋白标记后前肠内胚层中的最早的肝脏祖细胞(zaret等人,发育生物学的当
前主题(curr topdev biol),2016;117:647-669)。
6.在改善从人多能干细胞生成肠内胚层细胞的协议方面已取得了进展。例如,以下出版物(spence等人,自然(nature),2011;470(7332):105-109;watson等人,自然医学(nature medicine),2014;20(11):1310-1314;和kauffman等人,前药理学(front pharmacol),2013;4(79):1-18)概述了使用成纤维细胞生长因子(fgf)-4、无翅型mmtv整合位族、成员3a(wnt3a)、chiron 99021或视黄酸(ra)和起始于定形内胚层阶段(在此阶段生成中/后肠球状体)的fgf7的分化协议,其不仅包含cdx2
+
/foxa2
+
内胚层群,而且还包含显著的间充质cdx2
+
细胞群。来自这些hesc衍生的中/后肠球体的肠内分泌细胞分化的过程非常低效,需要长时间段,并且无差别地指向所有肠细胞类型的绒毛间和绒毛区域的生成。仍需要技术来生成肠中肠内胚层细胞,而不会显著污染间充质,从而能够产生用于细胞治疗剂的高效率肠内分泌细胞。
技术实现要素:
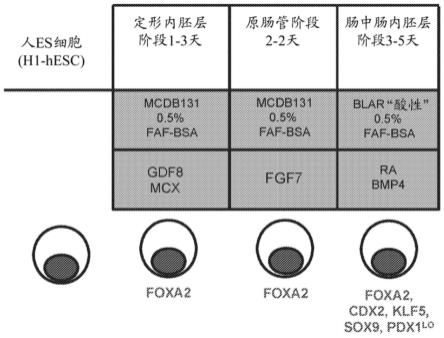
7.如所体现和完全描述的,本发明提供细胞、细胞群和通过分化人多能干细胞而生成细胞的方法。具体地,本发明的特征在于使人多能干细胞直接分化以生成肠中肠内胚层细胞,更具体地生成肠中肠内胚层细胞的内胚层单层的方法。
8.本发明的一个方面是产生肠中肠内胚层细胞群的方法,包括在培养基中培养人多能干细胞。在实施方案中,该方法包括诱导人多能干细胞向肠中肠内胚层细胞的分化。在一些实施方案中,产生肠中肠内胚层细胞群。在一些实施方案中,产生基本上肠中肠内胚层细胞群。在本发明的实施方案中,肠中肠内胚层细胞在培养物中形成并稳定为单层。在实施方案中,大于50%的分化细胞表达肠中肠内胚层的标记特征,优选地大于60%的分化细胞表达肠中肠内胚层的标记特征,更优选地大于70%、大于80%和大于90%的分化细胞表达肠中肠内胚层的标记特征。在实施方案中,分化细胞表达肠中肠内胚层(为肠中肠内胚层细胞)的标记特征。在实施方案中,肠中肠内胚层细胞表达cdx2和foxa2。在所有实施方案中,肠中肠内胚层细胞表达选自由以下各项组成的组的转录因子:sox9、pdx1、klf5和hoxc5。在实施方案中,肠中肠内胚层细胞不表达选自由以下各项组成的组的转录因子:sox2、alb、ptf1a、hoxa13和lgr5。
9.在本发明的实施方案中,通过步骤使人多能干细胞分化成肠中肠内胚层细胞,该步骤包括:a)在包含gdf-8和gsk3β抑制剂(诸如mcx化合物)的第一培养基中培养人多能干细胞,以诱导分化成定形内胚层细胞;b)在包含抗坏血酸和fgf7的第二培养基中培养定形内胚层细胞,以诱导分化成原肠管细胞;以及c)在包含视黄酸和bmp2或bmp4的第三培养基中培养原肠管细胞,以诱导分化成肠中肠内胚层细胞。在特定实施方案中,酸性条件为具有blar培养基的培养物。酸性培养物的ph可在6.8至7.2的范围内。在本发明的实施方案中,肠中肠内胚层细胞在培养物中形成单层。在实施方案中,肠中肠内胚层细胞的单层被保持在培养物中。
10.本发明的另一个实施方案围治疗患有糖尿病或有患糖尿病风险的患者的方法,该方法包括使人多能干细胞分化成肠中肠内胚层细胞,以及在患有糖尿病的患者体内施用经分化的肠中肠内胚层细胞。在实施方案中,糖尿病为1型或2型。在实施方案中,施用细胞可经由植入、注射或以其他方式直接或间接施用到治疗部位。在一些实施方案中,肠中肠内胚
层细胞植入体内,诸如皮下空间、网膜、肝脏、肾等。另外的实施方案涵盖对细胞的包封递送,包括对宏或微包封装置包封。
11.本发明的另外的实施方案为产生肠中肠内胚层细胞的方法,包括在培养物中诱导定形内胚层细胞分化成原肠管细胞。在实施方案中,定形内胚层细胞在包含抗坏血酸和fgf7的培养基中培养。在另外的实施方案中,原肠管细胞在包含视黄酸和bmp2或bmp4的培养基中培养。原肠管细胞分化成肠中肠内胚层细胞。在一些实施方案中,原肠管细胞在酸性条件(酸性培养基)中分化成肠中肠内胚层细胞。在特定实施方案中,酸性条件为具有blar培养基的培养物。酸性培养物的ph可在6.8至7.2的范围内。在实施方案中,肠中肠内胚层细胞在培养物中形成并维持单层。
12.在上述实施方案中的每个实施方案中,人多能干细胞为人胚胎干细胞或经诱导的多能干细胞。在上述实施方案中的每个实施方案中,肠中肠内胚层细胞表达cdx2和foxa2。在所有实施方案中,肠中肠内胚层细胞表达选自由以下各项组成的组的转录因子:sox9、pdx1、klf5和hoxc5。在所述实施方案中,肠中肠内胚层细胞不表达选自由以下各项组成的组的转录因子:sox2、alb、ptf1a、hoxa13和lgr5。在上述实施方案中,肠中肠内胚层细胞表达cdx2、foxa2、sox9、pdx1、klf5和hoxc5。在上述实施方案中,肠中肠内胚层细胞不表达sox2、alb、ptf1a、hoxa13和lgr5。在实施方案中,大于50%的分化细胞表达肠中肠内胚层的标记特征,优选地大于60%的分化细胞表达肠中肠内胚层的标记特征,更优选地大于70%、大于80%和大于90%的分化细胞表达肠中肠内胚层的标记特征。在实施方案中,分化细胞表达肠中肠内胚层(为肠中肠内胚层细胞)的标记特征。在实施方案中,肠中肠内胚层细胞表达cdx2和foxa2。在实施方案中,肠中肠内胚层细胞表达选自由以下各项组成的组的转录因子:sox9、pdx1、klf5和hoxc5。在实施方案中,肠中肠内胚层细胞不表达选自由以下各项组成的组的转录因子:sox2、alb、ptf1a、hoxa13和lgr5。在所述实施方案中,肠中肠内胚层细胞不表达hand1。
13.在上文所述的实施方案中,肠中肠内胚层细胞群为基本上肠中肠内胚层细胞。在一些实施方案中,肠中肠内胚层细胞群包含大于70%的肠中肠内胚层细胞,优选地大于80%、大于90%,以及大于95%的肠中肠内胚层细胞。在一些实施方案中,肠中肠内胚层细胞群包含小于20%的间充质细胞,优选地小于15%、更优选地小于10%、小于5%、小于2%、小于1%、小于0.5%。在实施方案中,肠中肠内胚层细胞缺乏对hand1的表达。
14.在上述本发明的一些实施方案中,在体外诱导分化。在其他实施方案中,肠中肠内胚层细胞在体内另外分化。另一个实施方案涉及在体内另外分化成肠内分泌细胞的肠中肠内胚层细胞。肠内分泌细胞表达或分泌肠促胰岛素。在实施方案中,肠促胰岛素为glp1和gip。
15.在另外的实施方案中,肠中肠内胚层细胞用作识别小分子的起始材料,该小分子以高效率促进肠中肠内胚层细胞在体外分化成第一肠内分泌前体,并且最终分化成用于表达或分泌肠促胰岛素的肠内分泌细胞。
附图说明
16.图1a至图1d示出了肠中肠内胚层细胞的分化方法。图1a为对分化方法的概述,包括向每个阶段添加的培养基组分、生长因子和小分子,以及分化肠中肠内胚层细胞的关键
阶段特异性标记(foxa2,叉头盒a2;cdx2,尾部型同源盒2;klf5,类kruppel因子5;sox9,sry(性测定区域y)-盒9;pdx1,胰腺和十二指肠同源盒1;lo,低表达和蛋白质存在)。与在s2d2(7.35
±
0.04)下所述的中性ph相比较,在阶段3期间,将细胞暴露于blar培养基(与“blar酸性培养基”可互换使用)中的轻度酸性条件(ph;s3d1,6.98
±
0.05;s3d2,7.02
±
0.04;s3d5,7.18
±
0.03)(图1b),并且作为结果blar培养基中的碳酸氢钠水平降低。图1c示出了被用作用于表征分化的基准的s3d5单层(左)和人上皮结肠癌细胞线(“caco-2”)(右)的代表性相位对比图像。一致地观察到s3d5处的均匀形态。使用nc 100(丹麦alleroed的chemometec公司(chemometec,denmark),目录号900-004)表征细胞编号示出了一个hesc分化成4.56
±
2.60s3d5肠中肠内胚层细胞(图1d)。
17.图2a至图2d展示了利用骨形态蛋白4(bmp4)在单层中生成肠中肠内胚层细胞的分化方法,其包含转录物和蛋白质水平上的cdx2和foxa2两者。图2a(底部)显示了针对cdx2和foxa2蛋白两者共存的90.0
±
5.85%的s3d5细胞,其类似于caco-2细胞中观察到的百分比(86.0
±
6.67)。相反,定形内胚层(de-s1d3)细胞缺乏cdx2和foxa2共存(2.3
±
1.2)。基因表达分析显示了cdx2被诱导(图2b)并在阶段3期间保持foxa2(图2c)。图2d示出了在建立foxa2阳性原肠内胚层阶段s2d2(图2d-i)之后对cdx2蛋白质水平和cdx2/foxa2蛋白质共存的诱导通过s3d2逐渐增加(图2d-ii),并且在s3d5(图2d-iii)达到与caco-2细胞中所观察到的类似的水平(图2d-iv)。cdx2蛋白质在底行上被示出,并且foxa2蛋白质在顶行上示出。使用相同的参数获取每个图像,以允许定量分析。蛋白质表达由facs评估;基因表达由qpcr评估。
18.图3a至图3q示出了由s3d5对构成稳健肠中肠内胚层诱导的附加转录因子(tf)的转录和蛋白质水平的诱导;实现适当的肠中肠内胚层。除了cdx2和foxa2共表达之外,s3d5细胞还表现出对sox9、pdx1、klf5、hoxc5(同源盒2)的共表达,但未表现出alb(白蛋白)、ptf1a(胰腺特异性转录因子,1a)和lgr5(含有富亮氨酸重复的g蛋白偶联受体5)的共表达。所有tf的蛋白质存在被描绘在单独的单通道图像中。图3a(底部)展示了98.7
±
0.25%的细胞在s3d5处针对cdx2和sox9两者共存。观察到将sox9基因表达强诱导至在caco-2细胞中所见水平(图3b),并且蛋白质存在通过免疫荧光(if)-分析来评估(图3c)。69.4
±
14.2%的细胞针对cdx2和pdx1两者为共阳性的(图3d-底部)。当与胰腺偏向的s4d3细胞相比时,pdx1基因表达以低水平被诱导(参见,例如,us2014/0242693)(图3e),并且在if分析中反映了低至不存在的蛋白质水平(图3f)。在s3d5细胞中未观察到前内胚层tf sox2,因为s3d5细胞的1.45
±
0.15表现出sox2和cdx2共存(图3g-底部;图3i),并且基因表达低于在hesc和caco-2细胞中所见的水平(图3h)。在s3d5处上调对klf5的基因表达,其对于肠中/后肠内胚层的正常发育是必需的(图3j)。在s3d5处观察到cdx2阳性细胞内的klf5的蛋白质共存(图3k)。alb基因表达(图3l)和蛋白质存在(图3m)未在s3d5细胞中观察到。对胰腺谱系分配tf即ptf1a的基因表达不会在s3d5细胞中诱导,这与胰腺偏向的s4d3细胞(图3n)不同。胚胎中肠内胚层中存在的同源盒基因hoxc5在s3d5细胞(图3o)中诱导。图3p表明lgr5(在小鼠中期开始于胚胎肠内胚层的标记)在s3d5细胞中未被诱导。图3q表明hoxa13(肠后肠内胚层的标记)在s3d5细胞中未被诱导(图3p)。通过qpcr来评估基因表达。
19.图4a至图4b表征分化s3d5细胞的增殖谱。图4a描绘了caco-2细胞(其中大多数
cdx2蛋白质阳性细胞处于活跃的细胞周期中(如通过与ki67蛋白的共表达所示的)(左侧)),以及h1-hesc衍生细胞在阶段3期间的随时间推移而减小的增殖指数(s3d2-中间;s3d5-右侧)。cdx2(顶行)和ki67(底行)蛋白质水平被描绘为单通道图像。通过facs评估的总s3d5细胞的ki67-蛋白质阳性细胞百分比(总细胞》90%cdx2阳性)为16.8
±
3.12,这与在s1d3(97.3
±
1.3)和caco-2细胞(99.2
±
0.2)中所见的百分比形成对比(图4b)。
20.图5a至图5c示出了在阶段3期间使用bmp2作为bmp4的替代物,以实现具有cdx2和foxa2蛋白质共存的单层肠中肠内胚层细胞。图5a总结了分化方法,包括向每个阶段添加的培养基组分、生长因子和小分子,以及分化肠中肠内胚层细胞的阶段特定标记(foxa2,cdx2,klf5,sox9和pdx1
lo
)。与在s2d2(7.35
±
0.04)下所述的中性ph相比较,在整个阶段3期间,细胞在blar培养基中被暴露于稍微酸性条件(ph;s3d1,6.92;s3d2,7.01;s3d5,7.22)(图5b),并且作为结果blar培养基中的碳酸氢钠水平降低。图5c描绘了s3d5单层(左侧)和caco-2细胞(右侧)的代表性相位对比图像;观察到s3d5处的均匀形态。
21.图6a至图6u表明了单层中的适当的肠中肠内胚层细胞的生成,每个细胞在转录物和蛋白质水平上包含cdx2、foxa2、klf5、sox9、pdx1lo和hoxc5。针对if图像,所有tf蛋白质水平均被描绘为单通道图像。图6a(底部)示出,94%的s3d5细胞为cdx2和foxa2蛋白质两者共存,类似于或大于在caco-2细胞中观察到的百分比(86.0
±
6.67)。基因表达分析示出在阶段3期间cdx2被诱导(图6b),并且foxa2被保持(图6c)。图6d示出了在s3d5诱导的cdx2蛋白质水平和完全cdx2/foxa2蛋白质共存,从而达到与caco-2细胞中所见类似的水平(图2d-iv)。图6e(底部)表明在s3d5处99.8%的细胞针对cdx2和sox9两者共存。观察到将sox9基因表达强诱导到caco-2细胞中所见的水平(图6f),并且蛋白质存在通过if分析来评估(图6g)。45.5%的细胞针对cdx2和pdx1两者为共阳性的(图6h-底部)。与胰腺偏向的s4d3细胞相比,pdx1基因表达以低水平被诱导(图6i);低到不存在的蛋白质水平在if分析中被反映(图6j)。在s3d5细胞中未观察到前内胚层tf sox2,因为0.8%的s3d5细胞表现出sox2和cdx2共存(图6k-底部;图6m),并且基因表达低于hesc和caco-2细胞中所见的水平(图6l)。在s3d5上调对klf5的基因表达,其对于肠中/后肠内胚层的正常发育是必需的(图6n)。在s3d5处观察到cdx2阳性细胞内的klf5的蛋白质共存(图6o)。alb基因表达(图6p)和蛋白质存在(图6q)未在s3d5细胞中被观察到。对胰腺谱系分配tf即ptf1a的基因表达不会在s3d5细胞中被诱导,这不同于胰腺偏向的s4d3细胞(图6r)。存在于胚胎肠中肠内胚层中的同源盒基因hoxc5在s3d5细胞中被诱导(图6s)。图6t表明lgr5(在妊娠中期开始的胚胎肠内胚层的标记)在s3d5细胞中未被诱导。图6u表明hoxa13(肠后肠内胚层的标记)在s3d5细胞中未被诱导(图6u)。
22.图7表征用于分化s3d5细胞的增殖谱。与caco-2细胞相比(其中大多数cdx2蛋白质阳性细胞在活性细胞周期中(如通过与“67蛋白质”的共表达所指示的)),阶段3期间的h1-hesc衍生细胞的增殖指数较低(s3d5-右侧)。cdx2(顶行)和ki67(底行)蛋白质水平被描绘为单通道图像。通过facs评估的总s3d5细胞的ki67-蛋白质阳性细胞百分比(总细胞》90%cdx2-阳性)为14.1%,这与在s1d3(97.3
±
1.3)和caco-2细胞中观察到的百分比(99.2
±
0.2)形成对比。
23.图8a至图8f表明了对cdx2
+
细胞的异质群体的诱导。图8a为分化方法的概述,包括添加到每个阶段的培养基组分、生长因子和小分子,以及区分肠中/后肠内胚层细胞的关键
阶段特异性标记(hand1)。图8b示出以下各项的相位对比图像:h1-hesc细胞(顶行,左侧)、利用500ng/ml fgf4和3μm chiron99021调节两天的后阶段1细胞(顶行,中间)、利用500ng/ml fgf4和500ng/ml wnt3a调节两天的后阶段1细胞(顶行,右侧)、由ra/bmp4调节的s3d5单层(底行,左侧)和由ra/bmp2调节的s3d5单层(底行,右侧)。调节两天之后的基因表达的诱导在低水平下针对cdx2被示出(图8c),针对内胚层标记foxa2被维持(图8d),并且针对中胚层/间充质标记hand1被诱导(图8f)。klf5未被诱导(图8e)。
具体实施方式
24.应当理解,本发明并非仅限于特定的方法、试剂、化合物、成分、或生物系统,当然,该方法、试剂、化合物、成分、或生物系统可发生变化。另外应当了解,本文所用的术语只是为了描述具体实施方案的目的,并非旨在进行限制。
25.本发明涉及肠中肠内胚层细胞的生成。使用特定培养序列来生成细胞。因此,本发明提供体外细胞培养物,以用于使来源于多能干细胞的细胞分化成用于表达肠中肠内胚层细胞谱系的标记特征的细胞,诸如对cdx2和foxa2的表达。本发明另外提供了一种用于经由体外细胞培养物来获取此类细胞的方法。在某些实施方案中,本发明基于这样的发现:包含视黄酸和bmp4或bmp2或其类似物用于诱导cdx2并维持分化细胞中的foxa2蛋白质表达,以促进向肠中肠内胚层细胞的分化。cdx2在定形内胚层(阶段1)或原肠管(阶段2)的蛋白质水平下不被表达。因此,本发明提供使多能干细胞分化以生成用于表达cdx2和foxa2的肠中肠内胚层细胞的方法。
26.定义
27.除非另有定义,否则本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。虽然与本文所述的那些方法和材料相似或等效的任意方法和材料都可以用于检验本发明的实践中,然而本文中描述优选的材料和方法。在描述和要求保护本发明时,将使用以下术语。
28.干细胞是由单细胞自我更新和分化以产生后代细胞的能力定义的未分化细胞,包括自我更新的祖细胞、非更新的祖细胞、以及终末分化的细胞。干细胞还由它们的以下能力来表征:从多个胚层(内胚层、中胚层和外胚层)体外分化成多种细胞谱系的功能细胞的能力,以及在移植后产生多个胚层的组织的能力和在注射到胚泡后基本上促成大多数组织(如果不是所有的组织的话)的能力。
29.根据干细胞的发育潜力,将它们分类为:(1)全能干细胞;(2)多能干细胞;(3)多潜能干细胞;(4)寡能干细胞;和(5)单能干细胞。全能细胞能够产生所有胚胎和胚胎外细胞类型。多能细胞能够产生所有胚胎细胞类型。多潜能细胞包括能够产生细胞谱系的子类,但均处于特定组织、器官或生理系统内的细胞(例如造血干细胞(hsc)可产生的后代包括hsc(自我更新)、局限于血细胞的寡能祖细胞、以及作为正常血液组分的所有细胞类型和成分(例如血小板))。寡能细胞可产生比多潜能干细胞更受限制的细胞谱系子类;并且单能细胞能够产生单细胞谱系(例如,生精干细胞)。
30.也基于可获取干细胞的来源而将它们分类。成体干细胞一般为在包含多个分化细胞类型的组织中发现的多潜能未分化细胞。成体干细胞可自我更新。在正常情况下,其也可分化产生特化组织细胞类型(其起源于该组织),并且可能产生其他组织类型。诱导多能干
细胞(ips细胞)为被转化成多能干细胞的成体细胞。(takahashi等人,cell,2006;126(4):663-676;takahashi等人,cell,2007;131:1-12)。胚胎干细胞为来自胚泡期胚胎的内细胞团的多能细胞。胎儿干细胞为源于胎儿组织或膜的干细胞。
31.胚胎组织通常定义为起源于胚胎的组织(在人体中是指受精至发育约六周的时期)。胎儿组织是指起源于胎儿的组织(在人体中是指发育约六周至分娩的时期)。胚胎外组织为与胚胎或胎儿相关但不起源于它们的组织。胚胎外组织包括胚外膜(绒毛膜、羊膜、卵黄囊和尿膜)、脐带和胎盘(其自身由绒毛膜和母体的底蜕膜形成)。
[0032]“分化”为非特化的(“未定向的”)或较少特化的细胞通过其获取特化的细胞(例如,诸如肠细胞或胰腺细胞)特征的过程。分化细胞而为已在细胞谱系中占据更特化的(“定向的”)位置的细胞。当被应用到分化的过程时,术语“定向的”是指在分化途径中已进行到这么一种程度的细胞:在正常情况下,其会继续分化成特定的细胞类型或细胞类型的子类,并且在正常情况下不能分化成不同的细胞类型或恢复到较少分化的细胞类型。“去分化”是指细胞通过其恢复到在细胞的谱系内较少特化(或定向)的位置的过程。如本文所用,细胞谱系定义细胞的遗传性,即源于何种细胞以及会产生什么细胞。细胞谱系将细胞放置在发育和分化的遗传方案内。
[0033]
在广义上,祖细胞为具有产生比其自身分化程度更高的后代的能力并且还保持补充祖细胞数目能力的细胞。根据此定义,因为干细胞为终末分化细胞的更直接前体,所以其本身也为祖细胞。在狭义上,祖细胞通常被定义为在分化途径中间(即,其起于干细胞)并且在成熟细胞类型或细胞类型子类生产过程中间的细胞。该祖细胞类型一般不能够自我更新。因此,如果本文涉及该类型的细胞,则其将被称为非更新的祖细胞或中间祖细胞或前体细胞。
[0034]
如本文所用,“标记”为在所关注的细胞中被差异表达的核酸或多肽分子。在该语境中,差异表达意指与未分化细胞相比阳性标记的水平升高并且阴性标记的水平下降。与其他细胞相比,标记物核酸或多肽在所关注细胞中的可检测水平充分地较高或较低,使得可使用本领域已知的多种方法中的任何一种方法来将所关注细胞与其他细胞鉴别和区分开来。
[0035]
如本文所用,当在细胞中充分地检测到特定标记物时,细胞“针对特定标记物呈阳性”或为“阳性的”。相似地,当在细胞中未充分检测到特定标记物时,细胞“针对特定标记物呈阴性”或为“阴性的”。具体地,通过荧光活化流式细胞术(“facs”)检测到的阳性通常大于2%,而通过facs检测到的阴性阈值通常小约1%。
[0036]
如本文所用,通过实时pcr(rt-pcr)的阳性具有小于28的循环(ct),并且使用低密度阵列(tlda)具有小于33的ct;而通过open的阴性大于28.5个循环,并且通过tlda的阴性大于33.5个ct。
[0037]
为了在静态体外细胞培养物中将多能干细胞分化成肠中肠内胚层细胞,通常将该分化过程视为通过连续阶段进展。在这里,肠道中肠内胚层的分化过程通过三个阶段发生。在这个逐步进展中,“阶段1”是指分化过程中的第一步,即多能干细胞分化成用于表达定形内胚层细胞的标记特征的细胞(下文中被可选地称为“阶段1细胞”)。“阶段2”是指第二步,将表达定形内胚层细胞的标记特征的细胞分化成用于表达原肠管细胞的标记特征的细胞(下文中被可选地称为“阶段2细胞”)。“阶段3”是指第三步,将表达肠管细胞的标记特征的
细胞分化成用于表达肠中肠内胚层细胞的标记特征的细胞(下文中被可选地称为“阶段3细胞”)。
[0038]
然而,应当指出在特定细胞群中并非所有细胞均以相同的分化速率经历所有这些分化阶段。因此,在体外细胞培养物中检测到存在该细胞,该细胞比存在于细胞群中的大多数细胞在分化途径中进程靠前或靠后的情况并不少见,尤其在处于后期分化阶段的培养物中。出于举例说明本发明的目的,本文描述了与上文定义的各阶段相关联的各种细胞类型的特征。
[0039]
如本文所用,“定形内胚层细胞”是指具有在原肠胚形成中由上胚层产生的细胞的特征并形成胃肠道及其衍生物的细胞。定形内胚层细胞表达下列标记中的至少一种标记:foxa2(也称为肝细胞核因子3-β(“hnf3β”))、gata4、sox17、cxcr4、鼠短尾突变体表型、刻耳柏洛斯、otx2、小耳畸形、c试剂盒、cd99和mixl1。定形内胚层细胞的标记特征包括cxcr4、foxa2和sox17。因此,定形内胚层细胞的特征可在于其对cxcr4、foxa2和sox17的表达。此外,取决于细胞能保持在第1阶段的时长,可能观察到hnf4α增多。
[0040]
如本文所用,“原肠管细胞”是指源于定形内胚层的细胞,这些细胞可产生所有的内胚层器官,诸如肺、肝、胰腺、胃和肠。相对于由定形内胚层细胞所表达的,原肠管细胞的特征可在于对hnf4α的表达大幅增加。
[0041]
如本文所用,“前肠内胚层细胞”是指产生食道、肺、胃、肝、胰腺、胆囊和十二指肠的大部分前部的内胚层细胞。前肠内胚层细胞的特征可在于其对sox2、pdx1、alb、sox17和foxa2的表达。
[0042]
如本文所用,“肠中肠内胚层细胞”是指产生小肠的内胚层细胞。肠中肠内胚层细胞的特征可在于其对cdx2、foxa2的表达和对pdx1(pdx1
lo
)的低表达。对某些hox基因的表达可将中肠内胚层和后肠内胚层区分开来。例如,hoxc5在中肠内胚层细胞中被优先表达。
[0043]
如本文所用,“后肠内切表皮细胞”是指产生大肠的内胚层细胞。因此,后肠内胚层的特征可在于其对cdx2、foxa2、hoxa13和hoxd13的表达。
[0044]
如本文所用,“间充质细胞”是指产生连接组织(诸如骨骼、软骨、淋巴和循环系统)的中胚层细胞。对hand1和foxf1的表达限定间充质细胞。
[0045]
术语“患者”或“受治疗者”或“宿主”是指利用组合物或药物组合物或根据本文所述方法鸡进行治疗的动物,包括哺乳动物,优选地为人。
[0046]
术语“有效量”或其等同形式是指一定量的试剂或化合物,该试剂或化合物包括但不限于生长因子,其足以促进和分化人类多能干细胞成分化的细胞群,例如定形内胚层、前肠内胚层、肠中肠内胚层、后肠内胚层、胰腺内胚层等。
[0047]
术语“正在施用”和“施用”在本文中可互换使用,并且意指可植入、注射、移植或以其他方式直接或间接施用于治疗部位的细胞。当细胞在半固体或固体装置中施用时,植入为合适的递送方式,尤其是将外科植入物植入身体内的精确位置,诸如进入皮下空间、网膜、肝、肾(肾胶囊)。可将液体或流体药物组合物施用到更一般的位置。
[0048]
如本说明书和所附权利要求中所用,除非内容另有明确说明,否则单数形式“一个”、“一种”和“所述”包括复数含义。因此,例如,对“一个细胞”的提及包括两个或更多个细胞的组合等等。
[0049]
如本文所用,术语“约”在涉及可测量值诸如量、持续时间等时,其意指涵盖与指定
值之间的以下变型:
±
20%和
±
0.1%,优选地
±
20%或
±
10%,更优选地
±
5%,甚至更优选地
±
1%,并且还更优选地
±
0.5%、
±
0.1%、0.05%或0.01%,因为此类变型适合执行所公开的方法。
[0050]
以下缩写可能出现在整个说明书和权利要求书:
[0051]
abcg2-atp结合盒,亚族g,成员2;
[0052]
alb-白蛋白;
[0053]
bmp-骨形态蛋白;
[0054]
cdx2-尾型同源盒2;
[0055]
cxcr4-c-xc趋化因子受体类型4;
[0056]
faf-bsa-脂肪酸游离牛血清白蛋白
[0057]
fgf-成纤维细胞生长因子;
[0058]
foxa2-叉头盒a2;
[0059]
gata4-gata结合蛋白4;
[0060]
gdf-生长分化因子;
[0061]
gip-葡萄糖依赖型促胰岛素多肽;
[0062]
glp-1-胰高血糖素样肽1;
[0063]
gsk3b-糖原合成酶激酶3β;
[0064]
hand1-心和神经冠衍生物表达1;
[0065]
hox-同源盒;
[0066]
htert-人端粒酶逆转录酶;
[0067]
klf-类kruppel因素;
[0068]
lgr5-含有富亮氨酸重复的g蛋白偶联受体5;
[0069]
mixl1-类混合配对的同源盒-1;
[0070]
oct4-八聚物结合转录因子4;
[0071]
otx2-正畸同源盒2;
[0072]
pdx1-胰腺和十二指肠同源盒1;
[0073]
ptf1a-胰腺特异性转录因子1a;
[0074]
sox-性测定区域y(sry)-盒;
[0075]
tra1-60-t细胞受体α-1-60;
[0076]
utf1-未分化的胚胎细胞转录因子1;
[0077]
wnt3a-无翼型mmtv整合位点族,成员3a;以及
[0078]
zfp42-锌指蛋白42
[0079]
具体实施方式
[0080]
多能干细胞具有分化成以下所有三个胚层的细胞的潜能:内胚层、中胚层和外胚层组织。可使用的多能干细胞的示例性类型包括经建立的多能细胞系,包括在妊娠期间的任何时间获取的胚胎前组织(诸如例如胚泡)、胚胎组织或胎儿组织,该任何时间通常但不一定是在约10至12周妊娠前。非限制性例子为经建立的人胚胎干细胞系或人胚胎生殖细胞系,诸如例如人胚胎干细胞系h1、h7和h9(wicell research institute,madison,wi,usa)。从已在不存在饲养细胞的情况下培养的多能干细胞群中取出的细胞也为适用的。使用对许
多多能相关转录因子诸如oct4、nanog、sox2、klf4和zfp42(基因组学和人类遗传学年度回顾(annu rev genomics hum genet)2011,12:165-185;也见于ips,细胞(cell),126(4):663-676)的强制表达衍生自成体体细胞的ips或经重新规划的多能细胞可被使用。在本发明的方法中使用的人胚胎干细胞也可如thomson等人(美国专利号5,843,780;科学(science),1998,282:1145-1147;发育生物学的当前主题(curr top dev biol)1998,38:133-165;美国国家科学协会公报(proc natl acad sci.)1995,92:7844-7848)所述那样进行制备。也可使用突变的人胚胎干细胞系,诸如bg01v(bresagen、athens、ga.),或衍生自成人体细胞的那些细胞,诸如takahashi等人在细胞(cell)131:1-12(2007)中公开的细胞。在某些实施方案中,适用于本发明的多能干细胞可根据以下文献中描述的方法来获取:(细胞干细胞(cell stem cell)4:16-19,2009);wright等人(细胞干细胞(cell stem cell)1:55-70,2007);wright等人(细胞干细胞(cell stem cell)2:230-240);wright等人nat biotechnol 26,101-106(2008);wright等人(细胞(cell)131:861-872,2007);以及美国专利申请公布号2011/0104805。在某些实施方案中,多能干细胞可能为非胚胎来源的。所有这些参考文献、专利和专利申请全文以引用方式并入本文,尤其是它们与多能细胞的分离、培养、扩增和分化有关的内容。
[0081]
多能细胞通过各种阶段分化,该各种阶段中是每个阶段的特征可在于其中有无特定标记存在。细胞分化到这些阶段是通过特定培养条件实现的,这些特定培养条件包括向培养基中添加某些生长因子,或者不向培养基中添加某些生长因子。一般来讲,这种分化可能涉及多能干细胞分化成定形内胚层细胞,这在本文中被称为阶段1。然后可将这些定形内胚层细胞另外分化成原肠管细胞,这在本文中被称为阶段2。然后,可将原肠管细胞继而分化成肠中肠内胚层细胞,这在本文中被称为阶段3。
[0082]
多能干细胞向表达肠中肠内胚层细胞的标记特征的细胞的分化
[0083]
多能干细胞的特性为本领域技术人员所熟知的,并且多能干细胞的其他特性有待继续鉴定。多能干细胞标记包括例如对下列标记中的一种或多种标记的表达:abcg2;cripto;foxd3;connexin43;connexin45;oct4;sox2;nanoghtertutf1;zfp42;ssea-3;ssea-4;tra-1-60;以及tra-1-81。
[0084]
示例性多能干细胞包括人胚胎干细胞系h1(nih代码:wa01)、人胚胎干细胞系h9(nih代码:wa09)、人胚胎干细胞系h7(nih代码:wa07)和人胚胎干细胞系sa002(瑞典(sweden)cellartis)。同样适用的是表达至少一种下列多能细胞标记特征的细胞:abcg2、cripto、cd9、foxd3、connexin43、connexin45、oct4、sox2、nanog、htert、utf1、zfp42、ssea-3、ssea-4、tra-1-60和tra-1-81。
[0085]
表达定形内胚层谱系的中的至少一种标记特征的细胞也适用于本发明。在本发明的一个实施方案中,表达定形内胚层谱系标记特征的细胞为原条前体细胞。在另选实施方案中,表达定形内胚层谱系标记特征的细胞为中内胚层细胞。在另选实施方案中,表达定形内胚层谱系标记特征的细胞为定形内胚层细胞。
[0086]
表达肠中肠内胚层谱系的标记特征中的至少一种标记特征的细胞也适用于本发明。在本发明的一个实施方案中,表达肠内胚层谱系标记特征的细胞为肠中肠内胚层细胞,其中该细胞表达foxa2和cdx2。在一些实施方案中,细胞不表达sox2、alb、ptf1a、hoxa13或lgr5。在实施方案中,表达肠内胚层谱系标记特征的细胞为肠中肠内胚层细胞,其中该细胞
表达foxa2、cdx2、sox9、pdx1、klf5和hoxc5中的每一者。在实施方案中,表达肠内胚层谱系标记特征的细胞为肠中肠内胚层细胞,其中细胞不表达sox2、alb、ptf1a、hoxa13和lgr5中的任一者。
[0087]
本发明提供了使用细胞培养条件和培养基对多能干细胞向肠中肠内胚层细胞进行分阶段的定向分化。在本发明的实施方案中,为了得到用于表达肠中肠内胚层细胞的标记特征的细胞,采用以多能干细胞诸如胚胎干细胞或诱导多能细胞开始的协议。该协议包括以下阶段:
[0088]
阶段1:利用合适的因子来处理由多能干细胞(诸如胚胎干细胞)获取的细胞培养系,以诱导其分化成用于表达定形内胚层细胞的标记特征的细胞。
[0089]
阶段2:利用合适的因子来处理来自阶段1的细胞,以诱导其另外分化成用于表达原肠管细胞的标记特征的细胞。
[0090]
阶段3:利用合适的因子来处理来自阶段2的细胞,以诱导其另外分化成用于表达前肠内胚层细胞的标记特征的细胞。
[0091]
用于评估对经培养的或经分离的细胞中的蛋白质标记和核酸标记的表达的方法为本领域的标准方法。这些方法包括定量反转录聚合酶链式反应(rt-pcr)法、northern印迹法、原位杂交法(参见例如,current protocols in molecular biology(ausubel等人编辑,2001增刊))以及免疫测定法(诸如分段材料的免疫组织化学分析、western印迹、以及用于未受损细胞中的容易获取的标记的facs(参见例如harlow和lane的使用抗体:实验室手册,纽约:冷泉港实验室出版社(using antibodies:a laboratory manual,new york:cold spring harbor laboratory)(1998))。另外,可将经处理的细胞群暴露于特异性识别由表达目标细胞类型的标记特征的细胞表达的蛋白质标记的试剂(诸如抗体)来确定分化效率。
[0092]
1.多能干细胞分化成用于表达定形内胚层细胞的标记特征的细胞
[0093]
可采用本领域已知的任何合适的方法或本发明提出的任何方法来使多能干细胞分化成用于表达定形内胚层细胞的标记特征的细胞。在本发明的一个实施方案中,将多能干细胞利用培养基诸如mcdb-131培养基(加利福尼亚州卡尔斯巴德的生命技术公司(life technologies,carlsbad,california))进行处理,该培养基补充有包含gdf8和gsk3β抑制剂(诸如以下美国专利申请中公开的环状苯胺吡啶并三嗪化合物:美国专利申请公布号2010/0015711;该专利全文以引用方式并入本文)的因子,以诱导分化成用于表达定形内胚层细胞的标记特征的细胞。存在宽范围的gsk3β抑制剂,诸如十字孢碱,并且优选的gsk3β抑制剂为14-丙-2-烯-1-基-3,5,7,14,17,23,27-七氮杂四环[19.3.1.1~2,6~.1~8,12~]二十七-1(25),2(27),3,5,8(26),9,11,21,23-壬-16-酮,在本文被称为“mcx化合物”。处理可涉及使多能干细胞与补充有约10ng/ml至1000ng/ml,优选地约50ng/ml至约150ng/ml,或者约75ng/ml至约125ng/ml,或者约100ng/ml的gdf8的培养基接触。处理还可涉及使多能干细胞与约0.1μm至10μm,优选地约0.1μm至5μm,或者约0.5μm至约2.5μm,优选地约1.5μm或约1.0μm的mcx化合物接触。培养基的其他组分可包括:约2.7g/1000ml至3.6g/1000ml,优选地2.7g/1000ml的碳酸氢钠;约0.1%至2.0%,优选地约0.5%的faf-bsa;以1:100稀释(“1x浓度”)的glutamax
tm
(加利福尼亚州卡尔斯巴徳的生命技术公司(life technologies corporation,carlsbad,california));以及浓度范围为约2mm至20mm,优选地4.5mm的d葡萄糖,以获取10mm d葡萄糖的浓度。
[0094]
可将多能细胞培养二到五天左右,优选地三到四天左右,使其分化成定形内胚层细胞。在一个实施方案中,在有效量的tgfβ信号分子和/或gsk3β抑制剂存在下培养多能细胞(例如,有效量的gdf8和mcx化合物)一天,然后在gdf8和较低浓度的mcx化合物的存在下培养一天,然后在存在gdf8但不存在mcx化合物的情况下培养一天。具体地,可将多能细胞在存在gdf8和约1.5μm mcx化合物的情况下培养一天,然后在存在gdf8和约0.1μm mcx化合物的情况下培养一天,然后在存在gdf8但不存在mcx化合物的情况下培养一天。在另选实施方案中,可将细胞在存在gdf8和约1.5μm mcx化合物的情况下培养一天,然后在存在gdf8和约0.1μm mcx化合物的情况下培养一天。
[0095]
可通过在执行特定协议前后分别检测是否有定形内胚层细胞的标记特征来确定是否生成用于表达这些标记特征的细胞。多能干细胞通常不表达此类标记。因此,在细胞开始表达定形内胚层细胞的标记特征诸如cxcr4、foxa2和sox17之后,便可检测到多能细胞的分化。在所述实施方案中,表达定形内胚层细胞标记特征的细胞为定形内胚层细胞。
[0096]
2.使表达定形内胚层细胞的标记特征的细胞分化成用于表达原肠管细胞的标记特征的细胞
[0097]
可使表达定形内胚层细胞的标记特征的细胞另外分化成用于表达原肠管细胞的标记特征的细胞。在一个实施方案中,形成用于表达原肠管细胞的标记特征的细胞包括利用包含fgf7的培养基诸如mcdb-131来培养用于表达定形内胚层细胞的标记特征的细胞,以使这些细胞分化。例如,培养基可包含约10ng/ml至100ng/ml,优选地约25ng/ml至约75ng/ml,或者约30ng/ml至约60ng/ml,或者约50ng/ml的fgf7。可在这些条件下培养所述细胞约二至三天,优选地约两天。
[0098]
在另一个实施方案中,分化成用于表达原肠管细胞的标记特征的细胞包括利用fgf7和抗坏血酸(维生素c)来培养用于表达定形内胚层细胞的标记特征的细胞。培养基诸如mcdb-131可包含约0.1mm至约1.0mm的抗坏血酸,优选地约0.1mm至约1.0mm,或者约0.2mm至约0.4mm,或者约0.25mm的抗坏血酸。该培养基还可包含约10ng/ml至100ng/ml,优选地约10ng/ml至约50ng/ml,或者约15ng/ml至约30ng/ml,或者约50ng/ml或约25ng/ml的fgf7。例如,该培养基可包含约0.25mm的抗坏血酸和约50ng/ml的fgf7。培养基的其他组分可包含:约2.7g/1000ml至3.6g/1000ml,优选地2.7g/1000ml的碳酸氢钠;约0.1%至2.0%,优选地约0.5%的faf-bsa;以1:100稀释(“1x浓度”)的glutamax
tm
;以及浓度范围为约2mm至20mm,优选地4.5mm的d葡萄糖,以获取10mm d葡萄糖的浓度。在一个实施方案中,利用fgf7和抗坏血酸来处理用于表达定形内胚层细胞的标记特征的细胞两天。当细胞开始表达原肠管细胞的标记特征(诸如对foxa2的表达和对hnf4α的增加的表达)时,可检测定形内胚层细胞的分化。在所述实施方案中,表达原肠管细胞标记特征的细胞为原肠管细胞。
[0099]
3.表达原肠管细胞的标记特征的细胞分化成用于表达肠中肠内胚层细胞的标记特征的细胞
[0100]
表达原肠管细胞的标记特征的细胞可另外分化成用于表达肠中肠内胚层细胞的标记特征的细胞。在一个实施方案中,通过在补充视黄酸和bmp4或bmp2的培养基诸如blar培养基(加利福尼亚州卡尔斯巴德的生命技术公司(life technologies,corporation,carlsbad,california))中培养原肠管细胞来将原肠管细胞另外分化成肠中肠内胚层细胞。在优选的实施方案中,培养基补充有约0.5μm至约5μm的视黄酸,优选地约1μm的视黄酸,
和约10ng/ml至约100ng/ml的bmp4或bmp2,优选地约50ng/ml的bmp4或bmp2。对该培养基的其他补充剂可包含:约0.1%至2.0%,优选地约0.5%的faf-bsa;glutamax
tm
;以及浓度范围为约2mm至20mm,优选地4.5mm的d葡萄糖,以获取10mm d葡萄糖的浓度。在一个实施方案中,表达原肠细胞的标记特征的细胞利用bmp4或bmp2和视黄酸处理3至5天,优选地5天。在5天的阶段3调节时间段期间,培养物的ph可在6.8至7.2的范围内(与s2d2的正常ph为7.3或更高相比)。
[0101]
本发明涉及通过在选定的培养基中培养人多能干细胞来产生肠中肠内胚层细胞群以用于生成肠中肠内胚层细胞的方法。在实施方案中,该方法在分阶段过程中诱导人多能干细胞分化成肠中肠内胚层细胞。在实施方案中,产生肠中肠内胚层细胞群。在一些实施方案中,产生基本上肠中肠内胚层细胞群。在实施方案中,肠中肠内胚层细胞形成并维持平坦培养物上的单层。在实施方案中,肠中肠内胚层细胞在培养物中稳定为单层。作为单层稳定或保持稳定为单层的细胞在本文中是指在培养物中不形成类球体的细胞单层。
[0102]
在实施方案中,大于50%的分化细胞表达肠中肠内胚层的标记特征。在实施方案中,大于60%、大于70%、大于80%、大于90%或大于95%的经分化的细胞表达肠中肠内胚层的标记特征。在实施方案中,表达肠中肠内胚层的标记特征的分化细胞为肠中肠内胚层细胞。在实施方案中,肠中肠内胚层细胞表达如通过facs分析和qpcr测定的cdx2和foxa2。在一些实施方案中,如通过if分析和qpcr测定地,肠中肠内胚层细胞表达选自sox9、pdx1、klf5和hoxc5的转录因子。在实施方案中,肠中肠内胚层细胞不表达选自sox2、alb、ptf1a的转录因子,如通过if分析和qpcr测定的,并且不表达选自hoxa13和lgr5的转录因子,如通过qpcr测定的。
[0103]
本发明的另外实施方案为产生肠中肠内胚层细胞的方法,该方法包括诱导定形内胚层细胞在培养物中分化成原肠管细胞。在实施方案中,定形内胚层细胞在包含抗坏血酸和fgf7的培养基中被培养。在另外的实施方案中,原肠管细胞在包含视黄酸和bmp2或bmp4的培养基中被培养。原肠管细胞被分化成肠中肠内胚层细胞。在一些实施方案中,原肠管细胞在酸性条件(酸性培养基)中被分化成肠中肠内胚层细胞。在特定实施方案中,酸性条件为blar培养基中的培养物。在从原肠管细胞到肠中肠内胚层细胞的5天分化调节期间,酸性培养物的ph可在6.8至7.2的范围内(与s2d2下的正常ph相比为7.3或更高)。在实施方案中,肠中肠内胚层细胞在培养物中形成并维持单层。
[0104]
在本文所述的实施方案中的每个实施方案中,人多能干细胞为人hesc或ips细胞。在上文和本文的实施方案中的每个实施方案中,如通过facs分析和qpcr所测定的,肠中肠内胚层细胞表达cdx2和foxa2。在所有实施方案中,肠中肠内胚层细胞表达选自sox9、pdx1、klf5和hoxc5的转录因子,如通过if分析和qpcr测定的。在上文和本文的实施方案中,不表达选自sox2、alb、ptf1a的转录因子,如通过if分析和qpcr测定的,并且不表达选自hoxa13和lgr5的转录因子,如通过qpcr测定的。在上文和本文的实施方案中,肠中肠内胚层细胞通过if分析和qpcr来表达cdx2、foxa2、sox9、pdx1、klf5和hoxc5。在实施方案中的每个实施方案中,肠中肠内胚层细胞不表达sox2、alb和ptf1a,如通过if分析和qpcr测定的,并且不表达hoxa13和lgr5,如通过qpcr测定的。
[0105]
作为上述和本文所述的分化协议的结果,使用特定的培养组分和培养条件具体地酸性培养条件诸如blar培养基中的培养物来生成用于表达肠中肠内胚层细胞的标记的细
胞培养物;细胞缺乏对如通过qpcr测定的hand1(中胚层/间充质谱系的标记)的表达。改变分化协议,以诱导多能干细胞至中肠/后肠内胚层谱系诸如在定形内胚层阶段1而不是原管细胞阶段2诱导干细胞,从而得到如由qpcr测定的表达hand1的内胚层间充质cdx2+中/后肠细胞的混合群。
[0106]
在某些实施方案中,肠中肠内胚层细胞群为基本上肠中肠内胚层细胞。在一些实施方案中,肠中肠内胚层细胞群包含大于70%的肠中肠内胚层细胞,优选地大于80%,大于90%,以及大于95%的肠中肠内胚层细胞。在一些实施方案中,肠中肠内胚层细胞群包含小于20%的间充质细胞,优选地小于15%,更优选小于10%,小于5%,小于2%,小于1%,小于0.5%。在实施方案中,肠中肠内胚层细胞缺乏对hand1的表达。
[0107]
对分化肠内胚层细胞的使用
[0108]
在本发明的另一个实施方案中,经分化的肠中肠内胚层细胞可用于单独或与分化的或成熟的内分泌细胞(例如,肠内分泌细胞)组合来治疗糖尿病患者或有患糖尿病风险的患者。在此类实施方案中,可将经分化的肠中肠内胚层细胞或它们的混合物施用到患有糖尿病例如1型或2型糖尿病的患者。在实施方案中,肠中肠内胚层细胞分化并成熟成为肠内分泌细胞。在实施方案中,肠中肠内胚层细胞分化并成熟成为肠内分泌细胞,并且肠内分泌细胞表达或分泌肠促胰岛素型激素。在实施方案中,肠促胰岛素包括glp1和gip。对细胞的施用可经由植入或注射而进入体内,具体地植入皮下空间、网膜、肝脏、肾等中。
[0109]
在上述本发明的一些实施方案中,肠中肠内胚层细胞的分化在体外诱导。在其他实施方案中,肠中肠内胚层细胞在体内另外分化和成熟。另一个实施方案涉及肠中肠内胚层细胞,其另外分化成体内的肠内分泌细胞或体内的与肠内分泌细胞的混合物。此类肠内分泌细胞表达或分泌肠促胰岛素。在实施方案中,肠内分泌细胞分泌的肠促胰岛素包括glp1和gip。
[0110]
在另外的实施方案中,肠中肠内胚层细胞用作用于鉴别小分子的起始材料,该小分子以高效率促进肠中肠内胚层细胞类型首先体外分化成肠内分泌前体,并且然后分化成用于表达或分泌肠内分泌细胞的肠促胰岛素。
[0111]
细胞和细胞群以及混合物诸如本文所述的那些可为微或宏胶囊包封的并随后移植到哺乳动物宿主体内。经包封的细胞或单独细胞可在皮下或在体内的任何其他位置移植(施用),由此细胞可在体内血管化并分化和成熟。
[0112]
实施例:
[0113]
鉴于以下非限制性实施例,可另外理解本发明。
[0114]
实施例1
[0115]
产生具有cdx2和foxa2共存在/共表达的肠中肠内胚层细胞群的方法
[0116]
以下实施例描述了从人胚胎干细胞(“hesc”)生成肠中肠内胚层细胞的定向方法。“肠中肠内胚层”是指对应的体内或原位细胞类型,其其cdx2阳性和foxa2阳性内胚层细胞,其存在于小鼠发育期间的大约胚胎的第8.5天(“e8.5”),或人类胚胎发育期间的约3-4周时间点。
[0117]
材料和方法
[0118]
细胞培养物:在第28代利用ez8培养基(cat#a1516901gibco,赛默飞世尔科学公司(thermo fisher scientific))培养的人胚胎干细胞系h1(“h1-hesc”)(wa01细胞,威斯康
辛州麦迪逊的wicell研究所,麦迪逊,威斯康星州(wicell research institute,madison,wisconsin))被接种作为matrigel
tm
上的0.094
×
106细胞/cm2密度下的单细胞(以1:30稀释率)(纽约州康宁的康宁公司(corning incorporated,corning,new york),目录号356231),在dulbecco的改良伊格尔培养基营养物混合物f-12(“dmem-f12”)培养基(“dmem-f12”)(加利福尼亚州卡尔斯巴德的生命技术公司(life technologies corporation,carlsbad,california),目录号11330-032)中涂布的培养皿,具有以下内容物:
[0119][0120][0121]
约四十八小时后接种,将培养物在不完全pbs(不含镁或钙的磷酸盐缓冲盐水)(加利福尼亚州卡尔斯巴德的生命技术公司(life technologies corporation,carlsbad,california),目录号14190)中洗涤。rock抑制剂y-27632(y化合物)仅用于培养的前24小时。
[0122]
分化:使用以下协议来分化培养物。在协议的阶段1至3期间,将培养物保持在平面贴壁培养物上。然而,其他人已描述了使用悬浮培养物的分化(包括us us2014/0242693,其全文以引用方式并入);本文所述的协议可被修改和在悬浮液中被执行,这提供了制造的可
扩展性。以下命名法s#d#指定了阶段1至3期间的确切时间。例如,s1d3为阶段1第3天。简而言之,每个阶段限定朝向定形内胚层(阶段1)、原肠管(阶段2)和肠中肠内胚层(阶段3)的分化。
[0123]
a.阶段1(3天):将细胞在以下阶段1培养基中培养一天:
[0124][0125][0126]
细胞然后在以下培养基中再培养一天:
[0127]
mcdb-131培养基 碳酸氢钠2.7g/1000mlfaf-bsa0.5%:glutamax
tm
1x浓度d葡萄糖4.5mm以获取10mmd葡萄糖的浓度gdf8100ng/mlmcx化合物0.1μm
[0128]
然后在与上文第2天相同的培养基中再培养细胞一天,但没有mcx化合物。
[0129]
b.阶段2(2天):利用以下培养基处理细胞两天:
[0130][0131][0132]
c.阶段3(5天):利用blar 001定制培养基处理细胞五天:
[0133][0134]
bmp4或bmp2在本方法的阶段3中可用于实现单层中具有cdx2和foxa2蛋白质共存的肠中肠内胚层细胞,如图1a至图4b(基于bmp4)和图5a至图7(基于bmp2)中所示的。
[0135]
表i.blar培养基的组分列表。
[0136]
[0137][0138]
[0139]
经分化的细胞的定量:用于定量蛋白质存在的协同定位,通过facs来收集并分析s3d5细胞。facs染色如在自然生物科学(nature biotechnology),2014(32)11,1121-1133中所述进行,其全文以引用方式并入本文,并且使用在表ii中列出的抗体。简言之,将细胞在37℃下在tryple
tm
express(生命技术公司(life technologies),目录号12604)中温育5-10分钟,释放到单细胞悬浮液中,此后利用包含0.2%的bsa的pbs的染色缓冲液(bd sciences,目录号554657)将该细胞洗涤两次。通过利用活/死紫色荧光活性染料(加利福尼亚州卡尔斯巴德的生命技术公司(life technologies corporation,carlsbad,california),目录号l34955)在4℃下进行30分钟,然后在冷pbs中单次洗涤。将细胞固定在300μlcytofix/cytoperm缓冲液(加利福尼亚州圣何塞的bd生物科学公司(bd biosciences,san jose,california),目录号554723)中,然后在perm/wash缓冲液(加利福尼亚州圣何塞的bd生物科学公司(bd biosciences,san jose,california),目录号554722)中洗涤两次。然后将细胞与适当的抗体在4℃下孵育30分钟(针对未缀合的抗体)或1小时(针对缀合的抗体),并且然后在使用bd facs diva软件在bd facs canto ii上进行分析之前洗涤两次(至少获取30,000项事件)。在facs分析期间排除非活细胞,并通过使用同种型抗体(“igg”)来确定门控。igg facs数据显示为所呈现的每个facs实验的上面板。使用阳性对照诸如caco-2细胞或阴性对照诸如s1d3定形内胚层(“de”)细胞)来测试抗体的特异性。
[0140]
表ii.用于facs分析的抗体的列表。
[0141][0142][0143]
为了定量各阶段的蛋白质共定位,作为单层收获caco-2、s2d2、s3d2和s3d5细胞,并通过免疫荧光(“if”)进行分析。注意,在if图像中看到的形态为通过粘附培养物单层细胞刮除的方法引起的。如自然生物技术(nature biotechnology),2014(32)11,1121-1133中所述制备并染色h1-hesc衍生的细胞,并使用表iii中列出的抗体。针对冷冻切片,利用
pbs来冲洗细胞,然后在4℃下在4%pfa(密苏里州圣路易斯的西格玛奥德里奇公司(sigma aldrich co.llc,st.louis,missouri),目录号158127)中过夜固定。在固定之后,除去4%的pfa,利用pbs冲洗细胞两次,并在4℃下在30%蔗糖溶液(俄亥俄州梭仑的amresco公司(amresco,solon,ohio),目录号0335)中孵育过夜。将样品在oct溶液(加利福尼亚州托兰斯的樱花辉盛达美国公司(sakura finetek usa inc.,torrance,california),目录号4583)中冷冻保存,并将5μm切片置于superfrost plus载玻片上(宾夕法尼亚州拉德纳的vwr国际公司(vwr international,llc,radnor,pa),目录号48311-703)。这蒙迪欧if染色,在4℃下以适当的稀释度加入一次抗体过夜,而在室温下加入二次抗体30分钟,然后利用pbs冲洗并加入具有dapi的vectastain固定试剂(加利福尼亚州伯林格姆的向量实验室公司(vector laboratories inc.,burlingame,california),目录号h-1200)。使用nikon ti荧光显微镜(纽约州梅尔维尔的尼康仪器公司(nikon instruments,inc.,melville,ny))来使切片可视化。
[0144]
表iii:用于if分析的抗体的列表。
[0145]
[0146][0147]
针对在不同阶段的基因表达的定量,收获caco-2、1-hesc、s1d3、s2d2、s3d2和s3d5细胞,如自然生物技术(nature biotechnology),2014(32)11,1121-1133中所述的。简而言之,使用定制阵列(加利福尼亚州福斯特城的应用生物系统公司(applied biosystems,foster city,california))来在细胞中评估基因表达。开放阵列用于cdx2、foxa2、sox2、sox9、pdx1、alb、ptf1a,并且低密度阵列(tlda)用于klf5、hoxc5和lgr5,其中管家基因gapdh用于两种测试。使用序列检测软件(加利福尼亚州福斯特城的应用生物系统公司(applied biosystems,foster city,california))来分析数据,并且使用gapdh作为未分化的h1-hesc的管家基因使用δδct方法来将数据归一化。。引物详情列于表iv中。
[0148]
表iv:rt-qpcr引物的列表。
[0149] 基因测定id1albhs00609411_m12cdx2hs00230919_m13foxa2hs00232764_m14gapdhhs99999905_m15pdx1hs00236830_m16ptf1ahs00603586_g17sox2hs01053049_s18sox9hs00165814_m19hoxc5hs00232747_m110klf5hs00156145_m111lgr5hs00969422_m112hoxa13hs00426284_ml13hand1hs00231848_ml
[0150]
结果
[0151]
分化方法的概述(包括向每个阶段添加的重要培养基组分、生长因子和小分子,以及区分肠中肠内胚层细胞的关键阶段特异性标记(foxa2;cdx2;klf5;sox9;pdx1
lo
))在图1a中描绘。与针对s2d2提出的中性ph(7.35
±
0.04)相比,在阶段3的整个过程期间,细胞在blar培养基中被暴露于稍微酸性条件(ph;s3d1,6.98
±
0.05;s3d2,7.02
±
0.04;s3d5,7.18
±
0.03)(图1b),并且作为结果blar培养基中的碳酸氢钠含量降低。在阶段3的5天期间,培养物的ph可在约6.8至7.2的范围内。图1c描绘了s3d5单层(左侧)和人上皮结肠腺癌细胞系(“caco-2”)(右侧)的代表性相位对比图像,其被用作用于表征分化的基准。观察到s3d5处的均匀形态。使用nc-100(丹麦alleroed的chemometec公司(chemometec,alleroed,denmark),目录号900-004)来表征细胞数示出了一个hesc分化成4.56
±
2.60个s3d5后肠内胚层细胞(图1d)。
[0152]
利用bmp4的分化方法有效地生成和维持单层中的肠中肠内胚层细胞,每个肠中肠内胚层细胞在转录物和蛋白质水平上包含cdx2和foxa2两者。图2a(底部)示出了针对cdx2和foxa2蛋白质两者90.0
±
5.85%的s3d5细胞共存,这类似于在caco-2细胞中观察到的百分比(86.0
±
6.67)。相反,定形内胚层(de-s1d3)细胞缺乏cdx2和foxa2共存(2.3
±
1.2)。基因表达分析示出了在阶段3期间诱导的cdx2(图2b)和保持的foxa2(图2c)。图2d示出了在建立foxa2阳原始肠内胚层阶段s2d2(图2d-i)之后,cdx2蛋白质水平和cdx2/foxa2蛋白质共存的诱导通过s3d2逐渐增加(图2d-ii),并且在s3d5(图2d-iii)处达到与caco-2细胞中所见类似的水平(图2d-iv)。cdx2蛋白质在底行上描绘,并且foxa2蛋白在顶行上描绘。
[0153]
另外的tf的转录物和蛋白质水平在s3d5处发现,其构成稳健的肠中肠内胚层诱导。图3a至图3p示出实现了适当的肠中肠内胚层。除了cdx2和foxa2共存外,s3d5细胞还表达sox9、pdx1、klf5、hoxc5的共存,但不表达sox2、alb、ptf1a和lgr5。所有tf的蛋白质存在被描绘成单独的单通道图像。图3a(底部)示出了在s3d5处针对cdx2和sox9共存在98.7
±
0.25%的细胞。sox9基因表达的强诱导与caco-2细胞中观察到的水平相当(图3b),并且观
察到通过if分析而评估的蛋白质存在(图3c)。针对cdx2和pdx1两者,69.4
±
14.2%的细胞为共阳性的(图3d-底部)。与胰腺偏向的s4d3细胞相比,pdx1基因表达以低水平被诱导(参见例如us2014/0242693)(图3e),并且这在if分析中被反映为低至不存在蛋白质水平(图3f)。
[0154]
s3d5细胞不表达前内胚层tf sox2,并且只有1.45
±
0.15的s3d5细胞表现出sox2和cdx2共存(图3g-底部;3i),并且基因表达低于在hesc和caco-2细胞中所见的水平(图3h)。在s3d5处上调对klf5的基因表达,其对于后肠内胚层的正常发育是必需的(图3j)。观察到s3d5的cdx2阳性细胞内的klf5的共存(图3k)。在s3d5细胞中未观察到alb基因表达(图3l)和蛋白质存在(图3m)。类似地,与胰腺偏向的s4d3细胞相比,在s3d5细胞中未诱导对ptf1a(胰腺谱系标记)的基因表达(图3n)。存在于胚胎肠中肠内胚层中的同源盒基因hoxc5在s3d5细胞中被强烈诱导(图3o)。图3p示出了lgr5(在小鼠中从妊娠中期开始的胚胎肠内胚层的标记)在s3d5细胞中未被诱导(图3p)。图3q示出了hoxa13(肠后肠内胚层的标记)在s3d5细胞中未被诱导(图3p)。
[0155]
图4a至图4b说明了分化s3d5细胞的增殖谱。图4a描绘了caco-2细胞,其中大多数cdx2-蛋白质阳性细胞处于活跃细胞周期中(如通过与ki67蛋白质的共表达所指示的)(左侧),并且阶段3期间随时间推移而减小的h1-hesc衍生细胞的增殖指数(s3d2-中间;s3d5-右侧)。cdx2(顶行)和ki67(底行)蛋白质水平被描绘为单通道图像。通过facs评估的总s3d5细胞的ki67-蛋白质阳性细胞百分比(总细胞》90%cdx2-阳性)为16.8
±
3.12,这与在s1d3(97.3
±
1.3)和caco-2细胞中看到的百分比(99.2
±
0.2)形成对比(图4b)。
[0156]
在该方法的阶段3期间,bmp2可用作bmp4的替代方案,以产生具有cdx2和foxa2蛋白质共存的肠中肠内胚层细胞的单层。图5a描绘了分化方法的概述,包括添加到每个阶段的培养基组分、生长因子和小分子,以及分化肠中肠内胚层细胞的关键阶段特异性标记(foxa2、cdx2、klf5、sox9和pdx1
lo
)。与在s2d2处注意到的中性ph(7.35
±
0.04)相比,在整个阶段3期间,细胞在blar培养基中暴露于微酸性条件下(ph;s3d1,6.92;s3d2,7.01;s3d5,7.22)(图5b),以及作为结果blar酸性培养基中的碳酸氢钠水平降低。图5c描绘了s3d5单层(左侧)和caco-2细胞(右侧)的代表性相位对比图像。观察到s3d5处的均匀形态。
[0157]
分化方法生成并维持单层中的适当的肠中肠内胚层细胞,每个肠中肠内胚层细胞在转录物和蛋白质水平上包含cdx2、foxa2、klf5、sox9、pdx1
lo
和hoxc5。所有tf蛋白质水平均被描述为单通道if图像。图6a(底部)示出了94%的s3d5细胞针对cdx2和foxa2蛋白质两者共存,这类似于在caco-2细胞中观察到的百分比(86.0
±
6.67)。基因表达分析示出了在阶段3期间诱导cdx2(图6b)并保持foxa2(图6c)。图6d示出了在s3d5处诱导cdx2蛋白质水平和完全cdx2/foxa2蛋白质共存(图6d),其与caco-2细胞中观察到的水平相当(图2d-iv)。图6e(底部)示出了在s3d5处99.8%的细胞针对cdx2和sox9两者共存。观察到对sox9基因表达的强烈诱导,这类似于caco-2细胞(图6f)中的水平,并且观察到通过if分析而评估的蛋白质存在(图6g)。45.5%的细胞对cdx2和pdx-1两者为共阳性的(图6h-底部)。当与胰腺偏向的s4d3细胞相比时,pdx1基因表达以低水平为诱导(图6i),并且低至不存在的蛋白质水平被反映在if分析中(图6j)。在s3d5细胞中未观察到前内胚层tf sox2,因为0.8%的s3d5细胞表现出sox2和cdx2共存(图6k-底部;6m),并且基因表达低于在hesc和caco-2细胞中所见的水平(图6l)。对klf5的基因表达(表明后肠内胚层正常发育的必需标记)在s3d5处强烈上
调(图6n)。观察到s3d5处的cdx2阳性细胞内klf5的蛋白质共存(图6o)。在s3d5细胞中未观察到alb基因表达(图6p)和蛋白质存在(图6q)。与胰腺偏向的s4d3细胞相比,在s3d5细胞中没有诱导对胰腺谱系分配tf即ptf1a的基因表达(图6r)。存在于胚胎肠中肠内胚层中的同源盒基因hoxc5在s3d5细胞中被强烈诱导(图6s)。图6t表明lgr5(在妊娠中期开始的胚胎肠内胚层的标记)在s3d5细胞中未被诱导。图6u表明hoxa13(肠后肠内胚层的标记)在s3d5细胞中未被诱导(图6u)。
[0158]
图7表征分化s3d5细胞的增殖谱,示出了caco-2细胞,其中与阶段3期间h1-hesc衍生细胞的较低的增值指数相比(s3d5-右侧),大多数cdx2-蛋白质阳性细胞处于活跃细胞周期中(如与ki67蛋白的共表达所指示的)(左侧)。cdx2(顶行)和ki67(底行)蛋白质水平被描绘为单通道图像。通过facs评估,与caco-细胞(99.2
±
0.2)(图7;4b)相比,总s3d5细胞的ki67-蛋白质阳性细胞百分比(总细胞》90%cdx2-阳性)为14.1%,这与在s1d3处观察到的百分比(97.3
±
1.3)形成对比。
[0159]
实施例2
[0160]
从定形内胚层开始并使用fgf4和wnt激动剂的肠培养,生成cdx2+中/后肠细胞的内胚层间充质混合物
[0161]
该实施例表明使用fgf4和wnt激动剂在定形内胚层阶段开始从肠培养生成的cdx2+中/后肠细胞的内胚层-间充质混合质量(spence等,自然(nature),2011;470:105-109;watson等人,自然医学(nature med),2014;11:1310-1314)。为了检查spence等人在下文中描述的对中肠/后肠内胚层细胞的诱导,使用以下协议来分化hesc。注意,本实施例中概述的分化条件与实施例1的不同之处如下:(i)肠道条件起始点在定形内胚层阶段开始;(ii)使用与ra和bmp4或bmp2不同的生长因子和小分子;以及(iii)未使用酸性培养条件。
[0162]
材料和方法
[0163]
细胞培养物:如实施例1中所述的,培养并维持h1-hesc细胞。
[0164]
分化:使用以下协议来分化培养物。
[0165]
阶段1-模拟物(3天):细胞在以下阶段1培养基中培养一天:
[0166][0167]
然后将细胞在以下培养基中再培养一天:
[0168][0169]
然后将细胞在以下培养基中再培养一天:
[0170]
rmpi1640培养基 青霉素-链霉素1x浓度(来自原液浓度的1:100稀释)l-谷氨酰胺2mm激活素a100ng/ml定义woi2.0%:
[0171]
后阶段1(2天):例如,ps1d1是阶段1后第1天,并且ps1d2是阶段1后第2天。将细胞在以下后阶段1培养基中培养两天:
[0172][0173]
定量:基因表达的相对照成像和量化遵循实施例1中的程序。
[0174]
结果
[0175]
分化方法的概述,包括添加到每个阶段的培养基组分、生长因子和小分子,以及分化肠中/后肠内胚层细胞(hand1)的特征或关键阶段特异性标记,这描绘于图8a中。肠道调节(后阶段1),在定形内胚层阶段开始,具有500ng/ml fgf4和3μm chior99021(watson等人)或500ng/ml wnt3a(spence等人)。术语“阶段1-模拟物”是指该实施例中的定形内胚层分化协议,其不同于在参考实施例1中描述的阶段1调节的“s1d3-原始”。图8b示出以下的相位对比图像:h1-hesc细胞(顶行,左侧),后阶段1细胞,其利用500ng/ml fgf4和3μm chiron99021(顶行,中间)调节两天,后阶段1细胞,其利用500ng/ml fgf4和500ng/ml wnt3a(顶行,右侧)调节两天,以及由ra/bmp4(底行,左侧)调节的s3d5单层,以及由ra/bmp2调节的s3d5单层(底行,右侧)(来自实施例1)。
[0176]
在调节两天后实现cdx2基因表达的诱导,但与ra/bmp2或ra/bmp4 s3d5相比,其水平低得多(图8c)。然而,维持对内胚层标记foxa2的基因表达(图8d),并且强烈诱导中胚层/间充质标记hand1(图8f)。而且,与ra/bmp4和ra/bmp2调节不同,klf5在两天时间点未被诱导(图8e)。如图8f最终所示,该基因表达模式反映了watson等人和斯宾塞等人所见的异质细胞群,其不仅包含cdx2
+
foxa2
+
内胚层群,还包含显著的间充质cdx2
+
细胞群。相反,ra/bmp4或ra/bmp2后阶段2(原肠管细胞)调节不诱导中胚层/间充质标记物hand1;仅诱导内胚层cdx2
+
foxa2
+
群。
[0177]
在描述本发明及其各种实施方案中,为了清楚起见,采用特定术语。然而,本发明不旨在被限制于如此选择的特定术语。相关领域的技术人员将会认识到,在不脱离本发明广泛构思的情况下,可采用其他等同部件,并且可开发出其他方法。在本说明书中任何地方引用的所有参考文献均引入作为参考,如同每个参考文献已单独结合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1