有机半导体化合物及包含其的有机光电元件的制作方法
1.本发明是关于一种化合物及其包含的光电元件,其特别是一种具有良好的物理化学性质,并可使用对环境友善的有机溶剂进行加工操作,提升其生产的便利性及降低对环境影响的有机半导体化合物,及其具有优异的红外光范围响应值与低暗电流密度的有机光电元件。
背景技术:
2.近年来,为了制造更通用、成本更低的电子元件,对于有机半导体化合物(organic semiconducting compound)的需求日增,此一现象是因有机半导体化合物与传统半导体材料相比,其吸光范围广、光吸收系数大且具有可调控结构,其吸光范围、能阶及溶解度皆可以依照目标需求做调整,另外有机材料在元件制作上具有低成本、可挠曲性、毒性较低及可大面积生产的优点,使有机光电材料在各个领域都具有良好的竞争性。此类化合物的应用范围十分广泛,包含有机场效应晶体管(organic field-effect transistor,ofet)、有机发光二极管(organic light-emitting diode,oled)、有机光传感器(organic photodetector,opd)、有机光伏(organic photovoltaic,opv)电池、传感器、存储元件和逻辑电路的各种元件或元件中。其中有机半导体材料于上述应用的各元件或元件中,通常以薄层的形式存在,其厚度约为50nm至1μm。
3.有机光传感器(opd)为近年新兴的有机光电领域,此类装置可侦测环境中的各种光源,并应用于如医疗照护、健康管理、智能驾驶、无人空拍机或数字化家庭等各种领域,因此依据应用领域的不同而有不同的材料需求,且由于使用有机材料,使装置具备良好的可挠曲性。受益于现今材料科学的发展,opd不仅可制成薄层,也可针对特定波长进行吸收;而目前市面上的产品依据光源不同,需要吸收的光线波段也各异,因此利用有机材料具有吸光范围可调控性,能有效针对需要的波段进行吸收而达到降低干扰的效果,且有机材料的高消光系数也能有效的提高侦测效率。近年来opd的发展从紫外线、可见光,逐渐发展至近红外线(near-infrared,nir)。
4.其中,有机光传感器中的主动层材料直接影响元件效能,因此扮演重要角色,而其材料可分为供体与受体两部分。供体材料方面常见的材料包含有机聚合物、低聚物或小分子单元,现今以发展d-a型的共轭聚合物为主流,藉由其聚合物中多电子单元与缺电子单元间交互作用而形成的推—拉电子效应,可用来调控聚合物的能阶与能隙;而搭配的受体材料通常为具有高导电度的富勒烯衍生物,其吸光范围大约在400-600nm,此外亦包含石墨烯、金属氧化物或量子点等,或是近年来逐渐兴起的非富勒烯有机化合物及其衍生物等。
5.在智能驾驶、无人空拍机领域中,为了避免讯号过强的可见光干扰,发展趋势为采用nir吸收波段;并且为了有更好的穿透度和长距离侦测性质,应用波长需超过1000nm。因应逐渐提高的应用领域需求,所采用的光电元件需要有更高的响应度(responsivity)和更低的暗电流密度(dark current density,jd)。另外,对应各国环保法规要求和良好加工操作性的要求,材料制程中必须尽可能使用对环境友善的溶剂,利于湿式制程操作。现今具有
相关潜力的有机半导体材料,有使用供体-受体架构的聚合物类型者,或是小分子类型者,仅在《1000nm的吸光范围有良好表现,而吸收范围》1000nm的材料其元件表现不彰。目前较具竞争力的聚合物型有机半导体材料,如j.mater.chem.c,2020,8,10098-10103前案所揭示,即使可应用于大于1000nm的范围,但在700nm波段有光电响应低落的问题而形成严重缺口,难以做到全波段皆有良好响应的效果。另外,由于本领域常用的p3ht聚合物分子容易形成堆栈,必须使用添加剂避免堆栈产生以降低所制备的有机光电元件的暗电流密度,但添加剂的使用会导致元件稳定度下降,影响有机光电元件的使用寿命。进一步而言,此类有机半导体材料在湿式加工所使用的溶剂主要为含卤素的有机溶剂,对环境造成负面影响,因此,开发一种在红外光具有更优异的光响应性能、更佳的电性表现、材料分子不易形成堆栈且不须使用含卤素的有机溶剂进行操作的有机半导体化合物,是有其需求。
技术实现要素:
6.鉴于上述对于现今材料不足处的问题,本发明的目的为提供一种新的有机半导体化合物,特别是一种p型有机半导体化合物,其可克服来自先前技术的有机半导体化合物的缺点,及提供一或多个上述有利特性,特别是可藉由适合量产的方法来合成、具备包含大于1000nm波长范围的全波段光响应性能、具有良好的元件效率、以及在生产制程中分子不易形成堆栈、以及表现出良好的加工性和对环境友善的溶剂的良好溶解度,有利于使用溶液加工法大规模制造。
7.本发明的另一目的,为提供一种新的有机光电元件,其中该元件包含本发明的有机半导体化合物,具有宽广波段的光响应性能,其范围涵盖紫外光-可见光-近红外光、更低的暗电流密度、以及优异的侦测度。
8.为了达到上述的目的,本发明提供一种有机半导体化合物,以下式表示:其中,a0为一拉电子基团;a1、a2为不同于a0的相同或不同的拉电子基团;ar0、ar1、ar2、π0、π1、π2各自独立为相同或不同的推电子基团;d、e、f为各自独立的选自0到5的整数;以及a,b,c为实数且a+b+c=1,其中0《a≤1,0《b≤1,0《c≤1。
9.为了达到上述的另一目的,本发明进一步是关于一种有机光电元件,其包含:一基板;一电极模块,其设置于基板之上,该电极模块包含一第一电极和一第二电极;以及一主动层,设置于该第一电极和该第二电极之间,该主动层的材料包含至少一种如本发明的有机化合物;其中该第一电极和该第二电极的至少一者为透明或半透明。
附图说明
10.图1a-1f:其为本发明的有机光电元件的结构示意图;图2a-2b:其为本发明的有机半导体化合物的溶液态和薄膜态的吸收光谱;图3a-3b:其为本发明的有机光电元件的实验结果图表;以及图4a-4b:其为本发明的有机光电元件的实验结果图表。【图号对照说明】
10有机光电元件100基板110电极模块112第一电极114第二电极120主动层130第一载子传递层140第二载子传递层
具体实施方式
11.为了使本发明的结构特征及所达成的功效有更进一步的了解与认识,特用较佳的实施例及配合详细的说明,说明如下:
12.本发明的有机半导体化合物除了易于合成,并且在生产装置的制程中表现出良好的加工性和对溶剂的良好溶解度,有利于使用溶液加工法大规模制造。
13.本发明的有机半导体化合物的制备可基于发明所属技术领域中具有通常知识者已知且描述于文献中的方法达成,将会进一步于实施例中说明。
14.本发明提供的有机半导体化合物,以下式表示:其中,a0为一拉电子基团;a1、a2为不同于a0的相同或不同的拉电子基团;ar0、ar1、ar2、π0、π1、π2各自独立为相同或不同的推电子基团;d、e、f为各自独立的选自0到5的整数;以及a,b,c为实数且a+b+c=1,其中0《a≤1,0《b≤1,0《c≤1。
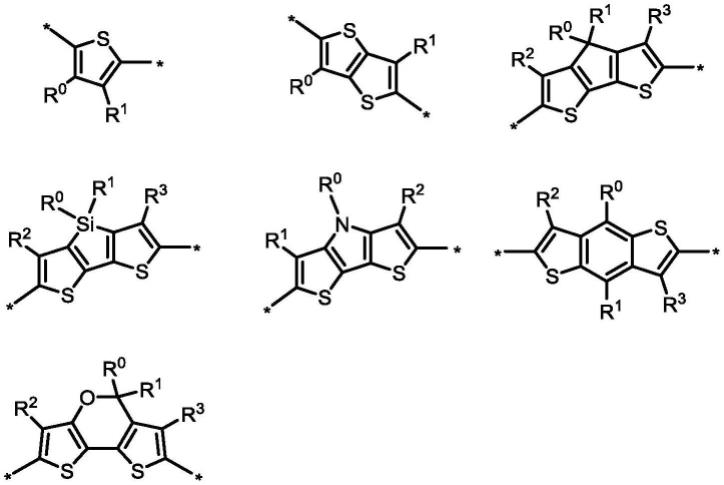
15.本发明的有机半导体化合物,其中ar0、ar1、ar2、π0、π1、π2为分别选自由以下基团组成的群组:组成的群组:其中r
0-r3为选自由以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷
基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基、未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个ra取代的芳香环、经一个或多个ra取代的杂环、经一个或多个ra取代的稠环、和经一个或多个ra取代的稠杂环;以及ra为选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基。
16.本发明的有机半导体化合物,其中a0为选自由以下基团组成的群组:其中ar3与ar4分别选自以下基团组成的群组:未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个ra取代的芳香环、经一个或多个ra取代的杂环、经一个或多个ra取代的稠环、和经一个或多个ra取代的稠杂环;ar5为选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基、未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个rb取代的芳香环、经一个或多个rb取代的杂环、经一个或多个rb取代的稠环、和经一个或多个rb取代的稠杂环;ra和rb各别选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基;以及g为选自1到8的正整数。
17.于本发明的该有机半导体化合物中,其中a1为选自由以下基团组成的群组:
其中r
4-r6为选自由以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基、未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个ra取代的芳香环、经一个或多个ra取代的杂环、经一个或多个ra取代的稠环、和经一个或多个ra取代的稠杂环;x为选自o、s、或se;ar6与ar7分别选自以下基团组成的群组:未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个ra取代的芳香环、经一个或多个ra取代的杂环、经一个或多个ra取代的稠环、和经一个或多个ra取代的稠杂环;ar8为选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基、未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个rb取代的芳香环、经一个或多个rb取代的杂环、经一个或多个rb取代的稠环、和经一个或多个rb取代的稠杂环;ra和rb各别选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基;以及h为选自1到8的正整数。
18.于本发明的该有机半导体化合物中,其中a2为选自由以下基团组成的群组:
其中r
7-r
14
为选自由以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基、未经取代的芳香环、未经取代的杂环、未经取代的稠环、未经取代的稠杂环、经一个或多个rb取代的芳香环、经一个或多个rb取代的杂环、经一个或多个rb取代的稠环、和经一个或多个rb取代的稠杂环;rb为选自以下基团组成的群组:氢原子、卤素、氰基、c1~c30的直链烷基、c3~c30的支链烷基、c1~c30的硅烷基、c2~c30的酯基、c1~c30的烷氧基、c1~c30的烷硫基、c1~c30的卤代烷基、c2~c30的烯烃、c2~c30的炔烃、c2~c30的经氰基取代的烷基、c1~c30的经硝基取代的烷基、c1~c30的经羟基取代的烷基、和c3~c30的经酮基取代的烷基;以及x为选自o、s、或se。
19.以下举例说明本发明的有机半导体化合物的制备方式
20.有机化合物c10的制备如下:
21.首先,化学反应式1:取c1(10g,86.3mmol)放入500ml四颈反应瓶,加入50ml无水四氢呋喃(tetrahydrofuran,thf)后搅拌溶解并降温至15℃。缓慢滴入34.5ml正丁基锂(n-buli),溶液呈淡橘色。回温至室温并搅拌1小时。在15℃下,滴入c2(19.81g,5.62mmol),此时溶液呈淡黄色澄清。将反应物回温至室温并搅拌20小时,的后加入5ml水中止反应。以旋转浓缩除去有机溶剂后,加入100ml庚烷溶解,并以20ml h2o萃取三次。收集有机层并用硫酸镁(magnesium sulfate,mgso4)除水,以旋转浓缩除去有机溶剂得到粗产物。使用减压蒸馏方式除去起始物与杂质(0.25torr,80-100℃)。釜残物以硅胶管柱纯化,冲提液为庚烷(heptane)。收集主要段,旋转浓缩除去有机溶剂,在真空50℃下干燥可得9.3g的淡黄色油状物c3(产率=51%)。1h nmr(500mhz,cdcl3):δ7.09(d,j=6.5hz,1h),6.85(d,j=6.5hz,1h),2.72(d,j=7.0hz,2h),1.68(m,1h),1.27(m,24h),0.88(m,6h)。
22.化学反应式2:取c3(20g,58.31mmol)放入250ml三颈反应瓶。加入160ml四氢呋喃。冰浴下(《10℃)加入正丁基锂(23.32ml,58.31mmol)。保持在冰浴下持续搅拌一小时。另取溴化亚铜(cubr)(8.36g,58.31mmol)与溴化锂(libr)(5.06g,58.31mmol)置于另一个500ml三颈反应瓶,冰浴下加入160ml四氢呋喃。将在250ml三颈反应瓶中的反应物加入到500ml三颈反应瓶中,于冰浴下搅拌1小时。在冰浴下,加入草酰氯(oxalyl chloride)(3.36g,2.27ml,26.5mmol),回温至室温搅拌18小时。加入100ml水终止反应,加入200ml heptane,以100ml水萃取三次。收集有机层并使用硫酸镁除水。将溶剂移除后用硅胶管柱纯化,冲提液为庚烷/二氯甲烷(dichloromethane,chcl2)=4/1。收集主要段,浓缩干燥得12g橘黄色油状液体c4,产率61.2%。1h nmr(500mhz,cdcl3):δ7.88(s,2h),2.80(d,j=7.0hz,4h),1.76(m,2h),1.29(m,48h),0.88(m,12h)。
23.化学反应式3:取c5(2g,5.21mmol)放入100ml三颈反应瓶。加入60ml冰醋酸。磁石剧烈搅拌下,加入铁粉(5.83g,104.4mmol)。加热至80℃反应16小时。降温至室温,反应混合物倒入200ml冰块水中并过滤收集固体,用蒸馏水冲洗固体后抽干。以200ml四氢呋喃溶解粗产物并过滤除去铁粉。减压浓缩除去有机溶液并在真空下干燥得1.35g,c6产率80%。在反应瓶中加入c6、c4(2.7g,3.65mmol)与40ml冰醋酸(acetic acid,ch3cooh)。磁石剧烈搅拌下,加热至120℃反应16小时。降温至室温,反应混合物倒入50ml冰块水。以二氯甲烷萃取,并以50ml蒸馏水清洗有机层三次。有机层以无水硫酸镁除水,减压浓缩得粗产物。将粗产物以硅胶管柱纯化,冲提液为庚烷/二氯甲烷=4/1。收集主要段,浓缩得暗红色固体,真空干燥后得2.4g,c7产率61.6%。1h nmr(500mhz,cdcl3):δ7.45(s,2h),2.83(d,j=7.0hz,4h),1.83(m,2h),1.30(m,48h),0.89(m,12h)。
24.化学反应式4:取c7(2g,1.942mmol)与c8(1.60g,4.287mmol)放入100ml三颈反应瓶,加入40ml四氢呋喃。通入氩气除氧15分钟。加入三(二亚苄基丙酮)二钯(pd2(dba)3)(0.071g,0.078mmol)与三(邻甲苯基)膦(三(邻甲苯基)膦)(0.095g,0.311mmol),加热至66℃搅拌2小时。降温后,以硅藻土(celite)过滤反应物并以庚烷冲洗,旋转浓缩去除有机溶剂。以硅胶管柱层析纯化,冲提液为二氯甲烷/庚烷=1/4。收集主要段,浓缩得1.81g褐色黏稠液体c9。产率90.1%。1h nmr(600mhz,cdcl3):δ8.88(d,j=4.8hz,2h),7.71(d,j=4.8hz,2h),7.43(s,2h),7.34(t,j=6.0hz,2h),2.85(d,j=8.4hz,4h),1.83(m,2h),1.30(m,48h),0.88(m,12h)。
25.化学反应式5:取c9(1.81g,1.75mmol)放入100ml三颈反应瓶,在氮气环境下加入107ml四氢呋喃。冰浴下加入n-溴代丁二酰亚胺(0.716g,4.023mmol)后缓慢回到室温并搅拌18小时。以旋转浓缩除去有机溶剂得到粗产物。以硅胶管柱层析纯化,冲提液为二氯甲烷/庚烷=1/4。收集主要段,浓缩得1.88g深褐色黏稠液体c10,产率89.8%。1h nmr(600mhz,cdcl3):δ8.73(d,j=5.4hz,2h),7.38(s,2h),7.21(t,j=4.8hz,2h),2.88(d,j=8.4hz,4h),1.87(m,2h),1.29(m,48h),0.85(m,12h)。
26.有机化合物c16的制备如下:
27.化学反应式6:取c11(20g,64.83mmol)放入250ml三颈反应瓶。加入160ml四氢呋喃。加入正丁基锂(25.93ml,64.83mmol)在冰浴下搅拌一小时。另取溴化亚铜(9.30g,
64.83mmol)与溴化锂(5.63g,64.83mmol)置于另一个500ml三颈反应瓶,冰浴下加入160ml四氢呋喃。冰浴下,将250ml三颈反应瓶中的反应物加入500ml三颈反应瓶中搅拌1小时。冰浴下,加入草酰氯(2.65g,30.87mmol),回温至室温搅拌18小时。加入100ml水终止反应,以旋转浓缩去除四氢呋喃后加入200ml庚烷,以100ml水萃取三次。收集有机层并用硫酸镁除水后浓缩去除溶剂。以硅胶管柱纯化,冲提液为庚烷/二氯甲烷=4/1。收集主要段,浓缩得9.3g橘黄色油状液体c12,产率66.6%。1h nmr(500mhz,cdcl3):δ7.87(d,j=4.2hz,2h),7.86(d,j=4.2hz,2h),2.82(d,j=7.0hz,4h),1.69(m,2h),1.29(m,48h),0.87(m,12h)。
28.化学反应式7:取c5(1g,2.60mmol)与c8(2.33g,6.25mmol)放入100ml三颈反应瓶,加入30ml四氢呋喃。通入氩气除氧15分钟。加入三(二亚苄基丙酮)二钯(0.095g,0.104mmol)与三(邻甲苯基)膦(0.126g,0.416mmol),加热至66℃搅拌2小时。降温后,以硅藻土过滤,再以四氢呋喃冲洗后用旋转浓缩去除有机溶液。以异丙醇与四氢呋喃再结晶,过滤收集固体并真空干燥得到0.87g。c13产率85.6%。1h nmr(600mhz,cdcl3):δ7.75(dd,2h,j=5.1hz,j=0.7hz),7.52(dd,2h,j=4.7hz,j=1.1hz),7.25(m,2h)。
29.化学反应式8:取c13(0.86g,2.20mmol)放入100ml三颈反应瓶,加入30ml冰醋酸。加入铁粉(1.73g,30.8mmol)以磁石剧烈搅拌并加热至80℃反应5小时。降温至室温后,将反应混合物倒入200ml冰块水中并过滤收集固体,再用蒸馏水冲洗固体后抽干。用乙酸乙酯溶解粗产物并过滤除去铁粉。减压浓缩除去有机溶液后得c14,在真空下干燥可得0.69g的c14(产率=95%)。1h nmr(500mhz,cdcl3):δ7.57(dd,2h,j=5.5hz,j=1.1hz),7.37(dd,2h,j=3.3hz,j=1.1hz),7.26(t,2h,j=4.7hz),4.39(br,4h)。
30.化学反应式9:取c14(0.5g,1.52mmol)、c12(1.02g,1.52mmol)放入100ml三颈反应瓶。加入15ml冰醋酸。以磁石剧烈搅拌并加热至120℃反应3小时。降温至室温的反应混合物倒入50ml冰块水。以二氯甲烷萃取,并以50ml蒸馏水清洗有机层三次。有机层以无水硫酸镁除水,减压浓缩得粗产物。以硅胶管柱纯化,冲提液为庚烷/二氯甲烷=4/1。收集主要段,浓缩得暗红色固体c15。真空干燥后产率:0.75g,51.3%。1h nmr(500mhz,cdcl3):δ8.90(d,j=7.0hz,2h),7.70(d,j=5.0hz,2h),7.49(d,j=3.5hz,2h),7.32(t,j=4.5hz,2h),6.73(d,j=3.5hz,2h),2.86(d,j=6.5hz,4h),1.75(m,2h),1.32(m,48h),0.88(m,12h)。
31.化学反应式10:取c15(0.75g,0.777mmol)放入100ml三颈反应瓶,在氮气环境下加入23ml四氢呋喃。冰浴下加入n-溴代丁二酰亚胺(0.318g,1.787mmol),再回温至室温下搅拌18小时。以旋转浓缩除去有机溶剂。以管柱层析纯化,冲提液为二氯甲烷/庚烷=1/4。收集主要段,浓缩得0.81g深褐色黏稠液体c16,产率92.8%。1h nmr(600mhz,cdcl3):δ8.77(d,j=4.0hz,2h),7.47(d,j=3.5hz,2h),7.22(d,j=4.0hz,2h),6.75(d,j=3.5hz,2h),2.88(d,j=6.5hz,4h),1.87(m,2h),1.29(m,48h),0.87(m,12h)。
32.有机化合物c21的制备如下:
33.化学反应式11:取c17(2.00g,21.25mmol),1-碘己烷(iodohexane)(2.82ml,19.13mmol)与碳酸钠(sodium carbonate)(2.94g,21.25mmol)放入100ml双颈瓶。加入40ml二甲基甲酰胺(dimethylformamide,dmf)。加热至90℃反应18小时。反应降温,加入水及乙酸乙酯(ethyl acetate)萃取,取有机层然后用硫酸镁除水,减压旋转浓缩去除有机溶剂。以硅胶管柱纯化,冲提液为庚烷/二氯甲烷=1/5。收集主要段,浓缩得2.70g透明液体c18,
产率71.2%。1h nmr(600mhz,cdcl3):δ7.28(m,1h),6.91(m,4h),3.96(t,j=7.8hz,2h),1.79(m,2h),1.49(m,6h),0.92(m,3h)。
34.化学反应式12:取氯化铝(aluminum chloride,alcl3)(1.17g,8.8mmol)置于100ml三颈瓶,并加入25ml无水二氯甲烷。在氩气环境下降温至-20℃,并加入草酰氯(0.254g,2.0mmol)。回温至0℃后,c18(0.783g,4.4mmol)与无水吡啶(pyridine)(0.16ml,2.0mmol)溶于5ml无水二氯甲烷加入至三颈瓶,再缓慢回到室温反应18小时。加100ml水中止反应,用二氯甲烷和水萃取,取有机层并用硫酸镁除水,减压旋转浓缩去除有机溶剂。以硅胶管柱纯化,冲提液为乙酸乙酯/庚烷=1/2。收集主要段,浓缩得到0.36g白色固体产物c19,产率43.6%。1h nmr(500mhz,cdcl3):δ7.22(d,j=8.5hz,4h),6.94(d,j=8.5hz,4h),4.03(t,j=6.5hz,4h),1.81(m,4h),1.38(m,12h),0.91(m,6h).
35.化学反应式13:取c19(0.202g,0.492mmol)与c14(0.17g,0.517mmol)于100ml双颈反应瓶。在氮气环境下加入20ml醋酸,并加热120℃反应18小时。倒入水中停止反应后,以二氯甲烷和水萃取,取有机层并用硫酸镁除水,减压旋转浓缩去除有机溶剂。以硅胶管柱纯化,冲提液为二氯甲烷/庚烷=1/2,收集主要段,减压旋转浓缩去除有机溶剂,得到0.31g墨绿色固体c20,产率89.0%。1h nmr(500mhz,cdcl3):δ8.99(d,j=3.5hz,2h),7.80(d,j=9.0hz,4h),7.68(d,j=5.5hz,2h),7.32(m,2h),6.94(d,j=9.0hz,4h),4.03(t,j=6.5hz,4h),1.83(m,4h),1.38(m,12h),0.91(m,6h).
36.化学反应式14:取c20(0.30g,0.426mmol)和9ml四氢呋喃于100ml双颈瓶。冰浴及氮气下,n-溴代丁二酰亚胺(0.167g,0.937mmol,2.2equiv.)缓慢加入,在室温反应18小时。加入水及二氯甲烷和水萃取,取有机层并用硫酸镁除水,减压旋转浓缩去除有机溶剂。以硅胶管柱纯化,冲提液为二氯甲烷/庚烷=2/3。收集主要段,减压旋转浓缩去除有机溶剂,得到墨绿色固体产物c21。产率:0.296g,80.6%。1h nmr(500mhz,cdcl3):δ8.87(d,j=4.0hz,2h),7.20(d,j=8.5hz,4h),7.23(d,j=4.0hz,2h),6.95(d,j=8.5hz,4h),4.05(t,j=6.5hz,4h),1.83(m,4h),1.38(m,12h),0.91(m,6h)。
37.有机化合物c25的制备如下:
38.化学反应式15:取c22(1.0g,2.226mmol)与c23(2.4g,5.779mmol)放入100ml三颈反应瓶,加入45ml四氢呋喃。通入氩气除氧15分钟。加入三(二亚苄基丙酮)二钯(0.082g,0.090mmol)与三(邻甲苯基)膦(0.108g,0.355mmol),加热至66℃并搅拌2小时。降温后,以硅藻土过滤,以庚烷冲洗,有机溶液以旋转浓缩去除。以硅胶管柱层析纯化,冲提液为二氯甲烷/庚烷=1/4。收集主要段,浓缩得1.64g褐色黏稠液体c24,产率93.2%。1h nmr(600mhz,cdcl3):δ8.69(s,2h),7.23(s,2h),4.91(d,j=7.2hz,2h),2.76(m,4h),2.38(s,1h),1.74(m,4h),1.38(m,2h),1.07(m,42h),0.89(m,12h)。
39.化学反应式16:取c24(1.0g,1.265mmol)放入100ml三颈反应瓶,在氮气环境下,加入45ml四氢呋喃。冰浴下,加入n-溴代丁二酰亚胺(n-bromosuccinimide,nbs)(0.450g,2.528mmol)。室温下搅拌18小时。以旋转浓缩除去有机溶剂。以管柱层析纯化,冲提液为二氯甲烷/庚烷=1/4。收集主要段,浓缩得1.15g深褐色黏稠液体c25,产率95.6%。1h nmr(600mhz,cdcl3):δ8.54(s,2h),4.95(m,2h),2.70(m,4h),2.38(s,1h),1.74(m,4h),1.38(m,2h),1.07(m,42h),0.88(m,12h)。
40.有机半导体化合物dp1的制备如下:
41.取c27(0.15g,0.366mmol)、c10(0.218g,0.183mmol)、c21(0.063g,0.073mmol)与c26(0.050g,0.109mmol)放入100ml三颈反应瓶,加入36.6ml氯苯(chlorobenzene)。通入氩气除氧15分钟。加入三(二亚苄基丙酮)二钯(3.35mg,0.0037mmol)与三(邻甲苯基)膦(4.46mg,0.0147mmol),加热至130℃并搅拌0.5小时。倒入70ml甲醇中析出过滤,收集固体。用索氏萃取纯化,溶剂使用甲醇与乙酸乙酯。残余固体真空干燥得到0.258g,dp1产率85.0%。
42.取c16(0.1234g,0.110mmol)、c10(0.2182g,0.183mmol)、c28(0.0773g,0.073mmol)和c29(0.180g,0.366mmol)放入100ml三颈反应瓶,加入36.6ml氯苯。通入氩气除氧15分钟。加入三(二亚苄基丙酮)二钯(3.35mg,0.0037mmol)与三(邻甲苯基)膦(4.46mg,0.0147mmol),加热至130℃,搅拌1小时。倒入70ml甲醇中析出过滤,收集固体。固体以甲醇与乙酸乙酯进行索氏萃取纯化。残余固体真空干燥得到dp2。产率:0.20g,95.0%。
43.取c25(0.0355g,0.0374mmol)、c16(0.042g,0.0374mmol)、c30(0.0131g,0.0187mmol)与c33(0.0576g,0.0935mmol)放入100ml三颈反应瓶,加入20ml氯苯。通入氩气,除氧15分钟。加入三(二亚苄基丙酮)二钯(0.86mg,0.0009mmol)与三(邻甲苯基)膦(1.14mg,0.0004mmol),加热至130℃并搅拌1小时。倒入40ml甲醇中析出过滤并收集固体。固体以甲醇与乙酸乙酯进行索氏萃取纯化。残余固体真空干燥得到0.091g,dp5产率88.6%。
44.本发明的有机半导体化合物实施例如表一表一 本发明的有机半导体化合物实施例
45.本发明的有机半导体化合物进一步适合做为有机光电元件的电子给体或p型半导体,以及适合制备n型及p型半导体的掺合物应用于有机光侦测器元件等领域。其中,该术语「n型」或「n型半导体」将被理解为是指外质半导体,其中导电电子密度超过移动电洞密度,而术语「p型」或「p型半导体」将被理解为是指外质半导体,其中移动电洞密度超过导电电子密度(亦见j.thewlis,concise dictionary of physics,pergamon press,oxford,
1973)。
46.而当本发明的有机半导体化合物要进行加工操作时,先需要加入一或多个具有电荷传输、半导体性、导电、光导、电洞阻挡及电子阻挡特性的一或多个的小分子化合物及/或聚合物,混合制备成第一组成物。
47.更进一步地,本发明的有机半导体化合物可与一或多个有机溶剂(较佳溶剂为脂肪族烃、氯化烃、芳香族烃、酮类、醚类及其混合物,如甲苯、邻二甲苯、对二甲苯、1,3,5-三甲基苯或1,2,4-三甲基苯、四氢呋喃、2-甲基四氢呋喃),混合并制备成第二组成物。
48.本发明的有机半导体化合物亦可用于如本文描述的装置中的图案化有机半导体化合物层。对于现代微电子应用,一般所欲为生产小结构或图案以降低成本(更多装置/单元面积),及电力消耗。包括本发明的有机半导体化合物的薄层图案化可例如由微影术、电子束蚀刻技术或雷射图案化进行。
49.对于电子或光电装置中用作为薄层,本发明的由有机半导体化合物所组成的第一组成物或第二组成物可由任何适当方法沉积。装置的液态涂布比真空沉积技术更好。而由本发明的有机半导体化合物所组成的第二组成物可以使数个液态涂布技术的使用变的可行。
50.较佳沉积技术包括,但非限制,浸涂、旋转涂布、喷墨印刷、喷嘴印刷、凸版印刷、网版印刷、凹版印刷、刮刀涂布、辊印刷、反向辊印刷、平版印刷术印刷、干式平版印刷术印刷、快干印刷、网络印刷(web printing)、喷涂、帘涂布、刷涂、狭缝式涂布(slot-dye coating)或移印。
51.因此,本发明亦提供包含该有机半导体化合物或由其所组成的第一组成物或第二组成物的有机光电元件。该些有机光电元件包含:一基板;一电极模块,其设置于基板之上,该电极模块包含一第一电极和一第二电极;以及一主动层,设置于该第一电极和该第二电极之间,该主动层的材料包含至少一种如本发明的有机化合物;其中该第一电极和该第二电极的至少一者为透明或半透明。
52.在本发明的第1实施方式中,请参见图1a,该有机光电元件10包含:一基板100,一电极模块110以及一主动层120,其中,该电极模块110设置于该基板100之上,该电极模块110包含一第一电极112和一第二电极114,该主动层120设置于该第一电极112及该第二电极114之间,且该第一电极112介于该基板100和该主动层120之间,该第二电极114位于该主动层120之上。
53.其中,本实施方式的该主动层120包含至少一种本发明的有机半导体化合物;其中该第一电极112和该第二电极114的至少一者为透明或半透明。
54.在本发明的第2实施方式中,请参见图1b,该有机光电元件10包含:一基板100,一电极模块110以及一主动层120,其中,该电极模块110设置于该基板100之上,该电极模块110包含一第一电极112和一第二电极114,该主动层120设置于该第一电极112及该第二电极114之间,且该第二电极114介于该基板100和该主动层120之间,该第一电极112位于该主动层120之上。
55.上述的基板100,较佳为使用具有机械强度、热强度且具有透明性的玻璃基板或透明性软性基板,其中透明性软性基板材质可为:聚乙烯、乙烯-乙酸乙烯酯共聚物、乙烯-乙烯醇共聚物、聚丙烯、聚苯乙烯、聚甲基丙烯酸甲酯、聚氯乙烯、聚乙烯醇、聚乙烯基丁醛、尼
龙、聚醚醚酮、聚砜、聚醚砜、四氟乙烯-全氟烷基乙烯基醚共聚物、聚氟乙烯、四氟乙烯-乙烯共聚物、四氟乙烯-六氟丙烯共聚物、聚氯三氟乙烯、聚偏二氟乙烯、聚酯、聚碳酸酯、聚氨基甲酸酯、聚酰亚胺等。
56.上述的第一电极112,较佳为使用具有透明性的铟氧化物、锡氧化物等的金属氧化物及其掺杂卤素的衍生物(fluorine-doped tin oxide,fto)、或是复合金属氧化物的铟锡氧化物(indium tin oxide,ito)、铟锌氧化物(indium zinc oxide,izo)等。
57.上述的第二电极114,为金属氧化物、金属(银、铝、金)、导电聚合物、碳基导体、金属化合物、或由上述材料交替组成的导电薄膜。
58.较佳地,该有机光电元件10的该主动层120包含至少一种p型有机半导体化合物,且该p型有机半导体化合物为如本发明的有机半导体化合物,以及至少一种n型有机半导体化合物。
59.更佳地,该有机光电元件10的n型有机半导体化合物具有下列化学式:
60.在本发明的第3实施方式中,参见图1c,其中该有机光电元件10的各元件顺序同于本发明的第1实施方式,并进一步包含:一第一载子传递层130,设置于该第一电极112和该主动层120之间;以及一第二载子传递层140,设置于该第二电极114和该主动层120之间。
61.在本发明的第4实施方式中,参见图1d,其中该有机光电元件10的各元件顺序同于本发明的第1实施方式,并进一步包含:一第一载子传递层130,设置于该第二电极114和该主动层120之间;以及一第二载子传递层140,设置于该第一电极112和该主动层120之间。
62.在本发明的第5实施方式中,参见图1e,其中该有机光电元件10的各元件的顺序同于本发明的第2实施方式,并进一步包含:一第一载子传递层130,设置于该第二电极114和该主动层120之间;以及一第二载子传递层140,设置于该第一电极112和该主动层120之间。
63.在本发明的第6实施方式中,参见图1f,其中该有机光电元件10的各元件的顺序同于本发明的第2实施方式,并进一步包含:一第一载子传递层130,设置于该第一电极112和该主动层120之间;以及一第二载子传递层140,设置于该第二电极114和该主动层120之间。
64.在前述的第3至第6实施方式中,该第一载子传递层可选自共轭聚合物电解质,例如pedot:pss;或聚合物酸,例如聚丙烯酸酯;或共轭聚合物,例如聚三芳基胺(ptaa);或绝缘聚合物,例如纳菲薄膜、聚乙烯亚胺或聚苯乙烯磺酸盐;或聚合物掺杂金属氧化物,该些金属氧化物例如moox,niox,wox,snox;或有机小分子化合物,例如n,n'-二苯基-n,n'-双
(1-萘基)(1,1'-联苯)-4,4'-二胺(npb)、n,n'-二苯基-n,n'-(3-甲基苯基)-1,1'-联苯-4,4'-二胺(tpd);或上述一或多种材料的组合。
65.在前述的第3至第6实施方式中,该第二载子传递层可选自共轭聚合物电解质,例如聚乙烯亚胺;共轭聚合物,例如聚[3-(6-三甲基铵己基)噻吩]、聚(9,9)-双(2-乙基己基-芴)-b-聚[3-(6-三甲基铵己基)噻吩]或聚[(9,9-双(3
’‑
(n,n-二甲基氨基)丙基)-2,7-芴)-alt-2,7-(9,9-二辛基芴)]、有机小分子化合物,例如三(8-喹啉基)-铝(iii)(alq3)、4,7-二苯基-1,10-菲咯啉;金属氧化物,例如znox,掺铝的zno(azo)、tiox或其奈米颗粒;盐,例如lif、naf、csf、csco3;胺,例如伯胺、仲胺或叔胺。
[0066]
为说明本发明的有机半导体化合物应用于有机光电元件后带来的功效改良,将制备包含本发明的有机半导体化合物的有机光电元件进行性质测试和功效表现,该些测试结果如下:材料吸收光谱测试
[0067]
使用紫外光/可见光光谱仪侦测样品的吸收光谱。样品以邻-二甲苯溶解后,方可测量溶液态的吸收光谱。薄膜样品的制备为配置样品浓度为10mg/ml,以玻璃当作基材,用旋转涂布的方式涂布于玻璃上形成薄膜,随后进行固态薄膜的吸收光谱量测。各样品的吸收光谱如图2a至图2b,量测结果如表二。表二 样品的吸收光谱测量和电化学性质测试的结果
[0068]
比较例一的pcbotq出自于j.phys.chem.c 2012,116,8379-8386,比较例二的pttq(bo)出自于j.mater.chem.c,2020,8,10098-10103。于本实施例中,dp2与dp5溶解于对环境友善的邻-二甲苯(o-xylene)并可进行加工操作,而比较例一pcbotq与比较例二pttq(bo)需用含卤素溶剂进行加工操作,与先前技术使用含卤素的溶剂相比,本案发明的有机半导体材料在加工操作上对环境影响更小。测试材料于薄膜态的吸收范围,本案设计的聚合物有效将最大吸收峰红移至1100nm以上,另外薄膜吸收起始值超过1350nm,而比较例pcbotq的起始吸收仅达816nm远小于本案发明的吸收范围。根据图2a和图2b,本案设计的聚合物可以预期于有机光传感器中,其外部量子效应(external quantum efficiency,eqe)可响应至1350nm或更长的波段。材料电化学性质测试
[0069]
本发明的化合物其氧化与还原电位使用电化学分析仪来记录,其中以0.1m的四正
丁基六氟磷酸铵(bu4npf6,tetra-1-butylammonium hexafluorophosphate)的乙腈溶液作为电解液,以0.01m硝酸银(agno3)与0.1m tbap(tetrabutylammonium perchlorate)乙腈溶液加入ag/agcl电极作为参考电极(reference electrode),铂(pt)为辅助电极(counter electrode),碳玻璃电极(glass carbon electrode)为工作电极(work electrode)。将样品以邻-二甲苯溶解并滴至工作电极上形成薄膜后进行量测。以50mv/sec的速率扫描该薄膜后得到氧化还原曲线。同时,以ferrocene/ferrocenium(fc/fc
+
)当作内参考电位校正后可得受测样品的homo及lumo值,其计算公式如下:homo=-|4.71+e
ox-e
ferroncene
|lumo=homo+e
gopt
各样品的测试结果如表二。
[0070]
实施例中,dp2与dp5利用循环伏安法测量氧化性质,经计算(homo=-|4.71+e
ox-e
ferroncene
|)得知最高占据分子轨域(highest occupied molecular orbital,homo),再经由材料薄膜态uv-vis-nir吸收光谱的吸收起始位置(λ
onset
),可得知材料的光学能隙(eg=1241/λ
onset
)以及最低未占分子轨域(lowest unoccupied molecular orbital,lumo,lumo=homo+e
gopt
)。opd效能测试
[0071]
使用具有薄层电阻、以预图案化的ito涂覆的玻璃作为基板。依序在中性清洁剂、去离子水、丙酮及异丙醇中超音波震荡处理,在每个步骤中清洗15分钟。用uv-o3清洁器进一步处理洗涤过的基材15分钟。将azo(aluminum doped zinc oxide nanoparticle,掺铝的氧化锌奈米粒子)的顶涂层,以2000rpm的旋转速率40秒旋转涂布在ito基板上,然后在空气中在120℃下烘烤5分钟。在邻-二甲苯中制备主动层溶液(供体聚合物:受体小分子重量比为1:1)。总浓度为20mg/ml。为了完全溶解聚合物,主动层溶液应在加热板上在100℃下搅拌至少3小时,以ptfe滤膜过滤(孔径0.45~1.0μm),再将主动层溶液加热1小时。随后将溶液置于室温冷却后进行涂布,以涂布转速控制膜厚范围于100nm上下。的后混合膜在100℃下退火5分钟,然后传送至蒸镀机中。在3x10-6
torr的真空镀下,沉积三氧化钼的薄层(8nm)作为电洞传输层以及银薄层(100nm)作为外电极。使用keithley
tm 2400source meter仪器纪录无光下的暗电流密度(jd,偏压为-8v),接着使用太阳光仿真器(具有am1.5g滤光器的氙灯,100mw cm-2
)在空气中及室温下量测元件光电流密度(j
ph
)特性。此处使用具有kg5滤光片的标准硅二极管做为参考电池来校准光强度,以使光谱不匹配的部分达到一致。外部量子效率(eqe)则使用外部量子效率量测器,量测范围为300~1800nm(偏压为0~-10v),光源校正使用硅(300~1100nm)及锗(1100~1800nm)。
[0072]
其中,dp2元件的主动层配方是以dp2:n1=1:1,总浓度为20mg/ml在邻-二甲苯(o-xylene)中进行制备;dp5元件的主动层配方是以dp5:n1=1:1,总浓度为20mg/ml在邻-二甲苯(o-xylene)中进行制备。上述的有机光电元件的结构为glass/ito/azo/atl/moo3/ag。
[0073]
本发明各样品的电流密度如图3a、图3b、图4a和图4b,测试结果如表三和表四。表三 包含本发明的有机半导体化合物的有机光电元件的电性测试
[0074]
实施例聚合物搭配非富勒烯小分子作为主动层与先前文献的测试结果如表三所示,于1100nm下,主动层为dp2:n1所制备的有机光电元件eqe响应可达20.0%,暗电流为10-6
a/cm2等级;主动层为dp5:n1所制备的有机光电元件eqe响应达21.5%,暗电流为10-6
a/cm2等级。有此可见,相对于现有技术,本发明的有机光电元件的具体实施例dp2:n1及dp5:n1在eqe与暗电流密度具有优异的表现。此外,相较于现有技术,本发明所开发随机共聚物材料于非卤素溶剂下有好的溶解度,可以使用非卤素溶剂(环境友善溶剂)进行涂布制程且无须使用添加剂,因此对于元件稳定度也预期会有所帮助。表四 包含本发明的有机半导体化合物的有机光电元件的电性测试
[0075]
本发明的聚合物搭配非富勒烯小分子作为主动层与先前文献的测试结果如表四所示,于700nm下,主动层为dp2:n1所制备的有机光电元件eqe响应可达39.9%,暗电流密度为10-6
a/cm2等级;主动层为dp5:n1所制备的有机光电元件eqe响应达35.0%,暗电流密度为10-6
a/cm2等级。由测试结果可知,相对于现有技术,本发明的有机光电元件的具体实施例在eqe与暗电流密度具有好的表现,特别是在可见光区与近红外光区,皆有良好的响应,可满足可见光与近红外光侦测器的需求,同时也解决如前案j.mater.chem.c,2020,8,10098-10103技术中,在700nm会有明显缺口导致无法侦测该波段的情况,因此,本发明的有机半导体材料及使用该有机半导体材料制成的有机光电元件较诸先前技术具有更佳的功效。
[0076]
上文仅为本发明的较佳实施例而已,并非用来限定本发明实施的范围,凡依本发明权利要求范围所述的形状、构造、特征及精神所为的均等变化与修饰,均应包括于本发明的权利要求范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1