一种氨基酸及其类似物的成环反应与开环方法与流程
1.本发明涉及医药化工领域,主要涉及一种氨基酸及其类似物的成环反应及开环方法。
背景技术:
2.蛋白或多肽的修饰是生物体内自然存在的一种现象,主要是构成多肽或氨基酸的残基被一些基团修饰,然后调控生物体内的一系列生命活动,氨基酸修饰是蛋白质修饰的一种常见方式。n-甲基-氨基酸是多数具有生物活性的肽类天然产物的重要片段。
3.氨基酸的n甲基化是一个长久的命题,1915年,fischer首次发表α-氨基酸的n-甲基化的合成路线,他将伯α-氨基选用合适基团进行暂时保护从而保留单一n
‑ꢀ
h基团,后进行
α
n-甲基化使得n-ch3基团取代n-h基团,后通过反应去掉保护基团得到仲
α
n-甲基氨基酸。这种制备方法的关键步骤仍为目前多数
α
n-甲基化化学方法所应用。但是fischer各步骤使用的试剂较为强烈,对于酰胺键适用性不高,因此需要开发更为温和的反应条件。
4.quitt发表的in proceedings of the 5
th europen peptide symposium oxford中进行了改进,使得反应条件更为温和同时可以使部分转化为官能团有立体化学纯的
α
n-甲基氨基酸。该制备方法在去除保护基团时选择通过催化氢化进行,但是氨基酸在氢化条件下溶解性不佳,同时含硫氨基酸会使得氢化催化剂中毒影响反应进行,导致反应收率不理想。
5.伯胺的n甲基化较难完成,1970年,olsen等人选用ag2o/ch3i的方法以 52~99%的产率得到了部分氨基酸的n-甲基化产物,但是该方法所用试剂为剧毒化合物。prashad等人在2003年进行了改进,选用强碱nah先夺氢后进行甲基化,以90%的产率得到了部分氨基酸的n-甲基化产物。但是目前仍存在反应步骤较多、试剂巨毒、用量大、成本大、手性易翻转等问题,不利于工业化批量生产。
6.大部分反应选择使用聚甲醛成环之后开环从而完成甲基化过程,聚甲醛在较高温度下易发生降解产生大量甲醛的刺激性气体。koh等人发表的hierarchicalassembly of branched supramolecular polymers from(cyclic peptide)
–
polymerconjugates在甲基化的成环步骤中使用的聚甲醛的当量是参与反应的氨基酸的当量的6.7倍,同时他们还使用了dean-stark装置用于排出回流温度下所进行的反应生成的水。
7.因此亟需开发一种安全无害、易操作的n甲基化工业化制备方法,提高反应产率以及产物纯度。
技术实现要素:
8.为了克服上诉现有技术的缺点与不足,本发明的提供一种氨基酸及其类似物的成环反应与开环方法。
9.本发明提供了一种氨基酸及其类似物的成环反应,式1化合物与多聚醛在催化剂作用下反应得到环状式2化合物,反应式如下式所示:
[0010][0011]
其中,x1为带有取代基的烷基链-(ch2)n-,n为1-2,其中x1亚甲基上的氢可以被取代基取代,所述取代基为c
1-c6烷基、卤素、或c
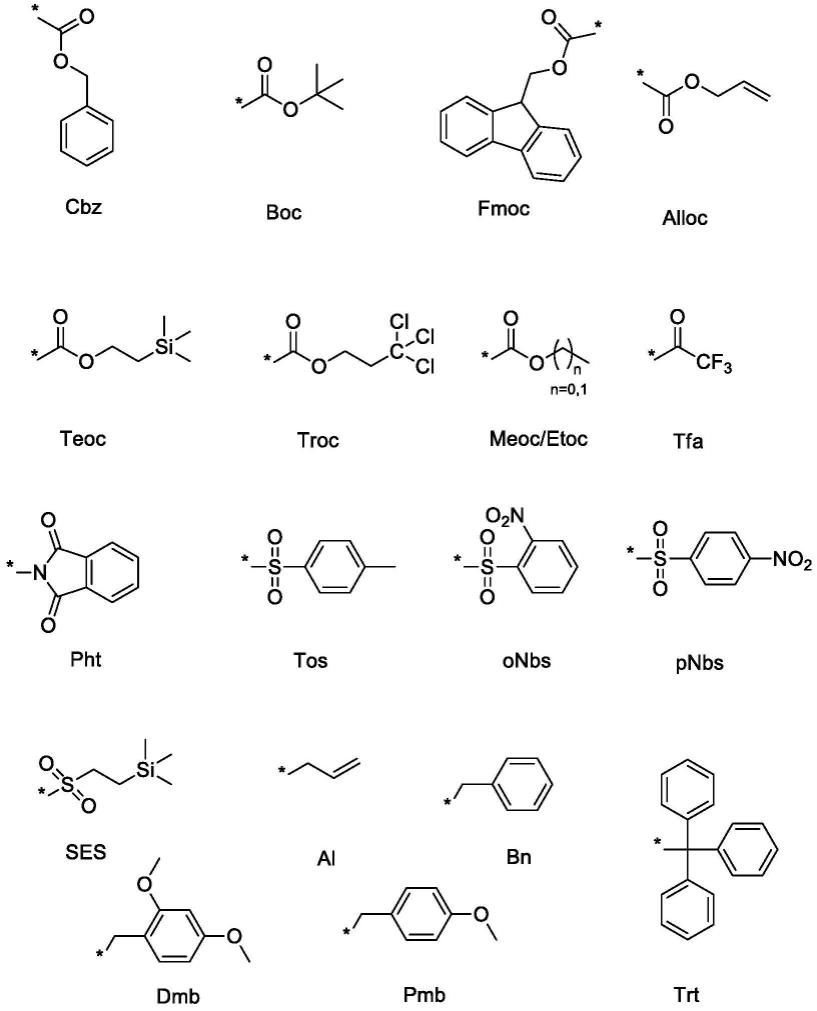
1-c2烷氧基;k为氢、或甲基;r1为氨基保护基选自苄氧羰基(cbz)、芴甲氧羰基(fmoc)、叔丁氧羰基 (boc)、烯丙氧羰基(alloc)、三甲基硅乙氧羰基(teoc)、三氯乙氧甲酰基 (troc)、甲基羰基(meoc)、乙基羰基(etoc)、三氟乙酰基(tfa)、邻苯二甲酰基(pht)、对甲苯磺酰基(tos)、邻硝基苯磺酰基(onbs)、对硝基苯磺酰基 (pnbs)、2-三甲基硅烷乙基磺酰基(ses)、烯丙基(al)、苄基(bn)、二甲基苯甲酸乙酯(dmb)、对甲氧基苄基(pmb)、三苯甲基(trt),具体结构如下:
[0012]
[0013]
具体的,c
1-c6烷基可以是:甲基、乙基、正丙基、正丁基、正戊基、正己基、异丙基、异丁基、或叔丁基;c
1-c2烷氧基可以是-och3、或-och2ch3。
[0014]
优选的,所述反应如下式所示:
[0015][0016]
其中,r1、k的定义与上文相同;r基团选自氢原子、c
1-c6烷基、c
1-c2烷氧基;具体的,c
1-c6烷基可以是:甲基、乙基、正丙基、正丁基、正戊基、正己基、异丙基、异丁基、或叔丁基;c
1-c2烷氧基可以是-och3、或-och2ch3。
[0017]
进一步优选的,所述反应如下式所示:
[0018][0019]
其中,r1、r的定义与上文相同。
[0020]
更优选的,所述反应如下式所示:
[0021][0022]
其中,r1、r的定义与上文相同,标注*处的碳为手性碳原子,且反应前后手性保持一致。
[0023]
具体的,所述反应如下式所示:
[0024][0025]
其中,r1的定义与上文相同,标注*处的碳为手性碳原子,且反应前后手性保持一致。
[0026]
优选的,式1与多聚醛的摩尔当量比为1:(0.2-8),进一步优选为1:(0.5
‑ꢀ
6),,更优选为1:(0.8-4),最优选为1:(1-2)。
[0027]
优选的,所述催化剂选自对甲苯磺酸、三氟乙酸、稀硫酸、甲磺酸、十二烷基苯磺酸、樟脑磺酸、硫酸镁、或氯化钾,进一步优选为对甲苯磺酸、樟脑磺酸、或硫酸镁。
[0028]
优选的,反应溶剂选自二氯甲烷、n,n-二甲基甲酰胺、甲苯、乙腈、苯、二甲基亚砜、四氯化碳、1,3-二甲基-2-咪唑啉酮、正己烷、氯仿中的一种或几种的混合。
[0029]
优选的,反应温度为30-90℃,进一步优选为50-70℃。
[0030]
优选的,反应时间为2-10小时,进一步优选为4-8小时。
[0031]
进一步的,该技术方案还包括该步骤反应结束后的纯化操作。
[0032]
向所述得到反应液中加入无机碱液进行水洗,水洗后分离得到的有机相减压蒸馏除去溶剂,加入良性溶剂再次溶解后继续减压蒸馏,加入有机溶剂后打浆,离心收得目标产物。
[0033]
此处良性溶剂是指对于初次减压蒸馏后得到的物质溶解性好的溶剂。
[0034]
优选的,所述良性溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙酸乙酯、正己烷、正庚烷、戊烷、辛烷、苯、甲苯、二甲苯、氯苯、二氯甲烷、甲基叔丁基醚、乙醚、石油醚、环戊基甲醚、四氢呋喃、1,4-二氧六环、或环己烷,进一步优选为n,n-二甲基甲酰胺、正己烷、正庚烷、或甲苯。
[0035]
优选的,所述无机碱液选自氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸铯、碳酸氢钾、或碳酸氢钠,进一步优选为碳酸钠、碳酸钾、或碳酸铯。
[0036]
优选的,所述无机碱液浓度为0.5%-10%,进一步优选为2%-6%。
[0037]
优选的,所述加入的有机溶剂选自甲基叔丁基醚、乙醚、石油醚、环戊基甲醚、四氢呋喃、1,4-二氧六环、环氧丙烷、或环氧乙烷,进一步优选为甲基叔丁基醚、四氢呋喃、或环氧乙烷。
[0038]
进一步的,本发明还提供了一种环状化合物的开环方法,所述式2化合物在催化剂作用下进行开环反应制备得到式10化合物,反应式如下式所示:
[0039][0040]
其中,r1、x1、k的定义与上文相同。
[0041]
优选的,所述反应如下式所示:
[0042][0043]
其中,r1、k、r的定义与上文相同。
[0044]
更为优选的,所述反应如下式所示:
[0045][0046]
其中,r1、k、r的定义与上文相同,标注*处的碳为手性碳原子,且反应前后手性保持一致。
[0047]
具体的,所述反应如下式所示:
[0048][0049]
其中,r1、r的定义与上文相同,标注*处的碳为手性碳原子,且反应前后手性保持一致。
[0050]
优选的,反应试剂选自三乙基硅烷、三甲基碘硅烷、六甲基二硅氮烷、叔丁基二甲基氯硅烷、或羟乙基三甲基硅烷。
[0051]
优选的,所述催化剂选自三氟乙酸、稀盐酸、稀硫酸、对甲苯磺酸、溴化锌、氯化铝、氯化铁、或氯化亚铁,进一步优选为三氟乙酸、稀盐酸、稀硫酸、或对甲苯磺酸。
[0052]
优选的,反应溶剂选自二氯甲烷、氯仿、乙腈、n,n-二甲基甲酰胺、二甲基亚砜、四氢呋喃、环氧乙烷、乙酸乙酯、乙酸甲酯、碳酸二甲酯、或丙二醇甲醚乙酸酯,进一步优选为二氯甲烷、氯仿、乙腈、n,n-二甲基甲酰胺、环氧乙烷、或乙酸乙酯。
[0053]
优选的,反应温度为10-80℃,进一步优选为20-45℃。
[0054]
优选的,反应时间为5-40小时,进一步优选为15-30小时。
[0055]
进一步的,还包括该步骤反应结束之后的纯化操作。
[0056]
将所述反应得到的反应液进行减压蒸馏除去溶剂,加入良性溶剂再次溶解后继续减压蒸馏,后加入有机溶剂再打浆,最后离心收得目标产物。
[0057]
此处良性溶剂是指对于初次减压蒸馏后得到的物质溶解性好的溶剂。
[0058]
优选的,所述良性溶剂选自二氯甲烷、氯仿、乙腈、n,n-二甲基甲酰胺、乙酸乙酯、甲苯、苯、氯苯、辛烷、正己烷、正庚烷、四氢呋喃、甲基叔丁基醚、乙醚、或石油醚,进一步优选为二氯甲烷、n,n-二甲基甲酰胺、甲苯、或甲基叔丁基醚。
[0059]
优选的,所述有机溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、正己烷、环己烷、二氯甲烷、氯仿、四氯化碳、乙腈、苯、甲苯、二甲苯、或氯苯,进一步优选为n,n-二甲基甲酰胺、二氯甲烷、乙腈、或甲苯。
[0060]
有益效果
[0061]
本发明提供了一种氨基酸及其类似物的成环反应与开环方法,本发明的技术方案可以在成环步骤合理控制反应物的当量比,减少易挥发的醛类物质的量同时利用更为简单的反应装置得到高纯度、高收率的目标产物。后续纯化步骤操作简单,步骤简化更适合工业化生产。
具体实施方式
[0062]
为了更好地理解本发明的技术方案,下面结合具体的实施例对本发明的技术方案做进一步说明,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0063]
实施例1,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0064][0065]
反应步骤:室温下,500ml反应釜中加入200ml乙腈,开启搅拌,加入式a
‑ꢀ
1化合物150g,多聚甲醛43.84g,稀硫酸40ml,内温升至50-70℃,保温搅拌4
‑ꢀ
8h。
[0066]
纯化步骤:保温下,向反应釜中加入5%碳酸钾水溶液水洗,静置分液得到的有机层加入自来水再次水洗,去掉水相后的有机层加入正己烷,减压蒸馏,析出固体,加入甲基叔丁基醚保温搅拌2小时后打浆,离心,收得白色固体湿品,真空减压烘干,时间24小时。制得成品141.52g,收率89.13%,纯度97.69%。
[0067]
实施例2,叔丁基-4-甲氧基-2-甲基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0068][0069]
反应步骤:室温下,500ml反应釜中加入200ml乙腈,开启搅拌,加入式a
‑ꢀ
1化合物150g,三聚乙醛192.94g,稀硫酸40ml,内温升至50-70℃,保温搅拌4
‑ꢀ
8h。
[0070]
纯化步骤:保温下,向反应釜中加入5%碳酸钾水溶液水洗,静置分液得到的有机层加入自来水再次水洗,去掉水相后的有机层加入正己烷,减压蒸馏,析出固体,加入甲基叔丁基醚保温搅拌2小时后打浆,离心,收得白色固体湿品,真空减压烘干,时间24小时。制得成品140.74g,收率91.26%,纯度98.44%。
[0071]
实施例3-19,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0072]
实施例3-19的制备方法参照实施例1,区别是反应步骤使用的多聚甲醛的量不同,具体见下方表格:
[0073]
序号多聚甲醛的量产率纯度实施例34.38g26.82%16.38%实施例49.76g33.62%30.02%实施例510.96g52.79%48.16%实施例613.14g60.35%55.97%实施例717.54g65.83%70.79%实施例821.92g85.71%97.59%实施例926.30g86.67%97.21%实施例1030.61g8.58%97.55%实施例1135.07g8.23%97.99%实施例1239.46g8.98%98.92%实施例1365.76g86.23%96.22%
实施例1487.68g87.17%98.76%实施例15109.1g85.99%97.71%实施例16131.52g87.23%98.88%实施例17153.44g86.36%96.68%实施例18173.36g85.01%97.59%实施例19197.28g86.30%98.88%
[0074]
实施例20-26,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0075]
实施例20-26的制备方法参照实施例1,区别是反应步骤使用的催化剂不同,具体见下方表格:
[0076]
序号催化剂产率纯度实施例20对甲苯磺酸96.61%98.26%实施例21三氟乙酸86.12%93.63%实施例22甲磺酸89.89%92.73%实施例23十二烷基苯磺酸87.53%94.25%实施例24樟脑磺酸97.24%99.78%实施例25硫酸镁96.59%98.22%实施例26氯化钾65.34%91.13%
[0077]
实施例27-35,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0078]
实施例27-35的制备方法参照实施例1,区别是反应步骤使用的溶剂不同,具体见下方表格:
[0079]
序号反应溶剂产率纯度实施例27二氯甲烷93.92%97.13%实施例28n,n-二甲基甲酰胺94.96%96.38%实施例29甲苯91.56%98.18%实施例30苯85.26%92.48%实施例31二甲基亚砜82.91%91.49%实施例32四氯化碳89.79%90.62%实施例331,3-二甲基-2-咪唑啉酮74.52%92.08%实施例34正己烷73.33%93.74%实施例35氯仿71.72%90.77%
[0080] 实施例36,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0081][0082]
反应步骤:室温下,500ml反应釜中加入100ml乙腈、100ml甲苯,开启搅拌,加入式a-1化合物150g,多聚甲醛43.84g,稀硫酸40ml,内温升至50-70℃,保温搅拌4-8h。
[0083]
纯化步骤:保温下,向反应釜中加入5%碳酸钾水溶液水洗,静置分液得到的有机
层加入自来水再次水洗,去掉水相后的有机层加入正己烷,减压蒸馏,析出固体,加入甲基叔丁基醚保温搅拌2小时后打浆,离心,收得白色固体湿品,真空减压烘干,时间24小时。制得成品146.92g,收率96.88%%,纯度99.62%。
[0084]
实施例37,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0085][0086]
反应步骤:室温下,500ml反应釜中加入100ml二氯甲烷、100mln,n-二甲基甲酰胺,开启搅拌,加入式a-1化合物150g,多聚甲醛43.84g,稀硫酸40ml,内温升至50-70℃,保温搅拌4-8h。
[0087]
纯化步骤:保温下,向反应釜中加入5%碳酸钾水溶液水洗,静置分液得到的有机层加入自来水再次水洗,去掉水相后的有机层加入正己烷,减压蒸馏,析出固体,加入甲基叔丁基醚保温搅拌2小时后打浆,离心,收得白色固体湿品,真空减压烘干,时间24小时。制得成品139.49g,收率94.58%%,纯度96.92%。
[0088]
实施例38,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0089][0090]
反应步骤:室温下,500ml反应釜中加入100ml氯仿、100ml正己烷,开启搅拌,加入式a-1化合物150g,多聚甲醛43.84g,稀硫酸40ml,内温升至50
‑ꢀ
70℃,保温搅拌4-8h。
[0091]
纯化步骤:保温下,向反应釜中加入5%碳酸钾水溶液水洗,静置分液得到的有机层加入自来水再次水洗,去掉水相后的有机层加入正己烷,减压蒸馏,析出固体,加入甲基叔丁基醚保温搅拌2小时后打浆,离心,收得白色固体湿品,真空减压烘干,时间24小时。制得成品140.79g,收率95.46%%,纯度97.69%。
[0092]
实施例39-44,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0093]
实施例39-44的制备方法参照实施例1,区别是纯化步骤使用的无机碱不同,具体见下方表格:
[0094]
序号无机碱产率纯度实施例39氢氧化钠85.69%94.33%实施例40氢氧化钾88.15%92.41%实施例41碳酸钠94.48%97.87%实施例42碳酸铯95.19%98.13%实施例43碳酸氢钾89.99%90.16%实施例44碳酸氢钠80.53%93.77%
[0095] 实施例45-82,叔丁基-4-甲氧基-5-氧代恶唑烷-3-羧酸酯的制备与纯化
[0096]
实施例45-82的制备方法参照实施例1,区别是纯化步骤使用的良性溶剂与有机溶剂不同,具体见下方表格:
[0097]
[0098][0099]
按照本发明实施例1或实施例2的制备方法,反应物与多聚甲醛或三聚乙醛进行成环反应得到产物进行制备下表所示化合物:
[0100]
[0101][0102][0103]
实施例102,2-((叔丁氧羰基)-(甲基)氨基)-2-甲氧基乙酸的制备与纯化
[0104][0105]
反应步骤:室温下,500ml反应釜中加入200ml氯仿,式a-2化合物100g,开启搅拌,加入稀硫酸100ml,三乙基硅烷75g,内温升至20-45℃,保温反应 18-30小时。
[0106]
纯化步骤:反应液进行减压蒸馏,析出固体,加入二氯甲烷重新溶解后,再次减压蒸馏,析出固体后加入甲苯保温搅拌2小时,打浆,离心,收得白色湿品固体,真空减压烘干,时间24小时。制得成品87.97g,产率92.16%,纯度 98.45%。
[0107]
实施例103-106,2-((叔丁氧羰基)-(甲基)氨基)-2-甲氧基乙酸的制备与纯化
[0108]
实施例103-106的制备方法参照实施例102,区别是反应试剂不同,具体见下方表格:
[0109]
序号反应试剂产率纯度实施例103三甲基碘硅烷84.13%92.66%实施例104六甲基二硅氮烷79.26%90.38%实施例105叔丁基二甲基氯硅烷81.02%93.03%实施例106羟乙基三甲基硅烷76.59%90.68%
[0110]
实施例107-113,2-((叔丁氧羰基)-(甲基)氨基)-2-甲氧基乙酸的制备与纯化
[0111]
实施例107-113的制备方法参照实施例102,区别是催化剂不同,具体见下方表格:
[0112]
序号催化剂产率纯度实施例107三氟乙酸93.23%96.13%实施例108稀盐酸91.22%95.25%实施例109对甲苯磺酸93.96%97.03%实施例110溴化锌84.66%91.95%实施例111氯化铝88.74%92.56%实施例112氯化铁83.21%94.15%实施例113氯化亚铁85.93%94.11%
[0113]
实施例114-123,2-((叔丁氧羰基)-(甲基)氨基)-2-甲氧基乙酸的制备与纯化
[0114]
实施例114-123的制备方法参照实施例102,区别是反应溶剂不同,具体见下方表格:
[0115]
序号反应溶剂产率纯度实施例114二氯甲烷93.44%96.34%实施例115乙腈92.67%97.32%实施例116n,n-二甲基甲酰胺93.52%97.16%实施例117二甲基亚砜89.25%92.87%实施例118四氢呋喃87.61%93.67%实施例119环氧乙烷95.78%98.22%实施例120乙酸乙酯94.56%99.10%
实施例121乙酸甲酯84.42%91.09%实施例122碳酸二甲酯81.68%93.27%实施例123丙二醇甲醚乙酸酯86.28%94.36%
[0116]
实施例124-154,2-((叔丁氧羰基)-(甲基)氨基)-2-甲氧基乙酸的制备与纯化
[0117]
实施例124-154的制备方法参照实施例102,区别是纯化步骤使用的良性溶剂与有机溶剂不同,具体见下方表格:
[0118]
[0119]
[0120][0121]
按照本发明实施例102的制备方法,反应物进行开环反应得到产物进行制备下表所示化合物:
[0122]
[0123]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1