CDK8基因在提高植物耐盐性的应用
cdk8基因在提高植物耐盐性的应用
技术领域
1.本发明属于生物技术领域,具体涉及cdk8基因在提高植物耐盐性的应用。
背景技术:
2.盐胁迫是限制植物生长和作物产量的重要因素之一。通常,在盐胁迫下,植物表现出种子低萌发率以及营养和生殖阶段生长延迟,严重时导致植物叶片发黄死亡。因此,植物如何感知和调节盐胁迫反应,从而调节植物的生长适应是一个重要的生物学问题,对提高植物抗逆和作物产量具有重要作用。
3.cdk8是真核生物中介体复合体激酶模块的一个亚基,在植物生长发育以及应对环境胁迫的适应中有重要作用。近年来,研究发现cdk8参与叶片蜡质层的发育和调节植物防御基因和次生代谢物的合成,cdk8突变体表现出独特的抗病反应。此外,cdk8还整合脱落酸(aba)信号与干旱胁迫反应,正向调节植物的抗旱性。然而,cdk8在植物耐盐中的生物学功能以及作用机制还不清楚。因此,揭示中介因子复合物cdk8在植物耐盐中生物学功能,能为抗逆作物分子育种提供丰富的基因资源和理论基础。
技术实现要素:
4.本发明的目的是提供cdk8基因在提高植物耐盐性的应用。
5.为了实现上述目的,本发明采用的技术方案概述如下:
6.基于tair官网(http://www.arabidopsis.org/)公布的拟南芥全基因组测序,获得拟南芥中介因子cdk8的核苷酸序列信息。cdk8基因(at5g63610)编码框核苷酸序列长度为1413bp,其核苷酸序列如seq id no.1所示,由470个氨基酸组成,其序列如seq id no.2所示,分子量大小约为52.80kd。
7.本发明还构建一系列植物表达载体,含有上述基因的表达载体、重组载体或转基因植物系以及含有所述载体的宿主细胞的再在提高植物耐盐性方面的功能也落入本发明的保护范围之内。
8.上述cdk8基因编码的蛋白选自,
9.(1)其氨基酸序列如seq id no.2所示;
10.(2)将seq id no.2氨基酸序列经过一个或多个(如1-30个;较佳地1-20个;更佳地1-10个;如5个,3个)氨基酸残基的取代、缺失或添加而形成的,且具有(1)蛋白功能的由(1)衍生的蛋白;
11.(3)与(1)限定的蛋白序列有80%(较佳地90%以上,如95%,98%,99%或更高)以上同源性且具有(1)蛋白功能的由(1)衍生的蛋白。
12.也就是说本发明所保护的基因的功能,不仅包括上述cdk8基因,还包括与seq id no.1具有较高同源性(如同源性高于40%;较佳地高于50%;较佳地高于60%;更佳地高于70%;更佳地高于80%;更佳地高于90%;更佳地高于95%;更佳地高于98%)的同源基因在耐盐性方面的功能。
13.本发明还将所述的带有外源基因的重组载体通过农杆菌浸花法转入野生型拟南芥中,获得过量表达cdk8蛋白的拟南芥植物。
14.本发明最主要的目的是通过构建cdk8过表达转基因系,分析了cdk8突变体和cdk8过表达转基因系在盐胁迫中的生物学功能,从而为作物抗盐分子育种提供基因资源。
15.本发明公开的拟南芥中介因子cdk8在植物耐盐中的生物学功能,具体表现在:
16.(1)在盐胁迫下,cdk8突变体种子萌发率低于野生型;而cdk8过表达系的种子萌发率高于野生型;
17.(2)在盐胁迫下,cdk8突变体子叶绿化率低于野生型;而cdk8过表达系的子叶绿化率高于野生型;
18.(3)在盐胁迫下,cdk8突变体的相对主根长低于野生型;而cdk8过表达系的相对主根长高于野生型。
19.(4)在盐胁迫下,cdk8突变体的存活率低于野生型;而cdk8过表达系的存活率高于野生型。
20.上述应用通过在培养基和土壤中模拟盐胁迫实验得出结论。
21.根据其功能,可以通过转基因的方式来获得耐盐的植株,具体地,可以通过将cdk8基因导入目的植物,得到转基因植物,该植株耐盐性高于目的植物。
22.具体地,cdk8基因具体可通过所述重组表达载体导入所述目的植物。所述方法中,所述重组表达载体可通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。
23.具体地,为了提高植物的优良性状,本发明还保护一种新的植物育种方法,包括如下步骤(1)或(2):
24.(1)通过增加目的植物中cdk8蛋白的活性,获得耐寒性强于目的植物的植株;
25.(2)通过促进目的植物中cdk8基因的表达,获得耐寒性强于目的植物的植株;
[0026]“促进目的植物中cdk8基因的表达”的实现方式可为如下(1)或(2)或(3):
[0027]
(1)将cdk8基因导入目的植物;
[0028]
(2)引入强启动子和/或增强子;
[0029]
(3)本领域内的其它常见方法。
[0030]
其中,目的植物(target plant),本发明所述目的植物是拟南芥。
[0031]
目的基因(target gene),也称靶标基因,在基因工程设计和操作中,被用于基因重组、改变受体细胞性状和获得预期表达产物的基因。可以是生物体本身的,也可以是来自不同生物体的。
[0032]
本发明中,对于适用于本发明的植物没有特别的限制,只要其适合进行基因的转化操作,如各种农作物、花卉植物、或林业植物等。所述的植物比如可以是(不限于):双子叶植物、单子叶植物或裸子植物。
[0033]
作为一种优选方式,所述的“植物”包括但不限于:拟南芥,凡是具有该基因或者与之同源的基因均适用。
[0034]
本发明中所说的“植物”包括整株植物,其亲本和子代植株以及植物的不同部位,包括种子、果实、芽、茎、叶、根(包括块茎)、花、组织和器官,在这些不同的部分均有我们目的基因或者核酸。这里所提及的“植物”也包括植物细胞、悬浮培养物、愈伤组织、胚、分生组
织区、配子体、孢子体、花粉和小孢子,同样,其中每种前述对象包含目的基因/核酸。
[0035]
本发明包括任何植物细胞,或任何由其中的方法获得或可获得的植物,以及所有的植物部分及其繁殖体。本专利也包含由任何前述方法所获得的转染细胞、组织、器官或完整植物。唯一的要求是子代表现出相同的基因型或表型特征,使用本专利中的方法获得的子代特性相同。
[0036]
本发明还扩展到如上所述的植物的可收获的部分,但不限于种子、叶、果实、花、茎、根、根茎、块茎和球茎。同时进一步涉及植株收获后的其他衍生物,如干燥颗粒或粉末、油、脂肪和脂肪酸、淀粉或蛋白质。本发明还涉及由相关植物获得的食品或食品添加剂。
[0037]
本发明的优点:
[0038]
(1)本发明通过植物基因组克隆获得拟南芥cdk8基因,构建了cdk8过表达载体,利用农杆菌介导的方法转入columbia拟南芥(col-0)中获得cdk8过表达转基因系。发明人通过在培养基和土壤盐胁迫模拟实验,揭示了cdk8在植物耐盐中的作用,为作物耐盐分子育种提供基因资源。
[0039]
(2)可以通过转基因的方式来获得耐盐性的植株,具体地,可以通过将cdk8基因导入目的植物,得到转基因植物,该植株耐盐性高于目的植物,为植物耐盐育种提供一种新的途径。
附图说明
[0040]
图1是cdk8基因扩增产物电泳图;
[0041]
图中,图1a是cdk8基因扩增电泳图,图1b是cdk8-yfp过表达重组载体大肠杆菌菌液pcr电泳图。
[0042]
图2是cdk8过表达转基因和cdk8突变体鉴定;
[0043]
图中,图2a是wt、cdk8突变体以及cdk8转基因的免疫印迹图,gfp抗体来源于美国sigma公司,货号为11814460001,丽春红来源于北京索莱宝科技有限公司,用于总蛋白染色,图2b是cdk8-1和cdk8-2突变体鉴定的pcr电泳图。
[0044]
图3是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系的种子萌发表型;
[0045]
图中,图3a是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系的种子在1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基上的萌发情况,图3b是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系的种子在1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基上的萌发后子叶绿化率统计。
[0046]
图4是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系的主根长表型;
[0047]
图中,图4a是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系在1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基上的主根生长情况;图4b是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系的在1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基上的主根长统计。
[0048]
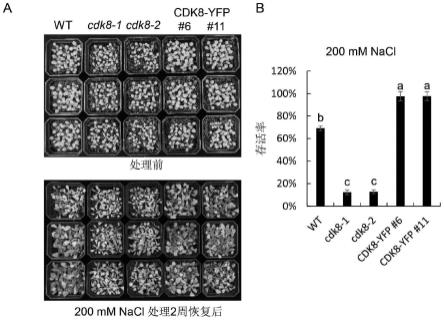
图5是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系在盐胁迫处理前后的存活表型;
[0049]
图中,图5a是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系在盐胁迫处理前后的生长情况,图5b是野生型拟南芥株系(wt)、cdk8突变体以及cdk8过表达系在盐处
理后的存活率统计。
具体实施方式
[0050]
下面将通过具体实施例对本发明进行详细的描述。提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
[0051]
若未特别指明,实施例中所用技术手段为本领域技术人员所熟知的常规手段。下述实施例中的试验方法,如无特别说明,均为常规方法。如无特殊说明,所采用的试剂及材料,均可以通过商业途径获得。
[0052]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
[0053]
除非另有说明,本发明的实施将使用本领域技术人员显而易见的植物学常规技术、微生物、组织培养、分子生物学、化学、生物化学、dna重组及生物信息学技术。这些技术均在已经公开的文献中进行了充分解释,另外,本发明所采用的dna提取、系统发育树的构建、基因编辑方法、基因编辑载体的构建、基因编辑植物获得等方法,除了下述实施例采用的方法外,采用现有文献中已经公开的方法均能实现。
[0054]
此处使用的“核酸”、“核酸序列”、“核苷酸”、“核酸分子”或“多聚核苷酸”术语意思是指包括分离的dna分子(例如,cdna或者基因组dna),rna分子(例如,信使rna),自然类型,突变类型,合成的dna或rna分子,核苷酸类似物组成的dna或rna分子,单链或是双链结构。这些核酸或多聚核苷酸包括基因编码序列、反义序列及非编码区的调控序列,但不仅限于此。这些术语包括一个基因。“基因”或“基因序列”广泛用来指一有功能的dna核酸序列。因此,基因可能包括基因组序列中的内含子和外显子,和/或包括cdna中的编码序列,和/或包括cdna及其调控序列。在特殊实施方案中,例如有关分离的核酸序列,优先默认其为cdna。
[0055]
另外,为了对本发明技术方案更直观的理解,对于本发明涉及到的一些专业术语解释如下:
[0056]“突变体”(mutant),是指发生突变的个体,具有与野生型不同的表型的特点。
[0057]“表达载体”(expression vectors),是指在克隆载体基本骨架的基础上增加表达元件(如启动子、rbs、终止子等),使目的基因能够表达的载体。
[0058]
本发明中用于cdk8基因扩增的拟南芥为哥伦比亚生态型(col-0),其t-dna插入突变体由其他人员赠送。
[0059]
发明人利用分子克隆技术克隆了cdk8基因的编码框序列,构建了cdk8过表达载体,并通过农杆菌浸花法获得了cdk8过表达转基因系。本发明还将其与过表达转基因植株在盐胁迫下进行功能验证。
[0060]
1.基因来源及分离:
[0061]
基于tair官网(http://www.arabidopsis.org/)公布的拟南芥全基因组测序,获得拟南芥中介因子cdk8的核苷酸序列信息。cdk8基因(at5g63610)编码框核苷酸序列长度为1413bp,由470个氨基酸组成,分子量大小约为52.80kd。利用primer premier 5软件设计序列特异性引物(f:5
′‑
atgggagatgggagttcc-3';r:5'-ttagaggcgtctggatttgtt-3
′
)。以col-0生态型拟南芥幼苗的cdna为模板,使用primer star max高保真酶扩增(takara),退
火温度为55℃。基因克隆结果如图1中的图1a所示。
[0062]
2.cdk8基因的功能鉴定
[0063]
为了研究cdk8基因在植物耐盐中的作用,通过拟南芥cdk8突变体和cdk8过表达转基因比较分析其功能。
[0064]
2.1过表达材料的构建
[0065]
将pcr获得的目的片段通过gateway重组克隆技术bp反应(gateway
tm bp clonase
tm enzyme mix,thermo fisher)连接到pdonr-207。再通过lr反应(gateway
tm lr clonase
tm enzyme mix,thermo fisher)克隆到p35s::yfp植物过表达载体。命名为cdk8-yfp。并转化大肠杆菌。随后对含有重组载体的菌液进行pcr鉴定(图1b)。挑选正确的菌液提质粒送测序。
[0066]
2.2 cdk8过表达转基因阳性株的筛选
[0067]
将构建好正确的重组质粒利用液氮冻融法转入农杆菌gv3101中,过夜摇菌,转接摇至od=0.8,使用转基因缓冲液重悬,侵染col-0拟南芥花序,避光一天,在长日照光照培养箱中培养收种,收获的种子在含有除草剂(basta)的1/2ms固体培养基上进行筛选。筛选过程如下:用10%次氯酸钠溶液进行表面消毒15min,无菌水漂洗5次干净后,4℃春化三天。将种子播种于ph=5.8,含有终浓度50μg/ml basta的1/2ms培养基中。16h/8h光暗,25℃,70%相对湿度的光照培养箱中培养。以野生型拟南芥作为对照,筛选出抗basta的小苗7d后移至+中(营养土:蛭石=1:1)在上述条件下进行培养。收获t0代种子后,继续在含有除草剂的1/2ms培养基上筛选t1阳性植株。真叶展开后提取蛋白,利用免疫印迹实验(wb)鉴定阳性植株cdk8-yfp#6和cdk8-yfp#11(图2a)。收获种子,扩繁鉴定直至t3代纯合。
[0068]
2.3突变体纯合检测
[0069]
基于拟南芥t-dna插入突变体的序列号,在突变体查询网站下载并合成测序序列(http://signal.salk.edu/tdnaprimers.2.html)。cdk8-1(salk_138675)为lp:5'-ttggtcttggcatcgatctac-3
′
,rp:5'-ttggtgaaggcacttatggtc-3
′
;cdk8-2(salk_016169)为lp:5'-cactattccgtgctcttctgc-3
′
,rp:5'-tttcctgatcgtcgatttttg-3'。通过pcr进行纯合鉴定(图2b)。
[0070]
2.4突变体和转基因株系表型分析
[0071]
为了分析野生型拟南芥株系(wt)、cdk8突变体和cdk8过表达转基因系的种子萌发对盐的敏感性。按以下实验方法进行:新鲜收获的种子用10%次氯酸钠溶液进行表面消毒15min,无菌水漂洗5次干净后,4℃春化三天。之后分别在1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基进行萌发实验,种子萌发7天后统计子叶绿化率。结果显示,在正常1/2ms培养基上,野生型wt、cdk8突变体和cdk8过表达系的子叶绿化率大致相同几乎为100%;在75mm或100mmnacl处理下,与野生型wt相比,cdk8突变体种子的子叶绿化率远低于野生型wt;而在100mm nacl处理下,cdk8过表达系的子叶绿化率显著高于野生型wt(图3a和图3b)。
[0072]
为了分析野生型拟南芥株系(wt)、cdk8突变体和cdk8过表达转基因系的主根生长对盐的敏感性。按以下实验方法进行:新鲜收获的种子用10%次氯酸钠溶液进行表面消毒15min,无菌水漂洗5次干净后,4℃春化三天后在1/2ms培养基萌发3天。之后分别转移至1/2ms培养基和含有75mm或100mm nacl的1/2ms培养基上生长7天后统计主根长度。结果显示,在正常1/2ms培养基上,cdk8突变体的主根长短于wt和cdk8过表达系,wt和cdk8过表达系之
间的主根长无明显差异;在75mm nacl处理下,cdk8突变体的主根长远短于wt和cdk8过表达系,cdk8过表达系的主根长略高于wt但无显著差异;在100mm nacl处理下,cdk8突变体的主根长远短于wt和cdk8过表达系,cdk8过表达系的主根长显著高于wt(图4a和b)。为了进一步分析cdk8突变体主根对盐的敏感性,我们使用胁迫后主根长与正常生长的主根长的比值来评估,结果显示,在75mm或100mm nacl处理下,cdk8突变体的相对主根长比率低于wt和cdk8过表达系,而cdk8过表达系的相对主根长比率高于wt和cdk8突变体(图4b)。
[0073]
为了分析野生型拟南芥株系(wt)、cdk8突变体和cdk8过表达转基因系的在土壤生长中对盐的敏感性,按以下实验方法进行:将消毒春化后的种子。在1/2ms培养基生长7天后转移至含有营养土:蛭石=1:1的混合土中,每盆重量相同且含有9颗幼苗。在16h/8h光暗循环,25℃,70%相对湿度的光照培养箱中培养至含水量为40%时进行200mm nacl处理2周,恢复1周后统计存活率。结果显示,在盐处理后,与wt和cdk8过表达系相比cdk8突变体的叶子变黄,脱水程度较大,恢复后cdk8突变体的存活率低于wt和cdk8过表达系,而cdk8过表达系的存活率显著高于wt和cdk8突变体(图5a和b)。
[0074]
以上结果表明cdk8基因正向调节植物的盐胁迫反应;在植物体内过表达cdk8基因有助于提高植物的耐盐性。
[0075]
以上所述之实施例,只是本发明的较佳实施例而已,仅仅用以解释本发明,并非限制本发明实施范围,对于本技术领域的技术人员来说,当然可根据本说明书中所公开的技术内容,通过置换或改变的方式轻易做出其它的实施方式,故凡在本发明的原理上所作的变化和改进等,均应包括于本发明申请专利范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1