抗HE4蛋白的单克隆抗体及其细胞株、制备方法和应用与流程
抗he4蛋白的单克隆抗体及其细胞株、制备方法和应用
技术领域
1.本发明涉及生物医学工程领域,特别涉及一种抗he4蛋白的单克隆抗体及其细胞株、制备方法和应用。
背景技术:
2.人附睾蛋白(he4)是一种分泌蛋白,其基因cdna是由kirchhoff于1991年首先从附睾上皮远端提取出来的,固命名为人附睾蛋白。由于分子结构中有高度保守的特征性wap结构域,he4基因也称为wap-4-二硫化物核心结构域2(wfdc2),又称为wfdc2。wap结构域是一种以4个二硫键(4-dsc)为核心区的含8个半胱氨酸的近50个氨基酸组成的保守序列,其编码蛋白与细胞外蛋白酶抑制剂有高度同源性,但目前尚未发现he4具有抑制蛋白酶的作用。he4基因位于人染色体20q12-13.1,全长大约12kb左右,由5个外显子和4个内含子组成,该基因存在多种剪切形式,编码小分子分泌蛋白。he4在人正常女性生殖道、乳腺、呼吸道、肾远曲小管、结肠、唾液腺中均有表达,但在正常卵巢组织中低表达或不表达,而在卵巢组织中的阳性表达率与卵巢癌的组织类型相关,其中浆液性卵巢癌中表明最高。研究表明在体外he4可能通过pi3k/akt信号转导途径抑制细胞增殖,从推测he4可能通过抑制癌细胞增殖而起到保护作用。
3.应用免疫组化的方法检测he4在不同卵巢组织中表达情况,研究结果显示,he4在高级别浆液性卵巢癌中高表达,与正常卵巢组织及良性卵巢肿瘤组织中表达差异有统计学意义。he4阳性表达率随临床分期的进展而升高,
ⅲ‑ⅳ
期与
ⅰ‑ⅱ
期相比,差异有统计学意义。
技术实现要素:
4.发明人提供了一种抗he4蛋白的单克隆抗体,所述单克隆抗体的重链可变区的氨基酸序列为seq id no.4所示的氨基酸序列;所述单克隆抗体轻链可变区的氨基酸序列为seq id no.5所示的氨基酸序列。
5.进一步地,所述单克隆抗体的重链可变区的dna序列为seq id no.2所示的核苷酸序列,所述单克隆抗体的轻链可变区的dna序列为seq id no.3所示的核苷酸序列。
6.进一步地,所述单克隆抗体特异性识别he4蛋白。
7.进一步地,所述单克隆抗体为小鼠igg1κ亚型单克隆抗体。
8.进一步地,所述单克隆抗体由保藏号为cgmccno21972的杂交瘤细胞株产生。
9.发明人又提供了一种抗he4蛋白的单克隆抗体的制备方法,其用于免疫小鼠的抗原为重组蛋白,所述重组蛋白由大肠杆菌重组表达,包含trx蛋白标签、he4蛋白片段及组氨酸蛋白标签。
10.进一步地,所述he4蛋白片段为he4蛋白的第31位至第124位氨基酸片段,其氨基酸序列为seq id no.1所示的氨基酸序列。
11.发明人还提供了一株分泌抗he4蛋白分子的杂交瘤细胞株,所述细胞株为小鼠杂
交瘤细胞株3g10,所述细胞株已于2021年3月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cgmccno21972,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
12.发明人还提供了一种he4蛋白免疫检测试剂,所述免疫检测试剂含有重链可变区的氨基酸序列为seq id no.4所示的氨基酸序列;轻链可变区的氨基酸序列为seq id no.5所示的氨基酸序列的抗he4蛋白的单克隆抗体为其有效成分。
13.进一步地,所述免疫检测包括免疫组织化学法,免疫印迹法和酶联免疫法。
14.区别于现有技术,本发明所产生的有益技术效果为:上述技术方案选取he4蛋白31-124位氨基酸为抗原肽,进行密码子优化,成为适合在大肠杆菌bl21表达的基因片段,最后得到的重组蛋白包含trx蛋白标签、he4蛋白片段及组氨酸蛋白标签。所述重组蛋白对小鼠进行免疫,经细胞融合、筛选和亚克隆,获得高效分泌抗he4蛋白单克隆抗体的小鼠杂交瘤细胞株3g10,以及由该细胞株所分泌的抗he4蛋白单克隆抗体。本方案得到的抗体具有高特异性、敏感性,可以特异性识别表达he4蛋白的细胞,适用于免疫学检测,特别是免疫组化检测。
附图说明
15.图1为实施例1融合组氨酸标签的重组he4蛋白纯化结果胶图,其中m表示marker;1为上清液样本;2为超声后沉淀样本。
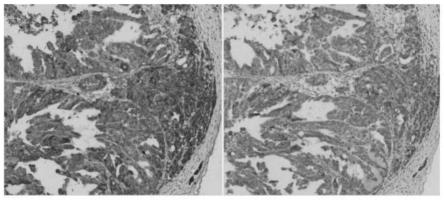
16.图2为卵巢浆液性肿瘤免疫组化染色结果对比图;其中左为3g10分泌的he4,右为市售he4。
具体实施方式
17.为详细说明本技术可能的应用场景,技术原理,可实施的具体方案,能实现目的与效果等,以下结合所列举的具体实施例并配合附图详予说明。本文所记载的实施例仅用于更加清楚地说明本技术的技术方案,因此只作为示例,而不能以此来限制本技术的保护范围。
18.在本文中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本技术的至少一个实施例中。在说明书中各个位置出现的“实施例”一词并不一定指代相同的实施例,亦不特别限定其与其它实施例之间的独立性或关联性。原则上,在本技术中,只要不存在技术矛盾或冲突,各实施例中所提到的各项技术特征均可以以任意方式进行组合,以形成相应的可实施的技术方案。
19.除非另有定义,本文所使用的技术术语的含义与本技术所属技术领域的技术人员通常理解的含义相同;本文中对相关术语的使用只是为了描述具体的实施例,而不是旨在限制本技术。
20.在本技术的描述中,用语“和/或”是一种用于描述对象之间逻辑关系的表述,表示可以存在三种关系,例如a和/或b,表示:存在a,存在b,以及同时存在a和b这三种情况。另外,本文中字符“/”一般表示前后关联对象是一种“或”的逻辑关系。
21.在本技术中,诸如“第一”和“第二”之类的用语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何实际的数
量、主次或顺序等关系。
22.在没有更多限制的情况下,在本技术中,语句中所使用的“包括”、“包含”、“具有”或者其他类似的表述,意在涵盖非排他性的包含,这些表述并不排除在包括所述要素的过程、方法或者产品中还可以存在另外的要素,从而使得包括一系列要素的过程、方法或者产品中不仅可以包括那些限定的要素,而且还可以包括没有明确列出的其他要素,或者还包括为这种过程、方法或者产品所固有的要素。
23.与《审查指南》中的理解相同,在本技术中,“大于”、“小于”、“超过”等表述理解为不包括本数;“以上”、“以下”、“以内”等表述理解为包括本数。此外,在本技术实施例的描述中“多个”的含义是两个以上(包括两个),与之类似的与“多”相关的表述亦做此类理解,例如“多组”、“多次”等,除非另有明确具体的限定。
24.实施例1重组he4蛋白片段的制备
25.一、基因优化与合成
26.he4按照uniprot数据库中登录号为q14508的蛋白质序列,选择31-124位氨基酸的蛋白片段,直接优化成适合在大肠杆菌bl21表达的基因片段。在pcr的过程中在基因5’和3’端分别加入
bamhi
和xhoi酶切位点。
27.pcr产物经琼脂糖凝胶电泳分离后回收,分别对回收的融合蛋白基因和用于表达的质粒载体pet30a进行bamhi和xhoi酶切,再次电泳回收,以t4dna连接酶连接。连接产物转化大肠杆菌感受态细胞bl21,挑取平板上的克隆接种,进行菌液pcr鉴定。挑选pcr结果阳性的克隆进行测序分析,序列完全正确的克隆使用。
28.选择不同的抗原进行免疫可能制备出不同结合特性的抗体,该分子同时存在多种因可变剪切引起的变异体,最终导致不同抗体对表达抗原细胞的识别能力和模式不同。he4分子按照公布的序列进行分析,依据在细胞膜上的结构、抗原性、组成氨基酸的亲疏水性以及二级结构,选择适宜可溶表达又具有良好免疫原性的区域用于重组表达,选择he4的31-124位氨基酸残基进行密码子优化,分子量约为42kda。通过序列优化设计利用原核表达基因序列获得he4蛋白。而重组免疫原由具有抗原性的he4蛋白片段及用于重组蛋白纯化的蛋白标签组成,蛋白标签为trx和his。
29.二、蛋白表达和纯化
30.按1:100的比例将单菌落培养的过夜菌转接至100mllb培养基,加入终浓度为10μg/ml的卡那霉素,37℃振荡培养至od600为0.6-0.8,加入0.5mmol/l的iptg,37℃震荡培养2h,收菌后超声破碎。该重组蛋白带有组氨酸标签,使用镍柱进行蛋白质的亲和纯化。用300mmol/l咪唑进行洗脱,sdspage分离检测。
31.图1为融合组氨酸标签的重组he4蛋白纯化结果胶图。蛋白浓度为2.3mg/ml,可用于动物免疫和抗体筛选与鉴定的要求。
32.实施例2杂交瘤细胞系的建立
33.一、免疫
34.将实施例1中重组蛋白用弗氏完全佐剂(sigma公司,f5881)乳化,免疫4-6周龄雌性icr小鼠(购自北京维通利华实验动物技术有限公司),腹部皮下注射每只小鼠6点,剂量为20μg/只。每14天加强免疫一次,抗原使用弗氏非完全佐剂(sigma公司,f5506)乳化,剂量为20μg/只。第3次加强免疫后7天以间接elisa(波长450nm)检测小鼠血清中抗免疫原的多
抗效价,效价最高的小鼠以尾静脉注射冲击免疫,抗原用生理盐水混匀,剂量为20μg/只。
35.二、细胞融合
36.无菌制备免疫达标的小鼠脾细胞悬液,与小鼠骨髓瘤细胞sp2/0(atcc numbercrl-8287)以5:1比例混合,离心1500rpm,5min。弃上清后离心管放入37℃水浴中,在1分钟内缓慢加入1ml的peg1500(roche公司),并搅动细胞。在温水中静置1min后,加入10ml无血清的imdm(sigma公司),混匀,离心1000rpm,5min。弃上清后,加入10ml血清(paa公司)小心的将细胞吹打起来,并加入5ml混合10xhat(sigma公司)的胸腺细胞,混匀。再加入25ml含有2.1%硝基纤维素(sigma公司)的半固体培养基充分混匀,然后均匀的倒入20个细胞培养皿中。将细胞培养皿放入到湿盒中,放入37℃5%co2培养箱中培养。
37.三、克隆化及elisa筛选阳性杂交瘤细胞
38.融合后7天克隆细胞团大小密度适中,在解剖镜下,吸取圆、实、大的克隆团打入事先准备好培养基的96孔培养板中,放入37℃5%co2培养箱中培养。3天后,细胞量大约占底面积2/3,取100μl上清用免疫原和合成多肽分别进行elisa筛选。阳性克隆完全换液,加入200μl含饲养细胞和1%ht(sigma公司)的完全培养基。两天后进行第二次elisa筛选,阳性克隆转入事先准备好培养基(含饲养细胞和ht)的24孔板培养。五天后取100μl上清进行第三次elisa筛选,阳性克隆逐次转入6孔板和细胞培养瓶扩大培养并冻存。实施例3腹水诱生法制备单克隆抗体
39.一、腹水制备
40.对数生长期细胞用无血清培养基洗涤并悬起,计数约5
×
105,1ml。悬浮的细胞腹腔注射事先用石蜡油致敏的小鼠。7天后开始收集腹水。取出的腹水于4℃离心4000rpm,10min。小心吸出中间的腹水收集于离心管中,4℃或-20℃保存。
41.二、单克隆抗体的纯化
42.用hitraprproteinaff(ge公司)亲和层析法按说明书从腹水中纯化抗体。sds-page胶鉴定纯度,bradford法测定浓度。纯化的抗体保存于-20℃。
43.实施例4单克隆抗体特性鉴定
44.一、亚类鉴定
45.用100mmpbs(ph7.4)稀释包被羊抗鼠igg(北京中杉金桥生物技术有限公司)至0.5μg/ml,每孔加100μl,4℃,过夜。倾空液体,用含0.05%tween的pbs(pbs-t)洗3次,每孔加入200μl封闭液(含2%bsa和3%蔗糖的pbs),37℃孵育1h。倾空液体,用pbs-t清洗3次。每孔加入0.1ml杂交瘤上清,37℃孵育1h。倾空液体用pbs-t清洗3次。用封闭液1:1000稀释hrp标记的羊抗鼠(κ,λ)抗体或1:2000稀释hrp标记的羊抗鼠(igm,igg1,igg2a,igg2b,igg3,iga)抗体(southernbiotech公司)0.1ml每孔分别加入适当的孔中,37℃孵育1h。倾空液体,用pbs-t清洗3次。每孔加50μl含0.15%abts(southernbiotech公司)和0.03%h2o2的柠檬酸缓冲液(ph4.0)进行显色反应,10-20min内测定405nm波长下的od值。
46.结果显示,本发明单克隆抗体为igg1κ型鼠源单克隆抗体。
47.二、亲和常数测定
48.包被实施例1中制备的he4重组蛋白,包被浓度为2μg/ml,100μl/孔,4℃包被过夜,pbs-t洗3次。每孔加200μl封闭液37℃封闭2h,pbs-t洗3次。实施例3中纯化的单克隆抗体,从1:200开始2倍梯度稀释,最后1孔留空白对照,37℃孵育1h,pbs-t洗3次。hrp标记的羊抗
鼠二抗1:20000稀释,每孔100μl,37℃孵育1h,pbs-t洗3次。每孔加入100μl含0.1%tmb(sigma公司)和0.03%h2o2的柠檬酸-磷酸缓冲液显色10min,加50μl0.5m硫酸溶液终止反应。用酶标仪测定波长450nm的吸光值。画出od值对应抗体稀释倍数的曲线,找到最大结合od值的一半时对应的稀释倍数a,利用下列公式计算出该抗体的亲和常数为1.92
×
109。
[0049][0050]
三.单抗反应特异性和应用效果
[0051]
取实施例1中制备的he4重组蛋白,用免疫印迹的方法检测本发明的单克隆抗体的识别特异性,进行12%聚丙烯酰胺凝胶电泳。按常规方法在bio-rad电转移系统中将凝胶蛋白带转移到pvdf膜上(millipore公司)。将膜置于含5%脱脂奶粉的tbs-t封闭液中4℃过夜。加入由41b1杂交瘤分泌的抗体的单克隆抗体(1:1000稀释)4℃孵育过夜。用tbs-t洗膜后,加入1:5000稀释的羊抗鼠二抗(北京中杉金桥生物技术有限公司),室温孵育1小时。再次tbst洗膜,加入ecl超敏显色液(北京普利莱基因技术有限公司),以chemidocmp多色荧光成像系统(bio-rad)进行化学发光图像数据的采集。
[0052]
实施例5抗体的可变区序列测定
[0053]
取培养新鲜的杂交瘤细胞,取上清进行抗原结合特性验证,证实用于克隆的细胞株的确能分泌需要的抗体,结果确认后,离心收集106以上杂交瘤细胞。trizol法提取杂交瘤细胞总rna,取9μl总rna,加入2.5μloligo(dt)12
–
18primer(10mm),及5μldntps,混合均匀,70℃保温5分钟后置冰上5分钟,或依照使用的逆转录酶进行变性操作。随后加入5μlrtbuffer(5x),2.5μldtt(0.1m)及1μl逆转录酶,42℃反应1小时。70℃孵育15分钟以终止反应,获得的cdna保存在-20℃。将获得的第一链cdna进行pcr扩增,在50μl反应体系中加入引物各25pmol,重链可变区和轻链可变区扩增用引物的序列按照沈倍奋主编的《重组抗体》(科学出版社,2005年出版)一书中鼠单抗引物序列设计和合成。
[0054]
其余dntps及缓冲液均按照常规加入,最后加入cdna模板1μl和1u热启动taqdna聚合酶。设置pcr扩增程序为94℃40秒,52℃40秒,72℃40秒,进行20至25个循环,最后72℃延伸3分钟,产物可置于4℃备用或直接电泳。取20μlpcr产物进行电泳分析,在1.5%琼脂糖凝胶上分离,轻链(κ轻链)的长度在320-340bp之间,重链的长度在340-370bp之间,有该区域特异产物时切胶回收,克隆至t载体或表达载体测序。
[0055]
实施例6.免疫组化组织芯片染色和鉴定
[0056]
一.芯片制备过程
[0057]
对各样本先进行he切片染色,以确定肿瘤部位。使用3dhistech公司的全自动组织芯片仪制作组织芯片。将制成的组织芯片蜡块再放入蜡块制作模具,放入68℃烤箱内10分钟,使组织芯与受体腊块的蜡融为一体,然后轻轻从烤箱中取出模具,让半融状态的石蜡在室温条件下冷却约30min,再放入-20℃冰箱冷冻6min后将组织芯片蜡块从模具中取出,切片或放入4℃冰箱内保存备用。修片后进行连续切片,厚度定为3μm,将连续切片漂在40%酒精中,让其自然展开,再将分开的切片转移到50℃的温水中展片30秒,用经多聚赖氨酸处理过的载玻片裱贴切片,将制成的组织芯片放入68℃烤箱内烤片2小时,取出,室温冷却,放入-4℃冰箱保存。
[0058]
二.ihc染色及分析
[0059]
常规二甲苯脱蜡3次,每次6分钟,100%、100%、95%、85%梯度乙醇中水化,每次3分钟,最后自来水冲洗。进行抗原修复,然后将切片放入湿盒中,pbs冲洗3
×
3分钟。滴加3%h2o2孵育10分钟,pbs冲洗3
×
3分钟。甩干切片,滴加适当比例稀释的一抗(首次稀释根据抗体浓度来设计抗体的稀释比例)室温(25℃)孵育1小时,pbs冲洗3
×
3分钟,滴加二抗室温孵育15-30分钟,pbs冲洗3
×
3分钟,甩去pbs,用新鲜配置的dab显色液显色3-10分钟。苏木素复染25秒,pbs返蓝30秒。按照85%(3分钟)-95%(3分钟)-100%(3分钟)-100%(3分钟)的酒精梯度依次脱水,最后二甲苯透明3分钟,中性树胶封片。
[0060]
免疫组化染色结果分为:阳性和阴性。阳性表达必须在细胞和组织特定的抗原部位才能视为阳性。在组织染色分布清晰及细胞定位准确的情况下,染色结果根据染色强度的差异进行进一步划分,具体如下:
[0061]
1、样本为弱阳性;标记为“+”;
[0062]
2、样本为中度阳性;标记为“++”;
[0063]
3、样本为高度阳性;标记为“+++”。
[0064]
4、样本为阴性,标记为
“‑”
。
[0065]
三.数据统计
[0066]
1、肿瘤组织芯片检测结果:
[0067]
将本抗体he4(3g10)和市售抗体he4(oti1b9)在32例卵巢粘液性腺癌和36例卵巢浆液性肿瘤进行同步检测并比较检测结果。
[0068]
he4的免疫组化结果进行统计。整个试验过程采取双盲设计,统计结果如下表:
[0069][0070]
结果显示:3g10细胞株所分泌的抗he4蛋白单克隆抗体的染色定位准确,染色清晰且无非特异性染色,背景干净。在免疫组化检测中,阳性率与市售抗体相当,但阳性强度高于市售抗体。说明3g10细胞株分泌的he4敏感度更高,有效避免假阴性结果。
[0071]
图2为卵巢浆液性肿瘤免疫组化染色结果对比图(左为3g10分泌的he4,右为市售he4)。
[0072]
2、正常组织芯片检测结果:
[0073]
正常组织芯片包括30种正常组织样本,正常组织样本主要选自新鲜、及时固定的手术标本;每种组织包括3个不同病例样本。30种正常组织包括:大脑、心脏、小脑、食管、肾上腺、胃、卵巢、小肠、胰腺、结直肠、甲状旁腺、肝脏、垂体、唾液腺、睾丸、肾、甲状腺、前列腺、乳腺、子宫、脾、膀胱、扁桃体、骨骼肌、胸腺(幼儿)、皮肤、骨髓、外周神经、肺、间皮细胞。
[0074]
将本抗体(3g10)和市售抗体在正常组织芯片上进行同步检测,阴阳性检测结果一致,说明本抗体在正常组织的特异性同市售抗体相当。
[0075]
最后需要说明的是,尽管在本技术的说明书文字及附图中已经对上述各实施例进
行了描述,但并不能因此限制本技术的专利保护范围。凡是基于本技术的实质理念,利用本技术说明书文字及附图记载的内容所作的等效结构或等效流程替换或修改产生的技术方案,以及直接或间接地将以上实施例的技术方案实施于其他相关的技术领域等,均包括在本技术的专利保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1