一种检测青花菜强自交不亲和系2M的SP11基因的引物及其应用的制作方法
一种检测青花菜强自交不亲和系2m的sp11基因的引物及其应用
技术领域
1.本发明涉及生物技术领域,具体而言,涉及一种检测青花菜强自交不亲和系2m的sp11基因的引物及其应用。
背景技术:
2.青花菜(brassica oleracea l.var.italica)又名西兰花、绿花菜,属十字花科芸薹属甘蓝种。青花菜具有很高的营养和保健价值,因其富含蛋白质、维生素及抗癌活性物质莱菔硫烷,莱菔硫烷具有抗癌功效、降低心脑血管疾病和高血压等患病风险,因此备受国内外消费者青睐。青花菜原产于地中海东部沿岸地区,上世纪80年代初传入我国,因其对土壤要求不太严格,栽培技术简单,目前在全国各地广泛种植,也是一种重要的出口创汇蔬菜。
3.我国青花菜栽培历史虽已超过30年,但我国青花菜育种工作起步较晚,自交不亲和系制种是杂种优势利用的重要途径之一。由于雄性不育技术的广泛应用,青花菜育种目标发生转变,自交不亲和系的材料选育转变为自交亲和系材料选育,然而育种家经过数年至十年分离固定获得的高世代优良材料基本上为自交不亲和系,尤其是作为母本的亲本材料基本上表现为强自交不亲和性,导致原种采种困难、采种量少,严重制约青花菜杂交优势的利用。因此开展青花菜自交不亲和性研究、克隆自交不亲和基因开发筛选亲和性好的青花菜材料对提高青花菜的结实性和育种效率具有重要的意义。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种检测青花菜强自交不亲和系2m的 sp11基因的引物,通过判断待测样本是否含青花菜强自交不亲和系 2m的sp11基因,从而判断其是否为强自交不亲和系。
6.本发明是这样实现的:
7.本发明青花菜强自交不亲和系2m中的芸薹属自交不亲和等位基因(s位点基因)为i类s单元型,具体为针对sp11基因设计的检测引物。该引物的扩增产物在1029bp,能够特异性实现青花菜强自交不亲和样本的检出。
8.一种检测青花菜强自交不亲和系2m的sp11基因的引物,引物的序列如seq id no.1-2所示。
9.seq id no.1上游引物sp11f-1276:
[0010]5’‑
tttctgcgagtaaaagagaatc-3’。
[0011]
seq id no.2下游引物sp11r-1277:
[0012]5’‑
ctatttacaatcgcaagaataagtacc-3’。
[0013]
pcr扩增产物的大小为1029bp。发明人发现采用上述检测引物能够特异性的对青花菜强自交不亲和性材料进行检出,对于筛选青花菜强自交不亲和性材料、筛选回交转育
改良材料具有重要意义。采用上述引物进行筛选青花菜强自交不亲和性材料,具有筛选方法简单,快捷的优势。
[0014]
需要说明的是,本发明选择自育高世代优良自交系2m,取花蕾组织材料,送样进行全基因组重测序和转录组测序,获得材料的测序数据,通过转录组测序数据分析获得芸苔属sp11基因及其信息,对全基因组重测序数据进行序列比对分析,通过可视化软件在对应染色体位置进行sp11基因定位,获得sp11基因相关的拼接序列,设计特异性引物进行扩增,获得的pcr产物与t载体连接并送样测序验证,克隆获得自育高世代优良自交系的sp11基因序列全长1029bp。并由此开发出相应的检测引物。
[0015]
本发明还提供了一种检测试剂盒,其包括上述的检测青花菜强自交不亲和系2m的sp11基因的引物。
[0016]
在本发明应用较佳的实施方式中,上述试剂盒还包括pcr缓冲液、水、dna聚合酶和dntp。例如dna聚合酶选自taq酶。
[0017]
在其他实施方式中,试剂盒包括utaq pcr mix,用于更高效准确的进行pcr扩增。
[0018]
本发明还提供了一种检测试剂,其包括上述的检测青花菜强自交不亲和系2m的sp11基因的引物。
[0019]
在本发明应用较佳的实施方式中,试剂还包括保护剂。保护剂包括不限于:二甲基亚砜、甘油、edta等。通过保护剂以延长引物的有效使用期。检测试剂的形态包括不限于:粉剂、悬浮剂、半乳剂、溶液等。
[0020]
本发明还提供了一种检测青花菜强自交不亲和系2m的sp11基因的引物在制备检测试剂或检测试剂盒中的应用。
[0021]
本发明还提供了一种筛选青花菜强自交不亲和性材料的方法,其包括如下步骤:
[0022]
以上述的引物对待测样本的dna进行扩增,选择pcr阳性样本即为青花菜强自交不亲和性材料。
[0023]
pcr阳性样本的判断方式包括不限于:电泳检测、测序等方式。
[0024]
在本发明应用较佳的实施方式中,扩增的条件包括:
[0025]
94-99℃预变性1-10min;94-95℃变性30s,58-60℃退火30s, 72℃延伸60s,28-30个循环;72℃延伸0-10min。
[0026]
在上述扩增条件下,能够高准确度地高特异性地实现目标样本中 sp11基因的检测。
[0027]
在本发明应用较佳的实施方式中,扩增的条件包括:94℃预变性4min;94℃变性30s,60℃退火30s,72℃延伸60s,28个循环;72℃延伸10min;4℃保存。
[0028]
本发明还提供了一种检测青花菜强自交不亲和系2m的sp11基因的引物、检测试剂盒或检测试剂在筛选强自交不亲和青花菜材料、克隆自交不亲和基因或青花菜材料的自交不亲和性分类中的应用。
[0029]
本发明具有以下有益效果:
[0030]
青花菜强自交不亲和系2m中的芸薹属自交不亲和等位基因(s 位点基因)为i类s单元型,本发明针对sp11基因设计了特异性检测引物。该引物的扩增产物在1029bp,能够特异性实现青花菜强自交不亲和样本的检出。
[0031]
发明人发现采用上述检测引物能够特异性的对青花菜强自交不亲和性材料进行
检出,对于筛选青花菜强自交不亲和性材料、筛选回交转育改良材料具有重要意义。采用上述引物进行筛选青花菜强自交不亲和性材料,具有筛选方法简单,快捷的优势。
附图说明
[0032]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0033]
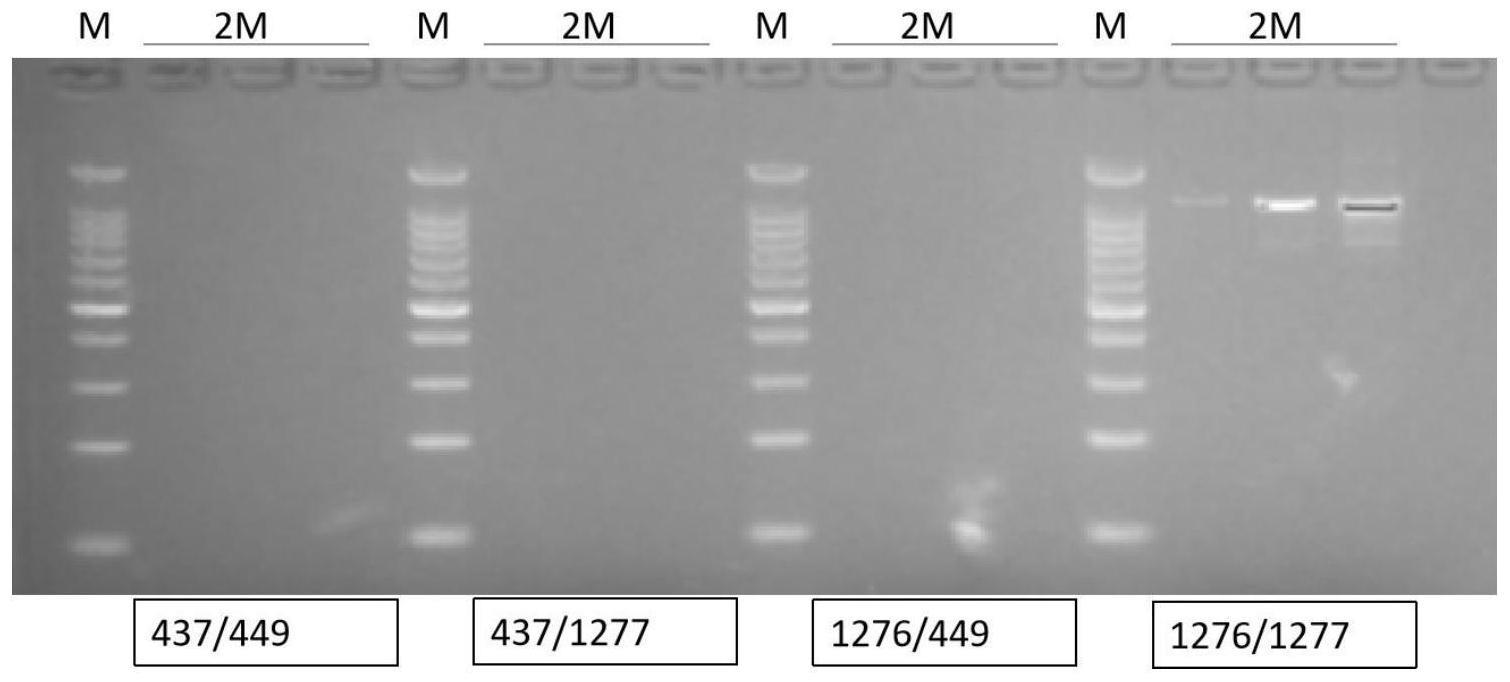
图1为引物用于青花菜自交系2m材料的sp11基因扩增电泳图;其中m为100bp dna ladder,2m材料3份dna上样跑胶,从左至右引物顺序分别为:s1000f1-437/s1000r1-449、 s1000f1-437/sp11r-1277、sp11f-1276/s1000r1-449、 sp11f-1276/sp11r-1277。
[0034]
图2为青花菜自交系2m的sp11基因克隆的碱基全长序列图;
[0035]
图3为引物sp11f-1276/sp11r-1277用于青花菜自交系2m回交转育改良材料的分子标记辅助鉴定电泳结果图。
具体实施方式
[0036]
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
[0037]
除非另外指明,否则实践本发明将采用细胞生物学、分子生物学 (包含重组技术)、微生物学、生物化学和免疫学的常规技术,所述常规技术在本领域技术人员的能力范围内。文献中充分解释了这种技术,如《分子克隆:实验室手册(molecular cloning:a laboratorymanual)》,第二版(sambrook等人,1989);《寡核苷酸合成 (oligonucleotide synthesis)》(m.j.gait编,1984);《动物细胞培养 (animal cell culture)》(r.i.freshney编,1987);《酶学方法(methodsin enzymology)》(学术出版社有限公司(academic press,inc.);《实验免疫学手册(handbook of experimental immunology)》(d.m.weir和 c.c.blackwell编);《哺乳动物细胞用基因转移载体(gene transfervectors for mammalian cells)》(j.m.miller和m.p.calos编,1987);《当代分子生物学方法(current protocols in molecular biology)》(f.m.ausubel等人编,1987);《pcr:聚合酶链反应(pcr:thepolymerase chain reaction)》(mullis等人编,1994);以及《当代免疫学方法(current protocols in immunology)》(j.e.coligan等人编,1991),所述文献中的每个文献均通过引用明确并入本文中。
[0038]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0039]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0040]
实施例1
[0041]
本实施例进行青花菜自交系2m材料sp11基因的克隆,包括如下步骤:
[0042]
1、自交系2m材料的取样、送样测序。
[0043]
青花菜自交系2m材料于大田种植,待出球期(12月初),挑选幼嫩健康的花球,使用剪刀剪取部分花球组织,迅速置于新自封袋中,并立即置于液氮罐里,待花球组织取材完毕,将组织材料保存于干冰中,送样至测序公司进行该材料的全基因组重测序和转录组测序,获得打包测序数据。
[0044]
2、sp11基因的克隆。
[0045]
2.1首先对转录组测序数据进行分析,获得sp11基因表达数值等信息,再对全基因组重测序数据进行序列比对分析,通过可视化软件在对应染色体位置进行sp11基因定位,获得sp11基因相关的拼接序列,设计了表1所示的1-4的特异性引物并由南京金斯瑞生物科技有限公司合成,见表1。
[0046]
序号引物名称引物序列(5
′‑3′
)1s1000f1-437tagaatgatcgttaacaag2s1000r1-449ctatttacaatcgcaaga3sp11f-1276tttctgcgagtaaaagagaatc4sp11r-1277ctatttacaatcgcaagaataagtacc
[0047]
2.2采集自交系2m材料叶片,使用ctab法提取材料的基因组 dna。
[0048]
田间取2m材料叶片0.1g左右于1.5ml离心管中(加钢珠2粒),液氮速冻,上机研磨成粉末。加入600ul dna提取液(高压灭菌过的,已预热至65℃的2.0
×
ctab),迅速颠倒混匀,65℃水浴 40-60min以上,期间混匀2-3次。取出离心管,冷却至室温。加等体积的氯仿异:戊醇(24∶1)溶液,混匀。室温下10000rpm离心10min,吸取上清液。加2倍体积预冷的无水乙醇,混匀,-20℃放置30min。室温下12,000rpm离心5min,弃上清。70-75%乙醇洗涤沉淀2-3次,在室温下倒置晾干。加入100ul ddh2o溶解dna。-20℃贮存备用。
[0049]
2.3以2m材料基因组dna为模板,配置pcr扩增体系:总体积为25ul,其中2
×
utaq pcr mix 12.5ul,上下游引物(10umol/l) 各1.25ul,模板dna 1.25ul,ddh2o 8.75ul。本实施例以3份2m 材料的dna为模板进行pcr检测,引物分别为 s1000f1-437/s1000r1-449、s1000f1-437/sp11r-1277、 sp11f-1276/s1000r1-449、sp11f-1276/sp11r-1277。
[0050]
2.4pcr反应程序:94℃预变性4min;94℃变性30s,60℃退火30s,72℃延伸60s,28个循环;72℃延伸10min;4℃保存。
[0051]
2.5使用2%琼脂糖凝胶对pcr扩增产物进行电泳检测,120v 恒压1h,采用紫外凝胶成像仪进行拍照。
[0052]
2.6电泳结果图参照图1所示,结果显示:仅 sp11f-1276/sp11r-1277引物对扩增出目的条带,产物的片段大小约 1000bp,其他引物对未扩增出条带,选择将该sp11f-1276/sp11r-1277 引物对扩增的pcr产物与pclone007 simple vector(北京擎科新业生物技术有限公司)、10
×
topo mix、ddh2o为1:1:1:7体积比配制反应体系,在室温连接反应5min,将2ul连接液加入50ul感受细胞 (北京擎科新业生物技术有限公司)中,冰上静置30min,42℃热激1min并于冰上1min,加入300ul不含抗生素的lb培养基于 37℃,250rpm复苏1h,在含50mg/l amp的lb培养基上涂板, 37℃培养过夜,挑选单克隆于含50mg/l amp的lb培养基于37℃, 250rpm过夜摇菌,筛选阳性克隆并送样测序。
[0053]
2.7测序序列碱基通过ncbi数据库进行blast比对分析,比对到sp11基因相似同源序列,最终成功克隆获得优良自交系2m材料的sp11基因。
[0054]
测序后的sp11基因全长序列参照图2所示,结果表明引物 sp11f-1276/sp11r-1277确定可特异扩增到自交系2m材料的sp11基因全长1029bp(如图2),确定其为sp11基因目的条带。
[0055]
实施例2
[0056]
本实施例采用实施例1提供的引物sp11f-1276/sp11r-1277进行青花菜自交系2m回交转育改良材料的分子标记辅助筛选鉴定。
[0057]
具体包括:
[0058]
1.采用ctab法,提取青花菜自交系2m回交转育改良材料20 份株系基因组dna。
[0059]
大棚取各株系材料叶片0.1g左右于1.5ml离心管中(加钢珠2 粒),液氮速冻,上机研磨成粉末。加入600ul dna提取液(高压灭菌过的,已预热至65℃的2.0
×
ctab),迅速颠倒混匀,65℃水浴40-60min以上,期间混匀2-3次。取出离心管,冷却至室温。加等体积的氯仿异:戊醇(24:1)溶液,混匀。室温下10000rpm离心 10min,吸取上清液。加2倍体积预冷的无水乙醇,混匀,-20℃放置30min。室温下12,000rpm离心5min,弃上清。70-75%乙醇洗涤沉淀2-3次,在室温下倒置晾干。加入100ul ddh2o溶解dna。
ꢀ‑
20℃贮存备用。
[0060]
2.以各株系材料基因组dna为模板,配置pcr扩增体系:总体积为20ul,其中2
×
utaq pcr mix 10ul,上下游引物(10umol/l) 各1ul,模板dna 1ul,ddh2o 7ul。
[0061]
3.pcr反应程序:94℃预变性4min;94℃变性30s,60℃退火30s,72℃延伸60s,28个循环;72℃延伸10min;4℃保存。
[0062]
4.使用2%琼脂糖凝胶对pcr扩增产物进行电泳检测,120v 恒压1h,采用紫外凝胶成像仪进行拍照。
[0063]
5.判断标准为:引物sp11f-1276/sp11r-1277扩增片段为1029bp 大小的材料为含强自交不亲和sp11基因,未扩增到目的片段的为回交材料中含有的自交亲和基因。鉴定结果如图3所示,结果表明,sp11f-1276/sp11r-1277引物筛选鉴定该20份回交转育改良材料的强自交不亲和与自交亲和基因的分离比为1:1,可清晰准确的筛选出目的材料,可以进行下一步2m自交亲和材料的固定选育工作。
[0064]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1