一种抗CD7的纳米抗体VHH12及其相关产品、方法和用途与流程
一种抗cd7的纳米抗体vhh12及其相关产品、方法和用途
1.本技术是申请日为2022年3月30日、申请号为202210331478.7、发明名称为“抗cd7纳米抗体、衍生物及其在肿瘤治疗中的应用”的专利的分案申请。
技术领域
2.本发明属于生物医药技术领域,具体地,本发明涉及一种抗cd7的纳米抗体vhh12及其相关产品、方法和用途。
背景技术:
3.cd7抗原是一种单链糖蛋白,是t细胞发育过程中的标志性抗原分子。除健康人胸腺细胞、t细胞和自然杀伤细胞外,淋系、髓系前体细胞等造血干祖细胞也表达cd7。大量研究显示在多数的人t淋巴细胞白血病和淋巴瘤上表达cd7分子(karube k,ohshima k,tsuchiya t,et al.non-b,non-t neoplasms with lymphoblast morphology:further clarification and classification[j].the american journal of surgical pathology,2003,27(10):1366-1374.;shiyong li,jonathan juco,karen p.mann,et al.flow cytometry in the differential diagnosis of lymphocyte-rich thymoma from precursor t-cell acute lymphoblastic leukemia/lymphoblastic lymphoma[j].,american journal of clinical pathology,2004,121:268-274.)和约10%的急性髓系白血病(acute myeloidleukemia,aml)上表达cd7抗原(foon k a,todd r f.immunologic classification of leukemia and lymphoma[j].blood.1986,68:1-31);此外,当cd7分子与其对应的抗体结合后会快速地发生内吞作用,这一特性使得cd7可作为一个适合靶向递送各类功能分子到cd7阳性细胞内的抗原受体;相关研究还表明人体内存在一群cd7阴性的t淋巴细胞群,这一群细胞可以维持人体正常的免疫功能,避免了使用cd7纳米抗体相关的免疫细胞清除全部cd7阳性细胞而造成的免疫功能丢失,可见靶向cd7是一个极具潜力的抗肿瘤方向。
[0004]
嵌合抗原受体修饰t细胞(chimeric antigen receptor modification t cells,car-t)和嵌合抗原受体修饰nk细胞(chimeric antigen receptor modification nk cells,car-nk)免疫疗法是目前研究进展最为迅速的两种肿瘤细胞免疫疗法,而car-t/car-nk细胞的有效激活均严重依赖识别肿瘤相关抗原的抗体的特异性以及抗原结合的亲和力高低等性质。所以在目前car-t/car-nk细胞胞内信号转导区的设计已经趋于成熟的现状下,抗原结合区的设计成为新型car-t技术开发的重点和关键。骆驼科(骆驼、羊驼)或鲨鱼体内存在一种天然缺乏轻链的重链抗体(heavy chain antibody,hcab),该抗体只包含一个重链可变区和两个常规的ch2与ch3区。其重链可变区具有与重链抗体相当的稳定性和抗原结合活性,其大小仅为2.4
×
4nm,是能够结合抗原的最小片段,称为单域抗体(variable domain of heavy chain of heavy-chain antibody,vhh)或纳米抗体。与传统抗体相比,vhh单域抗体分子量小且表达量高,化学稳定性好,亲和力高并且与人源抗体同源性高,免疫原性低。分子量小易于进行基因工程改造,构建双重或多重特异性的单域抗体
组合,达到一个分子多靶点或多种功能的效果。vhh组织渗透性好,在进行肿瘤治疗时,具有接触到不能被常规抗体接触的较为隐蔽的靶点的可能性。正由于这些优点,利用单域抗体作为car的抗原结合区进行car修饰及car-t/car-nk细胞疗法能够为本领域提供全新的肿瘤治疗策略。
技术实现要素:
[0005]
鉴于此,本发明的目的在于为本领域提供一种抗cd7的纳米抗体vhh12及其相关产品、方法和用途。
[0006]
本发明的上述目的通过以下技术方案得以实现:
[0007]
本发明的第一方面提供了一种抗cd7的纳米抗体。
[0008]
进一步,所述纳米抗体为vhh12;
[0009]
所述vhh12的cdr1、cdr2、cdr3的氨基酸序列分别如seq id no:3、seq id no:5、seq id no:7所示。
[0010]
本发明所述的纳米抗体vhh12的cdr1、cdr2、cdr3的氨基酸序列还包括分别与seq id no:3、seq id no:5、seq id no:7所示的氨基酸序列具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0011]
进一步,所述vhh12的cdr1、cdr2、cdr3的核苷酸序列分别如seq id no:4、seq id no:6、seq id no:8所示;
[0012]
本发明所述的纳米抗体vhh12的cdr1、cdr2、cdr3的核苷酸序列还包括分别与seq id no:4、seq id no:6、seq id no:8所示的核苷酸序列具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0013]
优选地,所述vhh12的氨基酸序列如seq id no:1所示;
[0014]
本发明所述的纳米抗体vhh12的氨基酸序列还包括与seq id no:1所示的氨基酸序列具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0015]
更优选地,所述vhh12的核苷酸序列如seq id no:2所示;
[0016]
本发明所述的纳米抗体vhh12的核苷酸序列还包括与seq id no:2所示的核苷酸序列具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列。
[0017]
此外,基于常规的纳米抗体人源化的方法制备得到的人源化的纳米抗体vhh12同样包含在本发明的保护范围内。
[0018]
进一步,cd7是t细胞表面一个非常稳定的标志物,无论是幼稚的t细胞还是成熟的t细胞均会表达cd7,所以不管是幼稚t细胞肿瘤(t-all/lbl/nkt细胞白血病)患者,还是成熟t细胞肿瘤(外周t细胞淋巴瘤、nkt细胞淋巴瘤、间变大细胞淋巴瘤)患者,基本都高表达cd7,因此,针对该靶点的car-t治疗t系血液肿瘤是目前临床上发展最为迅速的技术之一。
[0019]
本发明的第二方面提供了基于单纳米抗体的嵌合抗原受体。
[0020]
进一步,所述嵌合抗原受体包含本发明第一方面所述的纳米抗体;
[0021]
优选地,所述嵌合抗原受体还包含跨膜结构域;
[0022]
优选地,所述嵌合抗原受体还包含胞内信号传导结构域;
[0023]
优选地,所述嵌合抗原受体还包含铰链区;
[0024]
优选地,所述嵌合抗原受体还包含信号肽;
[0025]
优选地,所述嵌合抗原受体还包含共刺激信号结构域;
[0026]
优选地,所述嵌合抗原受体还包含启动子ef1α、自断裂肽t2a、检测标签/辅助功能元件tegfr;
[0027]
优选地,所述嵌合抗原受体还包含tegfr信号肽;
[0028]
更优选地,所述跨膜结构域包括下列分子的跨膜结构域:cd8α、cd28、igg1、igg4、4-1bb,pd-1、cd34、ox40、cd3ε、il-2受体、il-7受体、il-11受体;
[0029]
更优选地,所述胞内信号传导结构域包括下列分子的胞内信号传导结构域:cd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、tcrζ、cd4、cd5、cd8、cd21、cd22、cd79a、cd79b、cd278、fcεri、dap10、dap12、cd66d;
[0030]
更优选地,所述铰链区包括下列分子的铰链区:cd8α、cd28、igg1、igg4、4-1bb,pd-1、cd34、ox40、cd3ε、il-2受体、il-7受体、il-11受体;
[0031]
更优选地,所述信号肽包括下列分子的信号肽:t细胞受体的α链及β链、cd3ζ、cd3ε、cd4、cd5、cd8、cd9、cd28、cd16、cd22、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd154、gitr、gm-csf;
[0032]
更优选地,所述共刺激信号结构域包括下列分子的共刺激信号结构域:4-1bb(cd137)、cd27、cd19、cd4、cd28、icos(cd278)、cd8α、cd8β、baffr、hvem、light、kirds2、slamf7、nkp30、nkp46、cd40、cds、icam-1、b7-h3、ox40、dr3、gitr、cd30、tim1、cd2、cd7、cd226;
[0033]
更优选地,所述启动子并不局限于ef1α启动子,还包括:cmv启动子、efs启动子、cag启动子、cbh启动子、sffv启动子、mscv启动子、sv40启动子、mpgk启动子、hpgk启动子、ubc启动子;
[0034]
更优选地,所述自断裂肽并不局限于t2a,还包括:p2a、e2a、f2a;
[0035]
更优选地,所述检测标签/辅助功能元件并不局限于tegfr,还包括:tcd34、tcd19、tcd20、tcd22、免疫检查点抑制剂(ctla-4、pd-1/pd-l1、lag-3、tim-3、tigit、cd226、cd155、cd47、b7-h3、b7-h4)纳米抗体、细胞因子及其受体(il2、il2受体、il7、il7受体、il15、il15受体);
[0036]
最优选地,所述跨膜结构域为cd8α跨膜结构域;
[0037]
最优选地,所述胞内信号传导结构域为cd3ζ胞内信号传导结构域;
[0038]
最优选地,所述铰链区为cd8α铰链区;
[0039]
最优选地,所述共刺激信号结构域为4-1bb共刺激信号结构域;
[0040]
最优选地,所述信号肽的氨基酸序列如seq id no:17所示或与seq id no:17具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0041]
最优选地,所述信号肽的核苷酸序列如seq id no:18所示或与seq id no:18具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0042]
最优选地,所述cd8α铰链区的氨基酸序列如seq id no:19所示或与seq id no:19具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0043]
最优选地,所述cd8α铰链区的核苷酸序列如seq id no:20所示或与seq id no:20具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0044]
最优选地,所述cd8α跨膜结构域的氨基酸序列如seq id no:21所示或与seq id no:21具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0045]
最优选地,所述cd8α跨膜结构域的核苷酸序列如seq id no:22所示或与seq id no:22具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0046]
最优选地,所述4-1bb共刺激信号结构域的氨基酸序列如seq id no:23所示或与seq id no:23具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0047]
最优选地,所述4-1bb共刺激信号结构域的核苷酸序列如seq id no:24所示或与seq id no:24具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0048]
最优选地,所述cd3ζ胞内信号传导结构域的氨基酸序列如seq id no:25所示或与seq id no:25具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0049]
最优选地,所述cd3ζ胞内信号传导结构域的核苷酸序列如seq id no:26所示或与seq id no:26具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0050]
最优选地,所述t2a的氨基酸序列如seq id no:27所示或与seq id no:27具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0051]
最优选地,所述t2a的核苷酸序列如seq id no:28所示或与seq id no:28具有至
少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0052]
最优选地,所述ef1α的核苷酸序列如seq id no:29所示或与seq id no:29具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0053]
最优选地,所述tegfr信号肽的氨基酸序列如seq id no:30所示或与seq id no:30具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0054]
最优选地,所述tegfr信号肽的核苷酸序列如seq id no:31所示或与seq id no:31具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0055]
最优选地,所述tegfr的氨基酸序列如seq id no:32所示或与seq id no:32具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0056]
最优选地,所述tegfr的核苷酸序列如seq id no:33所示或与seq id no:33具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0057]
最优选地,所述嵌合抗原受体为ef1α、信号肽、本发明第一方面所述的纳米抗体、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、tegfr信号肽、tegfr依次串联得到。
[0058]
本发明的第三方面提供了基于双纳米抗体的嵌合抗原受体。
[0059]
进一步,所述嵌合抗原受体包含两种纳米抗体,所述两种纳米抗体中的一种为本发明第一方面所述的纳米抗体,所述两种纳米抗体中的另一种为本发明第一方面所述的纳米抗体或纳米抗体vhh06;
[0060]
优选地,所述vhh06的cdr1、cdr2、cdr3的氨基酸序列分别如seq id no:11、seq id no:13、seq id no:15所示或与seq id no:11、seq id no:13、seq id no:15分别具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0061]
更优选地,所述vhh06的cdr1、cdr2、cdr3的核苷酸序列分别如seq id no:12、seq id no:14、seq id no:16所示或与seq id no:12、seq id no:14、seq id no:16分别具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的核苷酸序列;
[0062]
最优选地,所述vhh06的氨基酸序列如seq id no:9所示或与seq id no:9具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0063]
最优选地,所述vhh06的核苷酸序列如seq id no:10所示或与seq id no:10具有至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、
89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%同一性的氨基酸序列;
[0064]
优选地,所述嵌合抗原受体还包含跨膜结构域;
[0065]
优选地,所述嵌合抗原受体还包含胞内信号传导结构域;
[0066]
优选地,所述嵌合抗原受体还包含铰链区;
[0067]
优选地,所述嵌合抗原受体还包含信号肽;
[0068]
优选地,所述嵌合抗原受体还包含共刺激信号结构域;
[0069]
优选地,所述嵌合抗原受体还包含启动子ef1α、自断裂肽t2a、检测标签/辅助功能元件tegfr;
[0070]
优选地,所述嵌合抗原受体还包含tegfr信号肽;
[0071]
更优选地,所述跨膜结构域包括下列分子的跨膜结构域:cd8α、cd28、igg1、igg4、4-1bb,pd-1、cd34、ox40、cd3ε、il-2受体、il-7受体、il-11受体;
[0072]
更优选地,所述胞内信号传导结构域包括下列分子的胞内信号传导结构域:cd3ζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、tcrζ、cd4、cd5、cd8、cd21、cd22、cd79a、cd79b、cd278、fcεri、dap10、dap12、cd66d;
[0073]
更优选地,所述铰链区包括下列分子的铰链区:cd8α、cd28、igg1、igg4、4-1bb,pd-1、cd34、ox40、cd3ε、il-2受体、il-7受体、il-11受体;
[0074]
更优选地,所述信号肽包括下列分子的信号肽:t细胞受体的α链及β链、cd3ζ、cd3ε、cd4、cd5、cd8、cd9、cd28、cd16、cd22、cd33、cd37、cd45、cd64、cd80、cd86、cd134、cd137、cd154、gitr、gm-csf;
[0075]
更优选地,所述共刺激信号结构域包括下列分子的共刺激信号结构域:4-1bb(cd137)、cd27、cd19、cd4、cd28、icos(cd278)、cd8α、cd8β、baffr、hvem、light、kirds2、slamf7、nkp30、nkp46、cd40、cds、icam-1、b7-h3、ox40、dr3、gitr、cd30、tim1、cd2、cd7、cd226;
[0076]
更优选地,所述启动子并不局限于ef1α启动子,还包括:cmv启动子、efs启动子、cag启动子、cbh启动子、sffv启动子、mscv启动子、sv40启动子、mpgk启动子、hpgk启动子、ubc启动子;
[0077]
更优选地,所述自断裂肽并不局限于t2a,还包括:p2a、e2a、f2a;
[0078]
更优选地,所述检测标签/辅助功能元件并不局限于tegfr,还包括:tcd34、tcd19、tcd20、tcd22、免疫检查点抑制剂(ctla-4、pd-1/pd-l1、lag-3、tim-3、tigit、cd226、cd155、cd47、b7-h3、b7-h4)纳米抗体、细胞因子及其受体(il2、il2受体、il7、il7受体、il15、il15受体);
[0079]
最优选地,所述跨膜结构域为cd8α跨膜结构域;
[0080]
最优选地,所述胞内信号传导结构域为cd3ζ胞内信号传导结构域;
[0081]
最优选地,所述铰链区为cd8α铰链区;
[0082]
最优选地,所述共刺激信号结构域为4-1bb共刺激信号结构域;
[0083]
最优选地,所述两种纳米抗体通过连接肽linker进行连接;
[0084]
最优选地,所述嵌合抗原受体为ef1α、信号肽、所述两种纳米抗体中的一种、linker、所述两种纳米抗体中的另一种、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、tegfr信号肽、tegfr依次串联得到;
[0085]
最优选地,所述嵌合抗原受体为ef1α、信号肽、本发明第一方面所述的纳米抗体、linker、本发明第一方面所述的纳米抗体、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、tegfr信号肽、tegfr依次串联得到;
[0086]
最优选地,所述嵌合抗原受体为ef1α、信号肽、纳米抗体vhh06、linker、本发明第一方面所述的纳米抗体、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、tegfr信号肽、tegfr依次串联得到。
[0087]
最优选地,所述信号肽、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、ef1α、tegfr信号肽、tegfr的氨基酸序列和核苷酸序列如前所述。
[0088]
本发明的第四方面提供了核酸分子。
[0089]
进一步,所述核酸分子包含编码本发明第一方面所述的纳米抗体、本发明第二方面所述的嵌合抗原受体或本发明第三方面所述的嵌合抗原受体的核苷酸序列;
[0090]
优选地,本发明第一方面所述的纳米抗体的核苷酸序列如seq id no:2所示;
[0091]
优选地,本发明第二方面所述的嵌合抗原受体或本发明第三方面所述的嵌合抗原受体中信号肽的核苷酸序列如seq id no:18所示,cd8α铰链区的核苷酸序列如seq id no:20所示,cd8α跨膜结构域的核苷酸序列如seq id no:22所示,4-1bb共刺激信号结构域的核苷酸序列如seq id no:24所示,cd3ζ胞内信号传导结构域的核苷酸序列如seq id no:26所示,t2a的核苷酸序列如seq id no:28所示,ef1α的核苷酸序列如seq id no:29所示,tegfr信号肽的核苷酸序列如seq id no:31所示,tegfr的核苷酸序列如seq id no:33所示。
[0092]
本发明的第五方面提供了重组表达载体。
[0093]
进一步,所述重组表达载体包含本发明第四方面所述的核酸分子;
[0094]
优选地,所述表达载体包括dna载体、rna载体、质粒、转座子载体、crispr/cas9载体、或病毒载体;更优选地,所述病毒载体包含慢病毒载体、腺病毒载体、逆转录病毒载体。
[0095]
本发明的第六方面提供了经工程改造的宿主细胞。
[0096]
进一步,所述经工程改造的宿主细胞表达本发明第一方面所述的纳米抗体、本发明第二方面所述的嵌合抗原受体或本发明第三方面所述的嵌合抗原受体;
[0097]
优选地,所述经工程改造的宿主细胞包含本发明第五方面所述的重组表达载体;
[0098]
优选地,所述经工程改造的宿主细胞包含经工程改造的免疫细胞;更优选地,所述经工程改造的免疫细胞包含t细胞、nk细胞、inkt细胞、ctl细胞、单核细胞、巨噬细胞、树突状细胞、nkt细胞。
[0099]
本发明的第七方面提供了一种缀合物或药物组合物或试剂盒或检测cd7蛋白的试剂。
[0100]
进一步,所述缀合物包含本发明第一方面所述的纳米抗体、以及连接于所述纳米抗体的修饰部分,所述修饰部分包括可检测的标记、治疗剂;
[0101]
优选地,所述可检测的标记包括酶、放射性核素、荧光染料、发光物质、生物素,
[0102]
优选地,所述治疗剂包括具有抗肿瘤活性的药物或细胞毒剂;更优选地,所述具有抗肿瘤活性的药物包括化疗药物、抗肿瘤血管生成药物、免疫检查点抑制剂;最优选地,所述化疗药物包括紫杉烷类化疗药物、长春花碱类化疗药物、金属铂类化疗药物、蒽环类化疗药物、抗叶酸类化疗药物、氮芥类化疗药物、鬼臼生物碱类化疗药物;最优选地,所述紫杉烷
类化疗药物包括紫杉醇、紫杉醇脂质体、白蛋白结合型紫杉醇、多西他赛;最优选地,所述长春花碱类化疗药物包括长春新碱、长春地辛、长春花碱;最优选地,所述金属铂类化疗药物包括顺铂、卡铂、奥沙利铂、奈达铂、洛铂;最优选地,所述蒽环类化疗药物包括表柔比星、吡柔比星、阿霉素、表阿霉素;最优选地,所述抗叶酸类化疗药物包括甲氨蝶呤、培美曲塞二钠;最优选地,所述氮芥类化疗药物包括环磷酰胺、苯达莫司汀;最优选地,所述鬼臼生物碱类化疗药物包括依托泊苷、替尼泊苷;最优选地,所述抗肿瘤血管生成药物包括小分子多靶点血管生成抑制剂、大分子单靶点血管生成抑制剂、内源性泛靶点血管生成抑制剂;最优选地,所述小分子多靶点血管生成抑制剂包括索拉非尼、舒尼替尼、培唑帕尼、凡德他尼、卡博替尼、瑞戈非尼、阿昔替尼、尼达尼布、乐伐替尼、阿帕替尼、安罗替尼、呋喹替尼、厄达替尼;最优选地,所述大分子单靶点血管生成抑制剂包括贝伐珠单抗、雷莫芦单抗、阿柏西普;最优选地,所述内源性泛靶点血管生成抑制剂包括恩度;最优选地,所述免疫检查点抑制剂包括伊匹木单抗、帕博利株单抗、纳武利尤单抗、阿替利珠单抗、度伐利尤单抗、阿维鲁单抗、信迪利单抗;更优选地,所述细胞毒剂包括生物碱类细胞毒剂、抗生素类细胞毒剂;最优选地,所述生物碱类细胞毒剂包括氢溴酸山莨菪碱、高三尖杉酯碱;最优选地,所述抗生素类细胞毒剂包括伊达比星、盐酸多柔比星;
[0103]
优选地,所述药物组合物或试剂盒包含本发明第一方面所述的纳米抗体、本发明第二方面所述的嵌合抗原受体、本发明第三方面所述的嵌合抗原受体、本发明第四方面所述的核酸分子、本发明第五方面所述的重组表达载体、本发明第六方面所述的经工程改造的宿主细胞或所述缀合物;
[0104]
优选地,所述检测cd7蛋白的试剂包含本发明第一方面所述的纳米抗体或所述缀合物。
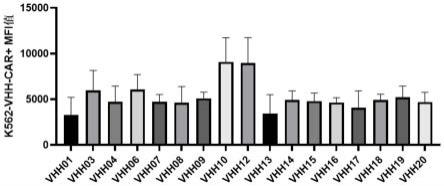
[0105]
进一步,所述药物组合物中还包含另外的药学活性剂;优选地,所述另外的药学活性剂包括另外的抗体、融合蛋白或药物(如抗肿瘤药物,如用于放疗的药物或化疗药物)。
[0106]
进一步,所述药物组合物中还包含药学上可接受的载体和/或赋形剂。
[0107]
本发明的第八方面提供了如下任一种方法:
[0108]
(1)一种非诊断目的的检测cd7蛋白的方法,所述方法包括如下步骤:
[0109]
①
获取含有cd7蛋白的样品;
[0110]
②
将步骤
①
收集的样品与本发明第一方面所述的纳米抗体或本发明第七方面所述的缀合物接触;
[0111]
③
检测抗体-抗原复合物的存在;
[0112]
(2)一种本发明第六方面所述的经工程改造的宿主细胞的制备方法,所述方法包括如下步骤:将本发明第五方面所述的重组表达载体引入到宿主细胞中;
[0113]
优选地,所述引入的方法包括脂质转染法、微注射、电穿孔、dna载体、rna载体、逆转录病毒载体、慢病毒载体、痘病毒载体、单纯疱疹病毒载体、腺病毒载体、腺相关病毒载体。
[0114]
本发明的第九方面提供了如下任一方面的应用:
[0115]
(1)本发明第一方面所述的纳米抗体在非诊断和治疗目的地检测cd7蛋白中的应用;
[0116]
(2)本发明第一方面所述的纳米抗体在制备用于检测cd7蛋白的试剂或试剂盒中
的应用;
[0117]
(3)本发明第一方面所述的纳米抗体、本发明第二方面所述的嵌合抗原受体、本发明第三方面所述的嵌合抗原受体、本发明第四方面所述的核酸分子、本发明第五方面所述的重组表达载体或本发明第六方面所述的经工程改造的宿主细胞在制备抗肿瘤药物中的应用;
[0118]
(4)本发明第四方面所述的核酸分子或本发明第五方面所述的重组表达载体在制备经工程改造的宿主细胞中的应用,所述经工程改造的宿主细胞为本发明第六方面所述的经工程改造的宿主细胞;
[0119]
优选地,所述抗肿瘤药物包括抗肿瘤免疫细胞治疗剂、抗肿瘤的基因治疗药物;
[0120]
优选地,所述肿瘤为表达cd7的肿瘤;
[0121]
更优选地,所述肿瘤为t淋巴细胞系血液肿瘤;
[0122]
最优选地,所述肿瘤包括急性髓系白血病(aml)、急性淋巴细胞白血病(all)、淋巴母细胞淋巴瘤(lbl)、nkt细胞白血病、外周t细胞淋巴瘤(nhl)、nkt细胞淋巴瘤、间变性大细胞淋巴瘤(alcl)。
[0123]
本发明还提供了一种预防和/或治疗患有表达cd7肿瘤的受试者的方法。
[0124]
进一步,所述方法包括向所述受试者施用有效量的本发明第六方面所述的经工程改造的宿主细胞或本发明第七方面所述的药物组合物。
[0125]
进一步,所述经工程改造的宿主细胞包含表达抗cd7的本发明第二方面所述的基于单纳米抗体的嵌合抗原受体(car)或本发明第三方面所述的基于双纳米抗体的嵌合抗原受体的免疫细胞;
[0126]
优选地,所述免疫细胞包括t细胞、nk细胞、inkt细胞、ctl细胞、单核细胞、巨噬细胞、树突状细胞、nkt细胞;更优选地,所述经工程改造的宿主细胞为car-t细胞。
[0127]
进一步,选自以下的量给受试者施用所述的经工程改造的宿主细胞:
[0128]
(1)若所述受试者的体重小于100公斤(kg)并且年龄小于18岁,则从为或约0.05
×
106个car-t细胞/kg所述受试者的体重至为或约5.0
×
107个car-t细胞/kg所述受试者的体重;
[0129]
(2)如果所述受试者的体重为或大于100公斤(kg)或年龄大于18岁,则从为或约0.05
×
106个car-t细胞/kg所述受试者的体重至为或约5.0
×
108个car-t细胞/kg所述受试者的体重。
[0130]
在本发明的一些实施方案中,所述car-t细胞疗法是通过自体转移进行的,其中从接受细胞疗法的受试者或从源自这种受试者的样品中分离和/或以其他方式制备细胞。因此,在一些方面,细胞源自需要治疗的受试者(例如,患者),并且在分离和处理后将细胞施用于同一受试者。
[0131]
在本发明的另一些实施方案中,所述car-t细胞疗法是通过同种异体转移进行,其中从将要接受或最终接受细胞疗法的受试者以外的受试者(例如,第一受试者)分离和/或以其他方式制备细胞。在此类实施方案中,然后将细胞施用于相同物种的不同受试者,例如第二受试者。在一些实施方案中,所述第一和第二受试者在遗传上是相同的。在一些实施方案中,所述第一和第二受试者在遗传上是相似的。在一些实施方案中,所述第二受试者与所述第一受试者表达相同的hla类别或超类型。
[0132]
在本发明的具体实施方案中,可以将所述car-t细胞通过任何合适的方式施用,例如通过推注输注,通过注射例如静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下(subconjectval)注射、眼球筋膜囊下(sub-tenon)注射、眼球后注射、眼球周注射或后近巩膜(posteriorjuxtascleral)递送。在一些实施方案中,将它们通过肠胃外、肺内和鼻内以及(如果需要用于局部治疗的话)病灶内施用来施用。肠胃外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。在一些实施方案中,给定剂量是通过所述细胞的单次推注施用来施用。在一些实施方案中,给定剂量通过例如在不超过3天的时间段内细胞的多次推注施用,或通过细胞的连续输注施用来施用。在一些实施方案中,细胞剂量或任何其他疗法(例如,淋巴细胞清除疗法、干预疗法和/或组合疗法)的施用是通过门诊递送进行的。
[0133]
进一步,对于疾病的预防或治疗,适当的剂量可取决于要治疗的疾病类型、细胞的类型、疾病的严重程度和病程、是针对预防目的还是针对治疗目的而施用细胞、先前治疗、受试者的临床病史和对细胞的反应以及主治医师的决断。在一些实施方案中,适合将药物组合物和/或car-t细胞一次或在一系列治疗中施用至受试者。
[0134]
在一些实施方案中,所述car-t细胞是作为组合治疗的一部分来施用,如与另一种或另外的治疗性干预(如抗体或工程化细胞或受体或药剂、如细胞毒性剂或治疗剂)同时或以任何顺序依序施用。在一些实施方案中,将所述car-t细胞与一种或多种另外的治疗剂共同施用或与另一种治疗性干预联合施用(同时或以任何顺序依次施用)。在一些实施方案中,所述另外的治疗剂是现有技术中本领域技术人员公知的可用于肿瘤干预治疗的任何干预制剂或药剂,在一些实施方案中,在所述一种或多种另外的治疗剂之前施用所述细胞。在一些实施方案中,在所述一种或多种另外的治疗剂之后施用所述细胞。在一些实施方案中,所述一种或多种另外的药剂包括细胞因子如il-2,以例如增强持久性。在一些实施方案中,所述方法包括施用化学治疗剂。在一些实施方案中,所述方法包括在所述施用之前施用化学治疗剂(例如,调理性化学治疗剂),例如以减小肿瘤负荷。在一些实施方案中,用免疫清除(例如,淋巴细胞清除)疗法预调理受试者可以改善细胞疗法的效果。
[0135]
在一些实施方案中,所提供的方法和应用中涉及的施用car-t细胞或药物组合物的全部或一部分,所述细胞如表达本发明第二方面所述的嵌合抗原受体car或本发明第三方面所述的嵌合抗原受体的工程化免疫细胞,在一些实施方案中,向受试者施用特定量或数量的细胞,或特定量的含有所述特定量或数量的细胞的药物组合物。在一些实施方案中,向受试者施用一个或多个细胞剂量,其含有特定量或数量的细胞或特定量的含有所述特定量或数量的细胞的药物组合物。在一些实施方案中,根据所提供方法和/或用所提供的制品或组合物将一定剂量的细胞施用至受试者。在一些实施方案中,剂量的大小、量或时间安排根据所述受试者的年龄来确定。在一些实施方案中,剂量的大小、量或时间安排根据所述受试者的体重来确定。在一些实施方案中,剂量的大小、量或时间安排根据受试者的肿瘤的特定类型来确定。
[0136]
本发明还提供了一种用于诊断受试者是否患有表达cd7肿瘤的方法。
[0137]
进一步,所述方法包括如下步骤:
[0138]
(1)提供来自怀疑患有表达cd7肿瘤的受试者的样品;
[0139]
(2)将样品与本发明第一方面所述的纳米抗体接触;
[0140]
(3)检测包含所述纳米抗体与抗原的复合物的形成,得到在来自所述受试者的样品中cd7的量,并将所述cd7在来自所述受试者的样品中的量与其在已知标准品或参照样品中的量进行比较,并确定来自所述受试者的样品的cd7水平是否落入与肿瘤相关的cd7水平内;
[0141]
优选地,所述样品可以选自尿液、血液、血清、血浆、唾液、腹水、循环细胞、循环肿瘤细胞、非组织缔合的细胞、组织或组织学制备物;
[0142]
优选地,所述肿瘤为t淋巴细胞系血液肿瘤;更优选地,所述肿瘤包括急性髓系白血病(aml)、急性淋巴细胞白血病(all)、淋巴母细胞淋巴瘤(lbl)、nkt细胞白血病、外周t细胞淋巴瘤(nhl)、nkt细胞淋巴瘤、间变性大细胞淋巴瘤(alcl)。
[0143]
相对于现有技术,本发明具有的优点和有益效果如下:
[0144]
本发明提供了一种抗cd7的纳米抗体vhh12,所述纳米抗体vhh12与cd7具有较好的亲和力,将所述纳米抗体作为嵌合抗原受体的抗原结合区进行了嵌合抗原受体修饰并用于car-t细胞疗法中,相对于传统的基于单克隆抗体(scfv)构建得到的car-t细胞而言,本发明基于单纳米抗体或双纳米抗体构建得到的car-t细胞具有多种优势,不仅有效避免了传统的以scfv为基础设计的car-t所常有的表达困难、稳定性差等缺陷,而且明显增强了免疫细胞靶向识别肿瘤抗原的能力,加强了对肿瘤细胞的杀伤活性,应用前景广阔。
附图说明
[0145]
图1为cd7抗原纯化sds-page结果图;
[0146]
图2为羊驼免疫流程图;
[0147]
图3为纳米抗体文库构建过程中第一轮pcr扩增结果图;
[0148]
图4为纳米抗体文库构建过程中第二轮pcr扩增结果图;
[0149]
图5为纳米抗体文库多样性检测pcr结果图;
[0150]
图6为噬菌体淘选后阳性组与阴性组的比值结果图;
[0151]
图7为单克隆筛选od值统计结果图;
[0152]
图8为单克隆筛选与鉴定统计结果图;
[0153]
图9为单vhh car-t结构示意图;
[0154]
图10为慢病毒包装流程图;
[0155]
图11为car-t细胞培养流程图;
[0156]
图12为单vhh car-t细胞流式细胞术检测代表性结果图;
[0157]
图13为单vhh car-t细胞cd7+平均mfi结果统计图;
[0158]
图14为单vhh car-t细胞杀伤比例统计结果图;
[0159]
图15为单vhh k562细胞系平均mfi值统计结果图;
[0160]
图16为单vhh专属性检测结果图;
[0161]
图17为单vhh car-t细胞流式细胞术检测代表性结果图;
[0162]
图18为单vhh car-t细胞cd7+平均mfi结果图;
[0163]
图19为源化序列与dp-47、模板h-nbbcii10pgla及原始序列比对结果图,突出显示位点为突变位点;
[0164]
图20为双vhh car-t结构示意图;
[0165]
图21为双vhh car-t细胞流式细胞术检测代表性结果图;
[0166]
图22为单vhh car-t细胞、双vhh car-t细胞cd7+平均mfi结果统计图;
[0167]
图23为dvhh-d car-t细胞扩增曲线结果图;
[0168]
图24为dvhh-d car-t细胞杀伤结果图;
[0169]
图25为dvhh-e car-t细胞扩增曲线结果图;
[0170]
图26为dvhh-e car-t细胞杀伤结果图。
具体实施方式
[0171]
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
[0172]
实施例1抗原制备
[0173]
1、实验方法
[0174]
利用rna提取试剂盒提取t细胞中的rna。参考superscript
tm ii reverse transcriptase使用说明书,利用random primers引物进行反转录,获得cdna。以cdna为模板,通过pcr获得抗原cd7的胞外区基因序列。将cd7胞外区基因序列连接入蛋白表达载体中进行表达,并进行ni柱纯化,获得纯化的cd7-his蛋白。
[0175]
2、实验结果
[0176]
结果见图1,结果显示,经过sds-page鉴定,本发明成功制备了大小为17.2kda,纯度>90%的cd7抗原,可进行后续的羊驼免疫。
[0177]
实施例2纳米抗体文库的构建
[0178]
1、实验方法
[0179]
(1)利用实施例1中本发明自主纯化的cd7-his蛋白进行羊驼免疫,具体羊驼免疫流程图见图2。每周进行1次免疫,共连续进行6次免疫;(3)最后一次免疫7天后采集外周血100ml,通过ficoll密度梯度离心法分离外周血单核细胞,并进行rna的提取,并利用反转录试剂盒进行cdna的制备;(4)利用soe-pcr获得vhh片段,并将其连接入pmes4噬菌体展示载体,(5)将连接产物电转化至电转感受态细胞tg1中,所得菌库即为构建的cd7的单域重链抗体噬菌体展示文库,库容量为3.37
×
108;(6)文库构建完成后,为检测文库的插入效率,随机选择25个克隆利用引物mp57以及gⅲ进行了菌落pcr,并将pcr产物进行sanger测序。
[0180]
2、实验结果
[0181]
第一轮pcr扩增结果图见图3,结果显示,第一轮pcr结束后,回收大小约为700bp的dna片段,第二轮pcr扩增结果图见图4,结果显示,第二轮pcr结束后,回收大小约为400bp的dna片段,文库构建完成后,为检测文库的插入效率,随机选择25个克隆利用引物mp57以及gⅲ进行了菌落pcr,并将pcr产物进行sanger测序,结果显示插入率接近95%(见图5)。
[0182]
实施例3纳米抗体的富集筛选
[0183]
1、噬菌体纳米抗体文库的扩增
no:3、seq id no:5、seq id no:7所示,vhh12的cdr1、cdr2、cdr3的核苷酸序列分别如seq id no:4、seq id no:6、seq id no:8所示,vhh12的氨基酸序列如seq id no:1所示,vhh12的核苷酸序列如seq id no:2所示;vhh06的cdr1、cdr2、cdr3的氨基酸序列分别如seq id no:11、seq id no:13、seq id no:15所示,vhh06的cdr1、cdr2、cdr3的核苷酸序列分别如seq id no:12、seq id no:14、seq id no:16所示,vhh06的氨基酸序列如seq id no:9所示,vhh06的核苷酸序列如seq id no:10所示。
[0196]
实施例5单vhh car-t细胞的制备及体外功能验证
[0197]
1、单vhh car结构构建
[0198]
(1)将序列特异性的克隆进行单vhh car结构构建。首先,利用pcr的方法扩增阳性克隆株的vhh序列,第一轮pcr引物为:
[0199]
ncar-f1:5
’‑
ctgcaggagtctggrggagg-3’[0200]
ncar-r1:5
’‑
tgaggagacggtgacctggg-3’[0201]
第一轮pcr结束后,以第一轮pcr产物为模板进行第二轮pcr,第二轮pcr引物为:
[0202]
ncar-f2:5
’‑
tttctgctgatcccccaggtgcagctgcaggagtctggrggagg-3’[0203]
ncar-r2:5
’‑
taggagccggggtgggcggccgcggtgctggggtagttgaggagacggtgacct ggg-3’[0204]
(2)将第二轮pcr产物通过同源重组的方式,连接入载体senl-s88bz,载体用not i单酶切。至此,包含有靶向cd7单vhh的car结构构建成功。共构建17个单vhh序列,分别命名为vhh01至vhh20(其中不包含02、05和11),构建得到的单vhh car-t结构示意图如图9所示,其中,ef1α为延长因子1α的启动子,leader是信号肽的编码序列,vhh是抗cd7纳米抗体的编码序列,cd8h+tm为cd8铰链区和跨膜区,4-1bb和cd3ζ胞内信号区为胞内共刺激域,通过t2a肽连接表达tegfr胞外区域,以便病毒转导后检测car的表达。
[0205]
其中,所述car中信号肽的氨基酸序列如seq id no:17所示,核苷酸序列如seq id no:18所示;cd8α铰链区的氨基酸序列如seq id no:19所示,核苷酸序列如seq id no:20所示;cd8α跨膜结构域的氨基酸序列如seq id no:21所示,核苷酸序列如seq id no:22所示;4-1bb共刺激信号结构域的氨基酸序列如seq id no:23所示,核苷酸序列如seq id no:24所示;cd3ζ胞内信号传导结构域的氨基酸序列如seq id no:25所示,核苷酸序列如seq id no:26所示;t2a的氨基酸序列如seq id no:27所示,核苷酸序列如seq id no:28所示;ef1α的核苷酸序列如seq id no:29所示;tegfr信号肽的氨基酸序列如seq id no:30所示,核苷酸序列如seq id no:31所示;tegfr的氨基酸序列如seq id no:32所示,核苷酸序列如seq id no:33所示。
[0206]
2、单vhh car-t细胞的制备
[0207]
car-t细胞制备前,首先进行慢病毒的包装:(1)将目的质粒与三个辅助质粒(pmd2.g、prsv-rev、pmdlg)在pei-pro作用下共转染293ft细胞;(2)包装6小时进行换液;(3)包装48小时后进行慢病毒收获;(4)收获的慢病毒原液进行超速离心浓缩,用dmem高糖培养基重悬慢病毒颗粒,并进行分装备用;慢病毒包装流程如图10所示;
[0208]
慢病毒包装完成后,进行car-t细胞的制备:(1)采集患者或健康供者外周血单个核细胞(pbmc);(2)通过cd3磁珠进行αβt细胞分选;(3)分选完成的αβt细胞在texmacs gmp培养基(macs)中进行培养;(4)2天后进行慢病毒的转导;(5)继续培养到12-14天进行car-t
细胞收获,获得靶向cd7的vhh ns car-t细胞(命名为vhh01-vhh20,其中不包括vhh02、vhh05和vhh11),car-t细胞培养流程如图11所示;(6)培养过程中进行流式检测,测定car+细胞的比例及cd7+细胞平均mfi值。
[0209]
3、单vhh car-t细胞的体外功能验证
[0210]
为了验证本实施例制备得到的抗cd7 vhh car-t细胞的体外生物学活性,培养过程中进行了体外杀伤实验的验证:首先收集靶细胞kg-1a-gfp-luc,2000rpm离心5min,dpbs重悬计数,按1
×
105个/孔的数量加到96孔板中。然后根据e:t=3:1向靶细胞中添加适量的效应细胞,混合后孵育4小时,加入相应的荧光素酶底物,并将96孔板用电化学发光酶标仪读取荧光素酶数值。根据数值变化,计算杀伤比例。另外,在17种单vhh car-t细胞培养的第12天,取17种单vhh car-t细胞、空白t细胞分别与cd7表达阳性细胞系kg-1a-gfp-luc按照e:t=3:1的比例进行细胞杀伤实验。
[0211]
4、实验结果
[0212]
单vhh car-t细胞流式细胞术检测代表性结果、及其cd7+平均mfi结果分别见图12和图13,结果显示,vhh01至vhh20(不包括vhh02、vhh05和vhh11)的car阳性率分别为:61.04%、96.2%、78.9%、83%、85%、72.72%、89%、95.6%、90.98%、68.38%、65%、84.1%、79.6%、54.4%、89.2%、72.6%、62.15%;空白t细胞cd7阳性细胞平均mfi值为2588,vhh01至vhh20(不包括vhh02、vhh05和vhh11)的car-t细胞cd7阳性细胞平均mfi值分别为:2257、694、1281、498、1566、2362、841、197、190、2010、1473、1077、1300、2054、1117、1391、2041;
[0213]
体外功能验证的结果见图14,结果显示,空白t细胞的杀伤比例为13.65%,vhh01至vhh20(不包括vhh02、vhh05和vhh11)car-t细胞的杀伤比例分别为4.79%、75.7%、57%、62.19%、61.63%、68.52%、71.47%、91.36%、78.18%、1.18%、60.44%、56.77%、72.87%、8.58%、74.52%、61.71%、9.38%。
[0214]
实施例6纳米抗体亲和力、专属性的检测
[0215]
1、亲和力检测
[0216]
将实施例4中经筛选鉴定得到的17种单vhh对应的vhh car结构转导人髓系白血病细胞系k562,在转导后第4天,利用cd7-his蛋白进行流式检测,统计阳性细胞的平均mfi值。根据各vhh与cd7亲和力的不同,阳性细胞平均mfi值会有差异,mfi值越高代表所对应的纳米抗体对抗原cd7的亲和力越高,共进行三次平行实验。
[0217]
2、专属性检测
[0218]
(1)将测序获得的不同克隆株的vhh片段克隆到原核表达载体pet-28a-sumo中;(2)测序正确后提取质粒,然后转化至大肠杆菌菌株bl21中,并在iptg诱导下进行蛋白表达(3)超声裂解菌体获得粗提蛋白;(4)经过镍柱离子亲和层析纯化纳米抗体;(5)以纯化后纳米抗体为一抗,以his-fitc抗体为二抗通过流式细胞术检测17个纳米抗体与k562和k562-cd7细胞系的结合情况。
[0219]
3、实验结果
[0220]
纳米抗体亲和力的检测结果见图15,结果显示,17个单vhh结构均与cd7-his发生了特异性结合,其中vhh03、vhh06、vhh10、vhh12的亲和力较强,表明了本发明实施例4中经筛选鉴定得到的17种单vhh与cd7均具有较好的亲和力;
[0221]
纳米抗体专属性的检测结果见图16,结果显示,17个vhh均能与cd7发生特异性结合,表明了本发明实施例4中经筛选鉴定得到的17种单vhh具有较好的专属性。
[0222]
实施例7人源化纳米抗体(hvhh06)的构建
[0223]
1、实验方法
[0224]
(1)以文献报道的通用人源化框架h-nbbcii10fgla为参考(详见文献:vincke,c.,et al.,general strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold.j biol chem,2009.284(5):p.3273-3284),并通过与dp-47进行比对,对vhh06关键位置的残基进行了人源化改造,改造后纳米抗体命名为hvhh06,三种结构(人源化序列与dp-47、模板h-nbbcii10pgla及原始序列)的序列对比如图19所示,所述hvhh06的cdr1、cdr2、cdr3的氨基酸序列分别如seq id no:139、seq id no:141、seq id no:143所示,cdr1、cdr2、cdr3的核苷酸序列分别如seq id no:140、seq id no:142、seq id no:144所示,所述hvhh06的氨基酸序列如seq id no:137所示,核苷酸序列如seq id no:138所示;(2)将hvhh06和vhh06按照前述方法同时进行慢病毒包装,并制备得到car-t细胞;(3)在car-t培养的第6天进行流式细胞术检测;(4)在car-t培养的第10天,以kg-1a-gfp-luc为靶细胞,按照前述方法,设定效靶比为e:t=5:1、10:1、20:1进行杀伤实验。
[0225]
2、实验结果
[0226]
流式细胞术检测的结果见图17,结果显示,vhh06和hvhh06的转导率分别为12.4%、21%,cd7阳性率分别为0.249%、0.157%;杀伤实验的结果见图18,结果显示,e:t=5:1、10:1、20:1时,空白t细胞对kg-1a-gfp-luc细胞的杀伤均值分别为27.40%、28.00%、26.80%;vhh06对kg-1a-gfp-luc细胞的杀伤均值分别为69.90%、79.80%、79.70%,hvhh06对kg-1a-gfp-luc细胞的杀伤均值分别为70.80%、81.20%、89.60%,由以上结果可知,人源化对抗体的性状未产生影响,表明了本实施例成功对vhh06进行了人源化改造。
[0227]
实施例8双vhh car-t细胞的制备
[0228]
1、双vhh car结构构建
[0229]
(1)将实施例6中筛选到的功能较好的vhh(vhh03、vhh06、vhh10、vhh12)用于构建双vhh的car结构目的质粒,结构示意图如图20所示,其中,所述car中信号肽、cd8α铰链区、cd8α跨膜结构域、4-1bb共刺激信号结构域、cd3ζ胞内信号传导结构域、t2a、ef1α、tegfr信号肽、tegfr的氨基酸序列和核苷酸序列如实施例5中所述。首先,利用pcr的方法扩增阳性克隆株的vhh序列,第一轮pcr引物为:
[0230]
dncar-f1:5
’‑
caggtgcagctgcaggag-3’[0231]
dncar-r1:5
’‑
tgaggagacggtgacctgg-3’[0232]
第一轮pcr结束后,以第一轮pcr产物为模板进行第二轮pcr,第二轮pcr引物为:
[0233]
dncar-f2:5
’‑
ccaggtcaccgtctcctcaggaggaggaggatccggaggaggaggatctggcgg cggcggcagtggcggcggcggctccggcggcggcggctctcaggtgcagctgcaggag-3’[0234]
dncar-r2:5
’‑
taggagccggggtgggcggccgcggtgctggggtagttgaggagacggtgacct gg-3’[0235]
然后,将第二轮pcr产物通过同源重组的方式,连接入载体vhh-xx(xx代表靶向cd7
单vhh的car结构的序号)中,载体用not i单酶切。其中,以vhh-06为载体,分别与vhh03、vhh12一起构建的双vhh结构分别命名为dvhh-b、dvhh-c。以vhh-10为载体,分别与vhh12、vhh10一起构建的双vhh结构分别命名为dvhh-d、dvhh-e。由vhh12为载体,与vhh12一起构建的双vhh结构命名为dvhh-f。
[0236]
2、双vhh car-t细胞的制备
[0237]
双vhh car-t细胞的制备流程与实施例5中单vhh car-t细胞的制备流程一致,慢病毒包装过程如图10所示,培养流程如图11所示。将5个双vhh结构和转导t细胞制备得到的car-t细胞、vhh10car-t细胞、vhh12 car-t细胞培养6天后进行流式细胞术检测。
[0238]
3、实验结果
[0239]
本实施例共构建5个双vhh结构,分别命名为dvhh-b至dvhh-f(vhh-06+vhh-03、vhh-06+vhh-12、vhh-10+vhh-12、vhh-10+vhh-10、vhh-12+vhh-12),结构如图20所示,ef1α为延长因子1α的启动子,leader是信号肽的编码序列,vhh是抗cd7纳米抗体的编码序列,cd8h+tm为cd8铰链区和跨膜区,4-1bb和cd3ζ胞内信号区为胞内共刺激域,通过t2a肽连接表达tegfr胞外区域,以便病毒转导后检测car的表达;
[0240]
car+细胞的比例及cd7 mfi值对应的结果图分别见图21和图22,结果显示,dvhh-b至dvhh-f的car阳性率分别为:22.59%、53.6%、68.68%、55.34%,vhh10的阳性率为72.2%,vhh12的阳性率为86.7%;空白t细胞cd7阳性细胞平均mfi值为10109,dvhh-b至dvhh-f的car-t细胞cd7阳性细胞平均mfi值分别为:708、797、648、577、1057,vhh10的car-t细胞cd7阳性细胞平均mfi值为2302,vhh12的car-t细胞cd7阳性细胞平均mfi值为1238。
[0241]
实施例9双vhh car-t细胞(dvhh-d)的培养及体外功能实验验证
[0242]
1、dvhh-d双vhh car-t细胞的制备
[0243]
用实施例8中所述的car-t细胞的制备方法对dvhh-d、vhh10、vhh12结构进行体外培养,并对培养过程中的细胞扩增倍数进行统计。
[0244]
2、dvhh-d双vhh car-t细胞的体外功能实验验证
[0245]
为比较dvhh-d与单vhh car-t的体外功能,dvhh-d、vhh10、vhh12 car-t细胞培养的第12天,car-t细胞以及空白t细胞分别与cd7表达阳性细胞系ccrf-cem(白血病t淋巴瘤细胞)按照e:t=2:1的比例进行细胞杀伤实验:首先收集靶细胞,2000rpm离心5min,dpbs重悬计数,进行cfse染色,并按照1e5/孔的数量添加到96孔板中。然后根据不同效靶比(e:t=0.5:1、1:1、2:1)向靶细胞中添加适量的效应细胞,混合后孵育4小时,流式细胞术检测细胞杀伤比例。
[0246]
3、实验结果
[0247]
dvhh-d扩增曲线见图23,结果显示,扩增到第14天,dvhh-d的平均扩增倍数为46.35,vhh-12的平均扩增倍数为26.3,vhh-10的平均扩增倍数为22.75,可见dvhh-d的扩增倍数要显著优于单vhh car-t;
[0248]
dvhh-d体外功能验证的结果见图24,结果显示,在杀伤比例为0.5:1、1:1、2:1时,dvhh-d对ccrf-cem的杀伤均值分别为86.925%、92.115%、94.465%,vhh10对ccrf-cem的杀伤均值分别为45.55%、69.95%、85.85%,vhh12对ccrf-cem的杀伤均值分别为58.65%、80.9%、82.95%,可见dvhh-d对ccrf-cem具有较高的杀伤力。
[0249]
实施例10双vhh car-t细胞(dvhh-e)的培养及体外功能实验验证
[0250]
1、dvhh-e双vhh car-t细胞的制备
[0251]
用实施例8中所述的car-t细胞的制备方法对dvhh-e、vhh10、vhh12结构进行体外培养,并对培养过程中的细胞扩增倍数进行统计。
[0252]
2、dvhh-e双vhh car-t细胞的体外功能实验验证
[0253]
用实施例9中描述的方法进行dvhh-e双vhh car-t体外功能实验验证。
[0254]
3、实验结果
[0255]
dvhh-e扩增曲线见图25,结果显示,扩增到第13天,dvhh-e的平均扩增倍数为45.875,vhh-12的平均扩增倍数为19.775,vhh-10的平均扩增倍数为21.36,可见dvhh-e的扩增倍数要显著优于单vhh car-t;
[0256]
dvhh-e体外功能验证的结果见图26,结果显示,在杀伤比例为0.5:1、1:1、2:1时,dvhh-e对ccrf-cem的杀伤均值分别为58.15%、84.385%、91.775%,vhh10对ccrf-cem的杀伤均值分别为45.55%、69.95%、85.85%,vhh12对ccrf-cem的杀伤均值分别为58.65%、80.9%、82.95%,可见dvhh-e表现出对ccrf-cem相对较高的杀伤力。
[0257]
实施例11spr方法测定抗体(dvhh-d、dvhh-e、vhh10、vhh12)亲和力
[0258]
1、实验方法
[0259]
本实施例中采用spr方法(表面等离子共振法)测定抗体的亲和力,通过氨基偶联法在cm5芯片上固定实施例1中经制备得到的cd7-his蛋白,以抗体(dvhh-d、dvhh-e、vhh10、vhh12)作为分析物进行实验,检测各个抗体与cd7抗原之间的亲和力。
[0260]
2、实验结果
[0261]
结果显示,dvhh-d与cd7-his蛋白之间的亲和力常数为3.35e-09m,dvhh-e与cd7-his蛋白之间的亲和力常数为4.51e-09m,vhh10与cd7-his蛋白之间的亲和力常数为9.99e-08m,vhh12与cd7-his蛋白之间的亲和力常数为1.34e-09m(见表2),上述结果进一步表明了dvhh-d、dvhh-e、vhh10、vhh12均能与cd7抗原发生特异性的结合,且具有较强的亲和力。
[0262]
表2spr方法测定抗体亲和力的结果统计
[0263][0264]
上述实施例的说明只是用于理解本发明的方法及其核心思想,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1