一种核苷类化合物或其中间体的制备方法和核苷类化合物的中间体与流程
1.本发明属于药物领域,尤其涉及一种核苷类化合物或其中间体的制备方法和核苷类化合物的中间体。
背景技术:
2.瑞德西韦(remdesivir)即是属于上述吡咯并三嗪衍生物,属于rna依赖的rna聚合酶(rdrp)抑制剂, 可以通过抑制病毒核酸复制而达到抗病毒目的。尽管瑞德西韦有很好的临床效果,但由于其较复杂的前 药形式、合成步骤长(j.med.chem.2017,60,1648-1661)、价格昂贵且需要静脉注射等因素,导致其应用 和可及性受到限制。
3.中国专利申请cn113735862a根据瑞德西韦结构,对瑞德西韦主要代谢产物gs-441524进行了改构, 开发了一系列新型碳-核苷类小分子药物,如atv006和atv014。该类化合物有效的改善了瑞德西韦的 生物利用度,优化了化合物药代动力学性质以及成药性,更重要的是,此类化合物在体内外均可有效对 目前变异毒株包括德尔塔和奥密克戎毒株的感染(liu c.,et al.,science translational medicine,2022)。
4.中国专利申请cn113735862a根据瑞德西韦结构,对瑞德西韦主要代谢产物gs-441524进行了改构, 开发了一系列新型碳-核苷类小分子药物,如atv006和atv014。该类化合物有效的改善了瑞德西韦的 生物利用度,优化了化合物药代动力学性质以及成药性,更重要的是,此类化合物在体内外均可有效对 目前变异毒株包括德尔塔和奥密克戎毒株的感染(liu c.,et al.,science translational medicine,2022)。
5.但对于atv006和atv014等新型碳-核苷类小分子药物的合成,现有技术仍存在产率低、操作复杂 、制备时间长等问题,如中国专利申请cn113735862a中,从化合物gs-441524制备得到atv006的产 率只有44.7%,从化合物gs-441524制备得到atv014的产率只有41.8%;从化合物5开始,制备得到 atv006或atv014需要30.5小时。
6.[0007][0008]
sars-cov-2自发现以来二年多的时间里,不断地在传播并且发生多种突变,病毒将极有可能与人类 共生存的形式一直存在下去。为了满足后续临床研究和人类抗击sars-cov-2的需求,对atv006和 atv014等的规模化制备工艺进行研究具有重要意义。因此,快速开发和优化一种高效、产率高、低成本、 可工业化的atv006和atv014等化合物的合成路线,是目前合成和生产上述药物的重要任务。
技术实现要素:
[0009]
为解决上述问题,本发明提供以下技术方案。
[0010]
第一方面,本发明提供一种式b所示化合物的制备方法。
[0011]
一种式b所示化合物的制备方法,其包括:
[0012][0013]
式a所示化合物在催化剂存在的条件下,与式f所示化合物在溶剂中发生反应,得到式b所示化合 物;
[0014]
其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代或未取代的芳基、 取代或未取代的杂芳基。
[0015]
在一些实施例中,所述催化剂选自浓硫酸、甲磺酸、三氟乙酸、三氟甲磺酸、氢溴酸、高氯酸、浓 盐酸中的至少一种。
[0016]
在一些实施例中,所述溶剂包括二氯甲烷、1,2-二氯乙烷中的至少一种。
[0017]
在一些实施例中,所述催化剂与式a所示化合物的投料摩尔比为0.1:1.0~2.0:1.0。在一些实施例中, 所述催化剂与式a所示化合物的投料摩尔比为0.5:1.0~2.0:1.0。在一些实施例中,所述催化剂与式a所示 化合物的投料摩尔比为0.1:1.0、0.5:1.0、1.5:1.0、2.0:1.0。在一些优选的实施例中,所述催化剂与式a所 示化合物的投料摩尔比为1.0:1.0~2.0:1.0。
[0018]
在一些实施例中,所述式f所示化合物与式a所示化合物的投料摩尔比为3:1~5:1。一些实施例中, 所述式f所示化合物与式a所示化合物的投料摩尔比为3:1、3.5:1、4.0:1、4.5:1或5:1。
[0019]
在一些实施例中,所述反应的反应温度为-10℃~30℃。在一些实施例中,所述反应的反应温度为-5℃ ~25℃。在一些实施例中,所述反应的反应温度为-5℃~25℃。在一些实施例中,所述反应的反应温度为0℃ ~25℃。
[0020]
在一些实施例中,所述反应的反应时间为3小时-10小时。在一些实施例中,所述反应的反应时间为 4小时-8小时。在一些实施例中,所述反应的反应时间为5小时-7小时。
[0021]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0022]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0023]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。在一些实施例中,所述c
3-c
12
环烷 基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环壬烷或环癸烷。
[0024]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。在一些实施例中,所述芳基包括 苯基或甲苯基。
[0025]
第二方面,本发明提供一种式c所示化合物的制备方法。
[0026]
一种式c所示化合物的制备方法,其包括:
[0027][0028]
式b所示化合物在溶剂中与碱发生反应,得到式c所示化合物;其中式b所示化合物第一方面所述 式b所示化合物的制备方法制备得到。
[0029]
在一些实施例中,所述碱包括甲醇钠、乙醇钠、碳酸钾、碳酸钠、磷酸三钾中的至少一种;优选为 碳酸钠。
[0030]
在一些实施例中,所述溶剂包括四氢呋喃、甲醇、乙醇、异丙醇中的至少一种,优选为甲醇或乙醇。
[0031]
在一些实施例中,所述反应的反应温度为0℃~30℃。在一些实施例中,所述反应
的反应温度为0℃ ~25℃。在一些实施例中,所述反应的反应温度为10℃~25℃。在一些实施例中,所述反应的反应温度为 15℃~25℃。在一些实施例中,所述反应的反应温度为20℃~25℃。
[0032]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0033]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0034]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。在一些实施例中,所述芳基包括 苯基或甲苯基。
[0035]
第三方面,本发明提供一种式d所示化合物的制备方法。
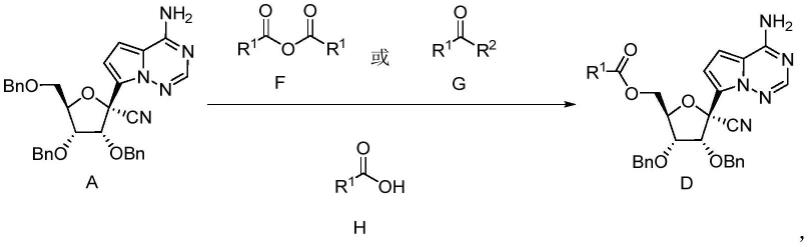
[0036]
一种式d所示化合物的制备方法,其包括:
[0037][0038]
式a所示化合物在催化剂和式h所示化合物存在的条件下,与式f所示化合物或式g所示化合物在 溶剂中发生反应,得到式d所示化合物;
[0039]
其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代或未取代的芳基、 取代或未取代的杂芳基;
[0040]
r2选自氯、溴原子中的至少一种。
[0041]
在一些实施例中,所述催化剂选自浓硫酸、甲磺酸、三氟乙酸、三氟甲磺酸、氢溴酸、高氯酸、浓 盐酸中的至少一种。
[0042]
在一些实施例中,所述溶剂包括二氯甲烷、1,2-二氯乙烷中的至少一种。
[0043]
在一些实施例中,所述催化剂与式a所示化合物的投料摩尔比为0.1:1.0~2.0:1.0,优选1.0:1.0~2.0:1.0。
[0044]
在一些实施例中,所述式h所示化合物的投料体积与式a所示化合物的投料摩尔量之比为1 ml:1mmol~2ml:1mmol。
[0045]
在一些实施例中,所述式f所示化合物或式g所示化合物与式a所示化合物的投料摩尔比为3:1~5:1。
[0046]
在一些实施例中,所述反应的反应温度为-10℃~25℃。在一些实施例中,所述反应的反应温度为-5℃ ~20℃。在一些实施例中,所述反应的反应温度为0℃~15℃。在一些实施例中,所述反应的反应温度为 0℃~10℃。在一些实施例中,所述反应的反应温度为0℃、1℃、2℃、3℃、4℃、5℃、6℃、7℃、8℃、 9℃或10℃。
[0047]
在一些实施例中,所述反应的反应时间为2小时~8小时。在一些实施例中,所述反应的反应时间为 3小时~8小时。在一些实施例中,所述反应的反应时间为3小时~5小时。
[0048]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0049]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0050]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0051]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0052]
在一些实施例中,所述芳基包括苯基或甲苯基。
[0053]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。第四方面,本发明提供一种式c 所示化合物的制备方法。
[0054]
第四方面,本发明提供一种式c所示化合物的制备方法。
[0055]
一种式c所示化合物的制备方法,其包括:
[0056][0057]
式d所示化合物在溶剂中与碱发生反应,得到式c所示化合物;其中式d所示化合物第三方面所述 式d所示化合物的制备方法制备得到。
[0058]
在一些实施例中,所述碱包括甲醇钠、乙醇钠、碳酸钾、碳酸钠、磷酸三钾中的至少一种;优选为 碳酸钠。
[0059]
在一些实施例中,所述溶剂包括四氢呋喃、甲醇、乙醇、异丙醇中的至少一种,优选为甲醇或乙醇。
[0060]
在一些实施例中,所述反应的反应温度为0℃~30℃。在一些实施例中,所述反应
的反应温度为0℃ ~25℃。在一些实施例中,所述反应的反应温度为10℃~25℃。在一些实施例中,所述反应的反应温度为 15℃~25℃。在一些实施例中,所述反应的反应温度为20℃~25℃。
[0061]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0062]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0063]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0064]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0065]
在一些实施例中,所述芳基包括苯基或甲苯基。
[0066]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。第五方面,本发明提供一种式c 所示化合物的制备方法。
[0067]
第五方面,本发明提供另一种式c所示化合物的制备方法。
[0068]
一种式c所示化合物的制备方法,其包括
[0069][0070]
在惰性气体氛围中,式a所示化合物在氧化剂和缓冲液存在的条件下,在溶剂中发生反应,得到式 c所示化合物。
[0071]
在一些实施例中,所述氧化剂包括2,3-二氯-5,6-二氰基-1,4-苯醌(ddq)或臭氧中的至少一种。
[0072]
在一些实施例中,所述溶剂包括二氯甲烷,1,2-二氯乙烷,甲苯中的至少一种。
[0073]
在一些实施例中,所述反应的反应温度为40℃~100℃。在一些实施例中,所述反应的反应温度为50℃ ~90℃。在一些实施例中,所述反应的反应温度为60℃~85℃。在一些实施例中,所述反应的反应温度为 70℃~85℃。在一些实施例中,所述反应的反应温度为75℃~85℃。在一些实施例中,所述反应的反应温 度为80℃~90℃。
[0074]
在一些实施例中,所述缓冲液包括磷酸缓冲液、醋酸缓冲液中的至少一种。
[0075]
在一些实施例中,所述缓冲液的ph为6~7。
[0076]
在一些实施例中,所述缓冲液中缓冲盐的浓度为0.1mol/l~0.3mol/l。
[0077]
在一些实施例中,所述缓冲盐包括磷酸二氢钠和磷酸氢二钠中的至少一种,或者所述缓冲盐包括醋 酸钠和醋酸铵中的至少一种。
[0078]
在一些实施例中,所述缓冲液的投料体积与式a所示化合物的投料摩尔量之比为 2ml:1mmol~8ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式a所示化合物的投料摩尔量之比 为2.5ml:1mmol~8ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式a所示化合物的投料摩尔 量之比为2.8ml:1mmol~8ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式a所示化合物的投 料摩尔量之比为2.8ml:1mmol~6ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式a所示化合 物的投料摩尔量之比为2.8ml:1mmol~5ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式a所 示化合物的投料摩尔量之比为2.8ml:1mmol~4ml:1mmol。在一些实施例中,所述缓冲液的投料体积与式 a所示化合物的投料摩尔量之比为2ml:1mmol、2.5ml:1mmol 2.8ml:1mmol、3ml:1mmol、4ml:1mmol、 5ml:1mmol、6ml:1mmol、7ml:1mmol或8ml:1mmol。
[0079]
在一些实施例中,所述氧化剂与式a所示化合物的投料摩尔比为4:1~6:1。在一些实施例中,所述氧 化剂与式a所示化合物的投料摩尔比为5:1~6:1。在一些实施例中,所述氧化剂与式a所示化合物的投料 摩尔比为4:1、5:1或6:1。
[0080]
在一些实施例中,所述惰性气体包括氮气、氦气、氖气或氩气中的至少一种。
[0081]
第六方面,本发明提供一种式d所示化合物的制备方法。
[0082]
一种式d所示化合物的制备方法,其包括:
[0083][0084]
式c所示化合物在催化剂和缩合剂存在的条件下,在溶剂中与式h所示化合物反应,得到式d所示 化合物;其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代或未取代的芳 基、取代或未取代的杂芳基。
[0085]
在一些实施例中,所述催化剂包括4-二甲氨基吡啶或4-吡咯烷基吡啶中的至少一种。
[0086]
在一些实施例中,所述缩合剂包括dcc(二环己基碳二亚胺)、dic(n,n-二异丙基碳二亚胺)、 edci(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)、bop(苯并三唑-1-基氧基三(二甲氨基)鏻六氟磷酸盐)、 pybop(1h-苯并三唑-1-基氧三吡咯烷基六氟磷酸盐)中的至少一种;优选为dcc(二环己基碳二亚胺)、 dic(n,n-二异丙基碳二亚胺)。
[0087]
在一些实施例中,所述溶剂包括乙腈、二氯甲烷、氯仿或1,2-二氯乙烷中的至少一种。
[0088]
在一些实施例中,所述反应的反应温度为-5℃~40℃,优选为0℃~10℃。
[0089]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0090]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0091]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0092]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0093]
在一些实施例中,所述芳基包括苯基或甲苯基。
[0094]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。第六方面,本发明提供一种式e 所示化合物的制备方法。
[0095]
第七方面,本发明提供一种式e所示化合物的制备方法。
[0096]
在本发明的一些实施方式中,一种式e所示化合物的制备方法,其包括:
[0097][0098]
式a所示化合物在催化剂和式h所示化合物存在的条件下,在溶剂中与式f所示化合物中发生反应, 得到化合物e,其中,
[0099]
r1选自异丙基或环己基,式h所示化合物为异丁酸或环己基甲酸。
[0100]
在一些实施例中,所述催化剂包括浓硫酸、甲磺酸、三氟乙酸、三氟甲磺酸、氢溴酸、高氯酸、浓 盐酸中的至少一种。
[0101]
在一些实施例中,所述反应中所述溶剂包括二氯甲烷、1,2-二氯乙烷中的至少一种。
[0102]
在一些实施例中,所述反应中催化剂与式a所示化合物的投料摩尔比为2.5:1.0~3.5:1.0。在一些实 施例中,所述反应中催化剂与式a所示化合物的投料摩尔比为3.2:1.0~3.5:1.0。
[0103]
在一些实施例中,所述反应中式f所示化合物与式a所示化合物的投料摩尔比为9:1~15:1。
[0104]
在一些实施例中,所述反应中式h所示化合物的投料体积与式a所示化合物的投料摩尔量之比为1 ml:1mmol~2ml:1mmol。
[0105]
在一些实施例中,所述反应中的反应温度为-10℃~30℃。在一些实施例中,所述
反应中的反应温度 为-10℃~25℃。在一些实施例中,所述反应中的反应温度为-5℃~20℃。在一些实施例中,所述反应中 的反应温度为-5℃~10℃。在一些实施例中,所述反应中的反应温度为-5℃~5℃。
[0106]
第八方面,本发明提供另一种式e所示化合物的制备方法。
[0107]
一种式e所示化合物的制备方法,其包括:
[0108][0109]
在惰性气体氛围中,式d所示化合物在路易斯酸存在的条件下,在二氯甲烷中发生脱苄基反应1, 得到化合物e,其中,
[0110]
r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代或未取代的芳基、取代或 未取代的杂芳基。
[0111]
在本发明的一些实施方式中,一种式e所示化合物的制备方法,其包括:
[0112][0113]
式d所示化合物在催化剂和式h所示化合物存在的条件下,与式f所示化合物或式g所示化合物在 溶剂中发生脱苄基反应2,得到式e所示化合物;其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未 取代的c
3-c
12
环烷基、取代或未取代的芳基、取代或未取代的杂芳基;r2选自氯原子或溴原子。
[0114]
在本发明的一些实施方式中,一种式e所示化合物的制备方法,其包括:
[0115][0116]
在惰性气体氛围中,式d所示化合物在氧化剂和缓冲液存在的条件下,在溶剂中发生脱苄基反应3, 得到式e所示化合物;其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代 或未取代的芳基、取代或未取代的杂芳基。
[0117]
在一些实施例中,所述路易斯酸包括三氯化硼或三溴化硼中的至少一种。
[0118]
在一些实施例中,所述催化剂包括浓硫酸、甲磺酸、三氟乙酸、三氟甲磺酸、氢溴
酸、高氯酸、浓 盐酸中的至少一种。
[0119]
在一些实施例中,所述氧化剂包括2,3-二氯-5,6-二氰基-1,4-苯醌(ddq)、臭氧中的至少一种。
[0120]
在一些实施例中,所述缓冲液包括磷酸缓冲液、醋酸缓冲液中的至少一种。
[0121]
在一些实施例中,所述缓冲液的ph为6~7。
[0122]
在一些实施例中,所述脱苄基反应1中所述溶剂包括二氯甲烷、1,2-二氯乙烷中的至少一种。
[0123]
在一些实施例中,所述脱苄基反应2中所述溶剂包括二氯甲烷、1,2-二氯乙烷中的至少一种。
[0124]
在一些实施例中,所述脱苄基反应3中所述溶剂包括二氯甲烷,1,2-二氯乙烷,甲苯中的至少一种。
[0125]
在一些实施例中,所述脱苄基反应1中路易斯酸与式d所示化合物的投料摩尔比为2.2:1.0~2.6:1.0。
[0126]
在一些实施例中,所述脱苄基反应2中催化剂与式d所示化合物的投料摩尔比为1.2:1.0~2.4:1.0。 在一些实施例中,所述脱苄基反应2中催化剂与式d所示化合物的投料摩尔比为1.5:1.0~2.4:1.0。在一 些实施例中,所述脱苄基反应2中催化剂与式d所示化合物的投料摩尔比为2.0:1.0~2.4:1.0。
[0127]
在一些实施例中,所述脱苄基反应2中式h所示化合物的投料体积与式d的投料摩尔量之比为1 ml:1mmol~2ml:1mmol。在一些实施例中,所述脱苄基反应2中式h所示化合物的投料体积与式d的投 料摩尔量之比为1.2ml:1mmol~2ml:1mmol。
[0128]
在一些实施例中,所述脱苄基反应2中式f所示化合物或式g所示化合物与式d所示化合物的投料 摩尔比为5:1~8:1。在一些实施例中,所述脱苄基反应2中式f所示化合物或式g所示化合物与式d所示 化合物的投料摩尔比为5:1、6:1、7:1或8:1。
[0129]
在一些实施例中,所述脱苄基反应3中氧化剂与式d所示化合物的投料摩尔比为8:1~12:1。在一些 实施例中,所述脱苄基反应3中氧化剂与式d所示化合物的投料摩尔比为8:1、9:1、10:1、11:1或12:1。 在一些实施例中,所述脱苄基反应3中氧化剂与式d所示化合物的投料摩尔比为10:1~12:1。
[0130]
在一些实施例中,所述脱苄基反应3中缓冲液中缓冲盐的浓度为0.1mol/l~0.3mol/l。
[0131]
在一些实施例中,所述缓冲盐包括磷酸二氢钠和磷酸氢二钠中的至少一种。
[0132]
在一些实施例中,所述脱苄基反应3中缓冲液的投料体积与d所示化合物的投料摩尔量之比为 3ml:1mmol~8ml:1mmol。在一些实施例中,所述脱苄基反应3中缓冲液的投料体积与d所示化合物的投 料摩尔量之比为3.5ml:1mmol~8ml:1mmol。在一些实施例中,所述脱苄基反应3中缓冲液的投料体积与 d所示化合物的投料摩尔量之比为3.8ml:1mmol~8ml:1mmol。在一些实施例中,所述脱苄基反应3中缓 冲液的投料体积与d所示化合物的投料摩尔量之比为3.8ml:1mmol~5ml:1mmol。在一些实施例中,所 述脱苄基反应3中缓冲液的投料体积与d所示化合物的投料摩尔量之比为3ml:1mmol、3.5ml:1mmol、 3.8ml:1mmol、4ml:1mmol、4.2ml:1mmol、5ml:1mmol、6ml:1mmol、7ml:1mmol或8ml:1mmol。
[0133]
在一些实施例中,所述脱苄基反应1的反应温度为-78℃~-40℃。在一些实施例
中,所述脱苄基反 应1的反应温度为-78℃~-45℃。在一些实施例中,所述脱苄基反应1的反应温度为-60℃~-45℃。
[0134]
在一些实施例中,所述脱苄基反应2的反应温度为-10℃~30℃。在一些实施例中,所述脱苄基反应 2的反应温度为-10℃~25℃。在一些实施例中,所述脱苄基反应2的反应温度为-5℃~20℃。在一些实 施例中,所述脱苄基反应2的反应温度为-5℃~10℃。在一些实施例中,所述脱苄基反应2的反应温度 为-5℃~5℃。
[0135]
在一些实施例中,所述脱苄基反应3的反应温度为40℃~100℃。在一些实施例中,所述脱苄基反 应3的反应温度为50℃~90℃。在一些实施例中,所述脱苄基反应3的反应温度为60℃~90℃。在一 些实施例中,所述脱苄基反应3的反应温度为70℃~85℃。在一些实施例中,所述脱苄基反应3的反应 温度为80℃~90℃。
[0136]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0137]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0138]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0139]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0140]
在一些实施例中,所述芳基包括苯基或甲苯基。
[0141]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。在一些实施例中,所述卤素原子 选自氟原子、氯原子或溴原子。
[0142]
在一些实施例中,所述惰性气体包括氮气、氦气、氖气或氩气中的至少一种。
[0143]
第九方面本发明提供一种化合物。
[0144]
一种化合物,其选自以下结构:
[0145][0146]
其中,r1选自取代或未取代的c
1-c
10
烷基、取代或未取代的c
3-c
12
环烷基、取代或未
取代的芳基、 取代或未取代的杂芳基。
[0147]
在一些实施例中,所述c
1-c
10
烷基包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基或c
10
烷基。
[0148]
在一些实施例中,所述c
3-c
12
环烷基包括c3环烷基、c4环烷基、c5环烷基、c6环烷基、c7环烷基、 c8环烷基、c9环烷基、c
10
环烷基、c
11
环烷基或c
12
环烷基。
[0149]
在一些实施例中,所述c
1-c
10
烷基包括甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁 基、2-丁基、2-甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2
‑ꢀ
甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、 2-甲基-3-戊基、2,3-二甲基-2-丁基、3,3-二甲基-2-丁基或正辛基。
[0150]
在一些实施例中,所述c
3-c
12
环烷基包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛烷、环 壬烷或环癸烷。
[0151]
在一些实施例中,所述芳基包括苯基或甲苯基。
[0152]
在一些实施例中,r1为甲基、乙基、1-丙基、2-丙基、1-丁基、2-甲基-1-丙基、i-丁基、2-丁基、2
‑ꢀ
甲基-2-丙基、1-戊基、2-戊基、3-戊基、2-甲基-2-丁基、3-甲-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1
‑ꢀ
己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、 2,3-二甲基-2-丁基、3,3-二甲基-2-丁基、正辛基、环丙烷、环丁烷、环戊烷、环己烷、环庚烷、环辛 烷、环壬烷或环癸烷。在一些实施例中,r1为甲基、2-丙基或环己烷。
[0153]
在一些实施例中,所述化合物选自以下结构:
[0154][0155]
有益效果
[0156]
相比现有技术,本发明的某一实施例具有以下至少一种有益效果:
[0157]
(1)由化合物式a出发合成atv006和atv014等化合物的合成步骤少,总收率高,反应条件温和, 不需要超低温反应,操作方便,适合工业化生产。
[0158]
(2)在本发明所提供的式b所示化合物的制备方法中,相比采用其他催化剂,采用本发明所提供的 催化剂更有利于提高产物的产量和纯度,尤其优选催化剂为浓硫酸。
[0159]
(3)在本发明所提供的式d所示化合物的制备方法中,相比采用其他催化剂,采用本发明所提供的 催化剂更有利于提高式d所示化合物的产率,具有预料不到的技术效果。
[0160]
(4)在本发明所提供的式d所示化合物的制备方法中,相比采用其他缩合剂,采用本发明所提供的 缩合剂更有利于提高式d所示化合物的产率,具有预料不到的技术效果。
[0161]
(5)在本发明所提供的由式a所示化合物制备式e所示化合物的制备方法中,采用异丁酸或环己基 甲酸(式h所示化合物),有利于缩短反应路线,简化操作。另外,相比采用其他酸,采用异丁酸或环己 基甲酸(式h所示化合物)有利于直接生成式e所示化合物,有利
于防止生成混合酸酐和不同的酯,有 利于后续分离纯化。
[0162]
术语说明
[0163]
除非另外说明,否则如本文使用的以下术语和短语意图具有以下含义:
[0164]
本发明中,如“化合物i”和“式i所示化合物”的表述,表示的是同一个化合物。
[0165]
本发明中,如“5.0eq.”的表述,表示的是“5.0当量”。
[0166]
所述“h”为氢原子,所述“d”为氘原子。所述“卤素原子”表示氟原子(f)、氯原子(cl)、溴原子(br)、 碘原子(i)、砹原子(at)或钿原子(ts)。
[0167]
本发明中“室温”指的是环境温度,温度由大约10℃到大约40℃。在一些实施例中,“室温”指的是 温度由大约20℃到大约30℃;在另一些实施例中,“室温”指的是温度由大约25℃到大约30℃;在又一 些实施例中,“室温”指的是10℃、15℃、20℃、25℃、30℃、35℃、40℃等。
[0168]“bn”基团表示苄基。
[0169]
术语“m”表示mol/l。
[0170]“烷基”是包含正碳原子、仲碳原子、叔碳原子或环碳原子的烃。例如,烷基可以具有1至10个碳原 子(即,c
1-c
10
烷基或c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基、c9烷基 或c
10
烷基)、1至8个碳原子(即,c
1-c8烷基)或1至6个碳原子(即,c
1-c6烷基)。合适的烷基的实例包 括但不限于,甲基(me、-ch3)、乙基(et、-ch2ch3)、1-丙基(i-pr、i-丙基、-ch2ch2ch3)、2-丙基(i-pr、 i-丙基、-ch(ch3)2)、1-丁基(n-bu、n-丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、i-丁基、-ch2ch(ch3)2)、 2-丁基(s-bu、s-丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、t-丁基、-c(ch3)3)、1-戊基(n-戊基、
ꢀ‑
ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基 (-c(ch3)2ch2ch3)、3-甲-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基 (-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基 (-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基 (-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、 2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基 (-ch(ch3)c(ch3)3和正辛基(-(ch2)7ch3)。
[0171]“烯基”是包含具有至少一个不饱和部位,即碳-碳sp2双键的正碳原子、仲碳原子、叔碳原子或环碳原 子的烃。例如,烯基可以具有2至10个碳原子(c
2-c
10
烯基)、2至12个碳原子(c
2-c
12
烯基)或2至6个碳 原子(c
2-c6烯基)。合适的烯基的实例包括但不限于,乙烯或乙烯基(-ch=ch2)、烯丙基(-ch2ch=ch2)、 环戊烯基(-c5h7)和5-己烯基(-ch2ch2ch2ch2ch=ch2)。
[0172]“炔基”是包含具有至少一个不饱和部位,即碳-碳sp三键的正碳原子、仲碳原子、叔碳原子或环碳原 子的烃。例如,炔基可以具有2至10个碳原子(c
2-c
10
炔基)、2至12个碳原子(c
2-c
12
炔基)或2至6个碳 原子(c
2-c6炔基)。合适的炔基的实例包括但不限于,乙炔基(-c=ch)、炔丙基(-ch2c=ch)以及类似物。
[0173]“芳基”意指通过从母体芳环系统的单个碳原子除去一个氢原子衍生的芳族烃基。例如,芳基可以具有 6至20个碳原子(例如6个碳原子、7个碳原子、8个碳原子、9个碳原子、10个碳原子、11个碳原子、 12个碳原子、13个碳原子、14个碳原子、15个碳原子、16个碳原
子、17个碳原子、18个碳原子、19 个碳原子或20个碳原子)、6至14个碳原子或6至10个碳原子(例如6个碳原子、7个碳原子、8个碳 原子、9个碳原子或10个碳原子)。典型的芳基包括但不限于,从苯(例如,苯基)、取代的苯、萘、蒽、 联苯等衍生的基团以及类似基团。
[0174]“芳基烷基”是指其中键合至碳原子(通常是末端或sp3碳原子)的氢原子中的一个被芳基代替的无环烷 基。典型的芳基烷基包括但不限于,苄基、2-苯基乙-1-基、萘基甲基、2-萘基乙-1-基、萘并苄基、2-萘并 苯基乙-1-基以及类似物。芳基烷基可以包括7至20个碳原子,例如,烷基部分是1至6个碳原子,且芳 基部分是6至14个碳原子。
[0175]
涉及烷基、芳基、芳基烷基、杂环基、杂芳基、碳环基等的术语“取代的”例如“取代的c
1-c
10
烷基”、
ꢀ“
取代的c
6-c
20
芳基”、“取代的芳基烷基”、“取代的c
1-c
20
杂环”和“取代的碳环基”分别意指其中一个或多 个氢原子各自独立地被非氢取代基代替的c
1-c
10
烷基、c
6-c
20
芳基、芳基烷基、c
1-c
20
杂环、碳环基。除 非另外表明,否则当术语“取代的”与具有能够取代的两个或更多个部分的基团例如芳基烷基结合使用时, 取代基可以连接至芳基部分、烷基部分或两者。
[0176]
如本文使用的术语“前药”是指当被施用至生物体系时由于自发化学反应、酶催化的化学反应、光解和 /或代谢化学反应而产生药物,即,活性成分的任何化合物。前药因此是治疗活性化合物的共价改性的类 似物或潜在形式。
[0177]
本文使用的“杂环”或“杂环基”包括作为实例且不限于在以下中描述的那些杂环:paquette,leo a.: principles of modern heterocyclic chemistry(w.a.benjamin,new york,1968),特别是第1、3、4、6、7和 9章:the chemistry of heterocyclic compounds,a series of monographs^(john wiley&sons,new york,1950 至现在),特别是第13、14、16、19和28卷和j.am.chem.soc.(1960)82:5566。在本发明的一个具体 的实施方案中,“杂环”包括如本文所定义的“碳环”,其中一个或多个(例如1、2、3或4个)碳原子已经被 杂原子(例如o、n或s)代替。术语“杂环”或“杂环基”包括饱和环、部分不饱和环和芳族环(即杂芳族环)。 取代的杂环基包括,例如,被本文公开的包括羰基的任何取代基取代的杂环。
[0178]
杂环的实例包括作为实例且不作为限制,吡啶基、二氢吡啶基、四氢吡啶基(哌啶基)、噻唑基、四氢 噻吩基、硫氧化的四氢噻吩基、嘧啶基、呋喃基、噻吩基、吡咯基、吡唑基、咪唑基、四唑基、苯并呋 喃基、硫杂萘基、吲哚基、吲哚烯基、喹啉基、异喹啉基、苯并咪唑基、哌啶基、4-哌啶酮基、吡咯烷基、 2-吡咯烷酮基、吡咯啉基、四氢呋喃基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、八氢异喹啉基、吖辛 因(氮杂环辛烷)基、三嗪基、6h-1,2,5-噻二嗪基、2h,6h-1,5,2-二噻嗪基、噻吩基、噻蒽基、吡喃 基、异苯并呋喃基、色烯基、咕吨基、酚黄素基、2h-吡咯基、异噻唑基、异噁唑基、吡嗪基、哒嗪基、 吲嗪基、异吲哚基、3h-吲哚基、ih-吲唑基、嘌呤基、4h-喹嗪基、酞嗪基、萘啶基、喹喔啉基、喹唑啉 基、噌啉基、蝶啶基、4ah-咔唑基、咔唑基、β-咔啉基、菲啶基、吖啶基、嘧啶基、菲咯啉基、吩嗪基、 吩噻嗪基、呋咱基、吩噁嗪基、异色满基、色满基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌嗪 基、二氢吲哚基、异二氢吲哚啉基、奎宁环基、吗啉基、噁唑烷基、苯并三唑基、苯并异噁唑基、羟吲 哚基、苯并噁唑啉基、靛红酰基和双-四氢呋喃基。
[0179]“杂芳基”是指在环中具有至少一个杂原子的芳族杂环基。可以在芳族环上包含的合适杂原子的非限制 性实例包括氧、硫和氮。杂芳基环的非限制性实例包括在“杂环基”定义中所列的所有那些芳香环,包括吡 啶基、吡咯基、噁唑基、引哚基、异吲哚基、嘌呤基、呋
喃基、噻吩基、苯并呋喃基、苯并噻吩基、咔 唑基、咪唑基、噻唑基、异噁唑基、吡唑基、异噻唑基、喹啉基、异喹啉基、哒嗪基、嘧啶基、吡唑基 等。
[0180]
本文使用的术语“治疗”,除非另外表明,否则意指逆转、减轻该术语所适用的病症或疾患或这样的病 症或疾患的一个或多个症状、抑制所述病症或疾患或其一个或多个症状的进展或防止所述病症或疾患或 其一个或多个症状。如本文使用的术语“治疗”是指治疗行为,如“治疗”在上文刚定义的。
[0181]
由式i所述化合物可以具有手性中心,例如手性碳。式i所述化合物因此包括所有立体异构体的外消 旋混合物,包括对映异构体、非对映异构体和阻转异构体。另外,本发明所述化合物包括在任何或所有 的不对称的手性原子处富集或拆分的旋光异构体。换句话说,与描述近似的手性中心以手性异构体或外 消旋的混合物形式提供。外消旋的和非对映异构体的混合物,以及分离或合成的、基本上不含其对映异 构体或非对映异构体配偶体的单独的旋光异构体,都在本发明的范围之内。通过公知技术将外消旋混合 物分离为它们的单独的、基本上旋光纯的异构体,所述公知技术例如,分离与旋光活性助剂(例如酸或碱) 形成的非对映异构体的盐,之后将其转变回旋光活性物质。在多数情况下,从所需原料的适当的立体异 构体开始,通过立体特异性反应,合成所需的旋光异构体。
[0182]
每当本文描述的化合物被多于一个相同的指定基团(例如,“r”或“r
1”)取代时,应当理解,这些基团 可相同或不同,即,各个基团被独立选择。
具体实施例
[0183]
为了使本领域的技术人员更好地理解本发明的技术方案,下面进一步披露一些非限制实施例以对本 发明作进一步的详细说明。
[0184]
本发明所使用的试剂均可以从市场上购得或者可以通过本发明所描述的方法制备而得。
[0185]
实施例1:化合物b01{((2r,3r,4r,5r)-5-(4-乙酰胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基四氢 呋喃-2-)甲基乙酸酯}的合成:
[0186][0187]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2
‑ꢀ
甲腈(式a所示化合物)(5.6g,10mmol,1.0eq.)与二氯甲烷(28ml),乙酸酐(3eq.),冷却至0℃,滴 加硫酸(1.0eq.)与二氯甲烷(11ml)的混合溶液,滴毕后在25℃反应6小时,反应液降温至0℃,加入纯 化水(11ml)搅拌15分钟,再加入三乙胺调反应液ph=7,分液,收集有机相,有机相用饱和食盐水洗两 次(11ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0至70:30) 纯化,得到化合物b01(4.2g,78%收率)。取适量所得化合物b01检测质谱和氢谱,结果为:ms(esi):554.3 [m-h]-;1h nmr(400mhz,dmso-d6)δ10.99(s,1h),8.38(s,1h),7.41
–
7.23(m,11h),
7.03(d,j=4.8hz, 1h),4.97(d,j=4.9hz,1h),4.92(d,j=11.7hz,1h),4.82(d,j=11.7hz,1h),4.63
–
4.51(m,2h),4.50(dt, j=5.5,2.7hz,1h),4.30(dd,j=12.3,3.3hz,1h),4.19(dd,j=12.3,5.1hz,1h),4.12(dd,j=6.1,4.9hz, 1h),2.41(s,3h),1.98(s,3h).
[0188]
实施例2:化合物b01{((2r,3r,4r,5r)-5-(4-乙酰胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基四氢 呋喃-2-)甲基乙酸酯}的合成:
[0189][0190]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2
‑ꢀ
甲腈(式a所示化合物)(5.6g,10mmol,1.0eq.)与二氯甲烷(28ml),乙酸酐(5eq.),冷却至0℃,滴 加硫酸(1.5eq.)与二氯甲烷(11ml)的混合溶液,滴毕后在25℃反应10小时,反应液降温至0℃,加入 纯化水(11ml)搅拌15分钟,再加入三乙胺调反应液ph=8,分液,收集有机相,有机相用饱和食盐水洗 两次(11ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0至 70:30)纯化,得到化合物b01(4.6g,84%收率)。取适量所得化合物b01检测质谱和氢谱,结果为: ms(esi):554.3[m-h]-;1h nmr(400mhz,dmso-d6)δ10.99(s,1h),8.38(s,1h),7.41
–
7.23(m,11h), 7.03(d,j=4.8hz,1h),4.97(d,j=4.9hz,1h),4.92(d,j=11.7hz,1h),4.82(d,j=11.7hz,1h),4.63
–ꢀ
4.51(m,2h),4.50(dt,j=5.5,2.7hz,1h),4.30(dd,j=12.3,3.3hz,1h),4.19(dd,j=12.3,5.1hz,1h),4.12 (dd,j=6.1,4.9hz,1h),2.41(s,3h),1.98(s,3h).
[0191]
实施例3:化合物c{(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双(苄氧基)-5-(羟甲基)四氢呋 喃-2-甲腈)}的合成
[0192][0193]
化合物b01(2.2g,4mmol)与甲醇(10ml),饱和碳酸钠水溶液(5ml)混合,25℃下搅拌反应1 小时,加入二氯甲烷(10ml),饱和食盐水(5ml)搅拌,分液,收集有机相,有机相经无水硫酸钠干燥, 过滤,滤液浓缩,得到化合物c(1.82g,98%收率)。
[0194]
实施例4:化合物d01{{((2r,3r,4r,5r)-5-(4-胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基四氢呋 喃-2-)甲基乙酸酯}}的合成
[0195][0196]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2
‑ꢀ
甲腈(16.8g,30mmol,1.0eq.),乙酸酐(3eq.)混合,冷却至0℃,滴加硫酸(1.0eq.)与冰醋酸(34ml) 的混合溶液,25℃反应3小时,反应液降温至0℃,加入二氯甲烷(85ml),纯化水(34ml)搅拌15分 钟,再加入三乙胺调反应液ph=7,分液,收集有机相,有机相用饱和食盐水洗两次(34ml/次),有机相 经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0至60:40)纯化,得到化 合物d01(13.0g,85%收率)。取适量所得化合物d01检测质谱和氢谱,结果为:512.2[m-h]-;1h nmr (400mhz,dmso-d6)δ8.06
–
7.79(m,3h),7.54
–
7.17(m,10h),6.92(d,j=4.6hz,1h),6.78(d,1h),4.96 (d,j=5.0hz,1h),4.88(d,j=11.7hz,1h),4.78(d,j=11.7hz,1h),4.64
–
4.50(m,2h),4.44(td,j=5.6, 3.3hz,1h),4.29(dd,j=12.3,3.4hz,1h),4.17(dd,j=12.3,5.3hz,1h),4.09(t,j=5.5hz,1h),1.97(s, 3h).
[0197]
实施例5:化合物d01{{((2r,3r,4r,5r)-5-(4-胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基四氢呋 喃-2-)甲基乙酸酯}}的合成
[0198][0199]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2-甲腈 (16.8g,30mmol,1.0eq.),乙酸酐(5eq.)混合,冷却至0℃,滴加硫酸(1.2eq.)与冰醋酸(34ml)的混合 溶液,25℃反应5小时,反应液降温至0℃,加入二氯甲烷(85ml),纯化水(34ml)搅拌15分钟,再 加入三乙胺调反应液ph=8,分液,收集有机相,有机相用饱和食盐水洗两次(34ml/次),有机相经硫酸 钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0至60:40)纯化,得到化合物d01(14.1 g,92%收率)。取适量所得化合物d01检测质谱和氢谱,结果为:512.2[m-h]-;1h nmr(400mhz, dmso-d6)δ8.06
–
7.79(m,3h),7.54
–
7.17(m,10h),6.92(d,j=4.6hz,1h),6.78(d,1h),4.96(d,j=5.0 hz,1h),4.88(d,j=11.7hz,1h),4.78(d,j=11.7hz,1h),4.64
–
4.50(m,2h),4.44(td,j=5.6,3.3hz,1h), 4.29(dd,j=12.3,3.4hz,1h),4.17(dd,j=12.3,5.3hz,1h),4.09(t,j=5.5hz,1h),1.97(s,3h).
[0200]
实施例6:化合物c{(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双(苄氧基)-5-(羟甲基) 四氢呋喃-2-甲腈)}的合成
1h),2.18(ddd,j=14.2,9.5,3.4hz,1h),1.74
–
1.50(m,5h),1.26
–
1.15(m,5h).
[0209]
实施例9:化合物d03(((2r,3r,4r,5r)-5-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双(苄氧基)-5-氰基四 氢呋喃-2-)甲基异丁酸酯)合成:
[0210][0211]
将含化合物c(11.8g,25mmol,1.0eq.)、dmap(4-二甲氨基吡啶)(0.5eq.)、异丁酸h02(1.2eq.)、 dic(n,n-二异丙基碳二亚胺)(1.25eq.)的乙腈溶液(60ml)混合,5
±
5℃搅拌24小时,反应结束,浓 缩,柱分离(二氯甲烷:ea(v/v)=100:0至50:50)纯化,得到化合物d03(11.8g,87%收率)。取适量 所得化合物d03检测质谱和氢谱,结果为:ms(esi):540.2[m-h]-;1h nmr(400mhz,chloroform-d)δ 7.93(s,1h),7.36
–
7.19(m,10h),6.96(d,j=4.6hz,1h),6.65(d,j=4.6hz,1h),5.89(s,2h),4.99
–
4.90 (m,2h),4.83(d,j=12.1hz,1h),4.63(ddd,j=6.8,5.0,3.6hz,1h),4.54(d,j=11.9hz,1h),4.43
–
4.26(m, 3h),3.93(dd,j=6.8,5.1hz,1h),2.52(dt,j=14.0,7.0hz,1h),1.17(d,j=6.5hz,3h),1.12(d,j=6.5hz, 3h).
[0212]
实施例10:化合物e01的制备(方法一)
[0213][0214]
氮气氛围下,将化合物d02(10mmol,5.8g,1.0eq.)与二氯甲烷(30ml)混合,冷却至-78℃,加入 1m的三氯化硼的二氯甲烷溶液(22ml,2.2eq.),-50℃反应结束,加入甲醇(12ml),再加入三乙胺(4.6eq.) 的甲醇(12ml)溶液淬灭反应,升温至室温,减压浓缩,加正己烷(12ml)洗涤3次,再加入二氯甲烷(12ml), 水(30ml),搅拌,静置,分液,收集有机相层,水相层加二氯甲烷(12ml)萃取两次,合并有机相层,纯 水(12ml)洗涤,有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:甲醇(v/v)=40:1)纯 化,得到化合物e01(2.9g,72%收率)。
[0215]
实施例11:化合物e01的制备(方法二)
[0216][0217]
将化合物d02(10mmol,5.8g,1.0eq.),乙酸酐(5eq.)混合,冷却至0℃,滴加硫酸(2eq.)与冰醋酸 (12ml)的混合溶液,25℃反应至原料消耗完全,减压浓缩,浓缩液降温至0℃,加入二氯甲烷(30ml), 纯化水(18ml)搅拌15min,再加入三乙胺调反应液ph=7,分液,水相经二氯甲烷(30ml)萃取两次,收 集有机相,有机相用饱和食盐水洗两次(18ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二 氯甲烷:甲醇(v/v)=40:1)纯化,得到化合物e01(3.7g,92%收率)。
[0218]
实施例12:化合物e01的制备(方法三)
[0219][0220]
氮气氛围下,将化合物d02(10mmol,5.8g,1.0eq.),1,2二氯乙烷(42ml)混合,加入0.1m磷酸缓冲液 (ph=7.0)(42ml),最后加入2,3-二氯-5,6-二氰基苯醌(ddq)(10eq.),80℃加热回流6小时。反应液 冷却至0℃,加入饱和碳酸氢钠溶液,调ph=6,二氯甲烷(30ml)萃取两次,有机相经饱和食盐水洗, 有机相经硫酸钠干燥,柱分离(二氯甲烷:甲醇(v/v)=40:1)纯化,得到化合物e01(2.5g,62%收 率)。
[0221]
实施例13:化合物e01的制备(方法四)
[0222][0223]
将化合物a(10mmol,5.8g,1.0eq.),环己基甲酸酐(5eq.)混合,冷却至0℃,滴加硫酸(1.2eq.)与 环己基甲酸(12ml)的混合溶液,25℃反应至原料消耗完全,主要得到化合物d02;继续补加环己基甲 酸酐(8eq.),冷却至0℃,滴加硫酸(2.0eq.),25℃反应至d02消耗完全,减压浓缩,浓缩液降温至0℃, 加入二氯甲烷(30ml),纯化水(18ml)搅拌15min,再加入三乙胺调反应液ph=7,分液,水相经二氯甲 烷(30ml)萃取两次,收集有机相,有机相用饱和食盐水洗两次(18ml/次),有机相经硫酸钠干燥,过滤, 滤液浓缩,柱分离(二氯甲烷:甲醇(v/v)=40:1)纯化,得到化合物e01(3.0g,76%产率)。
[0224]
实施例14:化合物e02的制备(方法一)
[0225][0226]
氮气氛围下,将化合物d03(10mmol,5.4g,1.0eq.)与二氯甲烷(27ml)混合,冷却至-78℃,加入 1m的三氯化硼的二氯甲烷溶液(22ml,2.2eq.),-50℃反应结束,加入甲醇(11ml),再加入三乙胺(4.6eq.) 的甲醇(11ml)溶液淬灭反应,升温至室温,减压浓缩,加正己烷(11ml)洗涤3次,再加入二氯甲烷(11ml), 纯化水(30ml),搅拌,静置,分液,收集有机相层,水相层加二氯甲烷(11ml)萃取两次,合并有机相层, 纯水(11ml)洗涤,有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:甲醇(v/v)=40:1) 纯化,得到化合物e02(2.3g,65%收率)。
[0227]
实施例15:化合物e02的制备(方法二)
[0228][0229]
将化合物d03(10mmol,5.4g,1.0eq.),乙酸酐(5eq.)混合,冷却至0℃,滴加硫酸(2eq.)与冰醋酸 (11ml)的混合溶液,25℃反应至原料消耗完全,减压浓缩,浓缩液降温至0℃,加入二氯甲烷(11ml), 纯化水(30ml)搅拌15min,再加入三乙胺调反应液ph=7,分液,水相经二氯甲烷(27ml)萃取两次,收 集有机相,有机相用饱和食盐水洗两次(16ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二 氯甲烷:甲醇(v/v)=40:1)纯化,得到化合物e02(3.2g,88%收率)。
[0230]
实施例16:化合物e02的制备(方法三)
[0231][0232]
氮气氛围下,将化合物d03(10mmol,5.4g,1.0eq.),1,2二氯乙烷(38ml)混合,加入0.1m磷酸缓 冲液(ph=7.0)(38ml),最后加入2,3-二氯-5,6-二氰基苯醌(ddq)(10eq.),80℃加热回流6小时。反 应液冷却至0℃,加入饱和碳酸氢钠溶液,调ph=6,二氯甲烷(27ml)萃取两次,有机相经饱和食盐 水洗,有机相经硫酸钠干燥,柱分离(二氯甲烷:甲醇(v/v)=
40:1)纯化,得到化合物e02(1.8g,50% 收率)。
[0233]
实施例17:化合物e02的制备(方法四)
[0234][0235]
将化合物a(10mmol,5.6g,1.0eq.),异丁酸酐(5eq.)混合,冷却至0℃,滴加硫酸(1.2eq.)与异丁 酸(11ml)的混合溶液,25℃反应至原料消耗完全,主要得到化合物d03;继续补加异丁酸酐(8eq.), 冷却至0℃,滴加硫酸(2.0eq.),25℃反应至d03消耗完全,减压浓缩,浓缩液降温至0℃,加入二氯 甲烷(28ml),纯化水(17ml)搅拌15min,再加入三乙胺调反应液ph=7,分液,水相经二氯甲烷(28ml) 萃取两次,收集有机相,有机相用饱和食盐水洗两次(17ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩, 柱分离(二氯甲烷:甲醇(v/v)=40:1)纯化,得到化合物e02(2.6g,73%产率)。
[0236]
对比例1:化合物b01{((2r,3r,4r,5r)-5-(4-乙酰胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基 四氢呋喃-2-)甲基乙酸酯}的合成:
[0237][0238]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2
‑ꢀ
甲腈(式a所示化合物)(5.6g,10mmol,1.0eq.)与二氯甲烷(28ml),乙酸酐(3eq.),冷却至0℃,滴 加三氟乙酸(1.0eq.)与二氯甲烷(11ml)的混合溶液,滴毕后在25℃反应6小时,反应液降温至0℃,加 入纯化水(11ml)搅拌15分钟,再加入三乙胺调反应液ph=7,分液,收集有机相,有机相用饱和食盐水 洗两次(11ml/次),有机相经硫酸钠干燥,过滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0 至70:30)纯化,得到化合物b01(0.4g,7%收率)。
[0239]
对比例2:化合物d01{{((2r,3r,4r,5r)-5-(4-胺基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双苄氧基-5-氰基四 氢呋喃-2-)甲基乙酸酯}}的合成(不加冰醋酸进行反应)
[0240][0241]
将(2r,3r,4r,5r)-2-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-基)-3,4-双(苄氧基)-5-[(苄氧基)甲基]四氢呋喃-2
‑ꢀ
甲腈(16.8g,30mmol,1.0eq.),乙酸酐(3eq.)混合,冷却至0℃,滴加硫酸(1.0eq.)的混合溶液,25℃ 反应3小时,反应液降温至0℃,加入二氯甲
烷(85ml),纯化水(34ml)搅拌15分钟,再加入三乙胺 调反应液ph=7,分液,收集有机相,有机相用饱和食盐水洗两次(34ml/次),有机相经硫酸钠干燥,过 滤,滤液浓缩,柱分离(二氯甲烷:乙酸乙酯(v/v)=100:0至60:40)纯化,得到化合物d01(6.5g,42% 收率)。
[0242]
实施例18:化合物d02(((2r,3r,4r,5r)-5-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双(苄氧基)-5-氰基四氢呋 喃-2-)甲基环己基甲酸酯)合成(缩合剂的考察):
[0243][0244]
将含化合物c(11.8g,25mmol,1.0eq)、dmap(4-二甲氨基吡啶)(0.5eq.)、环己基甲酸h01(1.2eq.)、 表1所示缩合剂(1.25eq.)的乙腈溶液(60ml)混合,5
±
5℃搅拌24小时,反应结束,浓缩,柱分离(二 氯甲烷:ea(v/v)=100:0至50:50)纯化,得到化合物d02,其结果如表1所示。
[0245]
表1:化合物d02的合成中缩合剂的考察
[0246]
缩合剂化合物d02产率dcc(二环己基碳二亚胺)72%dic(n,n-二异丙基碳二亚胺)90%edci(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)67%
[0247]
实施例19:化合物d02(((2r,3r,4r,5r)-5-(4-氨基吡咯并[2,1-f][1,2,4]三嗪-7-)-3,4-双(苄氧基)-5-氰基四 氢呋喃-2-)甲基环己基甲酸酯)合成(催化剂的考察):
[0248][0249]
将含化合物c(11.8g,25mmol,1.0eq)、表2所示催化剂(0.5eq.)、环己基甲酸h01(1.2eq.)、dic(n,n
‑ꢀ
二异丙基碳二亚胺)(1.25eq.)的乙腈溶液(85ml)混合,5
±
5℃搅拌24小时,反应结束,浓缩,柱分离 (二氯甲烷:ea(v/v)=100:0至50:50)纯化,得到化合物d02,其结果如表2所示。
[0250]
表2:化合物d02的合成中缩合剂的考察
[0251]
催化剂化合物d02产率dmap(4-二甲氨基吡啶)90%吡啶53%4-吡咯烷基吡啶78%
[0252]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何 未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都 包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1