一种感染性疾病病原体核酸筛选混合检测方法
1.本发明属于医药生物技术领域,具体涉及感染性疾病病原体核酸筛选混合检测方法,用于确定混合检测时混合组包含最佳样本数量(样本池大小),可应用于针对新冠病毒等病原体筛查阳性核酸样本时的优化处理。
背景技术:
2.实时荧光定量逆转录聚合酶链反应(qrt-pcr)检测新冠病毒核酸是疑似新冠病毒感染病例确诊的重要证据之一,新冠病毒核酸检测在确定传染源、集中医学观察人群确定、以及切断传播途径、保护易感人群等方面发挥了重要作用。在对大规模可疑人群筛选阳性核酸时,为了在最短时间内提高检测通量的同时兼具经济性考量,核酸(筛选)混合样本检测是主要方法之一。
3.核酸混合样本检测(pooling sample assay)是指将多个检测目的相同的不同样本混合后进行检测,若结果为阴性,则每个样本均判定为阴性;若结果为阳性,再分别对阳性池中的每个样本作单独检测,以确定混合样本中哪一个或几个样本为阳性。核酸混合样本检测一般是建立在已成熟的检测方法上,通过规范标本的采集、保存和混合检测等流程,最大程度地避免非实验因素变化对结果带来的影响。核酸混合检测可以数倍甚至数十倍提高检测效率,有效节约医疗资源,降低检测成本,提高传染性疾病防控能力。
4.虽然以往已有核酸混合样本检测的报道,比如:国内血站筛查献血员时已采用混合血样检验以排除hbv、hcv、hiv以及梅毒感染者;国外也有采用多样本混合检测提高人群hiv筛查效率的报道。但这些方法对样本混合池中样本数的选择标准不统一,只凭经验随机确定每混合组(样本池)样本数量,或者依据数学模型作推导计算,但该计算推导过程复杂,非专业人士不易理解。becker等人根据已知或预估的样本阳性率,选择合适的混合比例(即样本池样本数),发现能够大幅提升核酸检测效率。regen f等人提出了样本池大小的数学模型在matlab(2019,ver.9.7.0,math works inc)进行计算,并给出计算公式:ps=1.24
×
pp-0.466
;pp为已知或预估的样本阳性率,ps为样本池样本数。该公式在推导中考虑了样本总量(数),在最终计算公式中只有样本预估(已知) 阳性率这一参数。然而,该公式不合适于样本总量偏小时样本池大小的确定。
5.由此可以看出,现有技术中各种核酸(筛选)混合检测方法在确定混合组包含样本数量(样本池大小)时的标准不统一,会带来核酸筛选效率低下、检测成本增加的问题,也给各检测机构的核酸检测结果共认造成了障碍,同时也造成社会资源的巨大浪费。
技术实现要素:
6.本发明要解决的技术问题是,克服现有技术中的不足,提供一种感染性疾病病原体核酸筛选混合检测方法,具体是在病原体核酸(筛选)混合检测时确定每组包含样本数量(样本池大小)的优化方法。
7.为解决技术问题,本发明的解决方案是:
8.提供一种感染性疾病病原体核酸筛选混合检测方法,所述核酸筛选混合检测是指,将检测指标相同的不同样本分组后进行混合,然后对每个混合组进行检测;若某混合组的结果为阴性,则判定该组中的每个样本均为阴性;若某混合组的结果为阳性,再分别针对属于该组中的每个样本进行单独检测;
9.所述混合检测方法具体包括以下步骤:
10.(1)根据操作规范的要求,对若干名受检者采集样本;
11.(2)对采集的全部样本进行分组,并对同组样本进行混合;分组时,根据下述公式确定混合组的样本组数g和单个混合组中的样本数量n:
12.g=sqrt(p
×
n2)
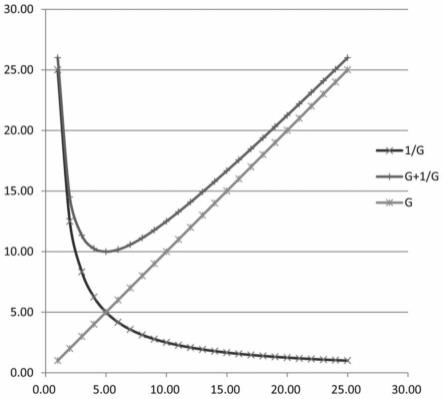
13.n=n/g=round[1/sqrt(p)]
[0014]
式中,p为已知或预估的样本阳性率,n为样本总量;sqrt为平方根函数,round 为四舍五入取整函数;
[0015]
(3)提取保存于病毒采样管中的混合组样本中的核酸;
[0016]
(4)对提取的核酸进行定量扩增检测;
[0017]
(5)根据质量控制和阳性结果判定标准,获得混合组试样检测的报告结果。
[0018]
发明原理描述:
[0019]
核酸混合检测是指将多个检测指标相同的不同样本混合后进行检测,若结果为阴性,则每个样本均判定为阴性;若结果为阳性,再分别对阳性池中的每个样本单独检测。
[0020]
现假设样本总量为n,样本已知或预估阳性率为p,混合组组数为g,每混合组包括样本数(样本池大小)为n,则阳性样本数为n
×
p,样本池大小(n)为n/g。混合检测样本分组后可能需要检测的最大数为g+n
×
p
×
n,即g+n
×
p
×
n/g,简化为g+p
×
(n2)/g。由于样本采集后,其阳性率和样本总量是确定的(均为正数,且g≥1),现在问题是,g 取什么数值时,混合检测样本可能需要检测的最大数为最小,即g+p
×
(n2)/g结果最小。把此公式在excel软件进行计算,并将计算结果转换得到图1。
[0021]
由于一个确定群体内个体数量及其预估的阳性率是固定的,故g+p
×
(n2)/g式中p
ꢀ×
n2为常数(a),则公式可简化为g+a/g,g为样本组数,p为阳性率,n为样本总量。当g=p
×
(n2)/g时,g+p
×
(n2)/g结果将最小,即混合检测样本所需检测总次数最小。所以,本发明提出混合组的样本组数g和单个混合组中的样本数量n的计算公式:
[0022]
1、核酸混合检测样本组数(g):
[0023]
g=sqrt(p
×
n2)
[0024]
g,样本组数;p,样本已知或预估阳性率;n,样本总量;sqrt,平方根
[0025]
2、每组最佳样本数(n):
[0026]
n=n/g=round[1/sqrt(p)]
[0027]
式中,p为已知或预估的样本阳性率,n为样本总量,sqrt为平方根函数,round 为四舍五入取整函数。
[0028]
根据上述计算,即可得到核酸混合检测每个样本池的样本数(样本池大小)。与已知报道的核酸混合样本检测样本池大小确定方法比较,本发明的方法简单易懂,使用便捷。通过上述内容可知,在混合样本检测时,样本池大小只与样本已知或预估的阳性率有关。为方便使用,可以预先把样本已知或预估阳性率与样本池大小间关系列画一个图 (如图2,只
显示了样本阳性率0.01%~25%)。这样在检测某一类样本时,只需知道该类样本阳性率预测值就可以确定混合检测组每组样本数多少,且该数值与需检测样本总数量无关。
[0029]
另外,根据上述内容也可以看出,当待检样本阳性率升高到一定值时,混合检测带来的效率提升达到极限,混合检测没有实际价值(可从图3所知,阳性率为25%时,混合检测没有实际价值)。
[0030]
与现有技术相比,本发明的有益效果是:
[0031]
1、本发明为大规模人群样本的病原体筛选混合检测提供了一种优化设计方案。该方法克服了现有各种确定样本池(混合组)样本量方法的局限性。相对而言,本发明更简单易用,可以通过简单计算公式或直接查图表确定混合组样本数量多少,且样本池大小只与样本(预估)阳性率有关。
[0032]
2、现行病原体筛选混合检测时确定混合组包含样本数量(样本池大小)的标准不统一,本发明的优化方法能够极大提升筛选效率,降低检测成本,同时也具有巨大的社会经济效益,实用性很强。也为目前核酸混合检测样本池大小确定提供了科学依据。
[0033]
3、只需在已知或预估样本阳性率条件下,本发明即可确定混合筛选检测时每个样本池大小,而不必考虑检测样本总量。在有足够灵敏度条件下,已知或预估的阳性率越低,总体样本量越大,则样本池包含样本数量越多,检测效率越高。
[0034]
4、本方法也可应用于低发病率(如,阳性率《10%)的肿瘤、慢性病等流行病学调查时阳性样本确定。
附图说明
[0035]
图1为样本混合组的组数g与1/g、g+1/g关系的曲线图。
[0036]
图2为样本阳性率(%)与样本混合组包含样本数(n)关系的曲线图。
[0037]
图3为样本阳性率与混合检测效率提高间关系的曲线图。
具体实施方式
[0038]
本发明创新地提出,在已知或预估样本阳性率条件,针对核酸筛选混合检测计算出混合样本组数和单个混合组中样本数量,使混合组中包含最佳样本数量(样本池大小)。从而为准备人员物资、预备检测材料等实际工作提供准确指导的同时,进一步提高效率。
[0039]
下面以针对新冠病毒的核酸筛选混合检测进行示例性说明,具体包括:
[0040]
(1)样本准备(采集)
[0041]
采集受检者咽拭子样本,通过使用一次性使用采样器(口咽拭子)于咽峡部反复刮取得到样本。采样成功后,将咽拭子置于一次性使用病毒采样管(含灭活病毒和核酸保护液)并及时送往实验室检测。因采集样本质量与核酸检测结果直接相关,故应确保采集操作规范,如把握采集力度、采集部位正确,受检者配合程度等。
[0042]
(2)样本混合
[0043]
为简化程序、避免额外操作影响样本,通常在采集样本时直接将多个受检者的样本直接置于同一个采样管中,并以采样管中预先加入含有保护病毒核酸成分的样本贮存液,从而实现样本混合。以采集受检者咽拭子样本为例,直接将每次采样时获得的带有咽拭子样本的棉签头放入同一个采样管中,直至达到指定的样本数量n。为满足采样点或检测单
位的耗材备料、人员安排的需要,需根据预估的受检者人数来确认混合组的样本组数g。具体可按下述公式计算获得:
[0044]
g=sqrt(p
×
n2)
[0045]
n=n/g=round[1/sqrt(p)]
[0046]
式中,g为混合组的样本组数,n为单个混合组中的样本数量;p为已知或预估的样本阳性率,n为样本总量;sqrt为平方根函数,round为四舍五入取整函数。
[0047]
(3)核酸提取
[0048]
使用磁珠法提取保存于病毒采样管(存有多个受检者样本)中的核酸,试剂为核酸提取试剂盒(磁珠法)(武汉明德生物科技股份有限公司),该试剂盒包含裂解液、蛋白酶k溶液、磁珠分散液、洗涤液、洗脱液,磁套等。核酸提取步骤按全自动核酸提取仪(ex3600,上海之江,中国)操作要求进行。操作如下:从试剂盒中取出预分装96 孔板,颠倒混匀数次使磁珠重悬,轻甩或离心使试剂和磁珠均集中到深孔板底部。于生物安全柜内加入病毒采样管中液体,300μl/孔。放置磁套,将深孔板放入全自动核酸提取仪的相应槽位中。提取仪自动进行核酸提取(按预设步骤程序),核酸提取的步骤是:裂解结合,洗涤,洗脱,弃磁。仪器运行结束后,将洗脱液深孔中的核酸转移至新的无核酸酶的ep管中,用于后续检测或保存于-20℃冰箱备用。
[0049]
(4)样本检测
[0050]
应用qrt-pcr检测试剂直接对核酸提取洗脱液的作定量扩增检测,相关操作均严格依照试剂盒说明书进行,简要步骤如下:每新冠病毒核酸反应孔qrt-pcr体系包含核酸提取洗脱液5μl(待检样本rna)和2019-ncov反应预混液20μl,总反应体系为 25μl/管,反应体系装于200μl孔pcr反应管(板),密封反应孔,瞬时离心,pcr反应管(板)移至实时荧光定量pcr仪器(7500,abi,thermo fisher scientific,waltham,ma) 反应腔内,按照对应的加样顺序设置检测孔、阳性质控品检测孔、阴性质控品检测孔、未知样本检测孔,并设置样本名称。
[0051]
按定量pcr试剂盒要求,荧光检测通道选择fam、hex和rox三个检测通道,其中ram为n基因指标通道,hex为orf1ab指示通道,rox为内控rnasep指标通道。pcr扩增过程反应参数如下:逆转录50℃(15min)
×
1cycle;预变性95℃(30s)
×
1cycle;循环内变性+退火延伸[95℃(3s)+60℃(40s)+荧光采集]
×
40cycles。
[0052]
(5)质量控制标准
[0053]
反应结束后仪器自动保存结果,根据结果图像调节各检测通道的基线(baseline)和阈值(threshold),点击“analysis”进行分析,使各项参数符合下面三项(abc)要求,然后查看各未知样本的检测结果。
[0054]
a阴性质控品:rox通道扩增曲线无指数增长或ct≥35,fam与hex通道扩增曲线无指数增长或ct≥40.
[0055]
b阳性质控品:fam、hex、rox三个通道扩增曲线增多呈指数增长且ct《35。
[0056]
c以上两项须在同一次检验中同时满足,否则当次检验视为无效,需重新上机检测。
[0057]
(6)阳性结果判定标准
[0058]
根据临床样本检测结果,利用roc曲线法确定阳性判断值如下:
[0059]
fam通道扩增曲线呈指数增长且ct《38为fam阳生;fam通道扩增曲线无指数增长或ct≥40为fam阴性。
[0060]
hex通道扩增曲线呈指数增长且ct《38为hex阳生;hex通道扩增曲线无指数增长或ct≥40为hex阴性。
[0061]
rox通道扩增曲线呈指数增长且ct《35为rox阳生;rox通道扩增曲线无指数增长或ct≥35为rox阴性。
[0062]
(7)样本结果判定
[0063]
每次实验均需检测阴性与阳性质控品,结果满足质控要求时方可进行检测样本结果的判定。
[0064]
阳性样本:rox、fam和hex三个pcr测通道均为阳性,可报告为阳性样本。
[0065]
阴性样本:rox通道为阳性,fam与hex通道均为阴性,可报告为阴性样本。
[0066]
rox通道为阳性,fam与hex通道检测结果满足以下任一情况时建议重复实验后再次结果确认(fam或hex通道扩增曲线呈指数增长且ct于38~40间;fam或 hex只有一个阳性),重复实验结果为fam和hex通道扩增曲线均呈指数增生且ct《40 时可判为阳性样本,否则报告为阴性样本。
[0067]
rox通道为阴性,则本次检测结果无效,需重新采样测定。
[0068]
更为具体的应用示例:
[0069]
1、样本池大小确定
[0070]
假设新冠病毒核酸阳性率为4%,在图2中,竖、横虚线表示样本阳性率为4%时,混合组样本数为5。注:若不考虑混合样本过程而额外花费时间和其它因素,当样本阳性率达到25%时,混合检测带来的效率提升已达到极限;若不考虑样本混合对检测灵敏度影响,样本阳性率越高,每混合组包含样本数则越多
[0071]
提示混合检测组包括样本数量为5,即5个样本混合为1组,然后只需检测这一混合样,若混合样检测为阴性,则5个样本均为阴性;若混合样检测为阳性,则对这5个样本分别检测以确定哪1个或几个样本为阳性。另外,在本案例中,为了方便后续实验,我们假设需要检测样本总量为200个,因为阳性率为4%,故200个样中有8个阳性样本。
[0072]
2、样本准备
[0073]
选取前期检测新型冠状病毒肺炎阳性咽拭子样本8份,选取192份阴性咽拭子作为混合用样本。从这200(8+192)份样本中随机取5个样本混合为样本混合组1(m1),另5个样本为样本混合组2(m2),以此类推,则共有40(200/5)个样本混合组(m1~m40)。
[0074]
3、试剂和设备
[0075]
自动核酸提取仪(ex3600,上海之江,中国),荧光定量pcr仪(7500,abi,美国)。磁珠法核酸提取试剂盒(明德生物科技股份有限公司,武汉,中国),荧光pcr法新型冠状病毒2019-ncov核酸检测试剂盒(明德生物科技股份有限公司,武汉,中国)。
[0076]
4、核酸提取
[0077]
参照核酸提取试剂盒(磁珠法)说明书,提取保存于病毒采样管(存有多个受检者样本)中的核酸。该核酸提取试剂盒(武汉明德生物科技股份有限公司)包含裂解液、蛋白酶k溶液、磁珠分散液、洗涤液、洗脱液,磁套等。核酸提取步骤按全自动核酸提取仪(ex3600,上海之江,中国)操作要求进行。操作如下:从试剂盒中取出预分装 96孔板,颠倒混匀数次
使磁珠重悬,轻甩或离心使试剂和磁珠均集中到深孔板底部。于生物安全柜内加入病毒采样管中液体,300μl/孔。放置磁套,将深孔板放入全自动核酸提取仪的相应槽位中。提取仪自动进行核酸提取(按预设步骤程序),核酸提取的步骤是:裂解结合,洗涤,洗脱,弃磁。仪器运行结束后,将洗脱液深孔中的核酸转移至新的无核酸酶的ep管中,用于后续检测或保存于-20℃冰箱备用。
[0078]
5、定量检测
[0079]
依照新型冠状病毒2019-ncov核酸检测试剂盒使用说明书,应用qrt-pcr检测试剂直接对核酸提取洗脱液的作定量扩增检测,操作步骤如下:每新冠病毒核酸反应孔 qrt-pcr体系包含核酸提取洗脱液5μl(待检样本rna)和2019-ncov反应预混液20μl,总反应体系为25μl/管,反应体系装于200μl孔pcr反应管(板),密封反应孔,瞬时离心,pcr反应管(板)移至实时荧光定量pcr仪器(7500,abi,thermo fisher scientific, waltham,ma)反应腔内,按照对应的加样顺序设置检测孔、阳性质控品检测孔、阴性质控品检测孔、未知样本检测孔,并设置样本名称。然后,进行荧光定量pcr扩增。pcr 反应参数如下:1,预反应,50.0℃for 15分,95.0℃for 30秒;2,核酸扩增及荧光信号收集(40个循环),95.0℃for 3秒,60.0℃for 40秒+荧光信号收集。
[0080]
6、质量控制
[0081]
fam、hex、rox三个检测指示通道分别对应n基因、orf1ab基因、rnasep基因,其中n基因、orf1ab基因为新冠病毒特异性基因,rnasep为人内标基因。
[0082]
7、结果判断
[0083]
每个反应孔均检测3个基因(由fam、hex、rox三个指示通道检测到的荧光信号表现),分别是rnasep,orf1ab和n基因,其中rnasep,即为核糖核酸酶p,是由一条长链非编码rna和十个蛋白质亚基组成的核糖核蛋白质复合物,可作用于催化切割rna。由于rnasep在人体各器官组织细胞中普遍存在,故可作为内标基因使用,用于被测样本中是否包含有人的基因,即样本是否为空白(采样时有无采集到样本,样本是否符合要求),并监测整个实验操作过程的准确。另外,orf1ab和n基因是新冠病毒特异性基因,结合ct值和标准曲线判定结果。若检测到典型的s型扩增曲线,且 ct≤40,表示样本阳性。若样本荧光信号有明显增幅,但ct值》40,且呈现s曲线,则该样本为疑似阳性,需要复检。如复检结果仍为疑似阳性,则判断为阳性。
[0084]
8、检测结果
[0085]
本实验案例中200个样本分为40个样本混合组,这40个样本混合组经检测后,发现有6个混合组(m35~m40)为阳性,这6个样本混合组的30个(6
×
5)原液样本分别单独检测后,发现8个样本阳性(混合组m35有2个阳性,m36有1个阳性,m37 有2个阳性,m38有1个阳性,m39有1个阳性,m40有1个阳性),余下的170个样本检测结果均为阴性。检测为阳性结果的样本混合组,和构成混合组的单个样本 qrt-pcr结果,请见表1。本次实验中,样本单独或混合检测结果相一致(阳性样本数),表明样本混合检测对结果没有显著影响。
[0086]
9、检测效率提升情况
[0087]
在本具体实施例子中,混合检测的次数为40+6
×
5=70,故检测效率提升了65% [=(200-70)/200],其中70为实际检测次数,实际检测次数只是单独样本检测时的35%。其它阳性率或预估阳性率样本混合检测时,最少检测效率提升(假设混合时阳性样本均分布
于不同样本混合组)与样本阳性率关系图,请参见图。图3中,三条竖虚线分别对应0.01%,4%,20%样本阳性率。
[0088]
从图3可知,样本阳性率越低,提高的检测效率则越多,如,当样本阳性率为0.01%时,样本混合组检测效率提升了99%,几乎是没有混合(单个)检测时100倍;当阳性率为20%时,提高的检测效率则只有10%。另外,若混合时有二个或多个阳性样本混合在同一样本混合组,则检测效率提升会更多。如本案例中,检测效率最低可提高60%,而实际上提高了65%,因为有二个样本组合组各包含有2个阳性样本。当然,这里计算检测效率时,没有考虑样本混合时会降低检测的灵敏度(虽然qrt-pcr有极高的灵敏性),及样本混合过程所增加的工作量。
[0089]
特别地,在检测指标的已知或预估阳性率较低、筛选检测样本量较大时,越能体现出本发明方法的优势和效率。样本阳性率(%)越低,则每混合组包含的样本数量越多。例如,样本阳性率为万分之一(0.01%)时,在不考虑混合检测样本会降低灵敏度,可把以100个样本混合在一起检测,从而检测效率是单个样本检测的100倍。特别地,对于目前大规模筛选sars-cov-2感染个体时新冠病毒核酸检测(样本阳性率极低,往往小于万分之一),具有巨大优势,从而将产生重大的社会经济效益。由于考虑到混合样本检测会相对降低目标指标检测的灵敏性,混合检测样本池大小(样本数量)不能随着样本已知或预估的阳性率降低而无限地增加。另外,确定样本池大小时,同时也要考虑临床操作(包括采样方便、安全和实验过程),检测需求等一系列问题。
[0090]
表1样本混合组或单独样本检测结果(ct)
[0091][0092]
n基因,orf1ab基因为新冠病毒特异性基因,rnasep为人保守基因(内参基因), ct为循环数,
“‑”
阴性或没检测到荧光信号,“+”阳性
[0093]
综上,本发明提供的确定核酸筛选混合检测组包括每组样本数(样本池大小)的方法,克服了以往方法的不足,为科学精准确定样本池大小提供了理论依据和实践数据。同时,该方法也可应用于临床实验室各种检测指标(包括但不限于核酸、蛋白、糖类等) 定性(阴性或阳性)时样本池大小确定(检测同一指标的多个样本)。
[0094]
当然,本领域技术人员也知晓,在应用于临床实验室时,针对不同感染性疾病病原体进行核酸筛选混合检测时,相应的样本采集、预处理、贮存方法,以及检测步骤、检测标准、结果判断等内容都可能存在区别。如乙型肝炎病毒(hbv)感染的血清学检测 (定性)时,
是采集患者外周静脉全血,待血液凝固后分离血清用于hbv dna(脱氧核糖核酸)检测,以确定患者有无感染hbv。但是,本发明提供的检测方法,其实质性贡献在于对具有相同检测目标同一批样本混合检测时进行最优解的分组混合方法,即对将多少样本混合为一组(每组多少样本),以及该批样本分为多少组。这个分组混合的步骤对各种感染性疾病病原体进行核酸筛选混合检测来说,都是普遍适用的;而各种样本的不同的采集和前期处理以及后续的样本检测分析等内容,并不会影响到分组混合的结果。故,本发明能够适用于各类不同感染性疾病病原体进行核酸筛选混合检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1