一种用于肿瘤化学免疫治疗的TREM2抑制剂及其应用的制作方法
一种用于肿瘤化学免疫治疗的trem2抑制剂及其应用
技术领域
1.本发明属于医药技术领域,特别涉及一种用于肿瘤化学免疫治疗的trem2抑制剂及其应用。
背景技术:
2.癌症是威胁人类健康、造成全球人口死亡的第二位主要原因。免疫疗法通过调节全身免疫系统发挥抗肿瘤作用,被认为是最具前景的癌症治疗方法(m.mcnutt,science 2013,342,1417)。然而由于肿瘤细胞通过免疫检查点抑制了其免疫原性特征,并诱导出免疫抑制性肿瘤微环境(tme),使t细胞受到免疫抑制性髓样细胞的破坏,导致目前的免疫治疗药物仅对不足四分之一的癌症患者有效。
3.髓样细胞是构成肿瘤微环境的重要部分,通过多种机制抑制t细胞应答(a.mantovani,nat.rev.clin.oncol.2017,14,399)。肿瘤浸润性髓样细胞包括免疫刺激和免疫抑制子集(m.m.gubin,cell2018,175,1014)。免疫刺激性髓样细胞包括1型树突状细胞(dc1s)和γ干扰素(ifn-γ)诱导的m1型巨噬细胞。抑制性髓样细胞包括m2型巨噬细胞、异源髓样祖细胞和未成熟的髓样细胞,统称为髓样来源的抑制细胞。免疫抑制性髓样细胞被认为是癌症免疫疗法的主要障碍,会破坏细胞毒性t淋巴细胞(ctl)对肿瘤细胞的免疫攻击(k.palucka,nat.rev.cancer 2012,12,265)。髓系细胞触发受体2(trem2)是一个全新的潜在抗肿瘤治疗靶标,在绝大多数原发性和转移性肿瘤浸润性巨噬细胞上高表达,抑制t细胞的活动(m.martina,cell 2020,182,886;k.yonatan,cell 2020,182,872);而在正常外周组织巨噬细胞中低表达或不表达(y.lavin,cell 2017,169,750),是肿瘤浸润性巨噬细胞的标志物。阻断trem2会减少肿瘤浸润抑制性巨噬细胞水平,抑制调节性髓样细胞的积累,增强cd8
+
t细胞抗肿瘤活性,有利于清除或抑制肿瘤。因此,调控trem2水平可以重塑肿瘤微环境,消除抑制性髓样细胞或诱导免疫刺激特性的髓样细胞,增强t细胞抗肿瘤活性,是具有重要应用前景的抗肿瘤免疫治疗策略(k.nakamura,signal transduct.tar.2020,5,233;k.nakamura,cell mol.immunol.2020,17,1)。另外,某些化学药物可能诱导肿瘤细胞发生免疫原性细胞死亡(icd),其特征为钙网蛋白(crt)从死亡细胞内迁移至质膜表面,高迁移率族蛋白b1(hmgb1)、atp和ifn向胞外释放等。细胞膜表面暴露crt可以促进树突细胞(dc)成熟、对肿瘤相关抗原进行加工和提呈并对肿瘤细胞进行识别和吞噬,由此激活机体一系列特异性抗肿瘤免疫应答。所以诱导icd也是刺激dc成熟、激活效应t细胞、清除肿瘤细胞的重要抗肿瘤免疫治疗策略。
4.化学免疫疗法是一种将化学药物治疗与免疫调节治疗相结合的治疗方法。化疗免疫疗法具有协同治疗的特点,一方面通过化疗机制直接杀死肿瘤细胞,另一方面通过激活免疫反应间接杀死肿瘤细胞,并通过重塑肿瘤微环境防止肿瘤复发和转移,可以减少用药剂量和增强治疗效果,是一种很有潜力的肿瘤治疗方法。然而化学免疫治疗常见的实施方案是免疫细胞治疗和化学治疗两种方法的联用,或免疫调节剂(如免疫检查点抑制剂)和化疗药物两种治疗剂连用,它们都是各自独立起作用,药代动力学性质和体内分布不同、作用
靶点不一致、作用时间不同步、肿瘤部位的药物比例不可控,因此经常出现严重的全身副作用,影响协同抗肿瘤效果。
5.铂(iv)配合物具有独特的作用机制及易于化学修饰的特点,在克服铂类抗肿瘤药物系统毒性及耐药性等方面受到了广泛关注,有可能用作肿瘤化学免疫治疗剂。
技术实现要素:
6.针对现有技术中存在的问题,本发明的目的在于提供了一种用于肿瘤化学免疫治疗的trem2抑制剂及其应用,以解决单纯化学治疗和免疫治疗抗肿瘤效果差、毒副作用多,而现有化学免疫治疗法步骤繁琐,缺少单一小分子化学免疫治疗剂的技术问题。
7.为实现上述目的,本发明采用了如下技术方案:
8.本发明第一方面提供了一种用于肿瘤化学免疫治疗的trem2抑制剂,所述trem2抑制剂为通过将青蒿琥酯(art)连接到奥沙利铂(op)衍生物上而得到的铂(iv)配合物opa,其结构式如下式(1)所示:
[0009][0010]
本发明第二方面提供上述trem2抑制剂在肿瘤化学免疫治疗中的应用。
[0011]
优选的,上述应用中,所述肿瘤为原发性和转移性肿瘤,包括但不限于卵巢癌、胃癌、结直肠癌、胰腺癌、乳腺癌、肺癌、肝癌、头部和颈部鳞状细胞癌、膀胱癌、宫颈癌、胆囊癌、骨瘤、骨肉瘤、甲状腺癌、唾液腺癌、食道癌、胶质细胞瘤、前列腺癌、胸腺瘤、子宫内膜癌等。
[0012]
本发明第三方面提供一种用于肿瘤化学免疫治疗的单分子化学免疫治疗剂,所述单分子化学免疫治疗剂的有效成分为opa,所述opa具有以下功效:(1)能够抑制免疫细胞巨噬细胞中trem2的表达;(2)能够促进人结直肠腺癌细胞表面钙网蛋白的表达;(3)能够诱导hct-116结肠癌细胞发生免疫原性死亡;(3)能够诱导肿瘤微环境中巨噬细胞向抗肿瘤m1表型极化;(4)能够促进免疫刺激性cd83
+
dcs的成熟;(5)能够促进肿瘤内cd8
+
t淋巴细胞浸润;(6)能够重塑肿瘤免疫微环境。
[0013]
本发明具备如下有益效果:
[0014]
本发明提供了一种用于肿瘤化学免疫治疗的trem2抑制剂,即通过将青蒿琥酯(art)连接到奥沙利铂(op)衍生物上得到的铂(iv)配合物opa。研究发现,opa既能直接通过化学作用杀伤肿瘤细胞,又能通过抑制髓系细胞触发受体2(trem2)表达降低免疫抑制性髓样细胞亚群、促进免疫刺激性细胞成熟扩增以及重塑肿瘤微环境和激活免疫反应间接杀死
肿瘤细胞。另外opa还具有诱导免疫原性死亡的性能。也就是说,本发明提供的trem2抑制剂,即opa同时具有免疫调节和化学治疗功能,能够实现对肿瘤的化学免疫治疗目的,从而解决单纯化学治疗和免疫治疗抗肿瘤效果差、毒副作用多,而现有化学免疫治疗步骤繁琐,缺少单一小分子化学免疫治疗剂的技术问题。本发明为设计制备用于肿瘤化学免疫治疗的单分子trem2抑制剂提供了理论和实验基础。
附图说明
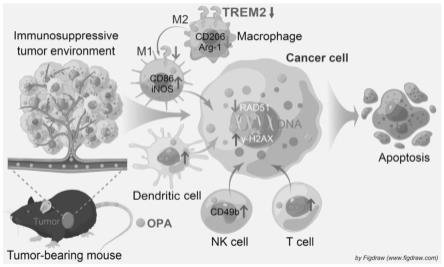
[0015]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0016]
图1为本发明涉及的化合物op、art和opa的化学结构式;
[0017]
图2为实施例1中opa的1h nmr(600mhz,dmso-d6)谱图;
[0018]
图3为实施例1中opa的
13
c nmr(101mhz,dmso-d6)谱图;
[0019]
图4为实施例1中opa的
195
pt nmr谱图;
[0020]
图5为实施例1中opa的hr-esi-ms(ch3oh)谱图;
[0021]
图6为青蒿琥酯(art)对bv2小胶质细胞中trem2表达的抑制作用(24h)效果图:(a)免疫荧光;(b)和(c)免疫印迹;
[0022]
图7为opa对thp-1巨噬细胞trem2的抑制作用效果图:(a)流式细胞术测定结果;(b)免疫荧光测定结果;
[0023]
图8为opa(1.5mg pt per kg)对mc38结肠癌小鼠模型肿瘤组织中trem2表达的抑制作用(15天)效果图;
[0024]
图9为opa与hct-116结肠癌细胞培养24h后流式细胞仪测得的细胞内ros变化(a)、共聚焦显微镜测得的表面crt表达(b)、以及培养48h后细胞培养上层清液中atp(c)和hmgb1(d)的含量结果图;
[0025]
图10为opa(0.8μm)对hct-116结肠癌细胞dna损伤标志物γ-h2ax和dna损伤修复蛋白rad51的影响(48h)结果图:(a)免疫印迹,(b)蛋白定量分析;
[0026]
图11为opa与hct-116结肠癌细胞37℃孵育72h后对细胞周期阻滞的影响效果图(a),及对细胞凋亡的影响效果图(b);
[0027]
图12为opa(1.5mg pt per kg)对c57bl/6小鼠mc38结肠癌移植肿瘤生长的抑制作用(15天)效果图;
[0028]
图13为hct-116细胞与opa(0.4μm)和人外周血单核细胞(pbmcs)共孵育48h后的细胞存活率结果图;
[0029]
图14为opa(1.5mg pt per kg)对c57bl/6小鼠mc38结肠癌移植肿瘤组织中cd86、inos、cd206、arg-1水平的影响(15天);
[0030]
图15为opa(1.5mg pt per kg)对c57bl/6小鼠mc38结肠癌移植肿瘤组织中免疫抑制性cx3cr1
+
cd206
+
细胞亚群的抑制效果图(a、b),及其对免疫刺激性(cd83
+
)dcs细胞的激活效果(15天)图(c、d);
[0031]
图16为opa(1.5mg pt per kg)对c57bl/6小鼠mc38结肠癌移植肿瘤组织中nk和
cd8
+
t细胞的免疫激活效果图;
[0032]
图17为opa抑制trem2表达、调节抗肿瘤免疫反应的作用机理图。
具体实施方式
[0033]
以下描述中,为了说明而不是为了限定,提出了诸如特定系统结构、技术之类的具体细节,以便透彻理解本发明实施例。然而,本领域的技术人员应当清楚,在没有这些具体细节的其它实施例中也可以实现本发明。
[0034]
本发明通过研究发现,将青蒿琥酯(art)连接到奥沙利铂(op)衍生物上得到的铂(iv)配合物opa同时具有免疫调节和化学治疗功能,可以实现对肿瘤化学免疫治疗的目的,而此类通过铂类配合物重塑肿瘤免疫抑制性微环境,具有增强临床药物疗效、降低毒副作用的单分子化学免疫治疗剂至今未见报道和应用。
[0035]
本发明提供的一种用于肿瘤化学免疫治疗的trem2抑制剂,该trem2抑制剂为通过将青蒿琥酯(art)连接到奥沙利铂(op)衍生物上而得到的铂(iv)配合物opa,其结构式如下式(1)所示:
[0036][0037]
并提供了上述trem2抑制剂在肿瘤化学免疫治疗中的应用,即在重塑肿瘤免疫微环境中的应用。上述肿瘤包括但不限于卵巢癌、胃癌、结直肠癌、胰腺癌、乳腺癌、肺癌、肝癌、头部和颈部鳞状细胞癌、膀胱癌、宫颈癌、胆囊癌、骨瘤、骨肉瘤、甲状腺癌、唾液腺癌、食道癌、胶质细胞瘤、前列腺癌、胸腺瘤、子宫内膜癌等200多种原发性和转移性肿瘤。
[0038]
实施例1
[0039]
称取oxoop(二羟合奥沙利铂,结构见图1;129mg,0.30mmol)和art(346mg,0.90mmol)溶于无水dmf(5ml),加入三乙胺(125μl,0.90mmol),tbtu(290mg,0.90mmol),室温搅拌48h。向反应液中加入40ml乙醚析出黄色粗产物沉淀,-20℃下冷却静置2h,过滤沉淀并溶解于丙酮(5ml)中。向溶液中加入正己烷(5ml)和乙醚(20ml),过滤沉淀,用乙醚和乙醇/水(1:1)洗涤,真空干燥,得到固体产物opa,产率为48%。通过1h nmr、
13
c nmr和hr-esi对其结构表征。1h nmr(400mhz,dmso-d6):δ(ppm)8.31-7.97(d,6h),5.66(d,2h),5.52(s,2h),2.59(m,10h),2.30-2.27(m,2h),2.21-2.14(m,2h),2.10-2.07(m,2h),2.01-1.98(m,2h),1.84-1.79(m,2h),1.62-1.43(m,16h),1.29(s,6h),1.21-1.14(m,4h),0.99-0.94(m,2h),0.90-0.88(d,6h),0.78-0.76(d,6h).
13
cnmr(101mhz,dmso-d6):δ(ppm)179.53,171.69,164.80,104.09,92.21,91.11,80.31,51.58,45.04,36.49,36.36,34.16,32.07,
30.59,29.94,25.97,24.66,23.97,21.52,20.52,15.64,12.28.
195
pt nmr(69mhz):1617.24ppm.hr-esi(正离子模式,m/z):[m+na]
+
=1186.39170,calcd 1186.3910.
[0040]
性能测试:
[0041]
(ⅰ)青蒿琥酯(art)对bv2小胶质细胞trem2表达的抑制能力(24h)的研究
[0042]
本发明通过免疫荧光成像技术考察免疫细胞trem2的表达水平。具体实施方式如下:将bv2小胶质细胞(1
×
104个细胞/孔)接种到共聚焦小皿(10%胎牛血清,dmem)中,37℃培养18h,加入青蒿琥酯(0.1,1μm)在37℃孵育24h,固定细胞,0.5%bsa封闭,trem2一抗在4℃孵育过夜;次日,加入对应二抗孵育1h,通过使用配备dapi、af488、af546和cy5滤光片组的lsm-710(zeiss,德国)共聚焦显微镜进行荧光观察,结果见图6。
[0043]
由图6结果可知:青蒿琥酯(art)能够抑制免疫细胞bv2小胶质细胞trem2的表达水平,并呈浓度依赖关系,即表明art具有抑制trem2的活性,是关键的药效团。
[0044]
(ⅱ)opa对巨噬细胞trem2及肿瘤组织trem2表达的抑制能力研究
[0045]
(a)本发明通过流式细胞技术和免疫荧光测试opa抑制thp-1巨噬细胞trem2的表达水平。具体实施方式如下:将thp-1单核细胞(1
×
105个细胞/孔)接种到6孔板(10%胎牛血清,rpmi 1640)中,37℃培养18h。用100ng ml-1
佛波酯(pma)刺激细胞72h,诱导成thp-1巨噬细胞。然后加入opa(1μm)在37℃孵育24h。胰酶消化并收集、固定细胞。上述操作完成后,按照说明书加入trem2抗体染色,通过流式细胞仪检测。另外,用相同方法处理细胞,通过免疫荧光技术测试thp-1巨噬细胞trem2的表达水平,测试结果见图7。
[0046]
由图7结果可知:pma诱导后的thp-1巨噬细胞trem2水平明显提高;opa处理后,thp-1巨噬细胞trem2水平显著降低,其抑制效果比art更显著,表明opa能抑制免疫细胞(巨噬细胞)中trem2的表达。
[0047]
(b)本发明通过免疫组化方法测试opa对结肠癌小鼠模型肿瘤组织trem2的表达。具体实施方式如下:将mc38细胞的pbs悬液按每只小鼠3
×
105个皮下注射到小鼠腋下。当肿瘤细胞植入9天后长到80-150mm3时,将小鼠随机分组:opa(1.5mg pt kg-1
)每3天通过尾静脉注射给药,共15天。给药结束后,通过免疫组化分析评估opa对mc38结肠癌小鼠模型肿瘤组织中trem2表达水平的影响,结果见图8。
[0048]
由图8结果可知:未经处理的肿瘤组织富含过表达trem2的巨噬细胞,表明处于免疫抑制微环境,有利于肿瘤生长;opa治疗后,trem2棕色区域几乎消失,肿瘤微环境得以重塑,有利于减少肿瘤免疫逃逸。相比之下,art对体内trem2表达几乎没有影响,可能是由于其局部浓度太低无法有效抑制trem2表达。
[0049]
(ⅲ)opa诱导肿瘤细胞免疫原性死亡能力的研究
[0050]
(a)本发明通过免疫荧光成像技术考察细胞表面钙网蛋白(crt)暴露水平。具体实施方式如下:将hct-116人结直肠癌细胞接种在20mm共聚焦小皿(nest)中,37℃培养18h。细胞分别用op(50μm)、art(10μm)、opa(5μm)处理24h,用冷pbs洗涤两次,1%多聚甲醛固定,并在4℃下用crt一抗孵育1h。然后用冷pbs洗涤两次,二抗室温下孵育1h。pbs洗涤两次后,用4%多聚甲醛固定细胞15min,然后用hoechst 33342染色5min,用配备dapi、af488、af546和cy5滤光片组的lsm-710(zeiss,德国)共聚焦荧光显微镜进行观察,结果见图9。
[0051]
由图9结果可知:用art处理24h后,hct-116细胞表面crt表达略有增加;而opa处理后crt表达显著增加。
[0052]
(b)本发明通过elisa方法测试细胞中atp(腺苷三磷酸)和hmgb1(高迁移率族蛋白b1)的释放效果。具体实施方式如下:将hct-116细胞接种在20mm共聚焦小皿(nest)中,37℃培养18h。细胞用op(50μm)、art(10μm)、opa(5、10μm)处理48h,收集上层清液。利用试剂盒检测细胞培养上层清液中分泌的hmgb1和atp的含量,结果见图9。
[0053]
由图9结果可知:与对照组(ctrl)相比,opa(5μm,10μm)处理组atp显著增加,opa(5μm,10μm)处理的hct-116细胞外hmgb1水平是对照组(ctrl)的3.18和4.88倍。结果表明opa可诱导hct-116细胞发生免疫原性死亡,art的诱导能力远弱于opa。
[0054]
(ⅳ)opa对肿瘤细胞dna损伤及修复能力的影响研究
[0055]
本发明通过westernblot技术测试hct-116细胞内γ-h2ax和rad51蛋白表达水平。具体实施方式如下:将hct-116细胞以每孔2
×
106个细胞的密度接种在6cm细胞培养皿中,并在含有10%胎牛血清的mccoy5a培养基中培养24h,之后将培养基更换为分别含有op、opa(0.8μm)或art(1.6μm)的新鲜培养基,再孵育48h,用冷pbs洗涤细胞两次,收集细胞,冰上裂解,4℃离心15min(12000g),收集上层清液加入上样缓冲液并归一化,96℃煮沸10min,样品通过sds-page分离,并转到pvdf膜上,将膜在室温下用5% bsa封闭1h,然后分别与γ-h2ax和rad51抗体在4℃下孵育过夜,洗膜并与二抗在室温下孵育1h,观察蛋白条带。结果见图10。
[0056]
由图10结果可知:opa可明显上调γ-h2ax的表达,表明其能够对肿瘤细胞dna造成显著损伤;opa明显下调rad51的表达,表明其可使肿瘤细胞修复dna双链断裂能力受到抑制。
[0057]
(
ⅴ
)opa对各种癌细胞及正常细胞的细胞毒性研究
[0058]
(a)本发明通过mtt法测试opa的细胞毒活性;具体实施方式如下:在人结肠癌细胞hct-116和人肾皮质近曲小管上皮细胞hk-2(正常细胞系)上测试opa的细胞毒活性。所有细胞均在75cm2培养瓶中培养,使用dmem或ripm 1640生长培养基,添加10%胎牛血清,在37℃、含5% co2的湿润培养箱中培养。使用mtt法测试opa的细胞毒活性,即:将细胞以每孔2
×
103个细胞的密度接种在含100μl培养液的96孔板中,培养24h。opa的储备液用dmso制备。将储备溶液稀释至不同浓度,以每孔200μl的等分加入(dmso《0.1%)。孵育72h后,加入mtt(20μl,5mg ml-1
)37℃下培养4h。移去培养液并加入dmso(150μl)溶解紫色晶体。摇板15min,用酶标仪测试溶液在570nm处的吸光度;采用类似方法可测试opa对其它细胞的毒性,结果见表1。
[0059]
表1.op,art,op和art(1:2),opa对不同细胞的ic
50
(μm)值
[0060][0061]
由表1结果可知,opa对人结肠癌细胞具有较高的选择性和较强的杀伤作用,对正常细胞毒性较低。
[0062]
(b)通过流式细胞技术测试细胞周期和凋亡情况。具体实施方式如下:将hct-116
细胞以每孔2
×
105个细胞的密度接种在6孔板中,并在含有10%胎牛血清的mccoy 5a培养基中培养24h。将培养基更换为分别含有op、opa(0.8μm)或art(1.6μm)的新鲜培养基。孵育72h后,通过胰蛋白酶消化收集细胞并用pbs洗涤,在冷乙醇(70%)中固定24h,通过离心沉淀,用rnase a处理,并用pi染色30min,通过流式细胞术检测分析细胞周期。将hct-116细胞以每孔2
×
105个细胞的密度接种在6孔板中,并在含有10%胎牛血清的mccoy 5a培养基中孵育24h。将培养基更换为分别含有op、opa(0.8μm)或art(1.6μm)的新鲜培养基。孵育72h后,用冷pbs洗涤细胞两次,胰蛋白酶消化并离心5min(2000g)。弃去上层清液,将细胞重新悬浮在缓冲液(500μl)中,用annexin v染色避光孵育60min。用pi处理细胞并通过流式细胞术分析凋亡情况,结果见图11。
[0063]
由图11结果可知:opa对细胞周期的主要作用是抑制dna合成前期(g1期)。另外,opa分别诱导5.17%和30.9%的hct-116细胞进入早期和晚期凋亡,从而证实其具有可促凋亡能力。
[0064]
(ⅵ)opa在小鼠体内的抗肿瘤活性研究
[0065]
本发明采用mc38结肠癌小鼠肿瘤模型测试opa对肿瘤生长的抑制作用。具体实施方式如下:将mc38细胞的pbs悬液按每只小鼠3
×
105个细胞皮下注射到c57bl/6小鼠腋下。当肿瘤细胞植入9天后,肿瘤长到80-150mm3,将16只小鼠随机分为两组:pbs和opa(1.5mg pt kg-1
)每3天通过尾静脉注射给药,共15天。每3天使用游标卡尺测量肿瘤的直径并根据公式计算:肿瘤体积(mm3)=0.5
×
长度
×
宽度2来监测肿瘤生长,结果见图12。
[0066]
由图12结果可知:opa能够有效抑制肿瘤体积至185.75mm3,opa治疗组肿瘤几乎完全停止生长,而对照组、op和art治疗小鼠的肿瘤平均体积分别为1856.57mm3、1271.56mm3和1498.75mm3。
[0067]
(ⅶ)确证opa的免疫刺激功能及其对小鼠肿瘤免疫微环境的影响
[0068]
(a)本发明通过mtt法测试opa在人外周血单核细胞(pbmcs)存在下对肿瘤细胞活性的影响。pbmcs含有多种免疫细胞,如自然杀伤(nk)细胞、巨噬细胞和dcs,因此常被用来模拟体内免疫微环境。具体实施方式如下:将hct-116细胞以一定密度接种于transwell小室(3.0μm)的底层,并分别向细胞中加入含有不同化合物的ripm 1640完全培养基。24h后,将pbmcs以1:10(hct-116:pbmcs)的比例接种在上层并培养48h,以无pbmcs或/和化合物的细胞作为对照。孵育结束时,移除transwell室的上层并加入mtt溶液。4h后,除去培养基并加入dmso(300μl)。在酶标仪上测量570nm处的吸光度。结果见图13。
[0069]
由图13结果可知:在pbmc存在下,opa将hct-116细胞存活率降至43.2%;而在没有pbmc的环境中,仅略微降低存活率,表明opa可以激活免疫细胞杀死癌细胞,存在化学和免疫协同作用。
[0070]
(b)通过免疫荧光技术测试opa对mc38结肠癌小鼠模型肿瘤组织中cd86、inos、cd206、arg-1的水平影响。具体实施方式如下:mc38结肠癌小鼠经过opa治疗后,收集肿瘤组织并用4%多聚甲醛固定。然后将固定的肿瘤组织样本浸入30%蔗糖中进行冷冻保护,并使用cryosta(microm hm 525,thermo scientific,waltham,ma,usa)切成5μm厚的切片。石蜡包埋的肿瘤组织切片用于组织学染色。切片分别在二甲苯中浸泡10min两次、乙醇中浸泡3min、95%乙醇/h2o中浸泡3min、90%乙醇/h2o中浸泡3min、在80%乙醇中浸泡3min,70%乙醇/h2o中浸泡3min,在60%乙醇/h2o中浸泡3min,在50%乙醇/h2o中浸泡3min,在dd水中浸
泡3min进行脱蜡水化。然后,组织切片用0.5% triton x-100的pbs溶液透化15min。用冷pbs洗涤切片5min,室温下用0.5% bsa的pbs溶液封闭30min。再用抗原修复缓冲液95℃加热15min。随后,将切片与一抗(1:100稀释),在4℃孵育过夜。然后,将切片用pbs缓冲液洗2
×
5分钟,并与二抗(1:100)在室温下孵育1h。使用配备dapi、af488、af546和cy5滤光片组的lsm-710(zeiss,德国)共聚焦荧光显微镜进行观察。结果见图14。
[0071]
由图14结果可知:opa显著增加了肿瘤组织中巨噬细胞m1型标志物cd86和inos的荧光强度,同时降低了m2型标志物cd206和arg-1的荧光强度,证明opa可以诱导肿瘤微环境中巨噬细胞向抗肿瘤m1表型极化。
[0072]
(c)通过流式细胞技术测试opa对mc38结肠癌小鼠模型肿瘤组织中免疫抑制性细胞和免疫刺激性细胞亚群的影响。具体实施方式如下:免疫抑制性细胞亚群以cx3cr1
+
cd206
+
细胞亚群为例。在mc38结肠癌小鼠模型给药第16天处死小鼠,收集肿瘤组织,并通过机械研磨制备单细胞悬液。随后通过1500rpm速度低温离心5min收集细胞悬液,在室温下加入rbc裂解缓冲液5min去除红细胞,并用冷pbs洗涤细胞两次。按照说明书用cx3cr1-fitc、cd206-apc抗体对细胞悬液进行共染,然后立即通过流式细胞术进行分析。免疫刺激性dc细胞水平检测方法与此类似,通过免疫荧光技术测试。结果见图15。
[0073]
由图15结果可知:opa将cx3cr1
+
cd206
+
细胞比例从52.7%降低到28.8%,并且cx3cr1
+
和cd206
+
细胞的百分比分别缩小到21.2%和32.3%,低于对照组(ctrl),说明opa减少了肿瘤组织中m2巨噬细胞并增加了m1巨噬细胞,这将减小对cd8
+
细胞毒性t细胞的免疫抑制活性。成熟和活化的dcs对活化的肿瘤特异性淋巴细胞募集和存活至关重要。cd83是成熟dc的标志物,可介导抗原呈递、t细胞识别和结合以及t细胞和b细胞的活化。opa增加了cd83的表达,表明其可以促进免疫刺激性cd83
+
dcs的成熟。
[0074]
(d)通过免疫荧光技术测试opa对mc38结肠癌小鼠模型肿瘤组织中浸润性nk、cd8
+
t细胞的影响。具体实施方式同(c),结果见图16。
[0075]
由图16结果可知,相对于对照组(ctrl),opa增强绿色荧光约6倍,增强红色荧光约3倍,说明被opa募集到肿瘤组织中的nk细胞增加约6倍,促进肿瘤内cd8
+
t淋巴细胞浸润约3倍。
[0076]
综上,可得以下结论:本发明提供的一种用于肿瘤化学免疫治疗的trem2抑制剂,即通过将青蒿琥酯(art)连接到奥沙利铂(op)衍生物上得到的铂(iv)配合物opa,既能直接通过化学作用杀伤肿瘤细胞,又能通过抑制髓系细胞触发受体2(trem2)表达降低免疫抑制性髓样细胞亚群、促进免疫刺激性细胞成熟扩增以及重塑肿瘤微环境和激活免疫反应间接杀死肿瘤细胞,具体机理参照图17。即本发明提供的trem2抑制剂同时具有免疫调节和化学治疗功能,可以对肿瘤实现化学免疫治疗的目的。
[0077]
本发明不局限于上述具体的实施方式,本领域的普通技术人员从上述构思出发,不经过创造性的劳动,所做出的种种变换,均落在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1