捕获及释放靶标细胞的特异性探针、其制备方法及其应用与流程
本发明涉及细胞分离,具体涉及一种捕获及释放靶标细胞的特异性探针、其制备方法及其应用。
背景技术:
1、细胞分选技术是细胞学研究中一个很重要的课题。基于免疫识别特性的细胞分选方法包括荧光激活细胞分选方法(fluorescence-activated cell sorting,facs)和磁性激活细胞分选法(magnetic-activated cell separation,macs)。facs是利用流式细胞仪分选细胞,虽被认为是细胞分选的“金标准”,但是它所需设备比较昂贵,耗时,且需要高水平的技术支持以及专业的操作人员;同时,由于facs对细胞刺激较大,因此对分选出的细胞活性有较大影响。磁性细胞分选(macs)用结合有抗体的免疫磁珠与样品细胞进行孵育通过磁分离纯化细胞。与facs相比,macs法是一种相对高效简便的细胞分选方法,所需设备和操作简单,对操作人员的技术要求也不高,一般实验室都可进行磁性分选。而且基本可以忽略对细胞的影响,分离得到的细胞具有较高的复苏率及细胞活性,对于下游应用影响较小,在保持细胞活性方面优于流式分选,因此具有潜在的应用前景。
2、现有的磁性激活细胞分选方法中,采用化学连接偶联方式将抗体与磁珠通过共价键连接比如美天旎公司,存在如下缺点:1、会破坏抗体的活性,不能保证抗体的空间取向,并且在捕获细胞之后磁珠无法与靶标细胞分离而去除;2、另外的一些方法比如stemcell公司通过抗体四聚体的方式标记磁珠来实现细胞分离,这种方式释放磁珠需要使用对细胞有损害的化学试剂比如dtt,且这种四聚体的方法比较复杂,代价高,对磁珠表面修饰的方式要求严苛。
3、鉴于此,本领域亟待提供新的技术解决方案,以更为高效地捕获及释放细胞,且尽可能不对细胞构成损害。
技术实现思路
1、本发明的目的在于提供一种捕获及释放靶标细胞的特异性探针、其制备方法及其应用。
2、在本发明的第一方面,提供一种分离、富集或纯化靶标细胞的方法,包括:
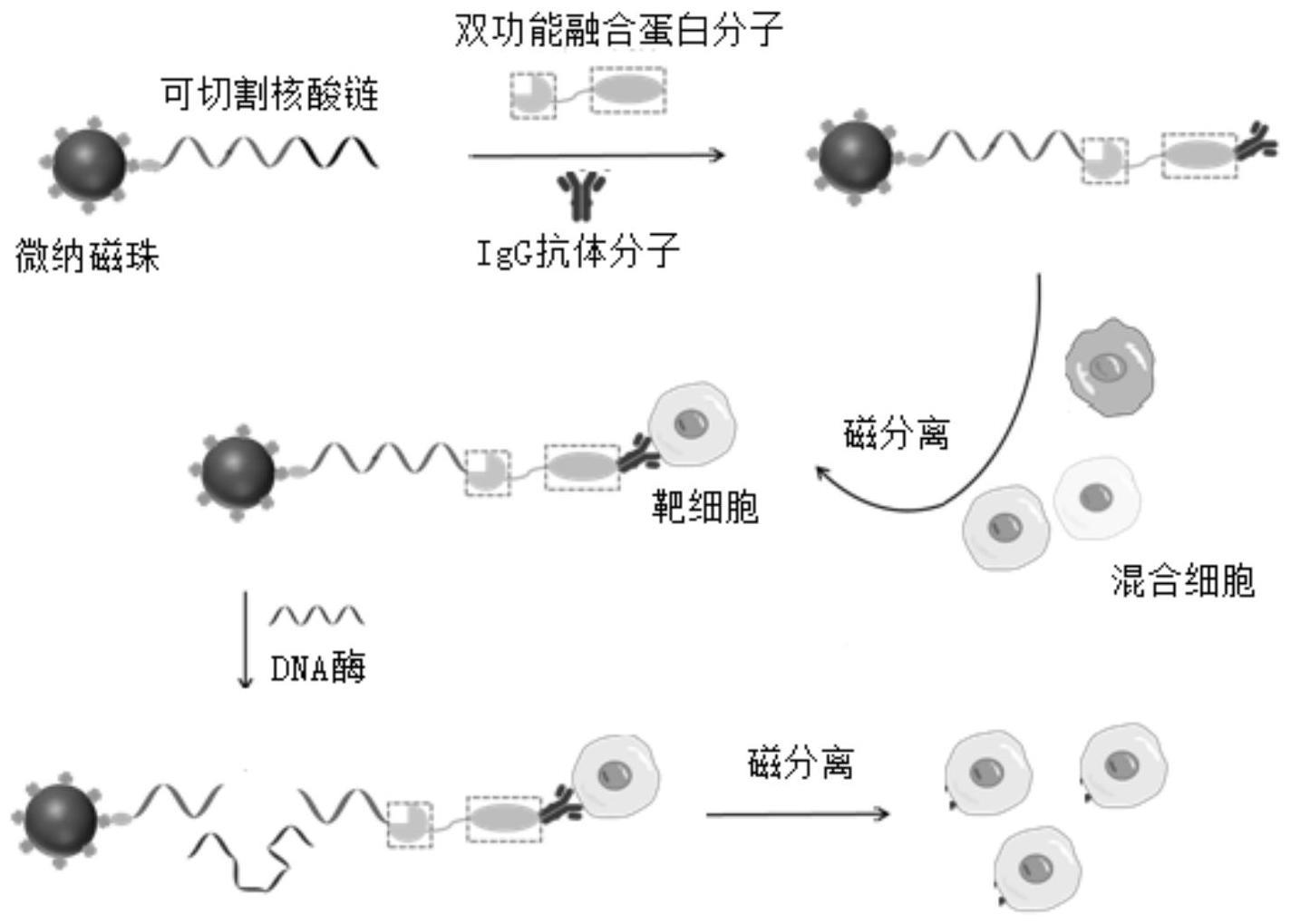
3、(1)提供特异性探针,所述探针具有式(i)结构:
4、固相载体–d–l–a(i);
5、式中,d为可切割单链核酸分子,具有核酸酶切割位点;
6、l为双功能融合蛋白,由识别且连接d的蛋白及结合a的蛋白融合而成;
7、a为所述靶标细胞的结合分子;
8、(2)将(1)的特异性探针加入到包含靶标细胞的体系中,获得含有式(ii)复合体的体系:
9、固相载体–d–l–a–靶标细胞(ii);
10、(3)从(2)的含有式(ii)复合体的体系中分离出带有固相载体的式(ii)复合体;
11、(4)以核酸酶或dna切割酶处理所述式(ii)复合体,切割d、去除固相载体,获得分离、富集或纯化的靶标细胞。
12、在一种或多种实施方式中,所述分离、富集或纯化靶标细胞包括捕获细胞及释放细胞的过程。
13、在一种或多种实施方式中,所述方法从待测样本中分离、富集或纯化靶标细胞。
14、在一种或多种实施方式中,所述可切割单链核酸分子为dna分子,或为rna分子。
15、在一种或多种实施方式中,所述l中,所述识别且连接d的蛋白与所述结合a的蛋白操作性连接。
16、在一种或多种实施方式中,所述a为能识别和结合靶标细胞的抗体;较佳地,所述a包括(但不限于)选自:igg类抗体,如人、鼠、兔或羊igg抗体。
17、在一种或多种实施方式中,所述结合a的蛋白包括(但不限于)选自:蛋白a/g(protein a/g),蛋白a(protein a),蛋白g(protein g),纳米抗体,zmab25蛋白。
18、在一种或多种实施方式中,所述识别且连接d的蛋白包括(但不限于):蛋白,所述d序列中存在蛋白识别位点。
19、在一种或多种实施方式中,所述d具有核酸酶切割位点ra(腺嘌呤核糖核苷酸,ramp)。
20、在一种或多种实施方式中,所述纳米抗体为:人、鼠、兔或羊抗人单克隆抗体片段。
21、在一种或多种实施方式中,所述蛋白识别位点包括序列:aagtattaccagaaa。
22、在一种或多种实施方式中,具有核酸酶切割位点ra(腺嘌呤核糖核苷酸,ramp)的分子例如(但不限于)seq id no:1或seq id no:2所示序列的分子。
23、在一种或多种实施方式中,所述a能结合于靶标细胞表面的抗原上。
24、在一种或多种实施方式中,所述igg抗体为人、鼠、兔或羊等的igg抗体。
25、在一种或多种实施方式中,蛋白a/g(protein a/g)为蛋白a与蛋白g的偶联物。
26、在一种或多种实施方式中,蛋白a/g(protein a/g)为蛋白a与蛋白g的融合蛋白。
27、在一种或多种实施方式中,所述固相载体包括(但不限于)选自:磁珠,微球,孔板,玻片;较佳地,所述固相载体为磁珠。
28、在一种或多种实施方式中,特异性探针加入到包含靶标细胞的体系中后,反应5~60min;较佳地反应10~50分钟。
29、在一种或多种实施方式中,分离出带有固相载体的式(ii)复合体后,还包括洗涤的步骤。
30、在一种或多种实施方式中,核酸酶或dna切割酶处理所述式(ii)复合体的体系中包括:核酸酶或dna切割酶,金属离子如mg2+;较佳地,核酸酶为0.01~50μm;较佳地,金属离子如mg2+为0.01~50mm;较佳地,核酸酶处理所述式(ii)复合体在37±5℃。
31、在一种或多种实施方式中,步骤(2)中,特异性探针加入到包含靶标细胞的体系中后,反应15~45分钟;如15、20、25、30、35、40、45分钟。
32、在一种或多种实施方式中,步骤(2)中,特异性探针加入到包含靶标细胞的体系中后,反应20~30min。
33、在一种或多种实施方式中,步骤(3)中,利用缓冲液进行所述的洗涤。
34、在一种或多种实施方式中,步骤(3)中,洗涤后,将所述式(ii)复合体加入到缓冲液。
35、在一种或多种实施方式中,所述的缓冲液为pbs缓冲液。
36、在一种或多种实施方式中,核酸酶为0.01~50μm;如0.05、0.1、0.5、0.8、1、1.5、2、3、5、10、15、20、25、30、40、45μm。
37、在一种或多种实施方式中,金属离子优选地为mg2+,其浓度0.01~50mm;如0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.5、5、10、15、20、30、40、45mm。
38、在一种或多种实施方式中,核酸酶处理所述式(ii)复合体在37±4℃,如37±3℃,37±2℃,37±1℃下进行。
39、在一种或多种实施方式中,核酸酶处理所述式(ii)复合体的孵育时间1±0.49h;如1±0.38h,1±0.26h,1±0.14h,1±0.3h,1±0.2h,1±0.1h。
40、在本发明的另一方面,提供一种用于分离、富集或纯化靶标细胞的特异性探针,所述特异性探针具有式(i)结构:
41、固相载体–d–l–a(i);
42、式中,d为可切割单链核酸分子,具有核酸酶切割位点;
43、l为双功能融合蛋白,由识别且连接d的蛋白及结合a的蛋白融合而成;
44、a为所述靶标细胞的结合分子。
45、在本发明的另一方面,提供一种制备特异性探针的方法,所述方法包括:将d、l、a与固相载体连接,形成式(i)结构的特异性探针:
46、固相载体–d–l–a(i);
47、式中,d为可切割单链核酸分子,具有核酸酶切割位点;
48、l为双功能融合蛋白,由识别且连接d的蛋白及结合a的蛋白融合而成;
49、a为所述靶标细胞的结合分子。
50、在一种或多种实施方式中,在将d、l、a与固相载体连接形成式(i)结构的特异性探针时,固相载体与d之间的连接、d与l之间的连接、l与a之间的连接不分先后。
51、在一种或多种实施方式中,所述制备特异性探针的方法包括:(a)将d与固相载体连接,形成“固相载体–d”;(b)将l与所述“固相载体–d”连接,形成“固相载体–d–l”;(c)将a与所述“固相载体–d–l”连接,获得具有式(i)结构的特异性探针。
52、在一种或多种实施方式中,所述制备特异性探针的方法包括:(a’)将l与d连接,形成“d–l”;(b’)将a与所述“d–l”连接,形成“d–l–a”;(c’)将“d–l–a”与固相载体连接,获得具有式(i)结构的特异性探针。
53、在一种或多种实施方式中,所述制备特异性探针的方法包括:(a”)将l与d连接,形成“d–l”;(b”)将固相载体与所述“d–l”连接,形成“固相载体–d–l”;(c”)将a与所述“固相载体–d–l”连接,获得具有式(i)结构的特异性探针。
54、在一种或多种实施方式中,所述制备特异性探针的方法包括:(a”’)将l与a连接,形成“l–a”;(b”’)将d与所述“l–a”连接,形成“d–l–a”;(c”’)将“d–l–a”与固相载体连接,获得具有式(i)结构的特异性探针。
55、在一种或多种实施方式中,所述制备特异性探针的方法包括:将d、l和a在混合体系中连接,之后与固相载体连接。
56、在一种或多种实施方式中,固相载体与d的连接为偶联,以偶联试剂将d与固相载体偶联,形成所述“固相载体–d”偶联物。
57、在一种或多种实施方式中,所述偶联试剂包括(但不限于)选自:edc,酶联免疫偶联分子。
58、在一种或多种实施方式中,所述酶联免疫偶联分子包括(但不限于)选自:生物素-亲和素,地高辛-抗地高辛抗体。
59、在一种或多种实施方式中,室温下偶联反应1~2h。
60、在一种或多种实施方式中,还包括:将l加入到含有所述“固相载体–d”的体系中混匀,在30~45℃(较佳地35~40℃)反应40~80min(较佳地55~65min),形成所述“固相载体–d–l”。
61、在一种或多种实施方式中,还包括:将a加入到含有所述“固相载体–d–l”的体系中混匀,在1~8℃(较佳地3~5℃)反应40~80min(较佳地55~65min),形成所述“固相载体–d–l–a”。
62、在一种或多种实施方式中,所述固相载体经过表面处理,形成适于与单链核酸分子连接的表面。
63、在一种或多种实施方式中,所述表面处理为氨基化修饰,羧基化修饰,丙烯酰基化修饰,或链霉亲和素修饰。
64、在一种或多种实施方式中,所述固相载体为磁珠,步骤(a)中,所述固相载体为磁珠,将表面羧基化的磁珠与氨基修饰的可切割单链核酸分子在pbs缓冲液中混合。
65、在一种或多种实施方式中,所述固相载体为磁珠,步骤(a)、(b)或(c)中,偶联反应/连接反应后,以磁铁吸附磁珠、pbs洗涤(1、2、3或多次)。
66、在本发明的另一方面,提供所述的特异性探针的用途,用于分离、富集或纯化靶标细胞,或用于制备分离、富集或纯化靶标细胞的试剂或试剂盒。
67、在本发明的另一方面,提供一种用于分离、富集或纯化靶标细胞的试剂盒,所述试剂盒中包括:前面所述的特异性探针。
68、在一种或多种实施方式中,所述试剂盒中还包括选自以下的试剂:
69、核酸酶(如dnazyme,较佳地为dnazyme序列17e:5’-cat ctc ttc tccgagccggtcgaa ata gtg agt-3’)或dna切割酶;所述dna切割酶包括(但不限于):单链dna内切酶,较佳地为dnase i;
70、固相载体(如磁珠,微球,孔板,玻片;优选磁珠);
71、固相载体表面处理试剂(如表面羧基化修饰试剂);
72、偶联试剂(如edc、酶联免疫偶联分子等;较佳地,所述酶联免疫偶联分子包括(但不限于):生物素-亲和素,地高辛-抗地高辛抗体);
73、缓冲液(如pbs缓冲液);
74、金属离子(如镁离子)或产生金属离子(如镁离子)的试剂。
75、本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!