一种靶向TSHR蛋白的核酸适体、核酸适体衍生物及其应用
一种靶向tshr蛋白的核酸适体、核酸适体衍生物及其应用
技术领域
1.本发明涉及分子生物学技术领域,尤其涉及一种靶向tshr蛋白的核酸适体、核酸适体衍生物及其应用。
背景技术:
2.促甲状腺素受体作为促甲状腺激素(tsh)的受体,在控制甲状腺细胞代谢中起核心作用。这种受体的活性由g蛋白介导激活腺苷酸环化酶。格雷夫斯病(gd)是一种常见的全身性自身免疫性疾病。我们现在称为gd的综合征,自从在19世纪早期的医学文献中首次被描述以来,甲状腺的增大和过度活动与眼睛周围结缔组织的炎症和膨胀之间的奇怪联系一直困扰着医学界。直到adams和purves发现长效甲状腺刺激剂,并证明其刺激甲状腺中的腺苷酸环化酶活性,才首次认识到tshr和gd之间的关系。这些抗体现在被称为促甲状腺素免疫球蛋白(tsi)。其中对tshr的免疫耐受性通过尚未确定的机制丧失。这种将tshr误认为“非我”的结果是产生了针对甲状腺上皮细胞上促甲状腺素受体的促甲状腺素免疫球蛋白。促甲状腺素免疫球蛋白直接参与了graves病的发病机制和甲状腺功能亢进,与tshr的相互作用导致不受控制的受体刺激。gd的临床标志是甲状腺的异常生长和过度活动,导致病理性的甲状腺激素水平高。这些增强了目标组织中的氧气消耗和新陈代谢。除了对甲状腺的影响之外,大约20%的真正的gd患者会出现该疾病的眼部表现,称为甲状腺相关眼病(tao)。tao代表了一个结缔组织激活和重塑的过程,这可能导致毁容和失明。在这一过程中,tsi通过甲状腺周围组织中局部表达的tshr发挥作用,与发生在眼眶内的炎症和扩张有关。已经在眼眶脂肪、眼外肌和眼眶成纤维细胞中检测到功能性tshr。因此,有强有力的证据支持tshr和tsi在gd的甲状腺过度活动和眼眶病理学中的作用。另外,已有广泛报道tshr的缺陷也是甲状腺肿瘤(乳头状癌和滤泡癌)的一个原因。(terry smith(2017):tshr as a therapeutic target in graves’disease,expert opinion on therapeutic targets,doi:10.1080/14728222.2017.1288215)
3.目前现有靶向促甲状腺素受体抗体5c9抗体k1
–
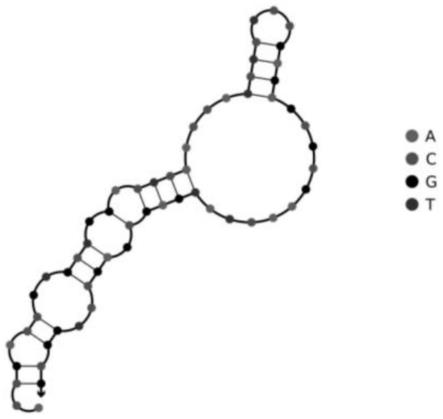
70,但具有生产成本高,周期长,批次稳定性差,免疫原性,价格昂贵的劣势;(turcuaf,kumar s,neumann s,et al.a small molecule antagonist inhibits thyrotropin receptor antibody-induced orbital fibroblast functions involved in the pathogenesis of graves ophthalmopathy.j clin endocrinol metab.2013;98(5):2153-2159.doi:10.1210/jc.2013-1149)小分子化合物ncgc00229600(antag2)/ncgc00242364(antag3)/smas37a/b,但亲和力低(微摩尔),半衰期短(<3h),生物利用率低(50%)的劣势。(marcinkowski p,hoyeri,specker e,et al.a new highly thyrotropin receptor-selective small-molecule antagonist with potential for the treatment of graves'orbitopathy.thyroid.2019;29(1):111-123.doi:10.1089/thy.2018.0349)。
4.核酸适体具有体积小、特异性强、稳定性高、免疫原性低、易于修饰、构建靶向递送等优点,具有作为靶向识别、标记蛋白的潜力。核酸适体是具有20-100个核苷酸长度的单链
dna或rna,通过指数富集(selex)方法对配体进行系统进化筛选得到,可以形成三维结构特异地结合到目标分子上。核酸适体最显著的特征如下:1)首先,适体介导的分子识别具有很高的特异性,可以用于区分细微的分子差异。对这一概念的证明是使用适体来区分三种不同但密切相关且形态相似的急性髓系白血病(aml)细胞。这种准确区分分子特征的能力,有助于阐明发病机制相关的分子基础。2)cell-selex是为了能够模拟真实环境中的活细胞而开发的,它能够为任何感兴趣的细胞生成适体,而不需要依赖其先前的分子特征知识。因此,cell-selex可用于发现以前未知的生物标志物,或其在发病机制中尚未被认识的特征;3)核酸适体易于修饰,可增强其体内稳定性;同时能偶联其他药物、分子或纳米颗粒,与细胞膜上的受体结合后,能介导自身或偶联颗粒进入细胞,可作为药物递送的理想靶向分子工具。但目前还没有促甲状腺素受体特异性核酸适体的报道。
技术实现要素:
5.本发明的目的在于提供一种靶向tshr蛋白的核酸适体、核酸适体衍生物及其应用。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了靶向tshr蛋白的核酸适体yc2,其特征在于,包含如seq id no.1所示的核苷酸序列。
8.优选的,所述靶向tshr蛋白的核酸适体yc2在22-27℃,0.5-2.0mm na
+
,0.1-1.0mm mg
2+
条件下具有茎环结构,如图1所示。
9.作为优选,在所述核酸适体yc2的基础上增加、删减或者替换碱基,获得具有相同功能的核酸适体。
10.作为优选,所述tshr蛋白属于人源性。
11.本发明还提供了一种靶向tshr蛋白的核酸适体yc2衍生物。
12.作为优选,所述核酸适体衍生物是在所述的靶向tshr蛋白的核酸适体yc2的两端或一端进行放射性标记、治疗性药物连接、荧光标记或生物素标记在内的一种或多种修饰。
13.本发明还提供了所述靶向tshr蛋白的核酸适体yc2和所述靶向tshr蛋白的核酸适体yc2衍生物在以下任一方面中的应用:
14.(1)制备tshr蛋白检测试剂;
15.(2)制备tshr靶向载体试剂;
16.(3)相对高表达tshr细胞和相对低表达tshr细胞之间的差异化研究;
17.(4)tshr蛋白活体标记研究;
18.(5)制备甲状腺相关疾病靶向载药制剂。
19.通过采用上述技术方案,本发明具有如下有益效果:本发明提供了一种靶向tshr蛋白的核酸适体,通过对所述靶向tshr蛋白的核酸适体核酸适体的性质表征和靶分子的鉴定,有助于发现格雷夫斯病(gd)的标志物之一—tshr蛋白,制备的核酸适体能特异性识别tshr蛋白以及靶向表达促甲状腺素受体的细胞,具有亲和力高、无免疫原性、序列稳定、便于保存、方便标记、分子量小等优点;核酸适体的不同部位易于修饰和取代。采用本发明的核酸适体进行tshr蛋白检测时,操作更为简单、迅速,并且本发明核酸适体的合成成本较抗体制备成本低,且周期短,重现性好,无细胞毒性,为甲状腺疾病、与甲状腺相关性眼病的诊
断和治疗提供了新思路。
附图说明
20.图1为核酸适体yc2在22-27℃,0.5-2.0mm na+,0.1-1.0mm mg
2+
条件下的结构式;
21.图2为流式检测所得核酸适体yc2与tshr-293t以及mock的结合情况(横坐标为荧光强度,纵坐标为细胞数目);
22.图3为流式检测核酸适体yc2的靶标类型初步鉴定为膜蛋白;
23.图4为aptamer-pull down证明yc2与tshr-293t细胞可能相互作用的蛋白是tshr(第一列为阳性对照组,第二列为空白组,第三列为lib组,第四列为yc2组)。
具体实施方式
24.以下的实施例便于更好的理解本发明,但并不限定于本发明。以下实施例中的实验方法如无特殊说明,均为常规方法。下属实施例中所用的实验材料如无特殊说明,均为自常规生化试剂商店购买所得到的。
25.实施例1构建tshr-293t以及mock细胞
26.在本实施例中,人胚肾细胞系(293t)购自中国武汉普诺赛生命科技有限公司。
27.(1)tshr-293t的构建
28.将人tshr过表达质粒用慢病毒转染至上述293t细胞中,得到tshr-293t。步骤如下:
29.1.含有tshr目的基因的慢病毒表达载体的构建和质粒纯化提取;
30.2.慢病毒表达载体与包装系统共转染病毒包装293t细胞;
31.3.细胞抗药性筛选。
32.(2)mock细胞的构建
33.将空载质粒用慢病毒转染至293t细胞中,得到mock细胞。
34.实施例2以cell-selex技术筛选所述核酸适体yc2
35.(1)所用dna文库和引物的设计:
36.随机单链dna文库:
[0037]5’‑
accgaccgtgctggactca(n)42actatgagcgagcctggcg-3’(n代表a、t、g、c四种任意碱基)(seq id no.2),所述序列为自定义序列,由中国上海生工随机合成。
[0038]
上游引物:5
’‑
异硫氰酸荧光素-accgaccgtgctggactca-3’(seq id no.3)
[0039]
下游引物:5
’‑
生物素-cgccaggctcgctcatagt-3’(seq id no.4)
[0040]
(2)筛选过程:
[0041]
本发明以高表达tshr的tshr-293t为正筛靶标,以不表达tshr的mock细胞为反筛靶标。
[0042]
2.1正筛选:
[0043]
a.孵育:用结合缓冲液溶解上述随机dna文库,95℃变性5min,冰上复性10min,然后与预处理好的培养48h以上细胞融合度达90%左右的tshr-293t在4℃共孵育1h。结合缓冲液的成分为:5mm mgcl2,4.5mg/ml葡萄糖,0.1mg/ml trna,1mg/ml bsa的dpbs,孵育液成分与结合缓冲液成分相同。
[0044]
b.分离:将孵育后上清移除,用洗涤缓冲液冲洗孵育后细胞数次,所述洗涤缓冲液为含浓度5mm的mgcl2,4.5mg/ml葡萄糖的dpbs溶液,随后取无菌水刮取洗涤后细胞与离心管,95℃变性10min,冰上复性10min,5500rpm离心3min,吸取上清即分离得到tshr-293t细胞的第一轮筛选核酸文库。
[0045]
c.pcr扩增文库:以步骤b中得到的文库为模板,利用步骤1中的引物进行扩增,扩增条件为:95℃,30s;55.9℃,30s;72℃,30s扩增8个循环,72℃,5min。得到初步扩增产物,而后以扩增产物为模板扩增8~12次进行大量扩增。
[0046]
pcr体系为:
[0047][0048]
d.dna单链制备:用链霉亲和素修饰的琼脂糖珠分离生物素标记的步骤c中的pcr扩增产物反义链,而后以0.2m的naoh将dna双链变性,通过脱盐收集异硫氰酸荧光素标记的正义dna单链文库。具体步骤如下:
[0049]
点振混匀链霉亲和素包被的琼脂糖凝胶球珠。分别取3个1.5ml ep tubes,各加入50ul球珠(每1ml dna需50ul球珠)。往上述含珠子的ep tubes中,每管加入pcr 1.3产物1ml。将ep管置于摩天轮上,4℃,孵育1h。
[0050]
ssdna提取—过变性柱
[0051]
取下孵育后的ep管,稍稍离心聚底,置于冰盒待用。
[0052]
将dna-球珠混合物吹打混匀后加入变性柱中,用同一ep管收集滤液,收集完全后再将滤液加入变性柱中过滤,重复3-4次,最后用5ml dpbs清洗一遍ep管,洗液过柱,以充分清洗ep管,减少dna的损失。再将10ml dpbs加入柱内中清洗珠子。
[0053]
清洗完后,用dpbs清洗柱盖,再用洗好的柱盖堵上柱子下面的流出口,往变性柱中加入约460μl 0.2mol/lnaoh,盖上柱盖,变性3min。
[0054]
变性后取出一个新的1.5ml ep管收集滤液,至无液体自然滴下,若收集的滤液不够500μl,加无菌水补至500μl。
[0055]
ssdna脱盐——过脱盐柱
[0056]
当脱盐柱内灭菌水滴至最后一滴时加入所收集的500μl ssdna滤液,当滤液液面滤至脱盐柱上膜面时,提示500μl滤液已全部进入脱盐区,此时用1个新的1.5ml ep管盛接滤液,并往柱中加入1ml无菌水,收集下滴液体,即得到1ml脱盐ssdna产物,置于冰盒中待测浓度。
[0057]
2.2反筛:将步骤d中所得到的dna单链文库与反筛细胞mock细胞在4℃进行孵育,孵育时间为30min-2h,收集孵育后上清,以排除非特异性结合的核酸分子,收集上清继续与正筛细胞孵育以进行下一筛选步骤。
[0058]
2.3筛选过程的循环:重复2.1和2.2的筛选过程,直至筛选到与靶细胞tshr-293t细胞结合较强的核酸适体文库。
[0059]
2.4高通量测序:将筛选最后一轮结合最大的核酸文库进行高通量测序,利用流式检测所得序列与tshr-293t细胞的结合能力,从而确定核酸适体。
[0060]
最终确定的核酸适体yc2的序列为:
[0061]5’‑
accgaccgtgctggactcaaccatctctccgagagcgcgaactatgagcgagcctggcg-3’(seq id no.1)。
[0062]
(3)流式检测所得核酸适体yc2与tshr-293t以及mock的结合情况
[0063]
首先,分别培养tshr-293t和mock 48h使细胞密度达90%,再分别用0.2%edta将贴壁状态的细胞从培养皿上消化下来。分别用200μl结合缓冲液配置250nm的合成好的fam标记的yc2(由上海生工生物工程公司合成),95℃变性5min,冰上复性10min。与30万个tshr-293t或mock细胞在4℃共孵育45min。使用洗涤缓冲液洗涤孵育后的细胞2-3次,而后将细胞重悬于300μl洗涤缓冲液中。通过流式细胞仪术进行荧光检测,流式细胞仪的型号为bd c6 plus,dna初始随机文库作为对照。结果如图2所示,由图2可以看出,适体yc2使正细胞荧光信号增强,但没有对于负细胞没有明显增强,说明核酸适体只结合靶细胞tshr-293t,不结合mock。
[0064]
实施例3流式检测核酸适体yc2的靶标类型初步验证
[0065]
首先,培养tshr-293t细胞48h使细胞密度达90%,再分别用0.2%edta、0.25%胰酶和100μg/ml蛋白酶k将贴壁状态的细胞从培养皿上消化下来。分别用200μl结合缓冲液配置250nm的合成好的5’端带有fam标记的yc2,95℃变性5min,冰上复性10min。与30万个不同消化方式处理的tshr-293t细胞在4℃共孵育1h。使用洗涤缓冲液洗涤孵育后的细胞2-3次,而后将细胞重悬于300μl洗涤缓冲液中。通过流式细胞仪术进行荧光检测,同样浓度梯度的dna初始随机文库作为对照。经过蛋白酶k以及胰酶处理之后yc2与靶细胞的结合荧光强度恢复到与文库相应位置,说明yc2与tshr-293t细胞膜表面上的蛋白结合,结果如图3所示。由图3可以看出,细胞由胰酶或蛋白酶k处理后,再与适体孵育,荧光信号没有明显的增强,表明适体的靶标受到了破坏;这是由于0.2%edta、胰酶和蛋白酶k处理细胞会损害细胞上的膜蛋白,因此,yc2靶标可以初步鉴定为膜蛋白。
[0066]
实施例4aptamer-pull down证明yc2与tshr-293t细胞相互作用的蛋白是tshr。
[0067]
(1)培养30个大皿的tshr-293t细胞,大皿的规格为直径10cm的培养皿,培养液为dmem+10%fbs+1%青霉素链霉素双抗,在37℃,5%co2培养箱中进行培养。
[0068]
(2)当细胞的汇集度到达80%时,用0.2%edta将细胞消化下来,然后用膜蛋白提取试剂盒(品牌:飞净,货号:ph0710)提取膜蛋白,取100μg膜蛋白与添加了20%胎牛血清和0.1mg/ml鲑鱼精子单链dna的结合缓冲液在4℃封闭1h后,将混合液一起转移到链霉素包被的琼脂糖球珠中孵育1h,离心获得上清和球珠沉淀(空白组),将上清继续和biotin-library(生物素标记的文库,由上海生工合成)孵育,然后离心获得上清和球珠沉淀(lib组);继续将上清和biotin-yc2(5’端用生物素标记的yc2核酸适体,由上海生工合成)孵育,然后离心获得球珠沉淀(yc2组)。
[0069]
(3)将空白组、lib组和yc2组球珠分别用洗涤缓冲液洗涤5遍,洗涤缓冲液为含浓度5mm的mgcl2,4.5mg/ml葡萄糖的dpbs溶液,然后加入2x loading buffer 70℃变性
10min,冰上复性10min,5000rpm离心3min,小心获得上清蛋白样品。
[0070]
(4)制备10%sds-page凝胶,上样顺序为marker,膜蛋白阳性对照,空白组,lib组,yc2组,转膜到nc膜上,用5%的脱脂牛奶封闭1h,4℃与浓度为1:1000的tshr抗体(品牌:abcam,货号:ab27974)孵育过夜。
[0071]
(5)用tbst缓冲液洗nc膜10min,共重复三次,nc膜与工作浓度为1:5000山羊抗小鼠igg第二抗体(goat anti-mouse igg second antibody)孵育1h后odyssey成像。
[0072]
结果如图4所示,在图4中,二三列没有条带,而第四列有条带,成功证明yc2能将tshr拉下来,而对照组lib不能。因此证明yc2与tshr-293t细胞相互作用的蛋白是tshr。
[0073]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1