一种用于鹅去氧胆酸合成熊去氧胆酸的重组表达质粒、重组酿酒酵母及转化方法
1.本发明属于微生物催化合成技术领域,具体涉及一种用于鹅去氧胆酸合成熊去氧胆酸的重组表达质粒、重组酿酒酵母及转化方法。
背景技术:
2.熊去氧胆酸(ursodeoxycholic acid,udca),化学名3α,7β-二羟基-5β-胆甾烷-24-酸,分子式c
24h40
o4,是名贵中药熊胆粉的主要活性成分之一,在临床上用于治疗各种胆石类和肝脏疾病,具有极高的药用价值。udca作为美国fda批准用于治疗原发性胆汁性肝硬化(pbc)的第一个一线药物,在食品和药品领域有广泛的应用。udca可以提高胆汁中胆固醇的溶解度,降低胆固醇的析出,减少胆结石的形成,具有保肝利胆的功效。随着对udca研究的逐步深入,其临床应用越来越广泛,市场需求量也不断增加。目前udca的合成方法主要包括天然的胆汁提取、传统的化学合成以及酶法合成,然而天然的胆汁提取主要包括活熊取胆或引流取胆汁,这不仅违背了2017年新修订《野生动物保护法》的宗旨,而且提取率低下且成本极高;传统的化学合成法反应条件剧烈、危险性高且污染严重,环保成本很高,与国家提倡的绿色发展的理念背道而驰,利用酶法既避免了自然界获取方法对野生动物的伤害,又解决了化学合成法高危险和高污染的难题,但是酶在体外稳定性差、活性低、分离纯化步骤复杂繁琐以及需要提供昂贵的辅因子来进行酶促反应,这都大大提高了合成udca的经济成本和时间成本,因而开发绿色环保而又高效经济的udca合成工艺具有非常重要的应用价值。
技术实现要素:
3.本发明的目的在于提供一种用于鹅去氧胆酸合成熊去氧胆酸的重组表达质粒、重组酿酒酵母及转化方法。本发明构建了重组表达质粒,质粒稳定,发酵使用的培养基简单,成本低,转入酿酒酵母后能够实现熊去氧胆酸的高效生产。
4.本发明提供了一种催化鹅去氧胆酸合成熊去氧胆酸的重组表达质粒,所述重组表达载体以双启动子载体为基础质粒,连接有e7αhsdh和rt7βhsdh两个脱氢酶的基因。
5.优选的是,所述双启动子载体包括pesc-ura。
6.本发明还提供了上述技术方案所述重组表达质粒的构建方法,包括以下步骤:
7.pcr扩增e7αhsdh基因,对扩增得到的e7αhsdh基因和双启动子载体分别进行酶切,将酶切后的e7αhsdh基因与酶切后的双启动子载体进行连接反应,得到重组质粒;
8.pcr扩增rt7βhsdh基因,对扩增得到的rt7βhsdh基因和重组质粒分别进行酶切,将酶切后的rt7βhsdh基因与酶切后的重组质粒进行连接反应,得到重组表达质粒。
9.优选的是,pcr扩增e7αhsdh基因使用的引物包括e-7α-f和e-7α-r;所述e-7α-f的核苷酸序列如seq id no.1所示,所述e-7α-r的核苷酸序列如seq id no.2所示;
10.pcr扩增rt7βhsdh基因使用的引物包括r-7β-f和r-7β-r;所述r-7β-f的核苷酸序
列如seq id no.3所示,所述r-7β-r的核苷酸序列如seq id no.4所示。
11.本发明还提供了一种催化鹅去氧胆酸合成熊去氧胆酸的重组酿酒酵母,所述重组酿酒酵母通过将上述技术方案所述重组表达质粒或上述技术方案所述构建方法得到的重组表达质粒转入酿酒酵母中构建得到。
12.优选的是,所述酿酒酵母包括酿酒酵母invsc1。
13.本发明还提供了上述技术方案所述重组表达质粒或上述技术方案所述构建方法得到的重组表达质粒或上述技术方案所述重组酿酒酵母在催化鹅去氧胆酸合成熊去氧胆酸中的应用。
14.本发明还提供了一种催化鹅去氧胆酸合成熊去氧胆酸的方法,包括以下步骤:
15.将上述技术方案所述重组酿酒酵母接种到液体培养基进行发酵培养,得到发酵培养液,将发酵培养液与鹅去氧胆酸和半乳糖混合,进行发酵转化培养,得到熊去氧胆酸。
16.优选的是,所述液体培养基包括ypd液体培养基;鹅去氧胆酸的投加量为4.0~6.0g/l;半乳糖的投加的体积百分含量为1~3%;所述发酵培养的条件包括28~30℃发酵24h;所述发酵转化培养的条件为28~30℃发酵转化72h。
17.本发明还提供了一种熊去氧胆酸的分离方法,包括以下步骤:
18.利用乙酸乙酯对上述技术方案所述方法中发酵转化培养得到的发酵液进行萃取,得到熊去氧胆酸。
19.本发明提供了一种催化鹅去氧胆酸合成熊去氧胆酸的重组表达质粒。本发明所述重组表达质粒稳定,发酵使用的培养基简单,成本低,转入酿酒酵母后能够实现熊去氧胆酸的高效生产。具体的,本发明利用分子克隆技术将e7αhsdh和rt7βhsdh两个脱氢酶的基因构建到双启动子载体(pesc-ura)上,获得重组表达质粒(peu-e7α-rt7β-hsdh)。将重组质粒peu-e7α-rt7β-hsdh转化至酿酒酵母invsc1获得重组酿酒酵母菌zl51cu,以zl51cu全细胞为催化剂将cdca转化为udca。利用乙酸乙酯从发酵液中萃取发酵产物,通过tlc和hplc分析发酵产物的转化情况。
20.试验结果表明,在底物cdca浓度为4g/l,诱导剂半乳糖浓度为2%的条件下,以含本发明重组表达质粒的酿酒酵母全细胞为催化剂使底物在ypd培养基中转化3d,cdca的转化率可以高达94.9%,udca的收率为83.0%;本发明发酵使用的培养基简单,恒温进行反应即可,且无需离心收集细胞,直接对发酵转化得到的发酵液进行萃取即可得到高纯度熊去氧胆酸,此外,本发明无需添加昂贵的辅因子,经济成本低,本发明为合成udca提供了一种全新的方法,对今后的工业应用具有非常大的借鉴意义。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
22.图1为本发明提供的7αhsdh和7βhsdh双酶催化的级联反应图;
23.图2为本发明提供的peu-e7α-rt7β-hsdh重组质粒的构建示意图;
24.图3为本发明提供的peu-e7α-rt7β-hsdh重组质粒的酶切验证结果图;其中,左图
为将e7αhsdh基因整合在pesc-ura载体获得的单基因质粒的酶切验证结果图,左图中,m:generuler
tm 1kb dnaladder;1-4:peu-e7α-hsdh;右图为将rt7βhsdh基因整合在peu-e7α-hsdh载体获得双基因质粒的酶切验证结果图,右图中,m:generuler
tm 1kb dnaladder;1-3:peu-e7α-rt7β-hsdh;
25.图4为本发明提供的酿酒酵母重组菌zl51cu中e7αhsdh(左图)与rt7βhsdh(右图)基因的pcr验证结果图;其中,左图中,m:generuler
tm 1kb dna ladder;b:invsci-pesc-ura提供模板,作为对照;1-6:invsci-peu-e7α-rt7β-hsdh提供模板,验证e7αhsdh目的基因;右图中,m:generuler
tm 1kb dnaladder;b:invsci-pesc-ura提供模板,作为对照;c:invsci-peu-e7α-hsdh提供模板,作为对照;1-6:invsci-peu-e7α-rt7β-hsdh提供模板,验证rt7βhsdh目的基因;
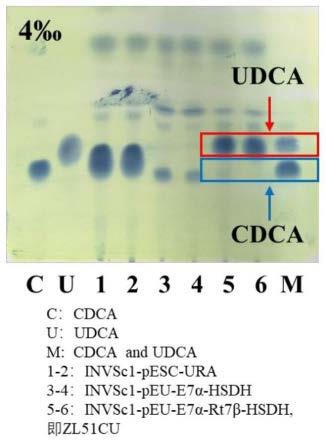
26.图5为本发明提供的cdca合成udca的tlc分析结果图;其中,c:cdca;u:udca;m:cdca和udca;1-2:invsc1-pesc-ura;3-4:invsc1-peu-e7α-hsdh;5-6:invsc1-peu-e7α-rt7β-hsdh;即重组菌zl51cu;
27.图6为本发明提供的cdca合成udca的hplc分析结果图。
具体实施方式
28.本发明提供了一种催化鹅去氧胆酸合成熊去氧胆酸的重组表达质粒,所述重组表达载体以双启动子载体为基础质粒,连接有e7αhsdh和rt7βhsdh两个脱氢酶的基因。在本发明中,所述双启动子载体优选包括pesc-ura。本发明所述的e7αhsdh和rt7βhsdh的基因优选分别来源于e.coli mg1655和ruminococcus torques。本发明e7αhsdh的氨基酸序列如seq id no.5所示,其相应核苷酸序列如seq id no.6所示。本发明rt7βhsdh的氨基酸序列如seq id no.7所示,其相应核苷酸序列如seq id no.8所示。本发明对pesc-ura双启动子载体的来源没有特殊限定,采用常规市售产品即可,如购自上海百风生物科技有限公司,本发明优选使用保存于天津科技大学化工与材料学院甾体微生物转化研究室的pesc-ura双启动子载体。
29.本发明7αhsdh和7βhsdh双酶催化的级联反应如图1所示。
30.本发明还提供了上述技术方案所述重组表达质粒的构建方法,包括以下步骤:
31.pcr扩增e7αhsdh基因,对扩增得到的e7αhsdh基因和双启动子载体(pesc-ura)分别进行酶切,将酶切后的e7αhsdh基因与酶切后的双启动子载体进行连接反应,得到重组质粒(peu-e7α-hsdh);
32.pcr扩增rt7βhsdh基因,对扩增得到的rt7βhsdh基因和重组质粒(peu-e7α-hsdh)分别进行酶切,将酶切后的rt7βhsdh基因与酶切后的重组质粒进行连接反应,得到重组表达质粒(peu-e7α-rt7β-hsdh)。
33.在本发明中,pcr扩增e7αhsdh基因使用的引物优选包括e-7α-f和e-7α-r;所述e-7α-f的核苷酸序列如seq id no.1所示,所述e-7α-r的核苷酸序列如seq id no.2所示;
34.pcr扩增rt7βhsdh基因使用的引物优选包括r-7β-f和r-7β-r;所述r-7β-f的核苷酸序列如seq id no.3所示,所述r-7β-r的核苷酸序列如seq id no.4所示。
35.本发明对pcr扩增的条件没有特殊限定,采用本领域技术人员熟知的常规pcr扩增条件即可。本发明对酶切和连接反应的条件没有特殊限定,采用本领域技术人员熟知的常
规酶切、连接反应条件即可。
36.本发明构建了双基因单质粒,质粒稳定,发酵使用的培养基简单,成本低。
37.本发明还提供了一种催化鹅去氧胆酸合成熊去氧胆酸的重组酿酒酵母,所述重组酿酒酵母通过将上述技术方案所述重组表达质粒或上述技术方案所述构建方法得到的重组表达质粒转入酿酒酵母中构建得到。本发明直接利用异源表达双脱氢酶的重组酿酒酵母菌体作为细胞催化剂,将底物cdca和诱导剂半乳糖直接投入含有重组酿酒酵母菌体的ypd培养基中,便可将cdca转化为udca。
38.在本发明中,所述酿酒酵母包括酿酒酵母invsc1。本发明对酿酒酵母(saccharomyces cerevisiae invsc1)的来源没有特殊限定,采用常规市售产品即可,本发明优选使用保存于天津科技大学微生物菌种保藏中心的酿酒酵母invsc1。
39.本发明还提供了上述技术方案所述重组表达质粒或上述技术方案所述构建方法得到的重组表达质粒或上述技术方案所述重组酿酒酵母在催化鹅去氧胆酸合成熊去氧胆酸中的应用。
40.本发明还提供了一种催化鹅去氧胆酸合成熊去氧胆酸的方法,包括以下步骤:
41.将上述技术方案所述重组酿酒酵母接种到液体培养基进行发酵培养,得到发酵培养液,将发酵培养液与鹅去氧胆酸和半乳糖混合,进行发酵转化培养,得到熊去氧胆酸。
42.即本发明于液体培养基和半乳糖的混合底料中利用重组酿酒酵母催化鹅去氧胆酸反应合成熊去氧胆酸。
43.在本发明中,重组酿酒酵母在液体培养基中的接种量优选为1~3%,更优选为2%。在本发明中,所述液体培养基优选包括ypd液体培养基。在本发明中,鹅去氧胆酸的投加量优选为4.0~6.0g/l,更优选为4.0g/l。在本发明中,半乳糖的投加的体积百分含量优选为1~3%,更优选为2%。在本发明中,所述发酵培养的条件优选包括28~30℃℃发酵24h,更优选为28℃发酵24h。在本发明中,所述发酵转化培养的条件优选为28~30℃发酵转化72h,更优选为28℃发酵72h。
44.本发明还提供了一种熊去氧胆酸的分离方法,包括以下步骤:
45.利用乙酸乙酯对上述技术方案所述方法中发酵转化培养得到的发酵液进行萃取,得到熊去氧胆酸。在本发明中,所述萃取过程中,萃取1ml发酵液需乙酸乙酯的量优选为400μl。
46.本发明依靠微生物(重组酿酒酵母)发酵产生的脱氢酶7α-hydroxysteroid dehydrogenases(7αhsdh)和7β-hydroxysteroid dehydrogenases(7βhsdh)催化底物鹅去氧胆酸(cdca)合成udca(即直接利用酿酒酵母全细胞为催化剂),本发明将底物投入培养基中,加入诱导剂(半乳糖),使细胞一直处于活菌状态,不需添加昂贵的辅因子((nad(p)
+
和nad(p)h)),直接利用酿酒酵母细胞产生辅因子即可满足转化的需要,也不需要收集细胞置于pbs中进行转化,操作简单。本发明避免了纯化蛋白的繁琐步骤,直接萃取获得重组酿酒酵母全细胞催化剂,大大降低了工业生产的应用成本,同时发酵过程操作简单安全。
47.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种用于鹅去氧胆酸合成熊去氧胆酸的重组表达质粒、重组酿酒酵母及转化方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
48.本发明中涉及菌株及载体:酿酒酵母(saccharomyces cerevisiae invsc1),
e.coli mg1655,天津科技大学微生物菌种保藏中心;pesc-ura双启动子载体,天津科技大学化工与材料学院甾体微生物转化研究室。
49.实施例1
50.peu-e7α-rt7β-hsdh重组质粒的构建
51.1.pcr扩增目的片段:
52.从-80℃冰箱取出e.coli mg1655甘油菌,按体积百分含量为1%的接种量转接到5ml的lb培养基中,37℃,200rpm/min过夜培养,收集1ml的菌体,然后利用ezup柱式细菌基因组dna抽提试剂盒提取基因组(生工生物工程(上海)股份有限公司),结束后通过琼脂糖凝胶验证,成功抽提出e.coli mg1655基因组。
53.以e.coli mg1655基因组为模板,pcr扩增目的基因e7αhsdh,引物由北京六合华大基因科技有限公司进行合成。
54.e-7α-f:cgcggatccatgtttaattctgacaacctga(seq id no.1)
55.e-7α-r:cggggtaccttaattgagctcctgtaccc(seq id no.2)
56.r-7β-f:ggaattc atgaacttaagagaaaaatacggtgag(seq id no.3)
57.r-7β-r:
58.ataagaatgcggccgccttactatcttcaacaaactcatgaacacg(seq id no.4)
59.(1)pcr反应体系(25μl):
[0060][0061]
(2)pcr反应条件:
[0062][0063]
pcr扩增目的片段经琼脂糖凝胶电泳验证正确,而且特异性高,几乎没有杂带,然后利用纯化试剂盒纯化,保存-20℃冰箱,用于后续实验。
[0064]
1.双酶切制备载体骨架:
[0065]
酶切体系:(50μl)
solution 3混合而成。
[0080]
solution1:称取1.211g tris,0.37g edta,超纯水定容至100ml,hcl调节ph至7.5,121℃,灭菌20min。
[0081]
solution2:称取10.202g liac,超纯水定容至100ml,用醋酸调节ph至7.5,121℃灭菌20min。
[0082]
solution3:50%peg3350:称取peg3350 50g定容至100ml的超纯水中,过膜除菌。
[0083]
(2)从28℃恒温培养箱中取出步骤(1)静置培养后的ep管,加入88μl的dmso,用移液枪缓慢吹吸混匀后将ep管放入42℃恒温水浴锅中保持7min,14000rpm/min离心10s后弃去上清;
[0084]
(3)1ml预冷的1
×
te溶液重悬步骤(2)弃去上清后得到的酵母菌体沉淀,混合均匀后再次离心,弃上清,保留约100μl液体,轻柔吹吸混合均匀,均匀涂布于sc平板上,在28℃恒温培养箱中静置培养2~3d,待长出转化子即可。
[0085]
酿酒酵母基因提取及pcr验证:
[0086]
a.从sc平板上挑取若干个转化子接种于ypd平板上,放置28℃恒温培养箱培养1~2d,再从若干ypd平板上各自挑取单菌落转接到5ml ypd试管中,28℃,200r/min,振荡培养24h。取1.5ml培养液于2ml的离心管中,14000r/min,离心5min,去上清,取沉淀,重复此步骤一次后加入200μl裂解液,振荡涡旋,混匀菌液。
[0087]
b.向离心管中加入适量的石英砂,使菌液呈现一种似干非干的状态,在旋涡振荡仪上振荡30min后加入200μl裂解液和5μlrna酶,振荡仪上振荡均匀,静置5min,14000r/min,离心12min。
[0088]
c.吸取上清于新的2ml的离心管中,加入等体积的氯仿与平衡酚,剧烈振荡均匀,14000r/min,离心10min,重复此步骤一次。
[0089]
d.取上清于新的2ml的离心管中,加入等体积的氯仿,剧烈摇匀,14000rpm/min,离心10min。取上清于新的2ml离心管中,加入2倍体积的无水乙醇,-20℃静置6min后,14000rpm/min,离心5min后弃沉淀。
[0090]
e.用1ml 70%乙醇洗涤沉淀后14000rpm/min离心2min,弃去上清,再离心30s,再弃上清,于通风橱晾10min,加入25-30μl ddh2o混合均匀,置于-20℃保存。
[0091]
f.取步骤e-20℃保存的酿酒酵母基因1μl,利用实施例1中pcr扩增目的片段所用的引物做pcr验证,pcr体系和程序如下:
[0092]
pcr体系(10μl):
[0093][0094][0095]
pcr扩增程序:
[0096][0097]
g.琼脂糖凝胶电泳验证正确的pcr产物(见图4)进一步送华大基因测序,测序正确的重组菌即为zl51cu的酿酒酵母重组菌,保菌于-70℃保存。
[0098]
图4左图:以挑取酿酒酵母重组菌的6个转化子基因为pcr模板,使用扩增e7αhsdh的引物进行扩增均有目的条带(e7αhsdh基因)出现,同时以invsc1-pesc-ura(b)为模板作为阴性对照无目标条带,表明重组菌具有e7αhsdh基因。同理,右图以挑取的6个酿酒酵母重组菌转化子基因为pcr模板,使用扩增rt7βhsdh基因的引物进行扩增均有目的条带(rt7βhsdh基因)出现,以invsc1-pesc-ura为模板(b)和invsc1-peu-e7α-hsdh(c)转化子基因作为阴性对照无目标条带,表明重组菌具有rt7βhsdh基因。
[0099]
图4标注为用作pcr扩增模板的重组酿酒酵母菌,扩增条带的位置表明对应验证目标基因的大小。b和c均为阴性对照,应无目标条带产生。b即为invsc1-pesc-ura空菌,c为前述构建的含有e7αhsdh基因的invsc1-peu-e7α-hsdh重组菌。
[0100]
实施例3
[0101]
zl51cu酿酒酵母重组菌的发酵转化分析
[0102]
(1)tlc分析发酵转化产物
[0103]
从invsc1-pesc-ura(空白对照菌),invsc1-peu-e7α-hsdh(单基因对照菌),zl51cu酿酒酵母重组菌的ypd平板上挑取适量菌体接种于50ml的ypd液体培养基中,利用250ml摇瓶于28℃摇床发酵培养24h后,投入cdca(浓度为4.0g/l,此浓度为相对于培养基的浓度)和半乳糖(浓度为2%,此浓度也为相对于培养基的浓度)继续发酵转化72h后取样1ml,用400μl乙酸乙酯萃取上清液,采取tlc对产物进行定性分析,结果如图5所示,空白对照菌invsc1-pesc-ura作为催化剂既没有消耗底物cdca,也没有合成产物udca;单基因对照菌invsc1-peu-e7α-hsdh作为催化剂虽然转化cdca,但是没有合成产物udca,酿酒酵母重组菌zl51cu作为催化剂几乎全部将cdca转化为udca。
[0104]
图5中的4
‰
指的是该次发酵的投料量为4g/l的cdca,图5中的1和2表示含有空载pesc-ura的酿酒酵母发酵结果,3和4表示含有peu-e7α-hsdh重组质粒酿酒酵母的发酵结果,5和6表示含有双基因重组质粒的酿酒酵母重组菌zl51cu的发酵结果。c代表cdca标品,u代表udca标品,m代表cdca和udca的混合标品,5和6上面圈出的条带强调指发酵结果中底物cdca和产物udca的相应位置。
[0105]
(2)hplc-elsd分析发酵转化产物
[0106]
取1ml重组酿酒酵母zl51cu的发酵液,加入400μl乙酸乙酯萃取后吸取100μl上清液于干净的ep管中晾干,100μl甲醇重悬后过0.22μm的有机膜制备样品,利用hplc-elsd分析合成产物,液相检测条件如下:
[0107]
色谱柱:c18色谱柱(4.6mm dl
×
250lmm,5μm)
[0108]
进样量:10μl;
[0109]
流动相及洗脱条件如表1所示:
[0110]
表1流动相及洗脱条件
[0111][0112]
流速:0.8ml/min;柱温:30℃;蒸发温度:110℃;气体流速:2.0l/min。
[0113]
检测结果分析:
[0114]
由液相结果(图6)分析可知:酿酒酵母重组菌zl51cu催化cdca的转化率为94.9%,udca的收率为83.0%。
[0115]
注:图(a)底物cdca标品,图(b)产物udca标品,图(c)中间产物7-酮-石胆酸(7k-lca)标品,图(d)zl51cu酿酒酵母重组菌发酵产物。
[0116]
转化率=(udca峰面积+7k-lca峰面积)/(cdca峰面积+udca峰面积+7k-lca峰面积)
[0117]
产率=udca峰面积/(cdca峰面积+udca峰面积+7k-lca峰面积)。
[0118]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1