抗PD-L1的抗体及其应用
抗pd-l1的抗体及其应用
技术领域
1.本发明涉及抗体领域,具体而言,涉及抗pd-l1的抗体及其应用。
背景技术:
2.t细胞介导的细胞免疫在识别和杀伤肿瘤细胞中起着重要的作用,t细胞通过t细胞受体(t cell receptor,tcr)与肿瘤细胞表面的带有特异性抗原的主要组织相容性复合体(major histocompatibility complex,mhc)结合,从而识别肿瘤细胞。tcr和mhc分子的相互作用受到一系列免疫检查点的控制,其中有共刺激信号和共抑制信号,可以使t细胞激活或抑制。其中pd-1和其配体pd-l1通路是抑制性免疫检查点,它们结合后传达出一种共抑制性信号,可以使t细胞的免疫活性受到抑制,在免疫耐受中发挥重要作用,同时也是肿瘤细胞免疫逃逸的重要原因。
3.程序性死亡受体-1(programmed death-1,pd-1)是cd28超家族成员的ⅰ型跨膜蛋白,是由活化的t细胞和b细胞表达的关键免疫检查点受体,在正常机体中,pd-1作为一种t细胞增殖的负调节分子,对维持机体的免疫耐受有重要作用。
4.细胞程式死亡配体1(programmed cell death 1ligand 1,pd-l1)也称为表面抗原分化簇274(cluster of differentiation 274,cd274)或b7同源体(b7 homolog 1,b7-h1),是人类体内的一种蛋白质,由cd274基因编码是一种40kda的i型跨膜蛋白。pd-l1是pd-1的表面糖蛋白配体,pd-1是由活化的t细胞和b细胞表达的关键免疫检查点受体,并介导免疫抑制。pd-l1与慢性感染、妊娠、同种异体移植、自身免疫性疾病和癌症期间的免疫系统反应的抑制有关。在抗原呈递细胞和人类癌细胞,例如头颈部鳞状细胞癌、黑色素瘤和脑瘤、甲状腺、胸腺、食道、肺、乳腺、胃肠道、结肠直肠、肝脏、胰腺、肾脏、肾上腺皮质、膀胱、尿路上皮、卵巢和皮肤上,都发现了pd-l1。pd-l1与其t细胞上的受体pd-1相互作用,在免疫应答的负性调控方面发挥着重要作用;许多研究均表明其与肿瘤的免疫逃逸机制相关。肿瘤部分的微环境可诱导肿瘤细胞上的pd-l1的表达,表达的pd-l1有利于肿瘤的发生和生长,诱导抗肿瘤t细胞的凋亡。pd-1与pd-l1结合后,传递抑制性信号,能够抑制淋巴细胞的增殖和活性、抑制cd4+t细胞向th1和th17细胞分化、抑制炎性细胞因子的释放,这些都起到了免疫负调控的作用。在正常情况下,pdl-1和pd-1的结合能够通过上述的作用,维持外周淋巴细胞对自身抗原的免疫耐受,从而防止自身免疫性疾病的发生。但在肿瘤的发生发展中,肿瘤细胞表达的pd-l1与pd-1结合后却能通过对淋巴细胞的抑制性作用,从而促进肿瘤的免疫逃逸。
5.因此,研发特异性强、亲和力高的抗pd-l1抗体,将为多种癌症的治疗提供可能,具有巨大的应用潜力和市场价值。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供抗pd-l1的抗体及其应用。
8.本发明是这样实现的:
9.第一方面,本发明实施例提供了一种抗体或其抗原结合片段,所述抗体或其抗原结合片段包括重链可变区和轻链可变区,所述重链可变区和轻链可变区包括(1)~(14)任一项所示的cdrs。(1)氨基酸序列依次如seq id no.1~3所示的hcdr1~3,氨基酸序列依次如seq id no.4~6所示的lcdr1~3;(2)氨基酸序列依次如seq id no.1、9和10所示的hcdr1~3,氨基酸序列依次如seq id no.4~6所示的lcdr1~3;(3)氨基酸序列依次如seq id no.1、13和13所示的hcdr1~3,氨基酸序列依次如seq id no.15、5和16所示的lcdr1~3;(4)氨基酸序列依次如seq id no.19、20和21所示的hcdr1~3,氨基酸序列依次如seq id no.22、5和6所示的lcdr1~3;(5)氨基酸序列依次如seq id no.25~27所示的hcdr1~3,氨基酸序列依次如seq id no.28、5和29所示的lcdr1~3;(6)氨基酸序列依次如seq id no.32、26和27所示的hcdr1~3,氨基酸序列依次如seq id no.33~35所示的lcdr1~3;(7)氨基酸序列依次如seq id no.38~40所示的hcdr1~3,氨基酸序列依次如seq id no.41~43所示的lcdr1~3;(8)氨基酸序列依次如seq id no.46~48所示的hcdr1~3,氨基酸序列依次如seq id no.41、49和50所示的lcdr1~3;(9)氨基酸序列依次如seq id no.53~55所示的hcdr1~3,氨基酸序列依次如seq id no.56~58所示的lcdr1~3;(10)氨基酸序列依次如seq id no.61~63所示的hcdr1~3,氨基酸序列依次如seq id no.64~66所示的lcdr1~3;(11)氨基酸序列依次如seq id no.69~71所示的hcdr1~3,氨基酸序列依次如seq id no.72、5和73所示的lcdr1~3;(12)氨基酸序列依次如seq id no.76~78所示的hcdr1~3,氨基酸序列依次如seq id no.79~81所示的lcdr1~3;(13)氨基酸序列依次如seq id no.84~86所示的hcdr1~3,氨基酸序列依次如seq id no.87、42和50所示的lcdr1~3;(14)氨基酸序列依次如seq id no.1、90和91所示的hcdr1~3,氨基酸序列依次如seq id no.92、5和6所示的lcdr1~3。
10.第二方面,本发明实施例提供了一种抗体偶联物,其包括:前述实施例所述的抗体或其抗原结合片段。
11.第三方面,本发明实施例提供了如前述实施例所述的抗体或其抗原结合片段在制备pd-l1抗原的检测产品中的应用。
12.第四方面,本发明实施例提供了如前述实施例所述的抗体或其抗原结合片段在制备用于靶向pd-l1来诊断、预防或治疗疾病的产品中的应用。
13.第五方面,本发明实施例提供了一种试剂或试剂盒,其包括如前述实施例所述的抗体或其抗原结合片段。
14.第六方面,本发明实施例提供了一种分离的核酸,其编码如前述实施例所述的抗体或其抗原结合片段。
15.第七方面,本发明实施例提供了一种载体,其含有前述实施例所述的分离的核酸。
16.第八方面,本发明实施例提供了一种细胞,其含有前述实施例所述的载体。
17.第九方面,本发明实施例提供了一种药物或药物组合物,其有效成分包括如前述实施例所述的抗体或其抗原结合片段、如前述实施例所述的抗体偶联物、如前述实施例所示的试剂或试剂盒、如前述实施例所述的分离的核酸、如前述实施例所述的载体和如前述实施例所述的细胞中的至少一种。
18.本发明具有以下有益效果:
19.本发明提供的抗体或其抗原结合片段能与激活的t细胞和dc细胞结合,并且能够十分有效地阻断pd-l1与pd-1之间的结合;
20.本发明提供的抗pd-l1抗体能有效抑制局部肿瘤生长;阻断pd-1/pd-l1信号可以促进肿瘤抗原特异性t细胞的增殖,发挥杀伤肿瘤细胞的作用;阻断肿瘤细胞上相关pd-l1信号可上调浸润cd8
+
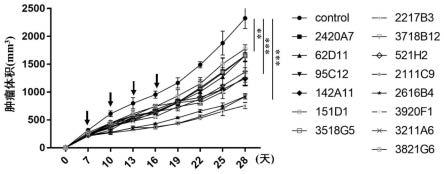
t细胞ifn-γ的分泌,表明pd-1/pd-l1信号通路的阻断在以诱导免疫应答为目的的肿瘤免疫应答中发挥作用;选择抗pd-l1抗体配合肿瘤疫苗进行肿瘤免疫治疗可有效加强肿瘤疫苗的免疫激活。目前,抗pd-1/pd-l1治疗以其良好的疗效和安全性走在了免疫治疗的前列,成为近两年肺癌治疗领域的热门靶点。
21.本发明并对其进行了单链抗体(scfv)和双特异性抗体(pd-l1-cd3)的构建,同时通过体外杀伤实验,验证了本发明pd-l1-cd3双特异性抗体的抗肿瘤作用,结果表明,pd-l1-cd3双特异性抗体对hela-pd-l1肿瘤细胞具有显著的杀伤效应。本发明可应用于制备预防、诊断和治疗人类肿瘤的药物。
附图说明
22.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
23.图1为免疫荧光分析重组嵌合抗体2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6对细胞过表达的pd-l1分子的结合结果;
24.图2为pd-l1单克隆抗体阻断pd-1与pd-l1的结合的部分代表性结果;
25.图3为2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6分别与cd3scfv串联的双特异性抗体的体外杀伤肿瘤结果;
26.图4为使用nsg鼠模型评价2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6分别与cd3scfv串联的双特异性抗体的体内抗肿瘤分析结果。
具体实施方式
27.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
28.首先,本发明实施例提供了一种抗体或其抗原结合片段,所述抗体或其抗原结合片段包括重链可变区和轻链可变区,所述重链可变区和轻链可变区包括(1)~(14)任一项所示的cdrs。
29.(1)氨基酸序列依次如seq id no.1~3所示的hcdr1~3,氨基酸序列依次如seq id no.4~6所示的lcdr1~3;(2)氨基酸序列依次如seq id no.1、9和10所示的hcdr1~3,
氨基酸序列依次如seq id no.4~6所示的lcdr1~3;(3)氨基酸序列依次如seq id no.1、13和13所示的hcdr1~3,氨基酸序列依次如seq id no.15、5和16所示的lcdr1~3;(4)氨基酸序列依次如seq id no.19、20和21所示的hcdr1~3,氨基酸序列依次如seq id no.22、5和6所示的lcdr1~3;(5)氨基酸序列依次如seq id no.25~27所示的hcdr1~3,氨基酸序列依次如seq id no.28、5和29所示的lcdr1~3;(6)氨基酸序列依次如seq id no.32、26和27所示的hcdr1~3,氨基酸序列依次如seq id no.33~35所示的lcdr1~3;(7)氨基酸序列依次如seq id no.38~40所示的hcdr1~3,氨基酸序列依次如seq id no.41~43所示的lcdr1~3;(8)氨基酸序列依次如seq id no.46~48所示的hcdr1~3,氨基酸序列依次如seq id no.41、49和50所示的lcdr1~3;(9)氨基酸序列依次如seq id no.53~55所示的hcdr1~3,氨基酸序列依次如seq id no.56~58所示的lcdr1~3;(10)氨基酸序列依次如seq id no.61~63所示的hcdr1~3,氨基酸序列依次如seq id no.64~66所示的lcdr1~3;(11)氨基酸序列依次如seq id no.69~71所示的hcdr1~3,氨基酸序列依次如seq id no.72、5和73所示的lcdr1~3;(12)氨基酸序列依次如seq id no.76~78所示的hcdr1~3,氨基酸序列依次如seq id no.79~81所示的lcdr1~3;(13)氨基酸序列依次如seq id no.84~86所示的hcdr1~3,氨基酸序列依次如seq id no.87、42和50所示的lcdr1~3;(14)氨基酸序列依次如seq id no.1、90和91所示的hcdr1~3,氨基酸序列依次如seq id no.92、5和6所示的lcdr1~3。
30.在本发明中,术语“抗体”涵盖各种抗体结构,包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如双特异性抗体、三特异性抗体、四特异性抗体等等),鼠源抗体,嵌合抗体,全长抗体等,只要它们展示出所期望的抗原结合活性。
31.本发明所述的“嵌合抗体”是将鼠源性抗体的可变区与人抗体的恒定区融合而成的抗体,可以减轻鼠源性抗体诱发的免疫应答反应。建立嵌合抗体,要先建立分泌鼠源性特异性单抗的杂交瘤,然后从小鼠杂交瘤细胞中克隆可变区基因,再根据需要克隆人抗体的恒定区基因,将小鼠可变区基因与人恒定区基因连接成嵌合基因后插入人载体中,最后在真核工业系统或原核工业系统中表达嵌合抗体分子。
32.在本发明中,术语“互补性决定区”、“cdr”或“cdrs”是指免疫球蛋白的重链和轻链的高度可变区,其是抗体可变结构域内主要促成与抗原特异性结合的区域。在本发明具体实施方式中,cdrs是指所述抗体的重链和轻链中2个以上高度可变区。
33.在本发明中,重链互补决定区用hcdr表示,重链可变区中含有的3个cdr区:hcdr1、hcdr2和hcdr3;轻链互补决定区用lcdr表示,轻链可变区中含有的3个cdr区:lcdr1、lcdr2和lcdr3。
34.在一些实施例中,所述抗体或其抗原结合片段的抗原包括pd-l1。
35.在一些实施例中,所述轻链可变区和重链可变区还包括骨架区。
36.在本发明中,“骨架区”或“fr”区是指抗体重链可变区和轻链可变区中除cdr之外的区域;重链骨架区可以被进一步细分成被cdrs分隔开的毗邻区域(fr1、fr2、fr3和fr4),其中,重链骨架区可以被进一步细分成被cdr分隔开的毗邻区域,包含hfr1、hfr2、hfr3和hfr4骨架区;轻链骨架区可以被进一步细分成被lcdr分隔开的毗邻区域,包含lfr1、lfr2、lfr3和lfr4骨架区。重链可变区由以下编号的cdr与fr(从氨基末端排到羧基末端)排列连接获得:hfr1-hcdr1-hfr2-hcdr2-hfr3-hcdr3-hfr4;轻链可变区由以下编号的cdr与fr(从
氨基末端排到羧基末端)排列连接获得:lfr1-lcdr1-lfr2-lcdr2-lfr3-lcdr3-lfr4。
37.在一些实施例中,所述重链可变区和轻链可变区如(a)~(n)任一项所示:
38.(a)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.7~8所示;(b)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.11~12所示;(c)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.17~18所示;(d)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.23~24所示;(e)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.30~31所示;(f)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.36~37所示;(g)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.44~45所示;(h)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.51~52所示;(i)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.59~60所示;(j)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.67~68所示;(k)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.74~75所示;(l)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.82~83所示;(m)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.88~89所示;(n)所述重链可变区和轻链可变区的氨基酸序列依次如seq id no.93~94所示。
39.需要说明的是,(1)~(14)所示的cdrs依次与(a)~(n)一一对应。
40.在一些实施例中,所述抗体或其抗原结合片段还包括恒定区。可选地,所述恒定区包括重链恒定区和/或轻链恒定区。全长抗体的轻链包括轻链可变区结构域vl及恒定区结构域cl,vl处于轻链的氨基末端,cl结构域处于羧基末端,轻链包括κ链及λ链;全长抗体重链包括重可变区结构域vh及恒定区ch,vh处于重链的氨基末端,ch结构域处于羧基末端。
41.在一些实施例中,所述恒定区选自igg1、igg2、igg3、igg4、iga、igm、ige和igd中的任意一者的恒定区。
42.在一些实施例中,所述恒定区的种属来源为牛、马、猪、羊、大鼠、小鼠、狗、猫、兔、驴、鹿、貂、鸡、鸭、鹅或人。
43.在一些实施例中,所述抗原结合片段选自抗体的f(ab’)2、fab’、fab、fv和scfv(单链抗体)中的任意一种。“抗原结合片段”是完整抗体的部分,所述部分与完整抗体所结合的抗原特异性结合。本领域技术人员根据本发明记载的内容容易理解到,抗原结合片段可以通过本领域已知方法制备获得,例如,酶消化的方法(包括胃蛋白酶或木瓜蛋白酶)和/或通过化学还原分裂二硫键的方法获得,还可以通过重组遗传学技术或通过自动肽合成仪(如applied biosystems的自动肽合成仪)合成获得。
44.其中,单链抗体的结构表示式为:vh-(g4s)3-vl-huigg1fc,其中,vh为重链可变区,vl为轻链可变区,(g4s)3为肽接头,huigg1fc为人igg1抗体的恒定区。
45.所述双特异性抗体(pd-l1-cd3)的结构表示式为:vl1-(g4s)3-vh1-g4s-vh2-(g4s)
3-vl2;其中,vh1为pd-l1重链可变区,vl1为抗pd-l1抗体的轻链可变区,vh2为抗cd3抗体的重链可变区,vl2为抗cd3抗体的轻链可变区,g4s和(g4s)3为肽接头,vh2-(g4s)3-vl2为cd3 scfv,其采用的是okt3的氨基酸序列(如下所示):
46.diklqqsgaelarpgasvkmscktsgytftrytmhwvkqrpgqglewigyinpsrgytnynqkfkdkatlttdkssstaymqlsslts edsavyycaryyddhycldywgqgttltvss(vh2)ggggsggggsggggs((g4s)3)diqltqspaimsaspgekvtmtcrasssvsy mnwyqqksgtspkrwiydtskvasgvpyrfsgsgsg
tsysltissmeaedaatyycqqwssnpltfgagtklelk(vl2)。
47.另一方面,本发明实施例还提供了一种抗体偶联物,其包括:前述任意实施例所述的抗体或其抗原结合片段。
48.在一些实施例中,所述抗体偶联物还包括与抗体或其抗原结合片段偶联的固相载体。可选地,所述固相载体包括但不限于磁性微球、塑料微球、塑胶微粒、微孔板、玻璃、毛细管、尼龙和硝酸纤维素膜中的至少一种。
49.在一些实施例中,所述抗体偶联物还包括与抗体或其抗原结合片段偶联的可被检测的标记物。
50.在实际的使用过程中,本领域技术人员可以根据检测条件或实际需要选择其它合适的标记物,无论使用何种标记物,均属于本发明的保护范围。
51.在一些实施例中,所述标记物选自荧光染料、酶、放射性同位素、化学发光试剂和纳米颗粒类标记物中的至少一种。
52.本发明实施例还提供了如前述实施例所述的抗体或其抗原结合片段在制备pd-l1抗原的检测产品中的应用。
53.在一些实施例中,所述产品包括试纸、试剂和试剂盒中的任意一种。
54.在一些实施例中,所述检测的方法选自:elisa、免疫荧光法、化学发光免疫分析、western blot、免疫层析法、电化学免疫分析和磁珠法中的任意一种。
55.另一方面,本发明实施例还提供了如前述任意实施例所述的抗体或其抗原结合片段在制备用于靶向pd-l1来诊断、预防或治疗疾病的产品中的应用。
56.优选地,所述疾病选自乳腺癌、肺癌、胃癌、肠癌、食管癌、卵巢癌、宫颈癌、肾癌、膀胱癌、胰腺癌、神经胶质瘤或黑素瘤中的任意一种;
57.优选地,所述产品选自试剂、试剂盒和药物中的任意一种。
58.另一方面,本发明实施例还提供了一种试剂或试剂盒,其包括如前述任意实施例所述的抗体或其抗原结合片段。
59.另一方面,本发明实施例还提供了一种分离的核酸,其编码如前述任意实施例所述的抗体或其抗原结合片段。
60.另一方面,本发明实施例还提供了一种载体,其含有前述任意实施例所述的分离的核酸。
61.所述载体包括表达载体。本发明所述的“表达载体”是指任何重组的多核苷酸构建体,该构建体可通过转化,转染或转导的方式将目的dna片段直接或间接(如包装成病毒)导入宿主细胞内,进行目的基因表达。其中一种类型的载体是质粒,即环状双链dna分子,可将目的dna片段连接至质粒环中。另一种类型的载体为病毒载体,其可将目的dna片段连接包装至病毒基因组中(如腺病毒,腺相关病毒,逆转录病毒,慢病毒,溶瘤病毒)。这些载体进入宿主细胞后,可以进行目的基因的表达。
62.本领域技术人员也可以通过体外转录的方式,以本发明的抗体的核酸序列为模板,转录成rna,进一步通过转染,转导或转化该rna到宿主细胞,也可以表达本发明抗体或其功能性片段,发挥本发明的生物功效。
63.另一方面,本发明实施例还提供了一种细胞,其含有如前述任意实施例所述的载体。
64.在一些实施例中,所述细胞为宿主细胞,宿主细胞包括原核宿主细胞、真核宿主细胞以及噬菌体。所述的原核宿主细胞可以为大肠杆菌、链霉菌或枯草杆菌等。所述真核宿主细胞可以为293细胞、293t细胞、293ft细胞、cho细胞、cos细胞、per6,酿酒酵母、毕赤酵母、汉森酵母、假丝酵母、部分昆虫细胞以及植物细胞。293系列细胞,per6细胞和cho细胞是用于生产制备抗体或重组蛋白的常用哺乳动物细胞,为本领域普通技术人员所熟知。
65.另一方面,本发明实施例提供了如前述任意实施例所述的抗体或其抗原结合片段的生产方法,其包括培养能表达所述抗体或其抗原结合片段的细胞。
66.在本发明公开了抗体的氨基酸序列的基础上,本领域技术人员可以采用基因工程技术或其他技术(化学合成、重组表达)制备得到该抗体,例如从能够重组表达如上任一项所述的抗体的重组细胞的培养产物中分离纯化得到该抗体,这对本领域技术人员来说是容易实现的,基于此,无论采用何种技术制备本发明的抗体,其均属于本发明的保护范围。
67.另一方面,本发明实施例还提供了一种药物或药物组合物,其有效成分包括如前述任意实施例所述的抗体或其抗原结合片段、如前述任意实施例所述的抗体偶联物、如前述任意实施例所示的试剂或试剂盒、如前述任意实施例所述的分离的核酸、如前述任意实施例所述的载体和如前述任意实施例所述的细胞中的至少一种。
68.本发明所述的“药物组合物”表示组合在一起以实现某种特定目的的至少一种药物以及任选地可药用载体或辅料的组合。在某些实施方案中,所述药物组合物包括在时间和/或空间上分开的组合,只要其能够共同作用以实现本发明的目的。一些药物组合物是通过联合施用一些可药用成分或化合物,达到增强本发明的生物功效或减小药物副作用(例如,可以和其他抗肿瘤药物联合使用,增强抗肿瘤效果)。另一些药物组合物的目的是促进对生物体的给药,利于活性成分的吸收,增强稳定性或靶向性,延长半衰期,进而更好的发挥本发明的生物功效。
69.另一方面,本发明还提供了一种靶向pd-l1以诊断、预防或治疗疾病的方法,其包括向有此需要的对象施用治疗有效量的本发明抗体或其抗原结合片段、核酸、载体、细胞和药物组合物。
70.所述疾病选自乳腺癌、肺癌、胃癌、肠癌、食管癌、卵巢癌、宫颈癌、肾癌、膀胱癌、胰腺癌、神经胶质瘤或黑素瘤等。
71.本发明所述的“有效量”是指足以显示其对于所施用对象益处的剂量。施用的实际量,以及施用的速率和时间过程会取决于所治疗者的自身情况和严重程度。治疗的处方最终由医生来做决定,通常会考虑患者的个体情况,递送部位,施用方法,疾病严重程度以及对于医生来说其它常规因素。
72.本发明所述的“对象”是指哺乳动物,如人类,但也可以是其它动物,如野生动物,家畜或实验动物。
73.另一方面,本发明还提供一种检测pd-l1抗原的方法,其包括采用前述任意实施例提供的抗体或其抗原结合片段对抗原进行检测。
74.检测的方法包括但不限于elisa,免疫层析、免疫组织化学,免疫荧光和流式检测,也可以用于细胞,组织或活体的抗原示踪,例如可以将本发明抗体或其功能性片段进行荧光或同位素标记从而进行抗原示踪。
75.以下结合实施例对本发明的特征和性能作进一步的详细描述。
76.实施例1
77.(1)pd-l1重组蛋白的制备:将编码人源pd-l1的核苷酸序列由安徽通用生物公司合成。pcr扩增并亚克隆至pcdna3.1表达载体中。然后,将pd-l1的胞外域分别亚克隆到c端携带fc或his标签的pcdna3.1表达载体中。其中fc标签包括人源fc(hfc)和鼠源fc(mfc)。通过瞬时转染293ft,使用freestyle
tm
无血清培养基(life technologies)摇瓶培养5-7天,收集上清,经过离心超滤,然后通过protein a/g或nta-ni亲和层析以及分子筛色谱柱纯化携带fc或his标签的重组pd-l1蛋白。
78.(2)表达人pd-l1抗原的稳定细胞株制备:将编码人源pd-l1的全长序列构建到携带plenti-egfp慢病毒载体中,包装成慢病毒颗粒。hela细胞于含10%胎牛血清的dmem中培养。采用浓缩的病毒液对hela细胞进行感染。48小时之后进行流式分选,培养至96孔板,进行单克隆稳定细胞株筛选和鉴定,并对稳定表达pl-l1的hela-pd-l1-egfp细胞进行保种。
79.实施例2:抗pd-l1单克隆抗体的制备
80.动物免疫:使用5-6周龄的balb/c雌性小鼠作为被免疫动物,免疫剂量为100μg/只。首次免疫采用100μl弗氏完全佐剂(sigma)与等体积重组pd-l1蛋白混合,充分乳化后进行皮下多点注射。每隔2周,用等体积弗氏不完全佐剂(sigma)与重组蛋白混合,充分乳化后进行皮下多点注射。加强免疫共4次,最后一次加强免疫后第10天,割尾采血检测小鼠抗体效价。细胞融合前3天,100μg重组蛋白腹腔冲击一次。
81.细胞融合与杂交瘤筛选:无菌条件下,取小鼠后腿根部淋巴结,制备富含b细胞的悬液,按经典的peg(sigma)法,与sp2/0细胞进行细胞融合。融合后的细胞重悬于hat培养基进行培养。融合后第5天和第10天使用新鲜的hat培养基进行培养。融合后第11-15天进行elisa,免疫荧光和流式分析,筛选阳性克隆。elisa筛选采用96孔板进行,将pd-l1重组蛋白按100ng/孔的量4摄氏度过夜包被到孔板底部,将50μl杂交瘤培养上清作为一抗,使用hrp偶联抗小鼠igg抗体和化学发光试剂(碧云天生物科技公司)进行显色,并于酶标仪在450nm波长读值。免疫荧光染色使用稳定表达pd-l1的hela细胞株,简言之,将细胞株在96孔板贴壁培养,加入50μl杂交瘤上清作为一抗,4度孵育2小时,pbs清洗3次,cy3标记的goat anti-mouse igg(proteintech)作为二抗,常温孵育1小时,pbs清洗3次,使用荧光显微镜采集图像。
82.根据上述elisa分析和免疫荧光分析结果,最终可确定14个最优的杂交瘤克隆(分别命名为2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6),用于后续的序列克隆和亲和力分析等实验。
83.实施例3
84.杂交瘤抗体可变区序列克隆:收集对数生长期的最优杂交瘤克隆细胞,用trizol(invitrogen)提取rna并反转录(primescript
tm reverse transcriptase,takara)。将反转录得到的cdna采用mouse ig-primer set(novagen)进行pcr扩增后测序,最终获得重链和轻链可变区序列。其中重链和轻链的可变区cdr序列如表1所示。
85.表1鼠单抗的重链和轻链可变区含有的cdr序列
86.87.88.89.90.91.92.[0093][0094]
实施例4:重组嵌合抗体对hela宫颈癌细胞过表达pd-l1的结合分析
[0095]
将人(igg1)重链恒定区,以及人轻链恒定区,克隆入pcdna3.1(invitrogen)质粒载体,然后将杂交瘤克隆2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6的vh和vl基因片段分别构到有人igg1重链恒定区和人iggκ轻链恒定区的基因重组载体上,得到重组嵌合抗体重链表达载体和轻链表达载体,通过瞬时转染293ft,使用freestyle
tm
无血清培养基(life technologies)摇瓶培养5-7天,收集上清,经过离心超滤,然后通过protein a/g亲和层析以及分子筛色谱柱纯化获得相应类型抗pd-l1重组单克隆抗体。
[0096]
人igg1重链恒定区序列(seq id no.95):
[0097]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk。
[0098]
人iggκ轻链恒定区序列(seq id no.96):
[0099]
tvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0100]
将hela-pd-l1-egfp细胞铺于24孔细胞培养皿中,第二天将重组嵌合抗体2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6作为一抗,cy3标记的goat anti-human igg(h+l)(碧云天生物科技公司)作为二抗,并用荧光共聚焦对其进行观察拍照。如图1所示,由图1结果表明:重组嵌合抗体2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6可以和细胞hela-pd-l1-egfp发生特异性结合。
[0101]
实施例5:杂交瘤抗体对鼠源pd-l1的结合分析
[0102]
鼠源pd-l1的cdna克隆购自义翘神州,然后按照实施例1构建鼠源pd-l1的稳定表达细胞株cho-mpd-l1。然后取杂交瘤2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6上清,按照实施例2进行免疫荧光染色。结果表明单克隆抗体不能够与鼠源pd-l1结合。
[0103]
实施例6:体外结合亲和力和动力学实验
[0104]
本实施例采用表面等离子共振(spr)方法测定,使用ge公司biacore 8k仪器进行分析。利用由biacore提供的试剂盒,采用标准氨基偶联法将pd-l1-his重组蛋白共价连接至cm5(ge)芯片上,然后将待测单链抗体按不同浓度梯度稀释于同样缓冲液中进样,进样后均以试剂盒内配再生试剂再生。数据的分析和采集使用biacore 8k配套分析软件进行。所得结果如下表2。
[0105]
表2亲和力
[0106][0107][0108]
实施例7:pd-l1单克隆抗体阻断pd-1与pd-l1的结合
[0109]
将实施案例4通过protein a/g亲和层析以及分子筛色谱柱纯化获得相应类型抗pd-l1重组单克隆抗体2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6。将hela-pd-l1-egfp细胞铺于96孔板中,第二天进行pd-l1抗体阻断pd-1结合pd-l1免疫荧光验证。细胞固定后,用pbs清洗两遍,pd-1-mfc的蛋白作为一抗,37℃孵育1h,pbs清洗两遍,之后分别加入2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6单克隆抗体进行封堵,不加anti-pd-l1抗体孔作为对照。37℃孵育1h,pbs清洗两遍,之后加入cy3标记的goat anti-mouse igg(h+l)(碧云天生物科技公司)作为二抗,并用荧光共聚焦对其进行观察拍照。代表性结果如图2所示,结果表明,pd-1-mfc蛋白可以和肿瘤细胞上面pd-l1结合,但是加了10ug/ml的anti-pd-l1单克隆抗体后,pd-1蛋白的结合量明显减少,说明这些pd-l1单克隆抗体能够明显地阻断pd-1与pd-l1的结合。
[0110]
实施例8:pd-l1-cd3双特异性抗体的体外杀伤实验
[0111]
pd-l1-cd3双特异性抗体的结构表示式为:vl1-(g4s)3-vh1-g4s-vh2-(g4s)
3-vl2;其中,vh1为pd-l1重链可变区,vl1为本发明提供的抗pd-l1抗体的轻链可变区,vh2为抗cd3抗体的重链可变区,vl2为抗cd3抗体的轻链可变区,g4s和(g4s)3为肽接头,vh2-(g4s)3-vl2为cd3 scfv,其采用的是okt3的氨基酸序列(如下所示):
[0112]
diklqqsgaelarpgasvkmscktsgytftrytmhwvkqrpgqglewigyinpsrgytnynqkfkdka
tlttdkssstaymqlsslts edsavyycaryyddhycldywgqgttltvss(vh2)ggggsggggsggggs((g4s)3)diqltqspaimsaspgekvtmtcrasssvsy mnwyqqksgtspkrwiydtskvasgvpyrfsgsgsgtsysltissmeaedaatyycqqwssnpltfgagtklelk(vl2)。
[0113]
效应细胞和靶细胞的准备:抽取健康捐献者外周血,分离pbmc,采用t细胞分离试剂盒(miltenyi t cell isolation kit)分离t细胞,分离后的t细胞培养用含5% ab血清的x-vivo(lonza)培养基,预先用1ml含50ng/ml抗人cd3抗体(peprotech)和50ng/ml cd28抗体(peprotech)的包被液37℃2h孵育包被tc处理的6孔板,使用前除去包被液。将细胞以1ml/孔接种到已包被抗体的6孔板中,刺激培养48小时后,补充添加il-2(100u/ml)和il-15(10ng/ml)作为活化因子继续培养。靶细胞选用pd-l1过表达的hela-pd-l1-egfp,培养于添加了10%胎牛血清(gibco)的dmem高糖培养液中。
[0114]
细胞共培养实验:将对数生长期的hela-pd-l1-egfp肿瘤细胞加入96孔板中,过夜培养后,添加0ng/ml(control)或者1ng/ml的双特异性抗体,同时按照t细胞和肿瘤细胞的效靶比分别为1:1、2:1、4:1和8:1的比例加入t细胞,24小时后,观察t细胞对肿瘤细胞的杀伤效果,代表性结果如图3所示,实验结果表明,与不添加双特异性抗体组(control)相比,十四种pd-l1-cd3双特异性抗体(2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6)对hela-pd-l1-egfp肿瘤细胞具有显著的杀伤效应(*p《0.05、**p《0.01、***p《0.001),各个抗体之间无显著性差异。
[0115]
实施例9:异种移植物小鼠模型抗肿瘤实验
[0116]
本实施例采用异种移植物小鼠模型来评估pd-l1靶向的双特异性抗体2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6的体内抗肿瘤活性。采用一种免疫缺陷鼠模型进行评估。
[0117]
ncg重症免疫缺陷鼠模型:ncg重症免疫缺陷鼠购自南京大学模式动物所,将2
×
106个对数生长期的a375细胞接种于ncg鼠右后背部皮下。待6天左右肿瘤长至200mm3后,将荷瘤体积均匀的小鼠随机分组,每组5只小鼠。设置与给药等体积的生理盐水为对照组。双特异性抗体的给药方式为腹腔给药,30μg/只,每3天给药1次,共计给药4次。每3天进行小鼠称重并测量肿瘤大小。移植瘤平均体积按照公式v=1/2(l
×
w2)计算,其中l代表瘤体的长度,w代表瘤体的宽度。当小鼠肿瘤体积达到2000mm3或者肿瘤表面出现明显溃破,则处死小鼠,结束动物实验。所有数据均为平均值
±
s.d.p值采用未配对双尾学生t检验获得。实验结果如图4所示,由图4结果可知,与不给药的对照组相比,十四种pd-l1-cd3双特异性抗体(2420a7、62d11、95c12、142a11、151d1、3518g5、2217b3、3718b12、521h2、2111c9、2616b4、3920f1、3821g6、3211a6)对a375肿瘤细胞的生长均具有显著的抑制效果(*p《0.05、**p《0.01、***p《0.001),其中2217b3/2616b4/3718b12-cd3组抑制效果最佳***p《0.001。
[0118]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1