CtSDR反应系统、基于CRISPR的RNA原位成像方法、研究方法及应用
本发明涉及生物化学,具体为ctsdr反应系统、基于crispr的rna原位成像方法、研究方法及应用。
背景技术:
1、原位杂交技术(in situ hybridization,ish)是细胞内或者组织中dna或者rna成像检测的技术,自开发以来以实现了广泛的使用。其主要工作流程包括:使用地高辛标记的核酸探针于组织、细胞或染色体中的dna进行杂交,再使用抗地高辛的一抗进行孵育。接着使用标记了hrp酶的二抗与一抗进行结合。反应完成后滴加催化底物3,3-二氨基联苯胺(diaminobezidin,dab)。hrp能够催化dab生成褐色产物原位沉积在细胞上,以达到原位成像rna的目的。
2、但是其存在以下弊端:1、检测过程需要多步流程,操作繁琐;2、检测总耗时较长;3、使用的dab显色物质是一种致癌物,易引起肺癌、膀胱癌等。
3、dna不仅作为编码遗传信息的容器,而且是工程纳米技术的强大而通用的生物材料。watson-crick碱基配对的可预测性、物理化学稳定性和特异性使dna纳米技术具有广阔的应用潜力。其中,链置换反应(strand displacement reaction,sdr)作为dna纳米技术的一种广泛采用的构建单元,已广泛应用于dna纳米技术中的逻辑门、dna机器和生物传感器。sdr指侵入链置换部分或完全互补杂交底物复合物中的一条预杂交链的过程。传统的sdr是一种可逆反应,由反应物最初提供的能量提供动力,一旦反应达到平衡,目标产物将不再可用。因此,传统sdr的效率受限于初始反应物的能量和反应的平衡。为了消除sdr的这些障碍,许多工作致力于寻找提高sdr初始能量和改变平衡的方法。不平衡的反应物浓度或燃料链的引入可以控制sdr反应向前进行以获得所需的产物。然而,由于双链核酸杂交的连续效率限制,仅通过碱基配对杂交仍然难以最大化产物量。其他研究侧重于设计dna的构象,如立足点和发夹,它们可以通过碱基配对、碱基堆叠和开环为sdr贡献更多的焓。sdr的热力学能量增加可以无限加速sdr。然而,这些系统中不利的二级结构会影响sdr的效率。此外,级联网络如杂交链式反应(hybridization chain reaction,hcr)和催化发夹组装(catalytic hairpin assembly,cha),是通过串联多重sdrs构建的,以实现信号放大。尽管如此,这些方法仍然需要大量的反应物来实现级联扩增,这限制了其在细胞内的应用,因为需要额外的操作来传递反应物。因此,克服sdr固有限制的简单、集成和有效的策略仍然是一个巨大的挑战。
4、聚集的规则间隔短回文重复(clustered regularly interspaced shortpalindromic repeats,crispr)相关内切核酸酶(cas)系统源自原核生物对入侵病毒的适应性免疫,已成为基因组编辑、转录组、分子诊断、基因治疗和核酸生物成像的革命性工具。在这些crispr-cas系统中,使用单个crispr rna(crrna)编程的cas12a效应子可以被单链dna(ssdna)或具有原型间隔区相邻基序(protospacer adjacent motif,pam)的双链dna(dsdna)激活。在形成cas12a/crrna/靶复合物后,非特异性切割向侧支ssdna的多次翻转,称为反式切割,由cas效应构象变化触发。cas效应子的核酸高效切割(每秒约1000次切割)和精确的双重识别机制(基于碱基序列的识别和蛋白质结构域识别)。
5、利用crispr-cas系统的高效剪切功能和sdr的超特异的特异性实现rna的原位成像,为高灵敏地分析完整细胞或组织中的rna时空和动态生理和病理信息提供了一种新的技术可能。
6、因此提出ctsdr反应系统、基于crispr的rna原位成像方法、研究方法及应用以解决上述问题。
技术实现思路
1、本发明的目的在于提供ctsdr反应系统、基于crispr的rna原位成像方法、研究方法及应用,以解决上述背景技术中提出的技术问题。
2、为实现上述目的,本发明提供如下技术方案:
3、一种ctsdr反应系统,ctsdr反应系统包括以下原料:cas12a,crrna,靶标,ds探针,f-q报告探针,rnase抑制剂和nebuffer。
4、进一步的,ctsdr反应系统中,采用mirna-21作为靶标。
5、进一步的,ctsdr反应系统中,cas与crrna的摩尔比为2:1;采用nebuffer3.0;反应时间控制在60min。
6、进一步的,ctsdr反应系统中,ts和nts链在nebuffer3.0的离子环境下变性退火形成ds探针,即dsdna-1,crrna用于结合cas12a蛋白和dsdna-1。
7、本发明还提出了一种基于所述的ctsdr反应系统用于组织中病毒相关致癌rna成像。
8、本发明还提出了一种基于所述的crispr的rna原位成像方法,步骤如下:
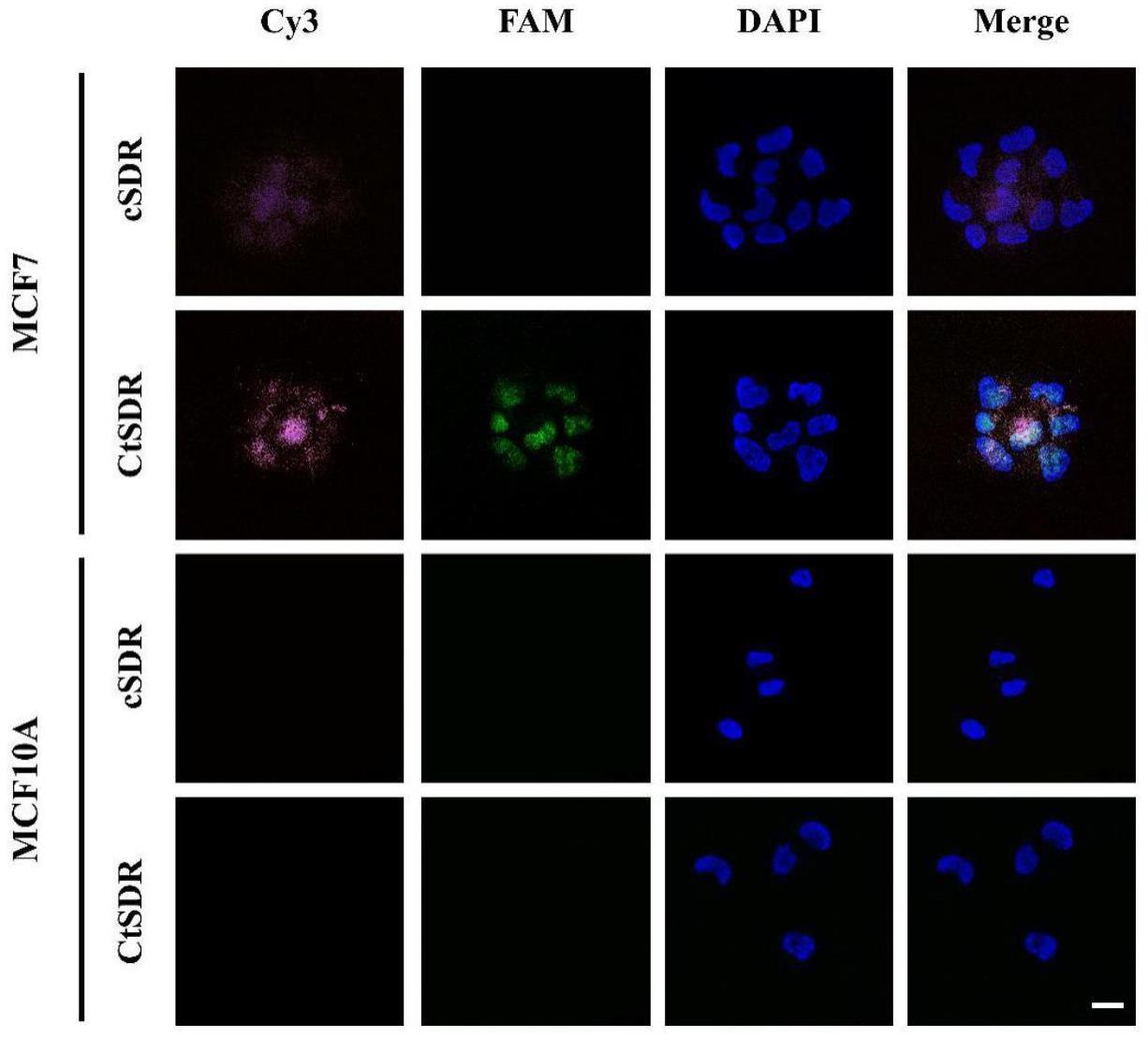
9、a、将mcf-7和mcf-10a细胞在室温下用固定溶液固定;
10、b、固定后,将细胞用含有triton-x 100的pbs进行透化;然后用pbs洗涤细胞;
11、c、将ctsdr反应系统与细胞进行孵育;
12、d、孵育后使用dapi对细胞核进行染色,再进行共聚焦成像。
13、本发明还提出了一种基于所述的crispr的rna原位成像研究方法,步骤如下:
14、一、研究cas12a对促进链置换反应效率的效果,提出cas12a双燃料推动的链置换反应ctsdr;
15、二、构建基于ctsdr的液相进行rna检测方法;
16、三、优化实验参数,并在优化条件下评估多目标检测方法对多重靶标的分析检测性能;
17、四、进行交叉反应以验证多重靶标引发的ctsdr的特异性;同时使用具有相似碱基序列的其他mirna来评估方法的特异性;
18、五、构建基于ctsdr的胞内mirna成像策略,并用于临床组织样本中癌原性rna的原位成像;
19、六、使用mirna抑制剂和mirna模拟物作为调节剂,进一步研究通过靶向启动ctsdr系统评估的下调或上调mirna表达水平;
20、七、进行评估mirnas水平的经典技术qrt-pcr,以确认用mirnas抑制剂处理后mirnas水平的变化。
21、进一步的,步骤二中,具体包括以下步骤:
22、a、构建基于ctsdr的液相rna检测方法;
23、b、采用mir-21作为靶标,使用聚丙烯酰胺凝胶电泳实验验证该检测方法的可行性;
24、c、通过监测cy3通道中的荧光信号来评估检测方法的可行性;
25、d、通过检查fam通道中的荧光信号来评估由靶点启动的ctsdr激活的cas12a的反式切割;
26、e、合成另一个靶标mir-155以及相应的sdr和反式切割系统,进行mirna-155启动的ctsdr的可行性分析,以验证靶标引发的ctsdr的普适性。
27、进一步的,步骤二中,步骤a具体步骤如下:
28、使用rna作为靶标通过立足点交换来置换双链底物中的封闭链,形成复合物y并且恢复底物中cy3的荧光;
29、随后cas12a/crrna复合物可以识别复合物y以启动ctsdr过程并激活cas12a的反式切割活性,恢复fam的荧光;
30、置换下来的自由目标可以进入下一个循环,实现信号输出的级联放大;以达到高灵敏特异性的检测靶标。
31、本发明还提出了一种基于所述的crispr的rna原位成像方法用于组织中病毒相关致癌rna成像。
32、有益效果
33、本发明通过利用crispr和链置换技术的高效性,实现对胞内rna的快速检测,极大的缩减现有技术的检测周期,助力临床对致癌性rna相关疾病的诊断;
34、通过crispr/cas12a显著促进的链置换反应,能实现rna的多重超灵敏特异性检测,能动态监测胞内rna的表达,以揭示rna和癌症发生发展的相关性,为癌症的诊断和预后监测提供了有力的证据;
35、本发明基于的crispr系统和链置换反应技术均能实现可编程化,能够根据不同的靶标需求,定制相应的检测体系,能真正意义上的体现检测体系的普适性;
36、本发明利用的探针为不依赖pam的部分杂交双链,能极大程度上突破因cas12a对于pam序列的要求而导致的应用限制,极大的扩宽了cas12a的应用场景。
37、本发明采用临床石蜡包埋的组织样本进行胞内致癌rna的原位成像检测,与现有金标准相当的检测准确性,更短的检测时间,更简单的操作步骤,更环保的检测体系均表明该新技术有极大的临床应用价值。
- 还没有人留言评论。精彩留言会获得点赞!