布劳特氏菌的发酵培养基及发酵工艺的制作方法
1.本发明涉及微生物培养领域。具体地,本发明涉及一种适用于布劳特氏菌、尤其是延长布劳特氏菌的非动物源性培养基及使用其的发酵工艺。
背景技术:
2.延长布劳特氏菌(blautia producta)隶属布劳特氏菌属(blautia),是严格厌氧的菌。布劳特氏菌通常呈圆形或者椭圆形,生长温度范围为20℃-40℃,可以在ph6-8范围内生长。同时,布劳特氏菌具有异养和自养的特性,能够以co或者h2/co2作为能量来源。
3.布劳特氏菌自发现以来,在缓解炎症与肥胖、糖尿病等代谢性疾病方面的功效受到研究人员的广泛关注。研究发现炎症性肠病(ibd)和克罗恩病(cd)患者的盲肠黏膜菌群中布劳特氏菌丰度较健康人群明显减少。k.lippert等人发现布劳特氏菌的丰度与血清葡萄糖和胰岛素水平相关,这意味着在宿主葡萄糖代谢中起作用。另外也有研究人员发现,布劳特氏菌在肥胖儿童胰岛素抵抗中发挥作用。
4.近年来,布劳特氏菌对草本植物和功能食品的生物转化和代谢方面的研究一直受到研究者的关注。探索布劳特氏菌的生物转化对于开发新的酶和补充于食物中的生物活性代谢物至关重要,并为人类肠道微生物的代谢组学研究提供有价值的视角。
5.有学者对延长布劳特氏菌作为益生菌的生物安全性进行了全方位的评估。另外有研究报道,对小鼠灌胃延长布劳特氏菌,可以明显改善小鼠肥胖症状,因为延长布劳特氏菌在小鼠体内产生12-甲基肉豆素酸(12-mma),这种物质被鉴定为白脂肪产物的重要活性代谢产物,在体内具有有效的降血脂作用,并激活g蛋白偶联受体120(gpr120),从而刺激白色脂肪组织褐变。
6.但是迄今为止,尚未有关延长布劳特氏菌应用于食品工业以及医药工业的培养基及其高密度发酵工艺的报道。尽管传统培养基可以用于筛选分离该菌株,但是成本高,成分复杂,生长速度慢,活菌数低,并不利于工业化生产。另外,传统培养基中富含蛋白胨、胰蛋白胨等动物来源成分,来源于动物的产品可能含有朊病毒或细菌来源的污染物,或含有过敏原等其他不被期望的成分,以致于不适合用于培养用于人类食品或药物中的延长布劳特氏菌。
7.因此,本领域需要一种延长布劳特氏菌的非动物源性的、低成本、高密度培养基及相关发酵方法。
技术实现要素:
8.基于上述问题,本发明的目的在于提供一种成分简单、成本低廉、能够显著提高布劳特氏菌的菌体量的发酵培养基及相关发酵方法。本发明的发明人通过对用于延长布劳特氏菌的发酵培养基及发酵工艺进行优化,将成分简化的非动物源性的发酵培养基与控制发酵过程中发酵液ph以及补料分批发酵工艺相结合,能够显著提高延长布劳特氏菌的菌体量。由此,完成了本发明。
9.因此,在本发明的第一方面,提供了一种用于培养布劳特氏菌(blautia sp.)的培养基,其包括碳源、非动物源氮源、生长因子、益生元。
10.在第二方面,提供了一种布劳特氏菌的发酵方法,其包括高密度发酵步骤:将布劳特氏菌的种子液接种到第一方面所述的发酵培养基中,并在厌氧环境条件下培养。
11.综上,本发明提供一种成分简单低廉、不含动物源成分、能够高效发酵布劳特氏菌的高密度培养基,以及由此提供了一种经济有效的培养布劳特氏菌的方法。具体来说,采用本发明的高密度发酵培养基及发酵方法培养布劳特氏菌,尤其是延长布劳特氏菌,细菌的生长状态好、增殖快、培养时长短、传代稳定性良好,并且非动物源性的培养基避免了污染物或过敏原的存在,具有更高的安全性,能够满足食品工业和医药工业的生产要求。
附图说明
12.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。
13.图1示出了本发明的延长布劳特氏菌在不同ph(ph=6.0、7.0、8.0、不控制ph)条件下的生长曲线。
14.图2示出了高密度发酵中不同的接种量(2%、6%和10%)对本发明的延长布劳特氏菌的生长的影响。
15.图3示出了有缓冲盐和无缓冲盐对本发明的延长布劳特氏菌的生长的影响。
16.图4示出了高密度发酵中不同的补料方式对本发明的延长布劳特氏菌的生长的影响。
17.图5示出了高密度发酵中本发明的延长布劳特氏菌在不同的传代次数下的生长曲线。
18.图6示出了延长布劳特氏菌在不同的传代次数下的革兰氏染色的菌株形态。
19.图7示出了本发明的延长布劳特氏菌在第一次传代下的革兰氏染色的菌株形态。
20.图8示出了延长布劳特氏菌的基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)图谱。
具体实施方式
21.在下文中,将结合附图对本发明进行详细的描述。需理解,以下描述仅以示例方式来对本发明进行说明,而无意于对本发明的范围进行限制,本发明的保护范围以随附权利要求为准。并且,本领域技术人员理解,在不背离本发明的精神和主旨的情况下,可以对本发明的技术方案进行修改。若并未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
22.除非另外定义,否则本文所使用的所有技术和科学术语具有与本发明所述主题所属领域的普通技术人员通常理解的相同含义。在对本发明进行详细描述之前,提供以下定义以更好地理解本发明。
23.在提供数值范围的情况中,例如浓度范围、百分比范围或比率范围,应当理解,除非上下文另有明确规定,否则在该范围的上限与下限之间的、到下限单位的十分之一的各中间值以及在所述范围内的任何其他所述值或中间值包含在所述主题内。这些较小范围的
上限和下限可独立地包括在较小范围中,并且此类实施方案也包括在所述主题内,受限于所述范围中的任何特定排除的极限值。在所述范围包括一个或两个极限值的情况中,排除那些所包括的极限值中的任一个或两个的范围也包括在所述主题中。
24.在本发明的上下文中,很多实施方案使用表述“包含”、“包括”或者“基本/主要由
……
组成”。表述“包含”、“包括”或“基本/主要由
……
组成”通常情况下可以理解为开放式表述,表示不仅包括该表述后面具体列出的各元素、组分、组件、方法步骤等外,还包括其他的元素、组分、组件、方法步骤。另外,在本文中,表述“包含”、“包括”或者“基本/主要由
……
组成”在某些情况下也可以理解为封闭式表述,表示仅包括该表述后面具体列出的各元素、组分、组件、方法步骤,而不包括任何其他的元素、组分、组件、方法步骤。此时,该表述等同于表述“由
……
组成”。
25.如本领域所常用的,术语“高密度发酵”又被称为高密度培养,指微生物在液体培养中细胞群体密度超过常规培养10倍以上时的生长状态的培养技术。
26.如上所述,本发明人旨在提供一种成分简单低廉、能够高效发酵布劳特氏菌的高密度发酵培养基及相关的发酵方法。
27.在本发明的第一方面,提供了一种用于培养布劳特氏菌(blautiasp.)的培养基,其包括碳源、非动物源氮源、生长因子、益生元。
28.在一个具体的实施方案中,所述布劳特氏菌可以是延长布劳特氏菌(blautia producta)。
29.在又一个具体的实施方案中,所述碳源可以选自:无机碳源如co2/h2、co、co
32-、hco
3-,有机碳源如葡萄糖、蔗糖、麦芽糖、乳糖、果糖、海藻糖,及其任意组合。
30.在一个优选的实施方案中,所述碳源为蔗糖。
31.在一个更优选的实施方案中,所述碳源为蔗糖与无机碳源的组合,例如蔗糖与hco
3-的组合。
32.在又一个具体的实施方案中,所述碳源的浓度范围可以为2-200g/l。在一个优选的实施方案中,所述碳源的浓度范围可以为2-20g/l。
33.在又一个具体的实施方案中,所述非动物源性氮源可以选自酵母浸粉、酵母蛋白胨、大豆蛋白胨、小麦蛋白胨、及其任意组合。
34.在一个优选的实施方案中,所述非动物源性氮源为酵母浸粉或酵母蛋白胨。
35.在又一个具体的实施方案中,所述非动物源性氮源的浓度范围可以为5-200g/l。在一个优选具体的实施方案中,所述非动物源性氮源的浓度范围可以为5-50g/l。
36.在又一个具体的实施方案中,所述生长因子可以选自半胱氨酸、半胱氨酸盐酸盐及其水合物、氯化血红素、生物素、叶酸、钴胺素、对氨基苯甲酸、及其任意组合。
37.在一个优选的实施方案中,所述生长因子为半胱氨酸盐酸盐。
38.在又一个具体的实施方案中,所述生长因子的浓度范围可以为0.5-5g/l。在一个优选的实施方案中,所述生长因子的浓度范围可以为0.5-2g/l。
39.在又一个具体的实施方案中,所述益生元可以选自低聚果糖、低聚木糖、大豆低聚糖、菊粉、低聚异麦芽糖、低聚甘露糖、乳糖醇、异麦芽酮糖、及其任意组合。
40.在一个优选的实施方案中,所述益生元为大豆低聚糖。
41.在又一个具体的实施方案中,所述益生元的浓度范围可以为1-50g/l。在一个优选
的实施方案中,所述益生元的浓度范围可以为1-5g/l。
42.在又一个具体的实施方案中,所述发酵培养基还可以包括缓冲盐。在一个优选的实施方案中,所述缓冲盐选自磷酸氢二钾、磷酸二氢钾、碳酸氢钠或其任意组合,例如为磷酸氢二钾、磷酸二氢钾和碳酸氢钠的组合,但不限于此。不希望被理论束缚,本发明人发现,缓冲盐尤其是不含碳酸盐的缓冲盐,对于布劳特氏菌的高密度发酵的影响并不大。
43.在又一个具体的实施方案中,磷酸二氢钾和磷酸氢二钾的浓度范围各自为0-4.5g/l。在一个优选的实施方案中,磷酸二氢钾和磷酸氢二钾的浓度范围各自为0-1g/l。
44.在又一个具体的实施方案中,碳酸氢钠的浓度范围为1-10g/l。在一个优选的实施方案中,碳酸氢钠的浓度范围为1-4g/l。
45.本发明人发现,碳酸氢钠在本发明的发酵培养基中不仅可以作为缓冲盐成分,也可以作为无机碳源。可以理解,当发酵培养基中不存在有机碳源如蔗糖时,碳酸氢钠则起着无机碳源的作用,使得布劳特氏菌的高密度发酵仍然可以进行。也就是说,不希望被理论束缚,本发明的发酵培养基可以不包括有机碳源。但是,同样可以理解,在本发明的发酵培养中,微生物对有机碳源的利用效率要高于无机碳源,因此,有机碳源是优选的。
46.在又一个具体的实施方案中,所述发酵培养基可以包括11.42g/l蔗糖、21.12g/l酵母浸粉、1.76g/l大豆低聚糖、1.18g/l半胱氨酸盐酸盐,以及任选的0.45g/l磷酸氢二钾、0.45g/l磷酸二氢钾和4g/l碳酸氢钠,余量为水;或者,所述发酵培养基包括21.12g/l酵母浸粉、1.76g/l大豆低聚糖、1.18g/l半胱氨酸盐酸盐、4g/l碳酸氢钠,以及任选的0.45g/l磷酸氢二钾和0.45g/l磷酸二氢钾,余量为水。
47.在第二方面,提供了一种布劳特氏菌的发酵方法,其包括高密度发酵步骤:将布劳特氏菌的种子液接种到第一方面所述的发酵培养基中,并在厌氧环境条件下培养。
48.在一个具体的实施方案中,所述布劳特氏菌是延长布劳特氏菌。
49.在又一个具体的实施方案中,所述种子液以2%-10%的接种量接种。在一个优选的实施方案中,所述种子液以2%-4%的接种量接种。
50.在又一个具体的实施方案中,所述培养在20℃-40℃的温度进行。在一个优选的实施方案中,所述培养在36℃-38℃的温度进行。在一个进一步优选的实施方案中,所述培养在37℃的温度进行。
51.在又一个具体的实施方案中,所述培养的时间为6h-18h。
52.在又一个具体的实施方案中,所述高密度发酵步骤还包括将发酵过程中的所述发酵培养基的ph控制为6-8。在一个优选的实施方案中,所述发酵培养基的ph控制为6.0-7.5。
53.在又一个具体的实施方案中,所述高密度发酵步骤在转速为50-300rpm的条件下进行。在一个优选的实施方案中,所述高密度发酵步骤在转速为50-150rpm的条件下进行。
54.在又一个具体的实施方案中,所述发酵方法还包括在所述高密度发酵前进行对菌种进行静置培养以得到布劳特氏菌的种子液。
55.在一个优选的实施方案中,所述静置培养的条件包括在厌氧条件下、36-38℃、2-3次传代,每次传代的培养时间为12-36h。
56.在又一个具体的实施方案中,所述静置培养的种子培养基可以与高密度发酵培养基相同或不同,例如包括碳源如葡萄糖、蔗糖、麦芽糖、乳糖、果糖、海藻糖等,氮源如蛋白胨、胰蛋白胨、鱼粉、酵母浸粉、酵母蛋白胨、大豆蛋白胨、小麦蛋白胨等,生长因子如半胱氨
酸、半胱氨酸盐酸盐及其水合物、氯化血红素、生物素、叶酸、钴胺素、对氨基苯甲酸等,益生元如低聚果糖、低聚木糖、大豆低聚糖、菊粉、低聚异麦芽糖、低聚甘露糖、乳糖醇、异麦芽酮糖等,缓冲盐如磷酸氢二钾、磷酸二氢钾、碳酸氢钠。
57.在一个示例性的实施方案中,所述静置培养的种子培养基包括:5g/l葡萄糖、10g/l胰酪胨、2.5g/l酵母浸粉、0.45g/l磷酸氢二钾、0.45g/l磷酸二氢钾、0.9g/l nacl、0.44g/l mgso4·
7h2o、0.99g/l cacl2、4g/l碳酸氢钠,余量为水。
58.在又一个示例性的实施方案中,所述静置培养的种子培养基可以包括:11.42g/l蔗糖、21.12g/l酵母浸粉、1.76g/l大豆低聚糖、1.18g/l半胱氨酸盐酸盐、0.45g/l磷酸氢二钾、0.45g/l磷酸二氢钾、4g/l碳酸氢钠,余量为水。
59.在又一个具体的实施方案中,所述高密度发酵采用补料分批发酵方式进行。例如,可以在高密度发酵过程中采用缓慢连续补料方式进行补料。如本领域常用的,术语“补料分批发酵”是指这样的发酵技术:在微生物分批发酵过程中,以某种方式向发酵系统中补加一定物料,但并不连续地向外放出发酵液。该发酵技术介于分批发酵和连续发酵之间的一种发酵技术。按照补料时间是否连续可以划分为间歇补料和连续补料两种。本领域技术人员会知道,培养基中高浓度的底物会对微生物的生长起抑制作用,而补料分批发酵则是先在营养物质浓度比较低的情况下进行发酵,随后不断补加新鲜的营养物质,使得菌体正常生长并不断积累代谢产物,从而可以避免分批发酵中一次性投料过多而引起的底物抑制。
60.在又一个具体的实施方案中,所述补料可以是完全补料培养基或半分批补料培养基。所谓“完全补料培养基”是指补入完全的培养基,而所谓“半分批补料培养基”是指仅补入一种或几种营养成分的培养基,例如仅补入包括碳源如蔗糖的不完全培养基,或包括碳源如蔗糖和益生元如大豆低聚糖的不完全培养基。
61.在又一个优选的实施方案中,在高密度发酵培养期间,可以采用补料流速为2g
·
l-1
·
h-1
至6g
·
l-1
·
h-1
的总糖速率进行缓慢连续补料。补料培养基的总糖浓度可以为100-300g/l。
62.在本发明的上下文中,术语“总糖”是指培养基中包含的所有糖类物质的总和。由此,术语“总糖速率”是指补料过程中补入所有糖类物质的流速的总和;术语“总糖浓度”是指培养基中包含的所有的糖类物质的浓度。
63.本领域技术人员会知道,对于本发明而言,在使用本发明人优化的发酵培养基的基础上,间歇地补加布劳特氏菌发酵所需的一种或者几种营养物质如碳源,细菌可以不间断地大量生长繁殖,进而实现布劳特氏菌的高密度培养,也避免了因发酵结束后离心阶段的时间延长而产生的菌体量下降问题。此外,采用补料分批方法能够进一步节约发酵时间、缩短发酵周期、提高发酵效率、简化发酵步骤、减少设备投入且降低生产成本,这对于布劳特氏菌的大规模生产是非常有利的。
64.生物样品保藏信息:延长布劳特氏菌(blautia producta)菌株bwt1,于2019年6月24日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号为cgmcc no.18016;保藏地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。经保藏中心于2019年6月24日检测为存活菌株。
65.本发明的有益效果在于:本发明采用原料可以均采用非动物来源,避免存在动物源产品中的不符合食品药品法规的成分。本发明培养基成分简单,用于静置培养的种子培
养基中仅7种成分,用于高密度发酵的发酵培养基中仅4种成分就可以达到非常高的活菌数量,而传统培养基成分高达20种以上。与传统培养基相比,本发明的方法得到的发酵活菌数提高一个数量级。本发明的非动物源培养基成本低,工业生产操作简单,发酵活菌数高,生产效率高,经济效益好,易于实现延长布劳特氏菌在食品工业以及医药工业的工业化生产。
66.下文中,结合示例性的实施方案会更详细地描述本发明。然而,本文公开的示例性的实施方案仅出于示例的目的,而不应该被认为旨在解释本发明的范围。
67.实施例
68.在下述实施例中给出了本发明的延长布劳特氏菌的高密度培养方法与相关表征。如无特殊说明,其中采用的试验方法均为常规方法,并且如无特殊说明,下述实施例中所用的试验材料均为自常规化试剂商店购买所得。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。
69.应注意,本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,而并非旨在限制本发明。上文的发明内容部分以及下文的详细描述仅为具体阐释本发明之目的,无意于以任何方式对本发明进行限制。在不背离本发明的精神和主旨的情况下,本发明的范围由随附的权利要求书确定。
70.实施例1:不同碳源对延长布劳特氏菌生长的影响
71.按照下表1给出的配方1-5所示的成分配制不同碳源培养基作为二级培养基,其中含葡萄糖的配方1也用作一级培养基。-80℃冰箱中取冻存管常温融化,在厌氧箱中以2%接种量接种于一级培养基,培养24h后得到一级种子液,将其以2%接种量接种于配方1-5所示的含不同碳源的二级培养基中开始培养,得到二级种子液。厌氧箱(whitley 35,英国)培养条件:厌氧(n2:h2=90:10),37℃。培养24h后用酶标仪(tecan,瑞士)检测od600,结果同样示于下表1中。
72.由表1的od600结果可知,含有蔗糖的二级培养基(配方4)得到的od600最高。因此,蔗糖对于延长布劳特氏菌的生长是优选的碳源。
73.表1:不同成分培养基对延长布劳特氏菌生长的影响
[0074][0075]
实施例2:不同益生元对延长布劳特氏菌生长的影响
[0076]
按照下表2给出的配方1-3所示的成分配制含有不同益生元成分的二级培养基,其中一级培养基与实施例1中的一级培养基相同。-80℃冰箱中取冻存管常温融化,在厌氧箱中以2%接种量接种于一级培养基,培养24h后得到一级种子液,将其以2%接种量接种于配方1-3所示的二级培养基中开始培养,得到二级种子液。厌氧箱(whitley 35,英国)培养条件:厌氧(n2:h2=90:10),37℃。培养24h后用酶标仪(tecan,瑞士)检测od600,结果同样示于下表2中。
[0077]
由表2的od600结果可知,含有大豆低聚糖作为益生元的二级培养基(配方2)得到的od600最高。因此,大豆低聚糖更适合延长布劳特氏菌生长。
[0078]
表2:不同益生元对延长布劳特氏菌生长影响
[0079][0080][0081]
实施例3:非动物源培养基与动物源培养基的比较
[0082]
按照下表3给出的配方1-5所示的成分配制分别具有非动物源和动物源的二级培养基,其中一级培养基与实施例1中一级培养基相同。-80℃冰箱中取冻存管常温融化,在厌氧箱中以2%接种量接种于一级培养基,培养24h后得到一级种子液,将其以2%接种量接种于表3中的二级培养基中,得到二级种子液。厌氧箱(whitley 35,英国)培养条件:厌氧(n2:h2=90:10),37℃。培养24h后用酶标仪(tecan,瑞士)检测od600,并进行活菌计数,结果同样示于下表3。
[0083]
表3:非动物源培养基与动物源培养基的比较
[0084][0085]
如表3所示,现有技术中常以酵母浸粉与胰蛋白胨的组合物为氮源(配方1),但是将其拆分开以后,单独以酵母浸粉为氮源(配方2),od600与配方1无显著差异(p>0.05)。但是以胰蛋白胨单独为氮源(配方4)的od600远低于配方1。此外,非动物源氮源酵母蛋白胨(配方3)的od600与配方1无显著差异。另外,配方5中以蛋白胨为氮源,od600最低。而酵母浸粉与酵母蛋白胨价格均低于胰蛋白胨。
[0086]
实施例4:本发明培养基与原始培养基的比较
[0087]
在本实施例中,根据下表4配制二级培养基,其中,配方1为文献(duncan s h,hold g l,harmsen h j m,et al.growth requirements and fermentation products of fusobacterium prausnitzii,and a proposal to reclassify it as faecalibacterium prausnitzii gen.nov.,comb.nov[j].international journal of systematic and evolutionary microbiology,2002,52(6):2141-2146)中给出的原始培养基配方,配方2为本发明培养基的配方。
[0088]-80℃冰箱中取冻存管常温融化,在厌氧箱中以2%接种量接种于一级培养基中,培养24h后得到一级种子液,将其以2%接种量接种于上述二级培养基中,得到二级种子液,其中原始培养基中的8种维生素成分及其添加量见上述duncan s h等人的文献。厌氧箱(whitley 35,英国)培养条件:厌氧(n2:h2=90:10),37℃。培养24h后用酶标仪(tecan,瑞士)检测od600,并进行活菌计数,结果同样如表4所示。
[0089]
表4:本发明培养基与原始培养基发酵效果比较
[0090][0091][0092]
由表4结果可知,本发明的配方2与配方1相比,od600提高190%以上,活菌数提高约24倍。
[0093]
实施例5:ph对延长布劳特氏菌的高密度发酵培养的影响
[0094]
本实施例中,一级培养基及一级种子液的制备与实施例1相同。二级培养基与实施例4中配方2的培养基相同。延长布劳特氏菌的一级种子液在二级培养基中培养24h后,将其接种于5l发酵罐中(含3l发酵培养基)进行高密度发酵,接种量2%。高密度发酵培养基与二级培养基相同。
[0095]
高密度发酵条件:37℃,厌氧(n2:h2:co2=85:10:5),150rpm。ph通过碱液分别调整为8.0、7.0、6.0以及ph不控制组,以探究不同ph以及不控制ph对延长布劳特氏菌高密度发酵的影响。
[0096]
由图1可知,在不控制ph条件下,接种8h后启动对数生长期,持续6小时发酵至14h达到稳定期。ph8条件下接种10h后启动对数生长期,持续6小时至16h后达到稳定期。在ph6和ph7条件下均于接种6h后启动对数生长,且发酵至12h达到稳定期,其中在ph6.0条件下od600达到最高。
[0097]
实施例6:不同接种量对延长布劳特氏菌生长的影响
[0098]
按照实施例5准备一级、二级种子液及高密度发酵培养基。
[0099]
高密度发酵条件:发酵ph6.5,37℃,厌氧(n2:h2:co2=85:10:5),150rpm,接种量分别为2%、6%、10%,以探究不同接种量条件对延长布劳特氏菌高密度发酵的影响。
[0100]
高密度培养期间od600随时间的变化如图2所示。由图2可知,接种量提高,对于对数生长期的启动并无显著影响,且对于发酵终点od600影响有限,各接种量条件下od600变化曲线重合度较高。此外,在接种量为2%条件下,发酵至12h时,od600最高。提高接种量至
6%、10%,发酵终点od600出现一定程度降低。
[0101]
实施例7:缓冲盐对延长布劳特氏菌的高密度发酵的影响
[0102]
按照实施例5准备一级、二级种子液。
[0103]
高密度发酵培养基分别配制两组:
[0104]
1)缓冲盐组:蔗糖11.42g/l、酵母浸粉21.12g/l、大豆低聚糖1.76g/l、半胱氨酸盐酸盐1.18g/l、磷酸氢二钾0.45g/l、磷酸二氢钾0.45g/l、碳酸氢钠4g/l;
[0105]
2)无缓冲盐组:蔗糖11.42g/l、酵母浸粉21.12g/l、大豆低聚糖1.76g/l、半胱氨酸盐酸盐1.18g/l。
[0106]
高密度发酵培养期间od600随时间的变化如图3所示。由图3可知,在培养基中剔除缓冲盐后,无缓冲盐组生长曲线与添加缓冲盐组生长曲线重合度较高,发酵至od600最高点,尽管无缓冲盐组od600数值低于缓冲盐组,但是差异不显著(p>0.05)。
[0107]
实施例8:补料分批发酵对延长布劳特氏菌的高密度发酵的影响
[0108]
按照实施例5准备一级、二级种子液,按照实施例7的无缓冲盐组配制高密度发酵培养基。
[0109]
高密度发酵条件:ph6.5,37℃,厌氧(n2:h2:co2=85:10:5),150rpm,接种量分别为4%。生长至稳定期后开始补料。
[0110]
半分批补料培养基:蔗糖及大豆低聚糖的混合溶液(蔗糖及大豆低聚糖的浓度分别是实施例4的配方2中相应浓度的10倍)。补料方式分为两种:
[0111]
a组:以5.42g
·
l-1
·
h-1
的总糖速率补入半分批补料培养基;
[0112]
b组:按照2.71g
·
l-1
·
h-1
的总糖速率补入半分批补料培养基。
[0113]
持续分批补料至再次进入稳定期。比较两种补料方式下延长布劳特氏菌生长情况,结果示于图4。由图4可知,在不补料组,od600达到最高点后随培养时间延长而迅速下降。在两种补料速率下,补料组的延长布劳特氏菌的生长情况类似,均未能获得更高的od600,但是可以保持恒定。补入半分批补料培养基可以解决因发酵结束后离心阶段的时间延长而产生的菌体量下降问题。
[0114]
实施例9:延长布劳特氏菌传代稳定性研究
[0115]
延长布劳特氏菌接种于根据实施例5配制的一级培养基中为第一代,本实验中后续传代培养基分为两组:
[0116]
a组传代:2-30代培养基与根据实施例5配制的一级培养基相同;
[0117]
b组传代:2-30代培养基与根据实施例5配制的二级培养基相同。
[0118]
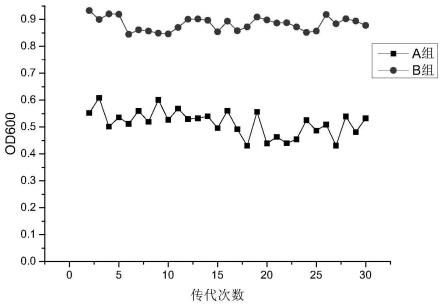
传代接种量1%(v/v),每24h传代一次,连续传代30代。每传一代进行od600检测(结果如图5所示),并通过autof ms1000(安图生物,中国)获得基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)鉴定图谱(结果如图8所示),传代1、10、20、30代通过镜检检测菌株形态(结果如图6、图7所示)。
[0119]
由图5可知,延长布劳特氏菌在b组培养基中传代过程中od600相较于在a组培养基中更加稳定、生长情况稳定。
[0120]
图6和图7分别示出了延长布劳特氏菌在第10、20和30代的传代次数下和第一次传代下的革兰氏染色的菌株形态。延长布劳特氏菌形态呈球形或者椭圆形,成对或者呈链状出现。由图6可知,延长布劳特氏菌在两种培养基中传代时,菌株形态符合上述描述且状态
稳定,无异常变化。在a组中细胞较为分散,多为成对出现。在b组中细胞呈链状出现,与图7状态更为接近。
[0121]
图8示出了延长布劳特氏菌的基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)图谱。由图8可知,该图谱得分最高为9.646,种水平置信,鉴定为延长布劳特氏菌(blautia producta)。(得分说明:[9.5,10]种水平置信,可能为亚种;[9.0,9.5)种水平置信;[6.0,9.0)属水平置信;[0.0,6.0)不可置信)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1