一株类肠膜魏斯氏菌MbWp-142及其产品与应用
142。
11.类肠膜魏斯氏菌主要来源于果酒、泡菜等植物,主要用于植物性产品发酵,在本发明实施例中,其分离得到的类肠膜魏斯氏菌具有良好的产酸能力,因而也具有较好的抑菌特性,能够抑制病原菌,促进宿主生长发育,从而在抗生素替代物方面具有一定的潜在应用价值。
12.在发明实施例中,发明人所分离得到的类肠膜魏斯氏菌mbwp-142具有如下生物学特性:革兰氏阳性菌,无鞭毛、不运动,不形成芽孢,兼性厌氧;菌体形状菌体呈不规则短杆状,两端呈圆形或稍细小,成对或短链排列,其菌落光滑且边缘完整,呈乳白色。最适生长温度为36.5-37.5℃;最适ph值为5.7~7.0。
13.根据本发明的第一个方面,在本发明的一些实施方式中,所述类肠膜魏斯氏菌的16srrna基因的核苷酸序列如seq id no:1所示。
14.在发明实施例中,发明人通过对类肠膜魏斯氏菌mbwp-142进行系统发育树构建,发现其与现有技术中发现的类肠膜魏斯氏菌存在一定的同源性差异。
15.本发明的第二个方面,提供一种含有本发明第一个方面所述类肠膜魏斯氏菌的产品,所述产品的剂型包括固体粉剂、液体菌剂、颗粒接种菌剂、冷冻菌泥液、琼脂载体菌剂。
16.当然,本领域技术人员也可以根据实际使用需求,合理调整其剂型选择,使其获得更高的贮藏存活率或使用效果。
17.根据本发明的第二个方面,在本发明的一些实施方式中,所述产品为类肠膜魏斯氏菌包埋冻干粉。
18.在本发明实施例中,发明人通过采用冻干粉的方式,有效的提高了其贮藏存活率,其相比于正常贮藏,有效活菌数提高了近10000倍。在本发明实施例中,该类肠膜魏斯氏菌包埋冻干粉活菌数大于1000亿cfu/g,经25℃贮藏6个月活菌存活率为60%以上。而且,本发明实施例中的制备方法是在非严格厌氧环境下进行包埋冻干处理,在冻干处理前分步骤使用多种价格低廉且容易获得的抗氧化成分对类肠膜魏斯氏菌进行微胶囊化包埋处理,有效防止氧气与类肠膜魏斯氏菌细胞膜系统的相互作用,从而阻止损害dna合成的行为,并且能够清除在菌株冻干前产生的自由基,从而预防干燥过程中的氧化损伤,并使类肠膜魏斯氏菌在常温贮藏条件下不易失活。
19.上述方法不仅限于对本发明中的类肠膜魏斯氏菌mbwp-142进行冻干,还适用于对其它兼性厌氧菌的冻干处理,以获得相同或者相似的效果。
20.在本发明的一些实施方式中,所述类肠膜魏斯氏菌包埋冻干粉的制备原料包括本发明第一个方面所述的类肠膜魏斯氏菌、海藻酸钠、碳酸钙、乳粉、大豆油、醋酸盐和辅剂。
21.当然,本领域技术人员可以根据实际使用需求,合理添加其他用于包埋或提高包埋效果的材料,包括但不限于海藻酸钠、碳酸钙、乳粉、大豆油。
22.在本发明的一些实施方式中,所述大豆油中添加有冰乙酸或吐温。
23.在本发明的一些实施方式中,所述大豆油为含0.3~0.7%(v/v)冰乙酸的大豆油。
24.在本发明的一些实施方式中,所述大豆油为含0.5%(v/v)冰乙酸的大豆油。
25.在本发明的一些实施方式中,所述大豆油为含1~2%(v/v)吐温的大豆油。
26.在本发明的一些实施方式中,所述大豆油为含1.5%(v/v)吐温的大豆油。
27.在本发明的一些实施方式中,所述海藻酸钠、碳酸钙、乳粉均为其与水配置而成的
水溶液。
28.在本发明的一些实施方式中,海藻酸钠水溶液、碳酸钙水溶液、类肠膜魏斯氏菌菌液、醋酸盐水溶液、乳粉水溶液、含冰乙酸的大豆油的质量比为10~15:3~6:1~4:200~230:350~370:390~420。
29.在本发明的一些实施方式中,海藻酸钠水溶液、碳酸钙水溶液、类肠膜魏斯氏菌菌液、醋酸盐水溶液、乳粉水溶液、含冰乙酸的大豆油的质量比为13:5:3:214:366:400。
30.在本发明的一些实施方式中,所述类肠膜魏斯氏菌菌液中活菌数为2000~3000亿cfu/g。
31.在本发明的一些实施方式中,所述类肠膜魏斯氏菌菌液中活菌数为2500亿cfu/g。
32.在本发明的一些实施方式中,所述海藻酸钠水溶液的质量浓度为3~8wt%。
33.在本发明的一些实施方式中,所述海藻酸钠水溶液的质量浓度为5wt%。
34.在本发明的一些实施方式中,所述碳酸钙水溶液的质量浓度为(45~55)wt%。
35.在本发明的一些实施方式中,所述碳酸钙水溶液的质量浓度为50wt%。
36.在本发明的一些实施方式中,所述醋酸盐水溶液的质量浓度为(40~60)wt%。
37.在本发明的一些实施方式中,所述醋酸盐水溶液的质量浓度为50wt%。
38.在本发明的一些实施方式中,所述醋酸盐为醋酸钠。
39.在本发明的一些实施方式中,所述乳粉为脱脂乳粉,所述脱脂乳粉水溶液的质量浓度为(10~20)wt%。
40.在本发明的一些实施方式中,所述脱脂乳粉水溶液的质量浓度为15wt%。
41.在本发明的一些实施方式中,所述辅剂包括乳化剂、ph调节剂、冻干保护剂、载体、溶剂。
42.当然,本领域技术人员可以根据实际使用需求,合理添加其他辅剂,包括但不限于乳化剂、ph调节剂、冻干保护剂、载体、溶剂。
43.在本发明的一些实施方式中,所述类肠膜魏斯氏菌包埋冻干粉的活化方法为:向类肠膜魏斯氏菌包埋冻干粉中加入0.3~0.5ml的复苏溶解液,然后将溶液转接至1~2个mrs琼脂平板和mrs液体培养基中,36.5-37.5℃复苏培养24-72h,鉴定无误后确认其纯度再继续进行传代培养。
44.在本发明的一些实施方式中,所述复苏溶解液为mrs液体培养基。
45.在本发明的一些实施方式中,所述mrs液体培养基组分为:按质量份计,酪蛋白酶消化物10份,牛肉膏10份,酵母膏粉4份,磷酸氢二钾2份,柠檬酸三铵2份,乙酸钠5份,硫酸镁(mgso4·
7h2o)0.2份,硫酸锰(mnso4·
4h2o)0.05份,磷酸氢二钾2份,葡萄糖20份,吐温80 1份,水1000份,ph值为7.0
±
0.2。
46.使用本发明实施例中的类肠膜魏斯氏菌包埋冻干粉在制备食品、饲料及医药保健产品过程中,其在常温贮藏过程中不易失活,货架期内能够有效保证活菌数,从而保证食品、饲料及医药保健产品等产品的功效。
47.本发明的第三个方面,提供一种类肠膜魏斯氏菌包埋冻干粉的制备方法,包括如下步骤:
48.取本发明第一个方面所述的类肠膜魏斯氏菌,加入海藻酸钠、碳酸钙和部分大豆油,充分乳化后再加入乳粉、剩余大豆油和醋酸盐,离心,除去上清后冷冻干燥即得。
49.在本发明的一些实施方式中,所述制备方法具体为:
50.在厌氧环境下,取本发明第一个方面所述的类肠膜魏斯氏菌,加入提前灭菌处理的海藻酸钠溶液与碳酸钙溶液,然后再加入一部分大豆油(所述大豆油中添加有乳化剂),充分搅拌乳化。在非严格厌氧环境中,向乳化后的溶液中加入脱脂乳粉和剩余的大豆油(所述大豆油中添加有ph调节剂),充分搅拌混匀。再加入醋酸盐,静置2~2.5h,离心,除去上清得到类肠膜魏斯氏菌包埋微胶囊,冷冻干燥得到冻干粉。
51.在本发明的一些优选实施方式中,所述乳化剂为吐温。
52.在本发明的一些实施方式中,第一次加入的大豆油为含1~2%(v/v)吐温的大豆油。
53.在本发明的一些实施方式中,第一次加入的大豆油为含1.5%(v/v)吐温的大豆油。
54.在本发明的一些优选实施方式中,所述ph调节剂为冰乙酸。
55.在本发明的一些实施方式中,第2次加入的大豆油为含0.3~0.7%(v/v)冰乙酸的大豆油。
56.在本发明的一些实施方式中,第2次加入的大豆油为含0.5%(v/v)冰乙酸的大豆油。
57.当然,本领域技术人员也可以根据实际使用需求合理选择其他乳化剂和ph调节剂,包括但不限于吐温80和冰乙酸。
58.在本发明的一些优选实施方式中,所述制备方法还包括对类肠膜魏斯氏菌包埋微胶囊进行洗涤,洗涤液为生理盐水,洗涤次数为2~3次。
59.在本发明的一些实施方式中,海藻酸钠水溶液、碳酸钙水溶液、类肠膜魏斯氏菌菌液、醋酸盐水溶液、乳粉水溶液、含冰乙酸的大豆油的质量比为10~15:3~6:1~4:200~230:350~370:390~420。
60.在本发明的一些实施方式中,海藻酸钠水溶液、碳酸钙水溶液、类肠膜魏斯氏菌菌液、醋酸盐水溶液、乳粉水溶液、含冰乙酸的大豆油的质量比为13:5:3:214:366:400。
61.在本发明的一些实施方式中,所述类肠膜魏斯氏菌菌液中活菌数为2000~3000亿cfu/g。
62.在本发明的一些实施方式中,所述类肠膜魏斯氏菌菌液中活菌数为2500亿cfu/g。
63.在本发明的一些实施方式中,所述海藻酸钠水溶液的质量浓度为3~8wt%。
64.在本发明的一些实施方式中,所述海藻酸钠水溶液的质量浓度为5wt%。
65.在本发明的一些实施方式中,所述碳酸钙水溶液的质量浓度为(45~55)wt%。
66.在本发明的一些实施方式中,所述碳酸钙水溶液的质量浓度为50wt%。
67.在本发明的一些实施方式中,所述醋酸盐水溶液的质量浓度为(40~60)wt%。
68.在本发明的一些实施方式中,所述醋酸盐水溶液的质量浓度为50wt%。
69.在本发明的一些实施方式中,所述醋酸盐为醋酸钠。
70.在本发明的一些实施方式中,所述乳粉为脱脂乳粉,所述脱脂乳粉水溶液的质量浓度为(10~20)wt%。
71.在本发明的一些实施方式中,所述脱脂乳粉水溶液的质量浓度为15wt%。
72.本发明的第四个方面,提供本发明第一个方面所述的类肠膜魏斯氏菌在制备改善
或治疗炎症的药物中的应用。
73.在本发明的一些实施方式中,所述炎症包括结肠炎。
74.在本发明实施例中,发明人通过结肠炎小鼠模型验证了本发明第一个方面所述的类肠膜魏斯氏菌能够显著改善或治疗结肠炎,从而说明类肠膜魏斯氏菌mbwp-142具有炎症改善或治疗功能。
75.本发明的第五个方面,提供本发明第一个方面所述的类肠膜魏斯氏菌在制备发酵产品中的应用。
76.根据本发明的第五个方面,在本发明的一些实施方式中,所述产品包括药物、食品、饲料、饲料添加剂和化妆品。
77.在本发明的一些实施方式中,所述食品包括酸奶、奶酪、发酵酒、发酵蔬菜或其他发酵食品。
78.本发明的有益效果是:
79.1.本发明提供了一种类肠膜魏斯氏菌,其命名为类肠膜魏斯氏菌mbwp-142,该类肠膜魏斯氏菌具有良好的产酸能力和抗胆盐效果,因而也具有较好的抑菌特性,能够抑制病原菌,促进宿主生长发育,具有极为广泛的应用价值。而且,通过试验验证,还发现了该类肠膜魏斯氏菌具有炎症治疗效果,而且在食品发酵中也具有较好的应用效果。
80.2.本发明还提供了一种含有上述类肠膜魏斯氏菌mbwp-142的冻干粉产品及其制备方法,该方法工艺简单,原材料成本低廉,能够极大的提高类肠膜魏斯氏菌的贮藏存活率,从而为类肠膜魏斯氏菌产品的再开发和利用提供了有效的技术支持。
附图说明
81.图1为类肠膜魏斯氏菌mbwp-142的革兰氏染色显微镜观察图。
82.图2为类肠膜魏斯氏菌mbwp-142的系统发育树。
83.图3为类肠膜魏斯氏菌mbwp-142的生长曲线图,横坐标为时间(h)。
84.图4为本发明实施例中的类肠膜魏斯氏菌mbwp-142冻干粉的贮藏稳定性结果图。
85.图5为本发明实施例中的各组小鼠疾病活动指数dai评分图。
86.图6为本发明实施例中的各组小鼠血清中ifn、il-6、il-10、il-1β、lps水平的检测结果。
87.图7为本发明实施例中的各组小鼠血清中no、mpo以及gsh-px水平的检测结果。
88.图8为本发明实施例中的各组小鼠小肠病理切片图。
89.图9为本发明实施例中的各组小鼠结肠长度对比图。
90.图10为本发明实施例中的dss+mbwp-142活菌(l142)的液相色谱图。
91.图11为类肠膜魏斯氏菌mbwp-142发酵流变学特性变化图。
92.图12为类肠膜魏斯氏菌mbwp-142在不同温度条件下的对比图。
93.图13为类肠膜魏斯氏菌mbwp-142随发酵时间的产酸变化图,横坐标为时间(min)。
具体实施方式
94.为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅
是为了解释本发明,并非为了限定本发明。
95.所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
96.类肠膜魏斯氏菌mbwp-142的获得
97.本发明实施例中的类肠膜魏斯氏菌mbwp-142(weissella paramesenteroides mbwp-142)是发明人从岭南桑果园自然发酵6~18个月的桑葚果酒(购自广州永和镇创鲜果桑采摘园)中分离得到的具有耐酸和耐胆汁酸功能的益生菌。该菌株已于2022年2月11日在广东省微生物菌种保藏中心(保藏地址:广州市先烈中路100号大院59号楼5楼)进行保藏,保藏编号为gdmcc no:62249。其分类命名为weissella paramesenteroides。
98.在本发明实施例中,发明人所分离得到的类肠膜魏斯氏菌mbwp-142具有如下生物学特性:革兰氏阳性菌(革兰氏染色结果如图1所示),无鞭毛、不运动,不形成芽孢,兼性厌氧;菌体形状菌体呈不规则短杆状,两端呈圆形或稍细小,成对或短链排列,其菌落光滑且边缘完整,呈乳白色。最适生长温度为36.5-37.5℃;最适ph值为5.7~7.0。
99.采用16s rrna sanger双脱氧测序对上述类肠膜魏斯氏菌mbwp-142进行鉴定(交由广州蓝光生物技术有限公司完成),其序列为:
[0100]5’‑
ctcaggatgaacgctggcggcgtgcctaatacatgcaagtcgaacgctttgtctt taattgatatgacgagcttgctctgatgtgattttatctgacaaagagtggcgaacgggtgagtaacacgtgggtaacctacctcttagcaggggataacatttggaaacaagtgctaataccgtataataccaacaaccgcatggttgttggttgaaagatggttctgctatcactaagagatggacccgcggtgcattagctagttggtaaggtaatggcttaccaaggcaatgatgcatagccgagttgagagactgatcggccacaatgggactgagacacggcccatactcctacgggaggcagcagtagggaatcttccacaatgggcgcaagcctgatggagcaacgccgcgtgtgtgatgaagggtttcggctcgtaaaacactgttataagagaagaacggcactgagagtaactgttcagtgtgtgacggtatcttaccagaaaggaacggctaaatacgtgccagcagccgcggtaatacgtatgttccaagcgttatccggatttattgggcgtaaagcgagcgcagacggttatttaagtctgaagtgaaagccctcagctcaactgaggaatggctttggaaactggatgacttgagtgcagtagaggaaagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaacaccagtggcgaaggcggctttctggactgtaactgacgttgaggctcgaaagtgtgggtagcaaacaggattagataccctggtagtccacaccgtaaacgatgagtgctagatgttcgagggtttccgcccttgagtgtcgcagctaacgcattaagcactccgcctggggagtacgaccgcaaggttgaaactcaaaggaattgacggggacccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatcccttgctaatcctagaaataggacgttcccttcggggacaaggtgacaggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttattattagttgccagcattcagttgggcactctagtgagactgccggtgacaaaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatggcatatacaacgagtcgccaacccgcgagggtgcgctaatctcttaaagtatgtctcagttcggattgtaggctgcaactcgcctacatgaagtcggaatcgctagtaatcgcggatcagcacgccgcggtgaatacgttcccgggtcttgtacacaccgcccgtcacaccatgag-3’(seq id no:1)。
[0101]
构建类肠膜魏斯氏菌mbwp-142的系统发育树,结果如图2所示。
[0102]
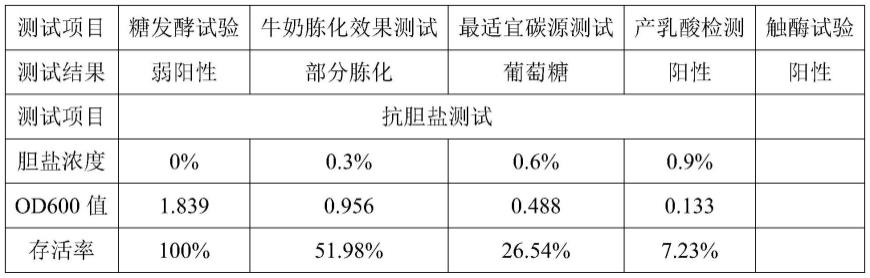
类肠膜魏斯氏菌mbwp-142的生长曲线以及相关理化性质如图3和表1所示。
[0103]
其中,理化性质测试包括糖发酵试验、牛奶胨化效果测试、最适宜碳源测试、产乳酸检测、抗胆盐测试(使用含有不同含量的胆盐的mrs培养基进行培养)、触酶试验。
[0104]
其中,糖发酵试验、牛奶胨化效果测试和触酶试验方法参考《益生菌》(《乳业科学与技术丛书》编委会,乳业生物技术国家重点实验室编.乳业科学与技术丛书益生菌.北京:化学工业出版社,2016.01.)。最适宜碳源测试方法参考文献(赵国声,韩浩.蛹虫草菌丝液体培养基中适宜碳源和氮源的研究[j].河北农业科学,2011,15(08):39-41.);产乳酸检测方法参考(吴锦兰,付玉麟,周小玲,陈正培,熊建文,崔娜,巩僖.酸笋中高产乳酸乳酸菌的筛选、鉴定及发酵条件优化[j].中国酿造,2021,40(01):65-69.)。
[0105]
表1类肠膜魏斯氏菌mbwp-142的理化性质
[0106][0107]
实施例1类肠膜魏斯氏菌mbwp-142冻干粉
[0108]
(1)类肠膜魏斯氏菌mbwp-142菌泥的制备:
[0109]
取上述实施例中分离获得的类肠膜魏斯氏菌mbwp-142,使用mrs液体培养基(购于广东环凯微生物)37℃厌氧培养24小时,传代培养2次得到种子液。取适量种子液接种至发酵培养基中37℃恒温厌氧发酵,得到类肠膜魏斯氏菌mbwp-142高密度培养液(测得培养液中类肠膜魏斯氏菌mbwp-142活菌数为10亿cfu/ml)。5000rpm离心15min,去除上清,得到类肠膜魏斯氏菌mbwp-142菌泥(测得菌泥中类肠膜魏斯氏菌mbwp-142活菌数为2500亿cfu/g)。
[0110]
其中,上述发酵培养基的组分为:按质量份计,酪蛋白酶消化物10份(购自广东环凯微生物),牛肉膏10份,酵母膏粉4份,磷酸氢二钾2份,柠檬酸三铵2份,乙酸钠5份,硫酸镁(mgso4·
7h2o)0.2份,硫酸锰(mnso4·
4h2o)0.05份,磷酸氢二钾2份,葡萄糖20份,吐温80 1份,水1000份,ph值为7.0。
[0111]
(2)微胶囊包埋:
[0112]
在本实施例中,按照下述方法先制备包埋预制液,具体包括:
[0113]
包埋预制液1:将0.02kg海藻酸钠加水配制成5%的水溶液,经115℃灭菌15min,即得;
[0114]
包埋预制液2:将0.07kg碳酸钙加水配制成50%溶液,经115℃灭菌15min,即得;
[0115]
包埋预制液3:将0.05kg醋酸盐(在本实施例中,醋酸盐为醋酸钠)加水配制成50%溶液,经115℃灭菌15min,即得;
[0116]
包埋预制液4:将1kg脱脂乳粉加水配制成15%溶液,经115℃灭菌7min,即得;
[0117]
包埋预制液5:将含有0.5%(v/v)冰乙酸的大豆油经115℃灭菌7min,即得。
[0118]
在厌氧环境中,向步骤(1)中获得的类肠膜魏斯氏菌mbwp-142菌泥中加入包埋预制液1和2(即5wt%海藻酸钠溶液与50wt%碳酸钙溶液)混合均匀后再加入40ml含有600μl吐温80的大豆油,4℃条件下400r/min搅拌15min,充分乳化混合。在非严格厌氧环境中,向
混合液中继续加入10ml包埋预制液4(即15wt%脱脂乳粉溶液)和10ml包埋预制液5(即含0.5%冰乙酸的大豆油),4℃条件下400r/min搅拌30min。搅拌完成后加入60ml ph为5.5的包埋预制液3(即50wt%醋酸盐溶液),放置2h。4000rpm离心10min,得到类肠膜魏斯氏菌mbwp-142微胶囊。
[0119]
(3)类肠膜魏斯氏菌mbwp-142冻干粉的制备:
[0120]
用生理盐水洗涤3次上述类肠膜魏斯氏菌mbwp-142微胶囊,液氮速冻至-50℃,真空干燥(真空度≤30pa)35h后得到类肠膜魏斯氏菌mbwp-142冻干粉。
[0121]
实施例2类肠膜魏斯氏菌mbwp-142冻干粉
[0122]
步骤同实施例1,区别在于,在步骤(2)中,15wt%脱脂乳粉溶液的加入量为20ml,含0.5%冰乙酸的大豆油的加入量为20ml。
[0123]
类肠膜魏斯氏菌mbwp-142冻干粉的效果测试
[0124]
取上述实施例1中的类肠膜魏斯氏菌mbwp-142冻干粉,使用本领域常规的活菌数检测方法对25℃贮藏6个月(180天)后的活菌数进行测定,计算其活菌存活率。以不进行包埋的类肠膜魏斯氏菌mbwp-142冻干粉作为对照。
[0125]
结果如图4所示。
[0126]
可以发现,未经过包被处理的类肠膜魏斯氏菌mbwp-142冻干粉在经过25℃贮藏6个月后,其活菌数为10亿cfu/g左右,相比贮藏前,存活率仅为0.06%。而实施例1中的类肠膜魏斯氏菌mbwp-142冻干粉在经过25℃贮藏6个月后,其活菌数为1000亿cfu/g左右,相比贮藏前,存活率为60%。由上述结果可知,上述方法制备得到的类肠膜魏斯氏菌mbwp-142冻干粉,通过采用微胶囊包埋处理,有效减少了菌体对外界不良环境的胁迫作用,减少细胞损伤,提高了类肠膜魏斯氏菌mbwp-142的贮藏稳定性,避免了其在常温贮藏过程中易失活,货架期内无法有效保证活菌数,影响其功效的弊端,可以广泛应用于食品、饲料及医药产品中,稳定产品品质和发挥其健康功效。
[0127]
实施例2中的类肠膜魏斯氏菌mbwp-142冻干粉的测试效果同实施例1。
[0128]
类肠膜魏斯氏菌mbwp-142对急性结肠炎的改善和治疗作用
[0129]
在本发明实施例中,发明人采用动物试验的方式验证上述类肠膜魏斯氏菌mbwp-142在改善和治疗急性结肠炎中的作用。
[0130]
在本实施例中,所用的受试动物为48只spf级c57bl/6j小鼠(体重为19~21g),购于广东维通利华实验动物技术有限公司,将所有实验小鼠置于佛山科学技术学院食品科学与工程学院实验动物中心的无菌spf实验室进行为期3天的安全检查,48只c57bl/6j小鼠通过自由饮水进食适应环境7天后根据体重分为空白组、dss造模组、阳性药组,mbwp-142活菌组、mbwp-142死菌组、mbwp-142益生元组以上6组,每组八只,每组分为两笼,每笼4只,同时在对小鼠进行分组的时候打耳标进行标记,以及在笼子上做好标记。在此期间,小鼠被给予充足的水和饲料,控制spf实验室的温度恒定在23~142℃,相对湿度为40~50%,按照12h光照和12h黑暗的照明周期为控制自动切换系统,室内光照强度控制在15~20勒克斯。
[0131]
具体试验步骤为:
[0132]
取试验小鼠在23~25℃和12h光照/黑暗的周期下熟悉正常饮食,进行7天的适应。然后将dss造模组、阳性药组,活菌组、死菌组、益生元组5个组别的40只c57bl/6j小鼠自由饮用4%dss溶液并同时作出如下处理,以构建急性结肠炎(uc)模型。分别在第1、3、5天换水
三次。所有组的饲料不加限制,可自由食用。在实验7天期间,均为每天对所有组中的小鼠进行称重、灌胃和观察,收集并观察小鼠粪便,第8天处死小鼠,对所有小鼠实施安乐死。
[0133]
各组具体处理情况为:
[0134]
(1)空白组(ck):不饮用4%dss溶液,自由饮用蒸馏水,每日灌胃生理盐水;
[0135]
(2)dss造模组(dss):自由饮用4%dss溶液,每日灌胃生理盐水;
[0136]
(3)阳性药组(sasp):自由饮用4%dss溶液,每天灌胃0.142g/l的柳氮磺吡啶水溶液,灌胃量为0.2ml/10g小鼠体重。
[0137]
(4)mbwp-142活菌组(l142):自由饮用4%dss溶液,每天灌胃1
×
108cfu/ml mbwp-142活菌菌液,灌胃量为0.2ml/10g小鼠体重。;
[0138]
(5)mbwp-142死菌组(d142):自由饮用4%dss溶液,每天灌胃1
×
108cfu/ml mbwp-142死菌菌液(复水后65℃保温10min),灌胃量为0.2ml/10g小鼠体重。
[0139]
(6)mbwp-142益生元组(p142):自由饮用4%dss溶液,每天灌胃0.2ml/10g小鼠体重的mbwp-142培养液代谢物溶液。
[0140]
其中,类肠膜魏斯氏菌mbwp-142菌液为:取上述实施例1中制备得到的类肠膜魏斯氏菌mbwp-142冻干粉用无菌生理盐水配制成1
×
108cfu/ml的菌悬液。mbwp-142培养液代谢物溶液的制备方法为:将mbwp-142活菌液离心,过滤去除菌泥后得到的滤液。
[0141]
期间,每日对各组试验小鼠的生理状态进行观察,包括其毛发光亮、毛发粗糙程度、粪便粘稠度、腹泻与便血情况、对刺激的反应、震颤、痉挛、沉睡卧倒情况,每日定期收集小鼠粪便并称量体重。
[0142]
其中,使用粪便隐血试剂盒,对小鼠的血便、大便稠度和体重减轻进行记录。疾病活跃指数(disease activity index,dai)评分是体重降低百分比例、代表腹泻情况的粪便粘稠程度和粪便潜血三个指标的加总,评分标准详情如下表2所示。
[0143]
表2 dai评分标准
[0144]
评分体重下降百分比粪便粘稠度粪便潜血00正常阴性11~5%软便浅蓝25~10%粘液样便蓝色310~20%稀液状便深蓝4》20% 肉眼血便
[0145]
将收集的各组小鼠的体重下降百分比、粪便粘稠度和粪便潜血三项评价得分综合起来进行疾病活动评分,结果如图5所示。
[0146]
将体重下降百分比例、粪便粘稠程度和粪便潜血三项评价得分综合起来进行疾病活动评分,结果如图5显示,其中dss组出现明显的体重下降,且表现出液化粪便和肉眼可见的便血症状,表明dss造模结肠炎成功。与dss模型组相比,mbwp-142对正常小鼠无显著影响,且可以显著缓解dss小鼠体重减轻、液化粪便以及便血等症状,同时下调dai评分。
[0147]
对实验小鼠麻醉后进行眼球取血,得到的血浆在4℃条件下3 000rpm离心5min,吸取上清,分装保存于-20℃,备用。使用elisa试剂盒测定血清中的ifn、il-6、il-10、il-1β、lps、no、mpo以及gsh-px水平。
[0148]
结果如图6和图7所示。
[0149]
与dss组相比,灌胃l142、d142、p142以及柳氮磺吡啶组的小鼠血清均有不同程度降低促炎性细胞因子水平、提高抗炎性细胞因子水平的作用。灌胃l142的整体效果优于d142,d142优于p142,而柳氮磺吡啶的效果较差。l142、d142、p142的效果较柳氮磺吡啶组更为显著。
[0150]
ifn-γ被认为是一种促炎性细胞因子,因为它能增强tnf的活性并诱导一氧化氮(no);il-1β是一种有效促炎细胞因子,主要由淋巴细胞、巨噬细胞以及单核细胞分泌产生。当有病毒感染或者发生炎症后,模式识别受体(prr)和toll样受体(tlr)表达增多导致il-1β表达增强。il-6是一种多效性促炎细胞因子,不仅影响免疫系统,还在其他系统和生理机制中发挥作用,如调节细胞生长,以及细胞活化、增殖、存活和分化;白细胞介素10(il-10),也被称为人类细胞因子合成抑制因子(csif),是一种抗炎细胞因子;脂多糖(lps)是免疫细胞(包括b细胞,单核细胞,巨噬细胞和其他lps反应性细胞)的强活化剂,这些免疫细胞需要lps等免疫原性刺激物,才能产生细胞因子。
[0151]
与dss组相比,灌胃l142、d142、p142以及柳氮磺吡啶在降低ifn-γ的水平效果显著,但在降低il-1β和il-6水平上的效果显著性较低,l142的摄入在促进il-1β、il-6和lps两种细胞因子和免疫反应标志物的调节中都发挥了极为显著的效果;d142的摄入在促进ifn-γ、il-1β、il-6和il-10四种细胞因子的调节中发挥了显著的效果;p142的摄入在促进ifn-γ、il-1β和il-10三种细胞因子和免疫反应标志物的调节中都发挥了显著的效果;柳氮磺吡啶则只在il-6和il-10两种细胞因子和免疫反应标志物的调节中发挥了较为显著的效果。
[0152]
将结肠从小鼠器官中分离,用钢尺对其进行测量,记录结肠长度,同时拍照记录。小鼠结肠处理干净后,剪下距肛门1-2cm处的结肠1cm左右收集到1.5ml ep管中,同时注入1ml多聚甲醛溶液固定,做好标记,备用。取实验小鼠小肠组织制作小肠组织切片并进行h&e染色。
[0153]
一氧化氮(no)是一种反应性自由基,在神经传递、免疫反应、细胞凋亡等重要生理功能中发挥重要作用,体内no水平和信号失调常发生于某些疾病状态,浓度水平合适的no对于保护肝脏等器官缺血性损伤很重要,长期高浓度no可能引发多种癌症、炎症,包括青少年糖尿病、多发性硬化、关节炎、溃疡性结肠炎。mpo是中性粒细胞的功能标志和激活标志,其水平及活性变化代表着嗜中性多形核白细胞(pmn)的功能和活性状态。谷胱甘肽过氧化物酶(glutathione peroxidase,gsh-px)是机体内广泛存在的一种重要的过氧化物分解酶。gsh-px的活性中心是硒半胱氨酸,其活力大小可以反映机体硒水平。与dss组相比,灌胃l142、d142和p142在调节no、mpo以及gsh-px的水平效果显著,柳氮磺吡啶则不具有显著性。
[0154]
结果如图8和图9所示。
[0155]
根据对各组小鼠进行组织学分析评分,并结合小鼠小肠病理切片结果(图8)和各组结肠长度对比图(图9),可以发现,相比ck组,dss组出现显著的结肠炎病理特征,说明结肠炎造模无误。而相比ck组,l142组并未出现显著变化,其组织形态良好,未出现炎症浸润等现象,说明类肠膜魏斯氏菌mbwp-142并不会引发炎症等相关问题。而相比于dss组,l142组的炎症浸润情况显著缓解,说明类肠膜魏斯氏菌mbwp-142显著缓解了dss引起的肠道损伤。且使用类肠膜魏斯氏菌mbwp-142及其代谢物喂养的小鼠结肠长度最佳,从而证明了类肠膜魏斯氏菌mbwp-142可以缓解因dss引起的肠道损伤,具有改善或治疗结肠炎的作用。
[0156]
采用液相色谱法(liquid chromatography,lc)测定粪便中短链脂肪酸(乙酸、丙酸、异丁酸、正丁酸和异戊酸)的浓度。
[0157]
结果如图10(l142组小鼠粪便短链脂肪酸液相色谱图)所示。
[0158]
与dss模型组相比,mbwp-142可以显著提高粪便短链脂肪酸的水平,有利于肠道健康。
[0159]
类肠膜魏斯氏菌mbwp-142发酵效果测试
[0160]
发明人为了进一步探究其在食品发酵领域的可行性,取上述实施例1中制备得到的类肠膜魏斯氏菌mbwp-142冻干粉用无菌生理盐水配制成1
×
108cfu/ml的菌悬液,然后加入10wt%的脱脂乳粉和8wt%的白砂糖进行混合发酵,发酵温度为37℃。
[0161]
(1)流变学特性检测:
[0162]
使用粘度计分析其发酵过程中的流变学特性变化。
[0163]
结果如图11所示。
[0164]
(2)发酵温度优化:
[0165]
按照上述组分配方,分别检测类肠膜魏斯氏菌mbwp-142在不同的发酵温度(25、28、31、34、37和42℃)下发酵产品中的活菌情况(以od600进行标表征)。
[0166]
结果如表3和图12所示。
[0167]
表3不同发酵温度下的类肠膜魏斯氏菌mbwp-142的活菌情况
[0168]
温度/℃od600nm250.413280.444311.197341.543371.821420.480
[0169]
结果发现,类肠膜魏斯氏菌mbwp-142在28~42℃条件下的发酵效果最佳,此时的活菌数和菌活力最佳。
[0170]
(3)产酸效果:
[0171]
按照上述组分配方,在发酵开始3h后使用ph计监控发酵产品中的酸度变化。
[0172]
结果如图13所示。
[0173]
可以发现,类肠膜魏斯氏菌mbwp-142的产酸效果稳定,在发酵1410min后进入稳定期,获得的产品ph值约为4.2,具有较好的产酸性能。
[0174]
上述结果说明,类肠膜魏斯氏菌mbwp-142可以有效用于食品发酵领域,其发酵效果优异。
[0175]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1