用于增强PKLR的基因表达的组合物和方法与流程
发明领域本发明涉及丙酮酸激酶缺乏症的基因疗法。
背景技术:
0、发明背景
1、丙酮酸激酶缺乏症(pkd)是由pklr基因突变引起的单基因代谢疾病,其导致可变症状的溶血性贫血,并且在新生儿期可能是致命的。pkd隐性遗传性状及其通过同种异体骨髓移植的治愈性治疗为开发基因治疗方法提供了理想的方案。
2、在影响红细胞的许多其他遗传性酶缺乏中,丙酮酸激酶缺乏症(pkd)是引起慢性非球形红细胞性溶血性贫血(chronic nonspherocytic hemolytic anemia,cnsha)的最常见因素(zanella等,2007)。pkd的发作和严重性变化很大,范围从轻微到严重的新生儿贫血,在最严重的病例中在童年期间变得致命(pissard等2006)。新生儿期间的生长迟缓、胎儿水肿和死亡也以低频率有过报道(gilsanz等,1993)。一般高加索人群中pkd患病率估计为1:20,000(beutler等,2000),到目前为止,在pklr基因中已鉴定出超过195种不同的突变(http://www.lovd.nl/pklr)。同种异体骨髓移植(bmt)已被成功用于治愈严重pkd患者(tanphaichitr等2000),但组织相容性供体的低可得性和与这些患者的bmt相关的严重并发症(即移植物抗宿主病、机会性感染等)使得定期输血和脾切除术成为大多数pkd的严重形式的主要治疗选择(zanella等2005),这大大提高了患者的发病率和死亡率(hilgard等2005)。对于严重pkd患者及其隐性遗传性状的治疗选择的有限功效和副作用使得pkd成为通过基因疗法治疗的合适疾病。
3、pkd是由丙酮酸激酶(pk)中的缺陷引起的(zanella 2005),该酶催化所有细胞中糖酵解途径的最后atp产生反应。在成熟的红细胞中,pk变得必不可少,因为rbc仅表达r型特异性同种型(rpk)(kanno等1992),这归因于pklr基因座的红系特异性替代启动子的调节(noguchi等1987)。因此,任何rpk活性的丧失都会损害rbc代谢和寿命(zanella 2005),导致cnsha。
4、治疗和预防遗传和其他疾病和病症的一种有希望的方法是用基因治疗载体递送治疗剂。目前,病毒载体在基因转移中表现出最大的效率,并且为了校正遗传疾病而使得需要持久的基因表达,疱疹病毒、逆转录病毒、慢病毒、腺病毒或基于aav的载体因病毒生命周期的整合性质而为理想的载体。
5、单基因疾病,特别是那些影响造血系统的疾病的基因疗法,已经提供了令人信服的证据,即自体造血干细胞(hsc)的遗传校正是对同种异体hsct的替代治疗选择,避免了其主要并发症(cartier等2009;cavazzana-calvo等2010;cartier等2012;aiuti等2013;biffi等2013)。对影响红细胞的疾病(例如β地中海贫血和镰状细胞病)的遗传校正已在动物模型(pestina等2009l breda等2012)以及也在人(cavazzana-calvo等2010)中得到解决。然而,遗传性红系代谢缺陷诸如pkd的基因治疗方法仍然有限。已经在小鼠(tani等1994;meza等2009)和狗rpk缺陷型实验模型(trobridge等2012)中证实了hsc基因疗法治疗pkd的可行性,鉴于缺乏供体基因校正的hsc的选择优势,这些实验结果显示了供体嵌合和转导水平是实现溶血表型的高效校正的关键点(richard等,2004)。先前使用pkd小鼠模型的工作表明,当移植超过25%的遗传修正细胞时,逆转录病毒来源的人rpk表达能够完全校正pkd表型(meza等2009)。最近在一只注入体内扩增和泡沫载体校正的hsc的pkd basenji狗中报道了校正细胞的相似治疗阈值(trobridge等,2012)。
6、在设计用于基因疗法的多核苷酸盒和表达载体方面仍然存在许多挑战。一个重要的挑战是在靶细胞中获得足够的转基因表达。本领域中一个长期未满足的需求是基因转移后转基因的足够稳健的表达。在一些情况下,某些载体(例如质粒dna载体)的功效需要更高效的表达。在其他情况下,需要更高效的基因表达盒以允许具有更有利的安全性谱或较低侵入性施用途径的较低治疗剂量。
7、当使用γ逆转录病毒(γ-rv)载体时,由于治疗性转基因表达受其ltr序列调节的事实,可以实现高水平的转基因表达。然而,基于此类型载体的首次临床试验引起了安全性问题,因为几个患者出现了意外的白血病(hacein-bey-abina等2008)。ltr序列的强启动子活性可通过激活原癌基因启动子或通过抑制肿瘤抑制基因(从而导致插入诱变)影响周围基因的调节(ott等2006;howe等2008;stein等2010;braun等2014)。这些发现突出了使用比γ逆转录病毒载体更安全和更高效的载体进行pkd基因治疗的必要性。
技术实现思路
0、发明概述
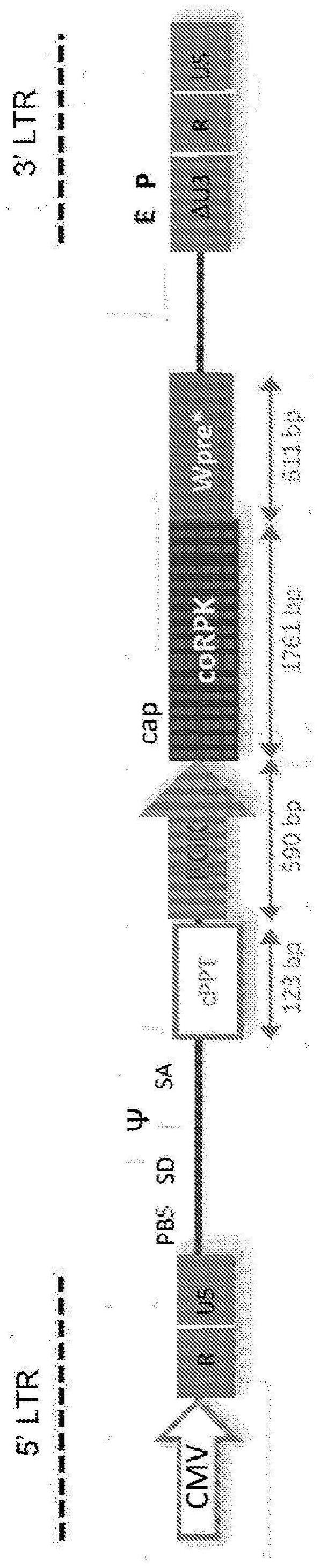
1、在一个实施方案中,本发明提供了包含多核苷酸序列的表达盒,所述多核苷酸序列包含:a)启动子序列;b)编码基因产物的序列;c)核糖核酸(rna)输出信号,其中启动子序列与编码丙酮酸激酶多肽的序列可操作地连接,并且任选地,其中a)-c)以5'至3'的顺序存在于表达盒中。在某些实施方案中,启动子是磷酸甘油酸激酶(pgk)启动子。在一些实施方案中,基因产物是治疗性基因产物。在一些实施方案中,治疗性基因产物是丙酮酸激酶(pk)多肽,任选地丙酮酸激酶肝和红细胞(pklr)多肽。在某些实施方案中,编码所述基因产物的序列是密码子优化的。在特定的实施方案中,rna输出信号是土拨鼠肝炎病毒的突变的转录后调控元件(wpre)。在某些实施方案中,突变的wpre是嵌合wpre,其包含与seq id no:1具有至少80%同一性的序列。在一些实施方案中,表达盒还包含一种或多种增强子序列。在一些实施方案中,表达盒还包含多嘌呤区(polypurine tract,ppt)或多腺苷酸化(polya)信号序列。在一些实施方案中,表达盒还包含以下序列中的一种或多种:i)包装信号序列;ii)截短的gag序列;iii)rev响应元件(rre);iv)中央多嘌呤区(cppt);v)中央末端序列(cts);和vi)上游序列元件(use),任选地来自猿猴病毒40(sv40-use)。在一些实施方案中,表达盒还包含5'和3'长末端重复序列。
2、在一个相关实施方案中,本发明提供了重组基因递送载体,其包含本文公开的表达盒。在某些实施方案中,重组基因递送载体是病毒或病毒载体。在某些实施方案中,病毒或病毒载体是慢病毒(lv)。
3、在另一相关实施方案中,本发明提供了包含本文公开的表达盒或基因递送载体的细胞。在一些实施方案中,所述细胞是血细胞。在一些实施方案中,所述细胞是红系细胞。在一些实施方案中,所述细胞是骨髓细胞,例如谱系贫化的骨髓细胞(lineage depletedbone marrow cell)。在一些实施方案中,所述细胞是造血干细胞。在一些实施方案中,所述细胞是cd34+造血干细胞。在一些实施方案中,所述细胞是定型的造血红系祖细胞。
4、在另一个相关的实施方案中,本发明提供药物组合物,其包含药学上可接受的赋形剂和本文公开的重组基因递送载体或细胞。
5、在另一个实施方案中,本发明提供治疗或预防有此需要的受试者中的疾病或病症的方法,包括向受试者提供本文公开的表达盒、基因递送载体或药物组合物。在一个实施方案中,所述疾病或病症是丙酮酸激酶缺乏症(pkd),并且所述基因产物是丙酮酸激酶(pk)多肽,任选地丙酮酸激酶肝和红细胞(pklr)多肽。在某些实施方案中,药物组合物包含重组基因递送载体。在其他实施方案中,药物组合物包含细胞。在一个实施方案中,所述细胞对受试者是自体的。在另一个实施方案中,所述细胞对受试者是同种异体的。
6、在一个相关的实施方案中,本发明提供了用于在红系细胞中表达转基因的方法,其包括使一种或多种红系细胞与有效量的重组病毒载体接触,其中所述载体包含人磷酸甘油酸激酶启动子、密码子优化形式的人丙酮酸激酶肝和红细胞(pklr)cdna转基因,以及土拨鼠肝炎病毒的突变的转录后调控元件,其中在所述接触后,pklr在所述一种或多种红系细胞中以可检测的水平表达。
- 还没有人留言评论。精彩留言会获得点赞!