一种微生物-肠-脑轴多器官芯片及其制备方法
1.本发明属于多器官芯片制备技术领域,涉及一种微生物-肠-脑轴多器官芯片及其制备方法。
背景技术:
2.肠道微生物与大脑之间存在着复杂的相互作用,肠道微生物群数量和种类的变化会影响大脑的发育关键过程,如神经元的产生及成熟,从而改变大脑免疫功能、血脑屏障通透性、脑结构和神经回路;同时,中枢神经系统(cns)的变化也能够诱导肠道微生物改变。以上生理变化涉及跨器官系统的复杂相互作用,这种肠道微生物通过肠道和大脑产生双向通信的体内途径被称为“微生物-肠-脑轴”。目前对“微生物-肠-脑轴”的研究主要通过动物模型和临床实验进行。
3.动物模型实验目前主要是依靠模式动物进行,主要包括秀丽隐杆线虫、果蝇、斑马鱼和小鼠。模式动物模型的个体标准化程度较高,实验可重复,提供的实验结果具有一定可扩展性,但是这些模型也存在很大的局限性,表现在:首先,不同物种间肠道微生物群的组成存在很大差异,简单模式动物肠道微生物大多是需氧的,而在人类肠道中专性厌氧细菌占主导地位,模式动物模型的肠道微生物在数量、种类和复杂程度上都无法概括人类肠道微生物的特性;其次,模式动物实验不能复制人类的遗传多样性,模式动物中枢神经系统的细胞组成、结构及电生理特性,难以全面概括人脑的复杂性。因此模式动物实验结果不能直接转化为对人类的实验协议,其昂贵的实验费用和实验伦理也是难以回避的问题。因此在“3rs”(replacement,refinement,reduction)原则指导下减少、替代和优化动物实验也是未来的趋势。
4.此外,在微生物-肠-脑轴的临床研究中则存在样本量过小,受试者的年龄、地域、性别、胃肠道症状、饮食和补充剂方面存在差异性等不足,受试者的肠道微生物情况极易受到外界各种因素的干扰,且研究时间跨度普遍较长。另外,临床研究中,对患者大脑的症状表征只能通过及其有限的手段进行,如认知测评、医学影像(活体)等,认知测评容易受到各种主客观因素的影响,而只能用于活体个体的影像检查无法对大脑直接进行需要通过解剖学实现的各种研究分析。
5.无论使用动物模型还是进行临床研究,都存在极大的局限性。因此,迫切需要建立一个与人类生理病理特性高度相关的肠-脑轴体外模型,以研究和分析肠道微生物对大脑的影响机制。
技术实现要素:
6.有鉴于此,本发明的目的之一在于提供一种微生物-肠-脑轴多器官芯片;本发明的目的之二在于提供一种微生物-肠-脑轴多器官芯片的制备方法。
7.为达到上述目的,本发明提供如下技术方案:
8.1.一种微生物-肠-脑轴多器官芯片,所述芯片从上到下包括上层芯片和下层芯
片;
9.所述上层芯片包括微生物-肠共生模块ⅰ、血脑屏障(bbb)模块ⅱ、脑类器官模块ⅲ、液体混匀模块ⅳ,所述下层芯片包括微生物-肠共生模块ⅰ、血脑屏障(bbb)模块ⅱ、脑类器官模块ⅲ;
10.其中脑类器官模块ⅲ依次被微生物-肠共生模块ⅰ、液体混匀模块ⅳ和血脑屏障(bbb)模块ⅱ环绕。
11.优选的,所述上层芯片的微生物-肠共生模块ⅰ包括上层微通道a和两个分别位于上层微通道a两侧的直线形上层真空腔室b,上层微通道a两端分别连接有上层微通道的进出口
②
和
⑤
,
12.两个上层真空腔室b分别连接有连接口
③
和
④
;
13.所述上层微通道a包括通过其中一端依次连接的直线形上层微通道1a-1、直线形上层微通道2a-2和直线形上层微通道3a-3,其中直线形上层微通道2a-2和直线形上层微通道1a-1、直线形上层微通道3a-3之间形成的外端夹角为135
°
,所述直线形上层微通道2a-2的长为2
㎝
、宽为1
㎜
、厚为0.5
㎜
,所述直线形上层微通道1a-1和直线形上层微通道3a-3的长度为5mm、宽为1
㎜
、厚为0.5
㎜
;
14.所述上层真空腔室b的尺寸中长为1.5
㎝
、宽为1
㎜
、厚为0.5
㎜
。
15.优选的,所述上层芯片的血脑屏障(bbb)模块ⅱ包括直线形上层微通道c,所述上层微通道c的一端连接有上层微通道进口
⑥
;
16.所述直线形上层微通道c的尺寸中长为2
㎝
、宽为1
㎜
、厚为0.5
㎜
。
17.优选的,所述上层芯片的液体混匀模块ⅳ中包括折线形微通道d,所述折线形微通道d的一端与上层微通道c的另一端相连,在所述折线形微通道d与上层微通道c的连接处连接有脑类器官培养基进口
⑧
,所述折线形微通道d的另一端连接有脑类器官培养基出口
⑨
;
18.所述折线形微通道d的宽为1
㎜
、厚为0.5
㎜
,折线部分的长为1.5
㎝
。
19.优选的,所述上层芯片的脑类器官模块ⅲ含有圆形上层腔室e、与圆形上层腔室e连接有与其水平中线性方向一致的上层腔室的直线形进口通道f和上层腔室的直线形出口通道g,所述直线形进口通道f连接有上层腔室的入口直线形出口通道g连接有上层腔室的出口
20.所述圆形上层腔室e的直径为1.5cm、厚度为5
㎜
;
21.所述直线形进口通道f的长为1.5cm、宽为1
㎜
、厚度为2
㎜
;直线形出口通道g的长为1.3cm、宽为1
㎜
、厚度为2
㎜
。
22.优选的,所述下层芯片包括下层微通道h和圆形下层腔室i;
23.所述下层微通道h包括通过其中一端依次连接的位于微生物-肠共生模块ⅰ中的直线形下层微通道1h-1、直线形下层微通道2h-2、位于血脑屏障(bbb)模块ⅱ中的直线形下层微通道3h-3和位于血脑屏障(bbb)模块ⅱ中直线形下层微通道4h-4,其中,所述下层微通道h的宽为1
㎜
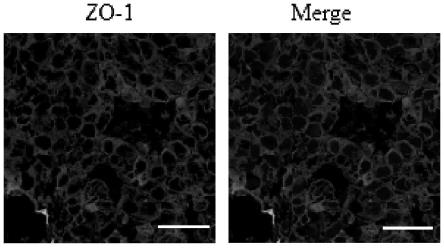
、厚为0.3
㎜
;所述直线形下层微通道1h-1的长度为4cm、所述直线形下层微通道2h-2的长度为3cm、所述直线形下层微通道3h-3的长度为2.5cm、所述直线形下层微通道4h-4的长度为5mm,所述直线形下层微通道4h-4与直线形下层微通道3h-3之间形成的外端夹角为135
°
;
24.所述圆形下层腔室i位于下层芯片的脑类器官模块ⅲ中,圆形下层腔室i连接有与
其水平中线性方向一致的下层腔室的直线形进口通道j和下层腔室的直线形出口通道k;
25.所述圆形下层腔室i的直径为1.5cm、厚度为3
㎜
;
26.所述圆形下层腔室i的直线形进口通道j的长度为1.3cm、厚度为2mm,所述圆形下层腔室i的直线形出口通道k的长度为1.5cm、厚度为2mm;
27.下层芯片中连接微生物-肠共生模块ⅰ和血脑屏障(bbb)模块ⅱ微通道的进出口分别为
①
和
⑦
,脑类器官模块ⅲ的下层腔室入口为
⑩
、脑类器官模块ⅲ的下层腔室出口为
28.进一步优选的,上层腔室的直线形进口通道f、上层腔室的直线形出口通道g下层腔室的直线形进口通道j和下层腔室的直线形出口通道k均匀分布在圆形的四周。
29.2.上述微生物-肠-脑轴多器官芯片的制备方法,所述方法包括如下步骤:
30.(1)制备阳膜:用3d打印技术分别制备多器官芯片的上层芯片阳模和下层芯片阳模;
31.(2)制备多孔膜:首先通过光刻加工具有圆柱形微阵列的硅晶片制备微生物-肠共生模块ⅰ所用的多孔膜,其次从6孔的transwell小室上剥离厚度为20μm、垂直孔隙为0.4μm、孔隙率为4
×
106孔/cm2的多孔膜作为血脑屏障(bbb)模块ⅱ的多孔膜,所述transwell小室基底为透明聚对苯二甲酸乙二醇酯(pet)材料,然后将厚度为20μm、孔直径为8μm、孔隙率为1
×
105孔/cm2的核孔膜作为制备脑类器官模块ⅲ的多孔膜;
32.(3)制备上层芯片和下层芯片:将上层芯片阳模和下层芯片阳模分别置于模具(亚克力板)上,用pdms预聚物进行浇注,在-80kpa下脱气至除去所有气泡,并在60℃下固化至少4h,脱模后在相应位置打孔即可得到上层芯片和下层芯片;
33.(4)将步骤(2)中制备的多孔膜与步骤(3)中制备的上层芯片和下层芯片相结合,用夹具固定即可得到微生物-肠-脑轴多器官芯片。
34.优选的,步骤(2)中,所述光刻加工具体为:将聚二甲基硅氧烷(pdms)和固化剂以9~10:1的质量比混合得到预聚物,将其浇注在硅晶片的微阵列上,用已固化的pdms层作为支撑层覆盖未固化的预聚物;然后在3kg材料的压力下、60℃下固化聚合12h,从硅晶片上剥离pdms多孔膜;
35.所述微阵列的尺寸为直径10μm、高30μm、间距25μm。
36.优选的,步骤(3)中,所述pdms预聚物由质量比为9~10:1的聚二甲基硅氧烷(pdms)和固化剂组成。
37.本发明的有益效果在于:本发明公开了一种微生物-肠-脑轴多器官芯片,包括上层芯片(由微生物-肠共生模块ⅰ、血脑屏障(bbb)模块ⅱ、脑类器官模块ⅲ、液体混匀模块ⅳ组成)和下层芯片(由微生物-肠共生模块ⅰ、血脑屏障(bbb)模块ⅱ、脑类器官模块ⅲ组成),用于微生物肠-脑-轴的体外建模和生理病理研究。该微生物-肠-脑轴多器官芯片可以用人源细胞或类器官进行实验,实验结果与人类具有良好的相关性,不存在动物实验与人类之间的种属间的差异;同时该微生物-肠-脑轴多器官芯片采用微流控芯片技术,在微通道和腔室内连续不断灌注流体对细胞和组织进行培养,能够明显加快实验进程,缩短实验时间;另外本发明的微生物-肠-脑轴多器官芯片结合微流控技术和流体力学采用pdms加工的多器官芯片代替动物实验,可以极大节约实验成本,并且不存在实验伦理的争议,使其可以扩展至规模化标准化加工生产,以便进行高通量、大规模的实验研究。
38.本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并
且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。
附图说明
39.为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
40.图1为上层芯片的平面结构图;
41.图2为下层芯片的平面结构图;
42.图3为夹具的平面结构图;
43.图4为实施例1制备的微生物-肠-脑轴多器官芯片的结构图;
44.图5为对整合后的芯片的微生物-肠-脑轴多器官芯片中的肠芯片模块的紧密连接蛋白zo-i和dapi进行免疫荧光染色的结果;
45.图6为对整合后芯片的微生物-肠-脑轴多器官芯片中的肠芯片模块进行肠菌共培养后,对肠上皮细胞和两歧双歧杆菌进行免疫荧光染色的结果;
46.图7为整合后芯片的微生物-肠-脑轴多器官芯片中的血脑屏障模块进行跨上皮电阻值测试结果;
47.图8为整合后芯片的微生物-肠-脑轴多器官芯片中的脑类器官分别进行16天免疫荧光染色(a)、45天免疫荧光染色(b)和阿尔茨海默病症状表达(c)的结果。
具体实施方式
48.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,以下实施例中所提供的图示仅以示意方式说明本发明的基本构想,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。
49.实施例1
50.制备一种微生物-肠-脑轴多器官芯片,具体方法如下所示:
51.1、制备阳膜:用3d打印技术按照上层芯片和下层芯片的结构分别制备多器官芯片的上层芯片阳模和下层芯片阳模;
52.其中上层芯片包括微生物-肠共生模块ⅰ(包括直线形上层微通道a)(包括通过其中一端依次连接的直线形上层微通道1a-1、直线形上层微通道2a-2和直线形上层微通道3a-3,其中直线形上层微通道2a-2和直线形上层微通道1a-1、直线形上层微通道3a-3之间形成的外端夹角为135
°
,该直线形上层微通道2a-2的长为2
㎝
、宽为1
㎜
、厚为0.5
㎜
,该直线形上层微通道1a-1和直线形上层微通道3a-3的长度为5mm、宽为1
㎜
、厚为0.5
㎜
)和两个分别位于上层微通道a两侧的直线形上层真空腔室b(长为1.5
㎝
、宽为1
㎜
、厚为0.5
㎜
),上层微通道a两端分别连接有上层微通道的进出口
②
和
⑤
,两个上层真空腔室b分别连接有连接口
③
和
④
)、血脑屏障(bbb)模块ⅱ(包括直线形上层微通道c(长为2
㎝
、宽为1
㎜
、厚为0.5
㎜
),而上层微通道c的一端连接有上层微通道进口
⑥
)、脑类器官模块ⅲ(含有圆形上层腔室e(直径为1.5cm、厚度为5
㎜
)、与圆形上层腔室e连接有与其水平中线性方向一致的上层腔室的直线形进口通道f(长为1.3cm、宽为1
㎜
、厚度为2
㎜
)和上层腔室的直线形出口通道g(长为1.3cm、宽为1
㎜
、厚度为2
㎜
),而直线形进口通道(f)连接有上层腔室的入口直线形出口通道g连接有上层腔室的出口)、液体混匀模块ⅳ)(包括折线形微通道d(宽为1
㎜
、厚为0.5
㎜
,折线部分的长为1.5
㎝
),而折线形微通道d的一端与上层微通道c的另一端相连,在折线形微通道d与上层微通道c的连接处连接有脑类器官培养基进口
⑧
,折线形微通道d的另一端连接有脑类器官培养基出口
⑨
)。
53.下层芯片包括微生物-肠共生模块ⅰ、血脑屏障(bbb)模块ⅱ、脑类器官模块ⅲ,下层芯片包括下层微通道h和圆形下层腔室i;下层微通道h以直线形分布在下层芯片的微生物-肠共生模块ⅰ和血脑屏障(bbb)模块ⅱ中(下层微通道h包括通过其中一端依次连接的位于微生物-肠共生模块ⅰ中的直线形下层微通道1h-1、直线形下层微通道2h-2、位于血脑屏障(bbb)模块ⅱ中的直线形下层微通道3h-3和位于血脑屏障(bbb)模块ⅱ中直线形下层微通道4h-4,其中,下层微通道h的宽为1
㎜
、厚为0.3
㎜
;该直线形下层微通道1h-1的长度为4cm、该直线形下层微通道2h-2的长度为3cm、该直线形下层微通道3h-3的长度为2.5cm、该直线形下层微通道4h-4的长度为5mm,该直线形下层微通道4h-4与直线形下层微通道3h-3之间形成的外端夹角为135
°
);圆形下层腔室i位于下层芯片的脑类器官模块ⅲ中,圆形下层腔室i连接有与其水平中线性方向一致的下层腔室的直线形进口通道j和下层腔室的直线形出口通道k,其中圆形下层腔室i的直径为1.5cm、厚度为3
㎜
;圆形下层腔室i的直线形进口通道j的长度为1.3cm、厚度为2mm,所述圆形下层腔室i的直线形出口通道k的长度为1.5cm、厚度为2mm。
54.上述上层腔室的直线形进口通道f、上层腔室的直线形出口通道g下层腔室的直线形进口通道j和下层腔室的直线形出口通道k均匀分布在圆形的四周。
55.2、制备多孔膜:
56.(1)首先通过光刻加工(具体方法为:将聚二甲基硅氧烷(pdms)和固化剂以10:1的质量比混合成得到预聚物,将其浇注在硅晶片的微阵列(微阵列的直径10μm、高30μm、间距25μm)上,用已固化的pdms层作为支撑层覆盖未固化的预聚物,以便剥离多孔膜时能够使其保持平整;然后在3kg材料的压力下、60℃下固化聚合12h,从硅晶片上剥离pdms多孔膜,并使用手术刀将其裁剪成长2
㎝×
宽2
㎜
的大小,用于支撑肠上皮细胞和血管内皮细胞的生长)具有圆柱形微阵列的硅晶片制备微生物-肠共生模块ⅰ所用的多孔膜,用于支撑肠上皮细胞和血管内皮细胞的生长;
57.(2)其次从6孔的transwell小室(其中transwell小室基底为透明聚对苯二甲酸乙二醇酯(pet)材料)上剥离厚度为20μm、垂直孔隙为0.4μm、孔隙率为4
×
106孔/cm2的多孔膜作为血脑屏障(bbb)模块ⅱ的多孔膜,用以支撑血管内皮细胞及星形胶质细胞的生长;
58.(3)然后将厚度为20μm、孔直径为8μm、孔隙率为1
×
105孔/cm2的核孔膜作为制备脑类器官模块ⅲ的多孔膜,用以支撑大脑类器官,使其不会沉入下腔室底部。
59.3、制备上层芯片和下层芯片:将上层芯片阳模和下层芯片阳模分别置于模具(亚克力板)上,用pdms预聚物(由质量比为9~10:1的聚二甲基硅氧烷(pdms)和固化剂组成)进行浇注,在-80kpa下脱气至除去所有气泡,并在60℃下固化至少4h,脱模后在相应位置打孔
(上层微通道a两端分别连接有上层微通道的进出口
②
和
⑤
,两个上层真空腔室b分别连接有连接口
③
和
④
,上层微通道c的一端连接有上层微通道进口
⑥
,在折线形微通道d与上层微通道c的连接处连接有脑类器官培养基进口
⑧
,折线形微通道d的另一端连接有脑类器官培养基出口
⑨
,直线形出口通道g连接有上层腔室的出口直线形进口通道f连接有上层腔室的入口下层芯片中连接微生物-肠共生模块ⅰ和血脑屏障(bbb)模块ⅱ微通道的进出口分别为
①
和
⑦
,脑类器官模块ⅲ的下层腔室入口为
⑩
,脑类器官模块ⅲ的下层腔室出口为即可得到上层芯片(其平面结构图如图1所示)和下层芯片(其平面结构图如图2所示)。
60.4、将步骤(2)中制备的多孔膜与步骤(3)中制备的上层芯片和下层芯片相结合,用夹具(夹具的平面结构图如图3所示)固定即可得到微生物-肠-脑轴多器官芯片。
61.实施例1制备的微生物-肠-脑轴多器官芯片的结构图如图4所示。
62.将实施例1中制备微生物-肠-脑轴多器官芯片进行应用,具体方法如下所示:
63.1、细胞及类器官培养
64.(1)按照标准程序培养人肠上皮细胞caco-2、人内皮细胞、人星形胶质细胞、人多能干细胞。
65.(2)按照标准程序培养两岐双歧杆菌。
66.(3)将在mtesr1
tm
中维持培养至成熟的人多能干细胞,以9000cells/well接种到96孔超低粘附培养板中,接种培养基为添加了10μm rho-kinase抑制剂的类胚体形成培养基,稳定培养5天后,将其转移到含有诱导培养基的24孔超低粘附培养板中诱导神经上皮细胞的分化,2天后使用液体matrigel包被分化的类胚体,并通过添加扩增培养基诱导扩增神经上皮结构,第10天起类器官进入成熟阶段,使用成熟培养基进行培养,将包含类器官的多孔板放置在定轨摇床上可连续培养,目前的研究中最多可培养180天。
67.(4)脑类器官片上培养:将器官芯片上下层和多孔膜进行充分消毒后,将芯片上层微通道和腔室开口朝上放置。用修剪过的移液枪头将位于成熟期特定阶段的大脑类器官小心取出,放置在上层芯片脑类器官部分的腔室中,并加入约1ml成熟培养基。依次将对应的pet多孔膜、核孔膜放置在血脑屏障通道和脑腔室上方,将已结合了pdms多孔膜的下层芯片与上层芯片的通道和腔室小心对齐,然后快速将芯片用夹具固定好。
68.将芯片翻转后,在脑腔室对应的上层进出口号口和号口,以及下层进出口
⑩
号口和号口的开口连接不锈钢弯针和tygon管道,分别以一定的流速经由号口和
⑩
号口对上下腔室通入脑类器官成熟培养基。组装芯片到通入培养基的过程尽量控制在10min之内,以保证脑类器官最佳状态和活性。
69.(5)多孔膜包被:用鼠尾胶原蛋白i和matrigel配置细胞外基质(ecm)溶液,取200μl分别从
①
号口和
②
号口加入微生物-肠模块上下、层微通道,取200μl分别从
⑥
号口和
⑦
号口加入血脑屏障模块的上、下层微通道,在培养箱中静置1h后,吸出细胞外基质凝胶液。
70.(6)肠和血脑屏障模块的片上培养:
71.(a)、将解离好的caco-2细胞悬液从
②
号口注入上层微通道,使细胞在加湿的二氧化碳培养箱中以37℃附着在ecm涂涂覆的多孔膜上,此时培养基不流动。让细胞粘附1小时后,通过上通道连续灌注培养基,建立完整的肠上皮细胞单层。
72.(b)、在步骤(a)的同时,将解离好的星形胶质细胞悬液从
⑥
号口注入上层微通道。
同样的方式培养1小时,并通过上通道连续灌注培养基。
73.(c)、将芯片翻转底部朝上,分别取解离好的血管内皮细胞悬液从
①
号口和
⑦
号口加入微生物-肠模块和血脑屏障模块的下层微通道,在下层微通道没有培养基流动的状态下在培养箱中培养1小时让细胞粘附。然后翻转芯片至正常状态,从
①
号口向下层微通道灌注内皮细胞培养基。
74.(d)通过
③
号口和
④
号口同时对空心侧室施加真空驱动循环机械应变,以促进肠上皮和内皮的微生理结构的形成。
75.(e)在此阶段,将
⑨
号口封闭,将
⑧
号口最为血管通路的出口。
76.2.5创建生理氧浓度梯度
77.在微生物接种到肠上皮单层之前24小时,先将微生物-肠道芯片模块的上下微通道的培养基都换为不添加抗生素的培养基。将肠上皮细胞培养基进行脱氧处理。在该模块上微通道注入低氧和无抗生素的培养基,下层微通道注入含氧的无抗生素培养基。将微生物悬液接种在上层微通道中。上层微通道暂停流体流动以及循环应力,在微生物附着在顶端上皮表面1小时后,恢复微流控培养。
78.2.6微生物与脑相连通
79.将
⑨
号口打开,并将
⑨
号口和
⑩
号口相连接,从
⑧
号口注入脑类器官成熟培养基,携带有微生物代谢因子并经血脑屏障选择性通透的培养基与脑类器官成熟培养基相混合,流入脑类器官芯片下腔室,对脑类器官施加影响。
80.实施例2
81.将caco-2细胞、内皮细胞、两歧双歧杆菌通过微流体通道上的进出口整合在实施例1中制备的大的微生物-肠-脑轴多器官芯片中的肠芯片模块,将内皮细胞、星形胶质细胞整合在血脑屏障模块,最终实现肠脑轴的连通。
82.图5为对整合后的芯片的微生物-肠-脑轴多器官芯片中的肠芯片模块的紧密连接蛋白zo-i和dapi进行免疫荧光染色的结果,从中可以看出,紧密连接蛋白zo-1表达良好。图6为对整合后芯片的微生物-肠-脑轴多器官芯片中的肠芯片模块进行肠菌共培养后,对肠上皮细胞和两歧双歧杆菌进行免疫荧光染色的结果,从中可以看出,实施例1中制备的大的微生物-肠-脑轴多器官芯片上可以成功构建有氧无氧界面,保证两歧双歧杆菌的生存。
83.图7为整合后芯片的微生物-肠-脑轴多器官芯片中的血脑屏障模块进行跨上皮电阻值测试结果,从中可以看出,上皮结构完整性的重要表征,上皮屏障趋于完整,teer值增加,反之减少。血脑屏障芯片的teer值从第2天的.35ω*cm2增加至704.5ω*cm2,证明此时已经形成了具有良好性能的血脑屏障。
84.图8为整合后芯片的微生物-肠-脑轴多器官芯片中的脑类器官分别进行16天免疫荧光染色(a)、45天免疫荧光染色(b)和阿尔茨海默病症状表达(c)的结果。从中可以看出,对多器官芯片上的脑芯片模块的脑类器官进行切片和免疫荧光染色。结果显示16天的脑类器官表达出了后脑标记物pax2、前脑顶端祖细胞标志物pax6,45天的脑类器官表达出了神经祖细胞标志物sox2和神经元标志物tuj1,证明此时的脑类器官已经分化出了前脑、后脑的脑区,并且神经细胞已经开始分化。而经过后诱导处理后的大脑类器官的神经元标记物map2表达减少,突触标记物syn1表达缺失,aβ淀粉样蛋白表达增加,炎症因子的分泌量有所增加,显示阿尔茨海默病的症状。而经过肠脑轴连通之后,三种不同组织之前可以实现超过
48小时的稳定共培养。
85.以上实验结果证明在此肠脑轴多器官芯片中,不仅不同模块可以单独稳定培养,也可以实现共培养。两岐双歧杆菌的治疗使得炎症因子的分泌量有所下降。
86.综上所述,本发明运用类器官和器官芯片技术,结合微流控技术和流体力学的应用,设计并制造一种多器官芯片,用于微生物肠-脑-轴的体外建模和生理病理研究。该多器官芯片应能够创造出仿生氧浓度梯度,实现肠道厌氧微生物和肠上皮细胞的共生;该芯片应通过优化微通道设计,更符合人体生理结构特征;该芯片应通过对尺寸和结构的设计,使得培养类脑器官的腔室中培养基的流动状态为层流,且可以调整流体的状态模拟大脑在体内低剪切力的微环境,使得类脑器官能够获得充足的氧气与养分供给;该芯片应是经过结构设计和优化的一体化多器官芯片,能够实现不同器官之间的相互连接、通信以及长时间共培养。
87.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1