一种高产四氢嘧啶的重组谷氨酸棒杆菌及其构建方法和应用与流程
1.本发明涉及生物工程技术领域,具体涉及一种高产四氢嘧啶的重组谷氨酸棒杆菌及其构建方法和应用。
背景技术:
2.四氢嘧啶是一种环状氨基酸衍生物,首次从极端嗜盐外硫红螺菌属的光合紫细菌中发现,后续发现在嗜盐或耐盐微生物中普遍存在,具有很强的水分子络合能力,在高渗透压、高温、低温、干燥、强酸碱和辐射等逆境条件下对蛋白质、核酸、酶、生物膜及细胞都有很好的保护作用,目前在医药、化妆品和生物制剂等领域应用广泛,前景广阔。
3.四氢嘧啶的合成主要有化学方法和生物方法,因生物合成方法较化学合成方法生产过程简单、合成率高、后期分离纯化难度低、对环境友好等特点,被广泛采用。早期四氢嘧啶的生物合成多通过噬盐单胞菌“细菌挤奶”方式生产,需要高盐环境且产量较低,最近几年研究者通过以大肠杆菌等模式菌株为底盘细胞构建基因工程菌株异源合成四氢嘧啶,避免了使用高盐培养基带来的一些弊端降低了发酵难度,且后期提取纯化简单,降低了四氢嘧啶的生产成本。
4.虽然目前报道的四氢嘧啶工程菌能在低盐条件下合成四氢嘧啶,避免了使用高盐培养基带来的一些弊端,但报道菌株多为大肠杆菌,大肠杆菌本身会产生内毒素有潜在的安全问题,而四氢嘧啶作为医药和化妆品原料安全问题至关重要;并且大肠杆菌大规模发酵经常面临噬菌体污染的问题,制约了大肠杆菌用于四氢嘧啶的工业化生产和大规模应用。与大肠杆菌相比,谷氨酸棒杆菌作为另外一种成熟的工业微生物生产菌株,具有发酵稳定、不产内毒素的特点,是公认的安全菌株,虽然目前也有利用谷氨酸棒杆菌生产四氢嘧啶的报道,但产量较低,因此,开发一种高产的四氢嘧啶谷氨酸棒杆菌,提高合成效率、降低生产成本,对四氢嘧啶工业化生产和大规模应用有重要的实践意义。
技术实现要素:
5.针对现有谷氨酸棒杆菌生产四氢嘧啶的产量偏低的技术问题,本发明提供一种高产四氢嘧啶的重组谷氨酸棒杆菌及其构建方法和应用,对四氢嘧啶工业化生产和大规模应用有重要的实践意义。
6.第一方面,本发明提供一种高产四氢嘧啶的重组谷氨酸棒杆菌的构建方法,以谷氨酸棒杆菌为出发菌株,在基因组编码高丝氨酸脱氢酶的hom基因位置和编码二氢嘧啶二羧酸合成酶dapa基因位置整合了由乳糖启动子ptac控制的t7噬菌体的rna聚合酶基因t7 rnap,减弱l-天冬氨酸-β-半醛向苏氨酸、赖氨酸、蛋氨酸的支路代谢,同时引入可诱导表达的t7rna聚合酶基因;在基因组编码磷酸烯醇式丙酮酸羧化激酶pck的基因位置整合了由t7强启动子控制来源于谷氨酸棒杆菌的天冬氨酸激酶lysc基因,增强天冬氨酸到4-磷酸天冬氨酸的代谢,同时有助于草酰乙酸的积累;导入重组载体pxmj19-t7-ectabc,构建由t7强启动子控制的l-天冬氨酸-β-半醛到四氢嘧啶的合成通路。
0.5-1.5g/l、消泡剂0.3-0.6g/l、feso4·
7h2o 10-80mg/l、mnso4·
h2o 10-80mg/l、生物素0.2-1mg/l,其余为水,用液氨调节ph值至7.0-7.2;
26.复合氨基酸包括均匀混合的高丝氨酸100-200g、蛋氨酸100-200g、苏氨酸100-200g、天冬氨酸100-200g;
27.(4)发酵培养:按照10%-20%接种量转移二级种子到装有发酵培养基的发酵罐中,发酵过程中控制ph值稳定在7.2左右,温度维持在30℃,溶氧在10%-30%;当培养基中的初始葡萄糖消耗完之后,添加终浓度0.2-1.0mm的iptg,间隔流加50%(m/v)的葡萄糖溶液,通过调节单次补糖量和补糖频次,使溶氧在单个补糖周期内上下波动,振幅为15%-30%,维持6-8h;后加快补糖速率,维持发酵培养基中的葡萄糖浓度在0.5-5g/l;发酵周期为32-40h;
28.发酵培养基成分为葡萄糖20-30g/l、玉米浆10-20g/l、蛋白胨3-7g/l、牛肉浸粉1-3g/l、复合氨基酸4-8g/l、柠檬酸2-4g/l、(nh4)2so
4 4-6g/l、kh2po
4 3-5g/l、mgso
4 0.5-1.5g/l、消泡剂0.6-1.5g/l、feso4·
7h2o 10-80mg/l、mnso4·
h2o 10-80mg/l、生物素0.2-1mg/l,其余为水,用液氨调节ph值至7.0-7.2;
29.复合氨基酸的配方是均匀混合的高丝氨酸100-200g、蛋氨酸100-200g、苏氨酸100-200g、天冬氨酸100-200g。
30.进一步的,四氢嘧啶发酵量的检测方法为:用去离子水适当稀释发酵液,12000rpm离心5min后取上清用0.22μm滤膜过滤,使用高效液相色谱法测定,色谱仪为安捷伦1260infinity ii,色谱柱为zorbax sb-c18,流动相为2%乙腈溶液,柱温为30℃,流速为1ml/min,进样量为10μl,紫外检测波长为210nm,保留时间为10min,并配置一系列浓度梯度的四氢嘧啶溶液作为标准样品,绘制标准曲线。
31.本发明的有益效果在于:
32.(1)本发明提供的高产四氢嘧啶的重组谷氨酸棒杆菌,具有良好的生长性状,四氢嘧啶发酵产量高,出发菌株为谷氨酸棒杆菌模式菌株cgmcc 1.1886,遗传背景清晰,基因操作简单高效,方便对其进行进一步的基因表达修饰。
33.(2)本发明使用上述高产四氢嘧啶的重组谷氨酸棒杆菌发酵生产四氢嘧啶,避免了常规利用嗜盐单胞菌发酵生产四氢嘧啶需要高盐环境且产量低的问题,同时解决了利用大肠杆菌发酵生产四氢嘧啶会产生内毒素有潜在的安全问题和大规模发酵经常面临噬菌体污染的问题,对四氢嘧啶工业化生产和大规模应用有重要的实践意义。
34.(3)本发明所提供的高产四氢嘧啶的重组谷氨酸棒杆菌构建方法是一种定向的理性的菌种改造方法,能快速定向优化代谢通路,相比传统诱变方法更为高效便捷,可操作性强,通过相应的发酵过程控制方案,使重组的菌株在低的盐离子浓度的胁迫下就能以葡萄糖为原料催化合成四氢嘧啶,可应用于四氢嘧啶的高效工业化生产。
35.(4)本发明的发酵培养基富含谷氨酸棒杆菌frd-gect-1/2/3生长所需的碳源、氮源、无机盐、微量元素和维生素,并针对基因修饰路径添加了复合氨基酸,通过制定的发酵控制方案菌种快速生长繁殖6-10小时左右od600可达30以上,缩短迟滞期和对数生长期时间,有利于四氢嘧啶的高产和节能减排。
36.(5)本发明以重组谷氨酸棒杆菌frd-gect-1/2/3作为生产菌株,通过在发酵过程中期间隔流加葡萄糖溶液,控制溶氧在单个补糖周期内上下波动,维持极低的葡萄糖浓度,
提高了t7 rna聚合酶、四氢嘧啶合成酶和天冬氨酸激酶的表达水平,中后期通过维持发酵后期培养基中的较高的葡萄糖浓度,加快四氢嘧啶产物的积累,发酵周期短(32-40h),发酵含量高(10-80g/l),有利于后期提取纯化。
附图说明
37.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
38.图1是重组表达载体pxmj19-t7rnap图谱。
39.图2是重组表达载体pk18mobsacb-homup-tac-t7rnap-homdown图谱。
40.图3是hom基因敲除及tac-t7rnap基因整合到基因组验证实验结果图。
41.图4是重组表达载体pk18mobsacb-dapaup-tac-t7rnap-dapadown图谱。
42.图5是dapa基因敲除及tac-t7rnap基因整合到基因组验证实验结果图。
43.图6是重组表达载体pk18mobsacb-pckup-t7-lysc-pckdown图谱。
44.图7是pck基因敲除及t7-lysc基因整合到基因组验证实验结果图。
45.图8是重组表达载体pxmj19-t7-ectabc图谱。
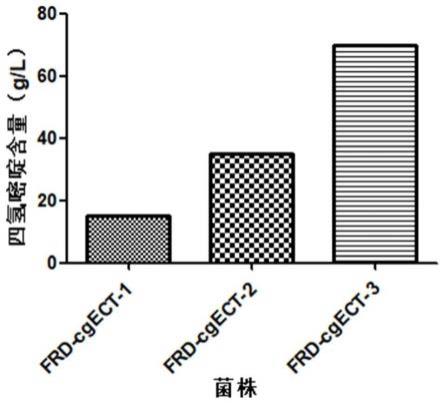
46.图9是frd-cgect-1/2/3菌株的四氢嘧啶发酵含量对比图。
具体实施方式
47.为了使本技术领域的人员更好地理解本发明中的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
48.下列实施例所使用的谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc 1.1886和伸长盐单胞菌(halomonas elongate)cgmcc 1.6329,购自中国普通微生物菌种保藏管理中心。
49.下列实施例所使用的大肠埃希氏菌(escherichia coli)bl21(de3)和大肠埃希氏菌(escherichia coli)dh5α,购自生工生物工程(上海)股份有限公司。
50.下列实施例所使用的质粒pxmj19和pk18mobsacb,购自武汉淼灵生物科技有限公司。下列实施例所使用的引物序列选自下表1。
51.表1引物序列表
[0052][0053][0054]
实施例1重组谷氨酸棒杆菌frd-cg-1构建
[0055]
s1重组表达载体pxmj19-t7rnap构建
[0056]
①
pcr扩增t7 rna聚合酶的编码序列
[0057]
采用pcr技术以大肠埃希氏菌bl21(de3)基因组为模板,根据t7 rna聚合酶基因序列和pxmj19序列设计一对引物(pxmj19-t7rnap-f、pxmj19-t7rnap-r),利用诺唯赞2
×
phanta flash master mix高保真pcr试剂盒扩增获取t7 rnap片段,琼脂糖凝胶电泳切胶
回收纯化待用。
[0058]
②
pxmj19的线性化片段制备
[0059]
利用生工限制性内切酶hind酶切质粒pxmj19,获得pxmj19的线性化片段,琼脂糖凝胶电泳切胶回收纯化待用。
[0060]
③
同源重组构建pxmj19-t7rnap表达载体
[0061]
利用诺唯赞clonexpress multis one step cloning kit同源重组试剂盒连接t7 rnap片段和pxmj19的线性化片段,转化大肠杆菌dh5α,利用引物对pxmj19-t7rnap-f、pxmj19-t7rnap-r对阳性克隆进行菌落pcr验证,验证正确的克隆扩繁后抽取质粒送测序,测序正确即为pxmj19-t7rnap表达载体。
[0062]
s2 pk18mobsacb-homup-tac-t7rnap-homdown表达载体构建
[0063]
①
pk18mobsacb的线性化片段制备
[0064]
利用生工限制性内切酶hind酶切质粒pk18mobsacb,获得pk18mobsacb的线性化片段,琼脂糖凝胶电泳切胶回收纯化待用。
[0065]
②
pcr扩增homup、homdown、tac-t7rnap的编码序列
[0066]
采用pcr技术以谷氨酸棒杆菌cgmcc 1.1886基因组为模板,根据hom基因序列设计引物(cg-δhom-t7rnap-1/2/5/6),扩增获取hom基因上下游同源臂homup,homdown片段;以质粒pxmj19-t7rnap为模板,根据pxmj19-t7rnap序列设计引物(cg-δhom-t7rnap-3/4),扩增获取tac-t7rnap片段,琼脂糖凝胶电泳切胶回收纯化待用。
[0067]
③
同源重组构建pk18mobsacb-homup-tac-t7rnap-homdown表达载体
[0068]
利用同源重组酶连接hom-up、hom-down、tac-t7rnap片段和pk18mobsacb的线性化片段,转化大肠杆菌dh5α,卡那霉素抗性平板筛选,利用引物对cg-δhom-t7rnap-1/6对阳性克隆进行菌落pcr验证,验证正确的克隆扩繁后抽取质粒送测序,测序正确即为pk18mobsacb-homup-tac-t7rnap-homdown表达载体。
[0069]
s3 frd-cg-1菌株构建
[0070]
①
谷氨酸棒杆菌电转感受态细胞的制备
[0071]
从新鲜的bhis固体培养基上挑取单菌落,接入到装有5ml bhis液体的试管中,30℃,220rpm过夜培养;将1ml菌液转接到装有100ml bhis液体培养基的300ml锥形瓶中,30℃、220rpm培养至od600在0.8-1.0;无菌条件下把菌液转移到冰预冷的离心管中,至菌液冷却;将离心管于4℃、8000rpm冷冻离心5min;除去上清液,将离心管倒置在无菌滤纸上吸收残留液体;用25ml 4℃预冷的10%甘油重悬菌体并将菌体上下混匀,4℃、8000rpm冷冻离心5min,除去上清液,将离心管倒置在无菌滤纸上吸收残留液体,重复2-3次;吸取1ml预冷的10%甘油溶液,加入到离心管中并轻轻吹打重悬菌体;最后将感受态细胞用预冷的1.5ml离心管分装,每管0.1ml。放入-80℃保存。
[0072]
bhis液体培养基组分为牛脑心浸粉37g/l,山梨醇91g/l,其余为水,ph值为7.0;固体培养基配置时添加15g/l的琼脂粉。
[0073]
②
电击转化构建重组谷氨酸棒杆菌菌株
[0074]
从-80℃冰箱取出制备好的的谷氨酸棒杆菌感受态细胞,放在冰上使其融化;向感受态细胞中加入待转化的质粒dna,轻轻吹打使其混合均匀;将感受态细胞放入到冰上预冷的宽度2mm电击杯中,用吸水纸将电击杯迅速擦干;将电击杯放入电转仪中,电击(2500v、
200ω、25μf);迅速将46℃预热的bhis液体培养基加入到电击杯中,反复吹吸几次,将感受态细胞吸出,放入1.5ml离心管中,将离心管置于46℃水浴或者金属浴中计时6min;将离心管放在30℃,220rpm的摇床中培养1h;
[0075]
③
重组谷氨酸棒杆菌阳性克隆筛选
[0076]
将离心管中的菌液8000rpm室温离心3min,倒去上清液,用适量的溶液重悬菌体,将菌液涂布到含15mg/l卡那霉素抗性的bhis固体培养基平板上,将平板倒置,于30℃恒温培养箱中培养36-48h,筛选阳性克隆;挑取单菌落,在含有100g/l蔗糖的bhis固体培养基平板上划线培养,于30℃下静置培养16h,进行二次筛选阳性克隆;利用引物对cg-δhom-t7rnap-1/6对二次阳性克隆进行菌落pcr,将得到的扩增片段送去测序。得到pcr产物大小在4.0kb左右且序列与seq id no.7所示一致的菌株,即为阳性重组菌,将其命名为frd-cg-1。
[0077]
实施例2重组谷氨酸棒杆菌frd-cg-2构建
[0078]
s1 pk18mobsacb-dapaup-tac-t7rnap-dapadown表达载体构建
[0079]
载体构建方法同实施例1,所使用引物为cg-δdapa-t7rnap-1/2/3/4/5/6,其中引物对cg-δdapa-t7rnap-1/2和cg-δdapa-t7rnap-5/6以谷氨酸棒杆菌cgmcc 1.1886基因组为模板扩增dapa基因上下游同源臂dapaup、dapadown片段;引物对cg-δdapa-t7rnap-3/4以质粒pxmj19-t7rnap为模板,扩增获取tac-t7rnap片段。
[0080]
s2重组谷氨酸棒杆菌菌株构建和筛选
[0081]
重组谷氨酸棒杆菌frd-cg-2菌株构建和筛选方法同实施例1,不同之处为本实施例制备感受态所使用菌株为重组谷氨酸棒杆菌frd-cg-1;利用引物对cg-δdapa-t7rnap-1/6对二次阳性克隆进行菌落pcr,将得到的扩增片段送去测序。得到pcr产物大小在4.0kb左右且序列与seq id no.8所示一致的菌株,即为阳性重组菌,将其命名为frd-cg-2。
[0082]
实施例3重组谷氨酸棒杆菌frd-cg-3构建
[0083]
s1 pk18mobsacb-pckup-t7-lysc-pckdown表达载体构建
[0084]
载体构建方法同实施例1,所使用引物为cg-δpck-t7-lysc-1/2/3/4/5/6/7/8,其中引物对cg-δpck-t7-lysc-1/2和cg-δpck-t7-lysc-7/8以谷氨酸棒杆菌cgmcc 1.1886基因组为模板扩增pck基因上下游同源臂pckup、pckdown片段;引物对cg-δpck-t7-lysc-3/4和cg-δpck-t7-lysc-5/6以谷氨酸棒杆菌cgmcc 1.1886基因组为模板扩增基因,扩增获取t7-lysc片段。
[0085]
s2重组谷氨酸棒杆菌frd-cg-3菌株构建和筛选
[0086]
重组谷氨酸棒杆菌frd-cg-3菌株构建和筛选方法同实施例1,其中不同之处为本实施例制备感受态所使用菌株为重组谷氨酸棒杆菌frd-cg-2;利用引物对cg-δpck-t7-lysc-1/8对二次阳性克隆进行菌落pcr,将得到的扩增片段送去测序。得到pcr产物大小在2.2kb左右且序列与seq id no.9所示一致的菌株,即为阳性重组菌,将其命名为frd-cg-3。
[0087]
实施例4重组表达载体pxmj19-t7-ectabc构建
[0088]
s1 pxmj19的线性化片段制备
[0089]
利用引物对pxmj19-t7-ectabc-1/4以pxmj19质粒为模板进行pcr,获得pxmj19的线性化片段,琼脂糖凝胶电泳切胶回收纯化待用。
[0090]
s2 pcr扩增t7-ectabc的编码序列
[0091]
采用pcr技术以伸长盐单胞菌cgmcc 1.6329基因组为模板,根据ectabc基因序列设计引物(pxmj19-t7-ectabc-2/3),扩增获取t7-ectabc片段,琼脂糖凝胶电泳切胶回收纯化待用。pcr反应体系和条件参考实施例1。
[0092]
s3同源重组构建pxmj19-t7-ectabc表达载体
[0093]
利用同源重组酶连接t7-ectabc片段和pxmj19的线性化片段,转化大肠杆菌dh5α,氯霉素抗性平板筛选,利用引物对pxmj19-t7-ectabc-2/3对阳性克隆进行菌落pcr验证,验证正确的克隆扩繁后抽取质粒送测序,得到pcr产物大小在2.6kb左右且序列与seq idno.10所示一致的即为pxmj19-t7-ectabc表达载体。
[0094]
实施例5重组谷氨酸棒杆菌frd-cgect-1/2/3菌株构建和筛选
[0095]
重组谷氨酸棒杆菌frd-cgect-1/2/3菌株构建方法同实施例1,其中不同之处为制备感受态所使用菌株为frd-cg-1/2/3,电转表达质粒为pxmj19-t7-ectabc。
[0096]
阳性克隆筛选方法同实施例1,利用引物对pxmj19-t7-ectabc-2/3对二次阳性克隆进行菌落pcr,将得到的扩增片段送去测序。得到pcr产物大小在2.6kb左右且序列与seq idno.10所示一致的菌株,即为阳性重组菌,将其分别命名为frd-cgect-1/2/3。
[0097]
将重组谷氨酸棒杆菌frd-cgect-3保藏至中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号,保藏日期为2022年07月29日,保藏编号为cgmcc no.25427。
[0098]
实施例6重组谷氨酸棒杆菌frd-cgect-1发酵
[0099]
(1)种子活化:在超净工作台用接种环蘸取重组谷氨酸棒杆菌frd-cgect-1菌液,在固体斜面活化培养基中划线,放置于30℃培养箱中培养16小时。
[0100]
固体斜面活化培养基成分为蛋白胨10g/l、牛肉浸粉3g/l、nacl 5g/l、琼脂粉15g/l,其余为水,用液氨调节ph值为7.2。
[0101]
(2)一级种子培养:在超净工作台用接种环刮取一环菌体,接种到装有30ml种子培养基的500ml三角瓶中,用八层纱布封口,在30℃、200-250r/min的条件下振荡培养,od600生长至1.8-2.0。
[0102]
一级种子培养基成分为蛋白胨10g/l、牛肉浸粉3g/l、nacl 5g/l,其余为水,用液氨调节ph值为7.2。
[0103]
(3)二级种子培养:按3%接种量转移一级种子到装有5l种子培养基的10l发酵罐中,发酵过程中控制ph稳定在7.0左右,温度维持在30℃,溶氧在20%,od600生长至15。
[0104]
二级种子培养基成分为葡萄糖20g/l、玉米浆10g/l、蛋白胨5g/l、牛肉浸粉2g/l、复合氨基酸4g/l、柠檬酸2g/l、(nh4)2so
4 3g/l、kh2po
4 2g/l、mgso
4 0.8g/l、消泡剂0.6g/l、feso4·
7h2o 50mg/l、mnso4·
h2o 50mg/l、生物素1mg/l,其余为水,用液氨调节ph值为7.2;复合氨基酸的配方是高丝氨酸100g、蛋氨酸100g、苏氨酸100g、天冬氨酸100g,混合均匀。
[0105]
(4)发酵培养:按照15%接种量转移二级种子到装有5l发酵培养基的10l发酵罐中,发酵过程中控制ph稳定在7.2左右,温度维持在30℃,溶氧在20%;当培养基中的初始葡萄糖消耗完之后,添加终浓度0.5mm的iptg,间隔流加50%(m/v)的葡萄糖溶液,通过调节单次补糖量和补糖频次,使溶氧在单个补糖周期内上下波动,振幅为25%-30%,维持8h;后加快补糖速率,维持发酵培养基中的葡萄糖浓度在0.5-5g/l;发酵周期为40h。
[0106]
发酵培养基成分为葡萄糖20g/l、玉米浆15g/l、蛋白胨5g/l、牛肉浸粉2g/l、复合
氨基酸8g/l、柠檬酸4g/l、(nh4)2so
4 6g/l、kh2po
4 5g/l、mgso
4 1.5g/l、消泡剂1.5g/l、feso4·
7h2o80mg/l、mnso4·
h2o 80mg/l、生物素1mg/l,其余为水,用液氨调节ph值为7.2;复合氨基酸的配方是高丝氨酸100g、蛋氨酸100g、苏氨酸100g、天冬氨酸100g,混合均匀。
[0107]
对最终发酵得到的四氢嘧啶含量进行检测,检测方法为用去离子水适当稀释发酵液,12000rpm离心5min后取上清用0.22μm滤膜过滤,使用高效液相色谱法测定,色谱仪为安捷伦1260infinity ii,色谱柱为zorbax sb-c18,流动相为2%乙腈溶液,柱温为30℃,流速为1ml/min,进样量为10μl,紫外检测波长为210nm,保留时间为10min,并配置一系列浓度梯度的四氢嘧啶溶液作为标准样品,绘制标准曲线。计算得到,实施例6重组谷氨酸棒杆菌frd-cgect-1的四氢嘧啶发酵含量为15g/l。
[0108]
实施例7重组谷氨酸棒杆菌frd-cgect-2发酵
[0109]
使用重组谷氨酸棒杆菌frd-cgect-2发酵生产四氢嘧啶,具体发酵方法同实施例6,经检测,实施例7的发酵含量为35g/l。
[0110]
实施例8重组谷氨酸棒杆菌frd-cgect-3发酵
[0111]
使用重组谷氨酸棒杆菌frd-cgect-3发酵生产四氢嘧啶,具体发酵方法同实施例6,经检测,实施例8的发酵含量为70g/l。
[0112]
尽管通过参考附图并结合优选实施例的方式对本发明进行了详细描述,但本发明并不限于此。在不脱离本发明的精神和实质的前提下,本领域普通技术人员可以对本发明的实施例进行各种等效的修改或替换,而这些修改或替换都应在本发明的涵盖范围内/任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1