一种核酸的提取试剂及其试剂盒和提取方法与流程
1.本发明涉及核酸提取领域,具体而言,涉及一种核酸的提取试剂及其试剂盒和提取方法。
背景技术:
2.提取核酸常见的方法有传统的酚/氯仿有机液相抽提法、碱裂解法、溴化十六烷基三甲铵(ctab)提取法、非传统的鳌合树脂法、离心柱吸附法。酚/氯仿抽提法虽然提取核酸纯度高,但是对人体危害大,且很容易造成环境污染,提取的过程需要反复抽提换管,步骤繁琐,会造成的样本的污染与丢失。碱裂解法较多用于提取dna,不适用于提取rna。离心柱法核酸提取的缺点是需要较多的样本,耗材多,同时离心柱法dna提取需要反复离心,不便于高通量、自动化操作,与现代生物学实验的高通量、自动化要求格格不入。
3.纳米磁珠法是使用了一种特别的磁性微粒,它是以高聚分子层包裹超顺磁性材料的磁性微球作为基质,通过在磁珠表面修饰-cooh、-oh等活性功能基团,可特异性吸附目标分子,并在外加磁场的作用下,进行导向和分离。商品化磁珠工艺成熟,磁性微球单分散、尺寸形状均一。基于其形态结构特点,具有较大的表面积,能有效结合核酸,在核酸提取中有更高的产量与可重复性,并且非常适用于自动化应用。磁珠核酸提取法在生物技术领域应用已比较广泛。
4.磁珠核酸提取法虽已广泛普及,但针对不同类型或复杂程度不一致的样本,对于dna或rna提取方法和效率仍有一定差别,导致提取不同样本需使用不同试剂盒。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种核酸的提取试剂及其试剂盒和提取方法。
7.本发明是这样实现的:
8.第一方面,本发明实施例提供了一种核酸提取试剂,其包括裂解液;所述裂解液包含的组分及组分的终浓度如下:核酸助沉剂、1~6m异硫氰酸胍、体积百分比为1%~10%的曲拉通x-100、体积百分比为1%~5%的吐温20、质量体积百分比为1%~10%的壬基酚聚氧乙烯醚、0.01~0.1m三(羟甲基)氨基甲烷盐酸盐和0.001~0.05m乙二胺四乙酸,ph为6.0~7.5;所述核酸助沉剂包括:聚乙二醇和线性丙烯酰胺中的至少一种。
9.第二方面,本发明实施例提供了一种核酸提取试剂盒,其包括前述实施例所述的核酸提取试剂。
10.第三方面,本发明实施例提供了如前述实施例所述的核酸提取试剂在制备多类型样本核酸的提取试剂盒中的应用。
11.第四方面,本发明实施例提供了一种核酸的提取方法,其包括:采用如前述实施例所述的核酸提取试剂对样本进行核酸提取;所述提取方法不以疾病的诊断或治疗为直接目的。
12.第五方面,本发明实施例提供了一种核酸的检测方法,其包括:采用前述实施例所述的核酸的提取方法对样本进行核酸的提取,并对提取后的核酸进行检测分析;所述核酸的检测方法不以疾病的诊断或治疗为直接目的。
13.本发明具有以下有益效果:
14.本发明公开了一种核酸提取的试剂及其应用方法,相对现有的核酸提取试剂而言,具有更好的核酸提取效率,且可用于多种不同类型样本的核酸提取,包括dna和/或rna,对于低浓度样本具有更高的检出率,同时可实现快速、高通量、自动化的核酸提取。
附图说明
15.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
16.图1-1为本发明试剂盒中使用不同浓度核酸助沉剂peg6000提取效果的对比;
17.图1-2为本发明试剂盒中使用不同浓度核酸助沉剂线性丙烯酰胺提取效果的对比;
18.图1-3为本发明试剂盒中使用不同核酸助沉剂提取效果的对比;
19.图2为本发明试剂盒不同配方提取试剂的效果对比;
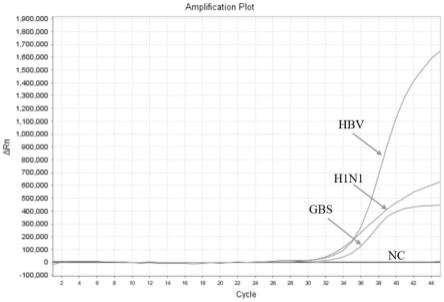
20.图3-1为本发明试剂盒提取不同类型样本核酸的效果展示,包括口咽拭子样本甲型流感病毒h1n1、宫颈拭子样本b族链球菌(gbs)、血清样本乙型肝炎病毒(hbv)的检测结果;
21.图3-2为本发明试剂盒提取痰液样本鲍曼不动杆菌的检测结果;
22.图3-3为本发明试剂盒提取不同浓度血清样本丙型肝炎病毒(hcv)的效果展示。
具体实施方式
23.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
24.首先,本发明实施例提供了一种核酸提取试剂,其包括裂解液。所述裂解液包含的组分及组分的终浓度如下:核酸助沉剂、1~6m异硫氰酸胍、体积百分比为1%~10%的曲拉通x-100、体积百分比为1%~10%的吐温20、质量体积百分比为1%~10%的壬基酚聚氧乙烯醚、0.01~0.1m三(羟甲基)氨基甲烷盐酸盐和0.001~0.05m乙二胺四乙酸,ph为6.0~7.5。
25.本文中的“质量体积百分比”中的质量体积比的单位为g/ml。
26.发明人经一系列创造性劳动发现,具有上述特定配比的裂解液应用于核酸提取,能适用于不同类型的样本的核酸(dna或rna)提取,且提取效率高,可高通量、自动化的实现多种类型或复杂程度不一样本的提取,同时对于低浓度样本具有更高的检出率,如血清血浆hcv样本可检测到20iu/ml,hbv样本可检测到10iu/ml。
27.具体地,裂解液中,异硫氰酸胍的终浓度可以为1m、1.5m、2m、2.5m、3m、3.5m、4m、4.5m、5m、5.5m和6m中的任意一种或任意两种之间的范围;曲拉通x-100的终浓度可以为1%、2%、3%、4%、5%、6%、7%、8%、9%和10%中的任意一种或任意两种之间的范围;壬基酚聚氧乙烯醚的终浓度可以为1%、2%、3%、4%、5%、6%、7%、8%、9%和10%中的任意一种或任意两种之间的范围;吐温20的终浓度可以为1%、2%、3%、4%和5%中的任意一种或任意两种之间的范围;三(羟甲基)氨基甲烷盐酸盐的终浓度可以为0.01m、0.02m、0.03m、0.04m、0.05m、0.06m、0.07m、0.08m、0.09m和0.1m中的任意一种或任意两种之间的范围;乙二胺四乙酸二钠盐的终浓度可以独立地为0.001m、0.005m、0.01m、0.02m、0.03m、0.04m、0.05m中的任意一种或任意两种之间的范围。
28.在一些实施例中,裂解液中含有核酸助沉剂,所述核酸助沉剂包含聚乙二醇和线性丙烯酰胺中至少一种。
29.可选地,聚乙二醇的分子量为800~8000da,具体可以为800、2000、4000、6000和8000中的任意一种。
30.优选地,所述聚乙二醇的分子量为4000~6000,具有更好的提取效果。
31.可选地,聚乙二醇在裂解液中的质量体积百分比为0.05%~2%,具体可以为0.05%、0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%和2%中的任意一种或任意两种之间的范围。
32.可选地,当核酸助沉剂包括线性丙烯酰胺时,线性丙烯酰胺在裂解液中的终浓度为5μg/ml~40μg/ml,该终浓度具体可以为5μg/ml、10g/ml、15g/ml、20g/ml、25g/ml、30g/ml、35g/ml和40g/ml中的任意一种或任意两种之间的范围。
33.在一些实施例中,所述核酸提取试剂还包括:痰液液化液、蛋白酶k、磁珠、洗涤液i、洗涤液ii和洗脱液中的至少一种。
34.在一些实施例中,所述洗涤液i包含的组分及组分的终浓度如下:1~4m异硫氰酸胍、0.5~3m nacl、体积百分比为1%~5%的吐温~20以及体积百分比为30%~70%的异丙醇。
35.具体地,在洗涤液i中,异硫氰酸胍的终浓度可以为1m、1.5m、2m、2.5m、3m、3.5m、4m中的任意一种或任意两种之间的范围;nacl的终浓度可以为0.5m、1m、2m、3m中的任意一种或任意两种之间的范围;吐温~20的终浓度可以为1%、2%、3%、4%和5%中的任意一种或任意两种之间的范围;异丙醇的终浓度可以为30%、35%、40%、45%、50%、55%、60%、65%和70%中的任意一种或任意两种之间的范围。
36.在一些实施例中,所述洗涤液ii包含的组分及组分的终浓度如下:1~100mm三(羟甲基)氨基甲烷盐酸盐、0.5~5mm乙二胺四乙酸二钠盐。使用前需加入3倍体积的无水乙醇。
37.具体地,在所述洗涤液ii中,三(羟甲基)氨基甲烷盐酸盐的终浓度可以为1mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、中的任意一种或任意两种之间的范围;乙二胺四乙酸二钠盐的终浓度可以为0.5mm、1mm、2mm、3mm、4mm、5mm中的任意一种或任意两种之间的范围。
38.在一些实施例中,所述洗脱液包含的组分及组分的终浓度如下:5~15mm三(羟甲基)氨基甲烷盐酸盐和0.5~5mm乙二胺四乙酸;洗脱液的ph值为7.8~8.2。
39.具体地,在所述洗脱液中,三(羟甲基)氨基甲烷盐酸盐的终浓度可以为5mm、6mm、mm、8mm、9mm、10mm、11mm、12mm、13mm、14mm和15mm中的任意一种或任意两种之间的范围;乙二胺四乙酸的终浓度可以为0.5mmol/l、1mmol/l、2mmol/l、3mmol/l、4mmol/l和5mmol/l中的任意一种或任意两种之间的范围;洗脱液的ph值可以为7.8、7.9、8.0、8.1、8.2中的任意一种或任意两种之间的范围。
40.在实施例中,所述磁珠包括:表面带有硅羟基的磁性微粒,磁珠的粒径为100~300nm,工作浓度为10~100mg/ml。
41.在一些实施例中,所述痰液液化液的组分及组分的终浓度如下:质量体积百分比为0.5%~5%的柠檬酸钠、质量体积百分比为1%~10%的氢氧化钠和质量体积百分比为0.1%~5%的n-乙酰-l-半胱氨酸。
42.具体地,在所述痰液液化液中,柠檬酸钠的终浓度可以为0.5%、1%、2%、3%、4%和5%中的任意一种或任意两种之间的范围;氢氧化钠的终浓度可以为1%、2%、3%、4%、5%、6%、7%、8%、9%和10%中的任意一种或任意两种之间的范围;n-乙酰-l-半胱氨酸的终浓度可以为0.1%、0.5%、1%、2%、3%、4%和5%中的任意一种或任意两种之间的范围。
43.在一些实施例中,所述核酸提取试剂适用于从多种类型的样本中提取细胞、病毒、细菌或真菌的核酸。所述核酸是指dna和rna中的至少一种。
44.在一些实施例中,所述多种类型的样本包括:血清、血浆、口腔、鼻咽、宫颈拭子、痰液和肺泡灌洗液中的任意一种。
45.另一方面,本发明实施例还提供了一种核酸提取试剂盒,其包括前述任意实施例所述的核酸提取试剂。
46.另一方面,本发明实施例还提供了如前述任意实施例所述的核酸提取试剂在提取多类型样本核酸的应用。
47.在一些实施例中,所述多类型样本核酸的提取的定义同前述任意实施例所述,不再赘述。
48.另一方面,本发明实施例还提供了一种核酸的提取方法,其包括:采用如前述任意实施例所述的核酸提取试剂对样本进行核酸提取。
49.在一些实施例中,所述多类型样本核酸的提取的定义同前述任意实施例所述,不再赘述。
50.可以理解的是,本发明提供的核酸试剂中包含的各组分,可结合本领域常规技术知识进行核酸的提取和应用。
51.在一些实施例中,所述核酸提取的步骤包括如下:
52.将样本、裂解液、蛋白酶k、异丙醇和磁珠混合,获得混合溶液;
53.将所述混合溶液静置,磁力吸附磁珠,去除上清液;
54.依次采用洗涤液i、洗涤液ii和洗脱液对去除上清液后的产物进行洗涤和洗脱,获得提取的核酸。
55.在一些实施例中,样本与裂解液的体积比为1:(1~5),具体可以为1:1、1:2、1:3、1:4和1:5中的任意一种或任意两种之间的范围。
56.此外,本发明实施例还提供了一种核酸的检测方法,其包括:采用前述任意实施例所述的核酸提取方法对样本进行核酸的提取,并对提取后的核酸进行检测分析;所述核酸
的检测方法不以疾病的诊断或治疗为直接目的。
57.以下结合实施例对本发明的特征和性能作进一步的详细描述。
58.实施例1
59.对不同核酸助沉剂的效果进行验证。
60.本实施例提供了核酸提取试剂配方一,单一改变核酸助沉剂物质及其浓度,测试核酸提取效果。
61.核酸提取试剂配方一:
62.裂解液:4m异硫氰酸胍、体积百分比为5%的曲拉通x-100、体积百分比为2%的吐温20、质量体积百分比为5%的壬基酚聚氧乙烯醚、0.05m三(羟甲基)氨基甲烷盐酸盐和0.01m乙二胺四乙酸二钠;裂解液ph为7.0;
63.核酸助沉剂,分别测试如下:
64.1、peg6000:质量体积百分比分别为0.01%、0.1%、0.5%、1%、2%、5%;
65.2、线性丙烯酰胺:在裂解液中的终浓度分别为5μg/ml、10μg/ml、15μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml;
66.3、质量体积百分比为1%的peg800、peg2000、peg4000、peg6000、peg8000,终浓度为15ug/ml的线性丙烯酰胺;
67.磁珠:带有硅羟基的磁性微粒,直径为200nm,浓度为40mg/ml;
68.蛋白酶k:裂解液中的终浓度为0.33mg/ml;
69.洗涤液i:2m异硫氰酸胍、1m nacl、体积百分比为2%的吐温~20以及体积百分比为50%的异丙醇;
70.洗涤液ii:10mm三(羟甲基)氨基甲烷盐酸盐、1mm乙二胺四乙酸二钠盐;使用时加入3倍体积的无水乙醇;
71.洗脱液:10mm三(羟甲基)氨基甲烷盐酸盐和1mm乙二胺四乙酸;洗脱液ph为8.0。
72.以血清hcv样本的核酸提取为例,采用上述核酸提取试剂但使用不同核酸助沉剂进行核酸提取效率的比较,具体包括以下步骤:
73.测试1:
74.(1)样本准备:以hcv国家标准品为代表样本,使用阴性的山羊血清稀释至50iu/ml,备用。
75.(2)样本提取:
76.a.取1.5ml离心管a,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含0.01%的peg6000),200μl异丙醇和10μl纳米磁珠。
77.b.取1.5ml离心管b,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含0.1%的peg6000),200μl异丙醇和10μl纳米磁珠。
78.c.取1.5ml离心管c,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含0.5%的peg6000),200μl异丙醇和10μl纳米磁珠。
79.d.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含1%的peg6000),200μl异丙醇和10μl纳米磁珠。
80.e.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含2%的peg6000),200μl异丙醇和10μl纳米磁珠。
81.f.取1.5ml离心管e,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含5%的peg6000),200μl异丙醇和10μl纳米磁珠。
82.g.另取一个新的1.5ml离心管,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(无核酸助沉剂),200μl异丙醇和10μl纳米磁珠。
83.h以上7管混合液涡旋振荡30s后置于65℃,1500rpm振荡10min。
84.i瞬离后置于磁力架上静置2min,用枪尖吸取弃去上清液。
85.j.加入600μl洗涤液i,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液。
86.k.加入600μl洗涤液ii,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液,室温干燥5min。
87.l.加入50μl洗脱液,轻微振荡混匀后置于60℃静置5min。
88.m.将离心管置于磁力架上直至溶液澄清,转移上清至新的离心管中,此即为得到的hcv rna,短期可置于-20℃保存。
89.(3)样本的荧光定量pcr检测
90.取30μl上述各rna提取物和20μl hcv扩增试剂,混匀后按以下程序扩增:
[0091][0092][0093]
(4)结果
[0094]
扩增曲线见附图1-1,ct值如下:
[0095]
裂解中peg6000含量0.01%0.1%0.5%1%2%5%无核酸助沉剂ct值39.136.6636.736.137.4739.1138.23
[0096]
结果显示,含有核酸助沉剂的提取方案的效果优于无核酸助沉剂的提取方案。另外,不同浓度的核酸助沉剂peg6000中,1%浓度的提取效果是最优的。
[0097]
测试2:
[0098]
(1)样本准备:以hcv国家标准品为代表样本,使用阴性的山羊血清稀释至2000iu/ml,备用。
[0099]
(2)样本提取:
[0100]
a.取1.5ml离心管a,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含5μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0101]
b.取1.5ml离心管b,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含10μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0102]
c.取1.5ml离心管c,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含15μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0103]
d.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含20μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0104]
e.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含30μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0105]
f.取1.5ml离心管e,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含40μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0106]
g.取1.5ml离心管e,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含50μg/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0107]
h.另取一个新的1.5ml离心管,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(无核酸助沉剂),200μl异丙醇和10μl纳米磁珠。
[0108]
i:以上8管混合液涡旋振荡30s后置于65℃,1500rpm振荡10min。
[0109]
j.瞬离后置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0110]
k.加入600μl洗涤液i,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0111]
l.加入600μl洗涤液ii,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液,室温干燥5min。
[0112]
m.加入50μl洗脱液,轻微振荡混匀后置于60℃静置5min。
[0113]
n.将离心管置于磁力架上直至溶液澄清,转移上清至新的离心管中,此即为得到的hcv rna,短期可置于-20℃保存。
[0114]
(3)样本的荧光定量pcr检测
[0115]
取30μl上述各rna提取物和20μl hcv扩增试剂,混匀后按以下程序扩增:
[0116][0117]
(4)结果
[0118]
扩增曲线见附图1-2,ct值如下:
[0119][0120]
结果显示,含有核酸助沉剂的提取方案的效果优于无核酸助沉剂的提取方案。另外,不同浓度的核酸助沉剂中,15μg/ml线性丙烯酰胺的提取效果是最优的。
[0121]
测试3:
[0122]
(1)样本准备:以hcv国家标准品为代表样本,使用阴性的山羊血清稀释至2000iu/ml,备用。
[0123]
(2)样本提取:
[0124]
a.取1.5ml离心管a,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含1%的peg800),200μl异丙醇和10μl纳米磁珠。
[0125]
b.取1.5ml离心管b,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含1%的peg2000),200μl异丙醇和10μl纳米磁珠。
[0126]
c.取1.5ml离心管c,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含1%的peg4000),200μl异丙醇和10μl纳米磁珠。
[0127]
d.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含1%的peg6000),200μl异丙醇和10μl纳米磁珠。
[0128]
e.取1.5ml离心管d,加入200μl待测样本,依次加入10μl蛋白酶k,400ul裂解液(含1%的peg8000),200μl异丙醇和10μl纳米磁珠。
[0129]
f.取1.5ml离心管e,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含15ug/ml的线性丙烯酰胺),200μl异丙醇和10μl纳米磁珠。
[0130]
g.取1.5ml离心管e,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(无核酸助沉剂),200μl异丙醇和10μl纳米磁珠。
[0131]
h:以上7管混合液涡旋振荡30s后置于65℃,1500rpm振荡10min。
[0132]
i.瞬离后置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0133]
j.加入600μl洗涤液i,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0134]
k.加入600μl洗涤液ii,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液,室温干燥5min。
[0135]
l.加入50μl洗脱液,轻微振荡混匀后置于60℃静置5min。
[0136]
m.将离心管置于磁力架上直至溶液澄清,转移上清至新的离心管中,此即为得到的hcv rna,短期可置于-20℃保存。
[0137]
(3)样本的荧光定量pcr检测
[0138]
取30μl上述各rna提取物和20μl hcv扩增试剂,混匀后按以下程序扩增:
[0139][0140]
(4)结果
[0141]
扩增曲线见附图1-3,ct值如下:
[0142][0143]
结果显示,含有核酸助沉剂的提取方案的效果优于无核酸助沉剂的提取方案。1%peg4000、1%peg6000以及15μg/ml的线性丙烯酰胺的提取效果均是较优的。
[0144]
实施例2
[0145]
提供了三种的核酸提取试剂配方进行比较,验证不同配方的效果。
[0146]
采用核酸提取试剂配方一、核酸提取试剂配方二和核酸提取试剂配方三同时对500iu/ml的hcv样本进行提取,验证不同浓度的配方对提取效果的影响。
[0147]
1、核酸提取试剂配方
[0148]
a.核酸提取试剂配方一:参见实施例1,其中核酸助沉剂为质量体积百分比为1%
的peg4000;
[0149]
b.核酸提取试剂配方二:
[0150]
裂解液:1m异硫氰酸胍、质量体积百分比为1%的peg4000、体积百分比为1%的曲拉通x-100、体积百分比为5%的吐温20、质量体积百分比为1%的壬基酚聚氧乙烯醚、0.1m三(羟甲基)氨基甲烷盐酸盐和0.05m乙二胺四乙酸二钠;裂解液ph为7.5;
[0151]
磁珠:带有硅羟基的磁性微粒,直径为200nm,浓度为40mg/ml;
[0152]
蛋白酶k:裂解液中的终浓度为0.33mg/ml;
[0153]
洗涤液i:1m异硫氰酸胍、3m nacl、体积百分比为1%的吐温~20以及体积百分比为70%的异丙醇;
[0154]
洗涤液ii:1mm三(羟甲基)氨基甲烷盐酸盐、5mm乙二胺四乙酸二钠盐,使用时加入3倍体积的无水乙醇;
[0155]
洗脱液:5mm三(羟甲基)氨基甲烷盐酸盐和5mm乙二胺四乙酸;洗脱液ph为7.8。
[0156]
c.核酸提取试剂配方三:
[0157]
裂解液:6m异硫氰酸胍、质量体积百分比为2%的peg4000、体积百分比为10%的曲拉通x-100、体积百分比为1%的吐温20、质量体积百分比为5%的壬基酚聚氧乙烯醚、0.01m三(羟甲基)氨基甲烷盐酸盐和0.001m乙二胺四乙酸二钠;裂解液ph为6.0;
[0158]
磁珠:带有硅羟基的磁性微粒,直径为200nm,浓度为40mg/ml;
[0159]
蛋白酶k:裂解液中的终浓度为0.33mg/ml;
[0160]
洗涤液i:4m异硫氰酸胍、0.5m nacl、体积百分比为5%的吐温~20以及体积百分比为30%的异丙醇;
[0161]
洗涤液ii:100mm三(羟甲基)氨基甲烷盐酸盐、0.5mm乙二胺四乙酸二钠盐和3倍体积的无水乙醇;
[0162]
洗脱液:15mm三(羟甲基)氨基甲烷盐酸盐和0.5mm乙二胺四乙酸;洗脱液ph为8.2。
[0163]
2、提取步骤包括以下:
[0164]
分别使用核酸提取试剂配方一、核酸提取试剂配方二、核酸提取试剂配方三,按照实施例1的操作方法,对500iu/ml的hcv样本进行核酸提取,得到的核酸进行后续检测。
[0165]
3、荧光定量pcr检测及程序设置
[0166]
取30μl上述各rna提取物和20μl hcv扩增试剂,混匀后按以下程序扩增:
[0167][0168]
4、检测结果
[0169]
扩增曲线见附图2,ct值如下:
[0170]
配方配方1配方2配方3ct值32.1233.0733.52
[0171]
结果显示,本发明试剂盒的试剂在所述浓度范围内均可以有较好的提取效果。
[0172]
实施例3
[0173]
本实施例提供了对不同类型的样本进行核酸提取,核酸类型包括dna和rna,并对多种不同病原体核酸进行检测的方法。
[0174]
本实施例提供了痰液样本的核酸提取,过程中使用了痰液液化液,所述痰液液化液的组分及组分终浓度如下:1.47%的柠檬酸钠、2%的氢氧化钠以及0.5%的n-乙酰-l-半胱氨酸。
[0175]
本实施例采用核酸提取试剂配方一进行检测,具体过程如下:
[0176]
1.提取甲型流感病毒h1n1咽拭子样本、b族链球菌(gbs)宫颈拭子样本、乙型肝炎病毒(hbv)血清样本、鲍曼不动杆菌痰液样本以及不同浓度的丙型肝炎病毒(hcv)血清样本进行检测;
[0177]
2.使用杭州博日的核酸提取仪进行自动化提取,具体包括以下步骤:
[0178]
2.1样本准备
[0179]
a.将甲型流感病毒h1n1阳性的咽拭子样本使用病毒保存液稀释至1tcid
50
/ml,备用。
[0180]
b.将b族链球菌(gbs)阳性的宫颈拭子样本使用细胞保存液稀释至10000cfu/ml,备用。
[0181]
c.将乙型肝炎病毒(hbv)国家标准品用阴性的山羊血清稀释至500iu/ml,备用。
[0182]
d.将鲍曼不动杆菌痰液样本和痰液液化液按体积比1:1混匀,静置30min进行液化,备用。
[0183]
e.将丙型肝炎病毒(hcv)国家标准品用阴性的山羊血清稀释至1x104iu/ml、2000iu/ml、500iu/ml、100iu/ml、50iu/ml以及20iu/ml,备用。
[0184]
2.2样本提取:
[0185]
a.配置裂解混合液:(400μl裂解液(含1% peg4000)+200μl异丙醇+10μl蛋白酶k+10μl磁珠)
×
10,混匀备用;
[0186]
b.96孔深孔板孔位添加试剂具体如下:孔1和孔7先加入600μl裂解混合液,再加入200μl待测样本;孔2和孔8加入600μl洗涤液i;孔3和孔9加入600μl洗涤液ii;孔5和孔11加入80μl洗脱液;
[0187]
c.核酸提取仪的提取程序设置如下:
[0188][0189][0190]
d.孔5和孔11的核酸可收集至新的离心管中保存使用;
[0191]
2.3提取核酸的荧光pcr检测
[0192]
取5μl h1n1流感病毒rna加入15μl甲流扩增试剂中,取5μl gbs dna加入15μl b族链球菌扩增试剂中,取20μl hbv dna加入30μl乙肝病毒核酸扩增试剂中,取5μl鲍曼不动杆菌dna加入15μl鲍曼不动杆菌核酸扩增试剂中,取30ul hcv rna加入20ul丙肝病毒核酸扩增试剂中,同时每种扩增试剂加入对应体积的洗脱液作为阴性对照,分别混匀后按以下程序扩增:
[0193][0194]
2.4检测结果:
[0195]
扩增曲线见附图3-1~3-3,扩增结果如下:
[0196][0197]
检测结果显示,本发明可以实现不同样本类型的核酸提取,其中包括dna或rna样本,提取效果好,并且可有效检测出低浓度样本。
[0198]
实施例4
[0199]
本实施例提供了本发明核酸提取试剂盒与商业化核酸提取试剂盒的提取效果比较。
[0200]
1.使用本发明核酸提取试剂盒(核酸提取试剂配方一)、凯杰柱法提取试剂盒以及诺唯赞磁珠提取试剂盒,同时提取新冠假病毒样本,进行性能比较。
[0201]
2.样本准备:将新冠假病毒样本用病毒保存液稀释至104copies/ml,备用。
[0202]
3.样本提取:
[0203]
3.1凯杰柱法提取试剂盒及诺唯赞磁珠提取试剂盒分别按照其说明书提取200μl样本,各完成10次重复。
[0204]
3.2本试剂盒按以下步骤进行提取:
[0205]
a.取10个新的1.5ml离心管,加入200μl待测样本,依次加入10μl蛋白酶k,400μl裂解液(含1%的peg4000),200ul异丙醇和10μl纳米磁珠。
[0206]
b.涡旋振荡30s后置于65℃,1500rpm振荡10min。
[0207]
c.瞬离后置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0208]
d.加入600μl洗涤液i,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液。
[0209]
e.加入600μl洗涤液ii,涡旋振荡10s后瞬离,置于磁力架上静置2min,用枪尖吸取弃去上清液,室温干燥5min。
[0210]
f.加入50μl洗脱液,轻微振荡混匀后置于60℃静置5min。
[0211]
g.将离心管置于磁力架上直至溶液澄清,转移上清至新的离心管中,此即为得到的新冠假病毒rna,短期可置于-20℃保存。
[0212]
h.本试剂盒完成10次重复。
[0213]
4.核酸提取物的pcr检测:取上述三种试剂盒提取产物各10μl分别加入10μl新冠核酸扩增试剂中,混匀后按以下程序扩增:
[0214][0215][0216]
5.检测结果
[0217][0218]
结果显示,本发明的检测方法效果相同于与或优于商业化试剂盒。
[0219]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1