一种宫颈癌检测分子标记物及基于其的单克隆抗体与应用的制作方法
1.本技术涉及生物诊断及医药的技术领域,尤其是涉及一种宫颈癌检测分子标记物及基于其的单克隆抗体与应用。
背景技术:
2.宫颈癌是女性生殖系统的常见恶性肿瘤,大量研究发现,人乳头瘤病毒(human papilloma virus,hpv)是导致宫颈癌的元凶。据统计,约20%的低度宫颈损伤将转变为高度损伤,如果不及时治疗,其中30%将会进一步转为恶性肿瘤。因此,早期诊断和预防hpv感染是降低宫颈癌等相关疾病死亡率和减少宫颈癌治疗开支的重要突破口。
3.目前宫颈癌筛查主要采用的是巴氏涂片检验,检测宫颈脱落细胞的细胞学形态。细胞形态学检测具有一定的主观性,制片困难,批内和批间重复性差,具有较高的假阳性和假阴性率,因此对早期癌症检测灵敏度低、漏诊率高,阳性检出率仅在30%~50%;在一些地区,巴氏涂片检验已经被液基细胞学(lbc)所取代,lbc是半自动或全自动标本处理新技术,能够自动分析检测样本并可提供剩余的细胞样本供其他hpv感染分析。另一种临床上使用的分子检测hpvdna检测(如hc2)可以辅助细胞学检测高危hpv病毒的存在,他是以具有致病性的高危型hpv核酸为目的基因,基于定量pcr的原理进行的,虽然检测的灵敏度高,但是检测过程中耗材较多且检测流程比较繁琐,导致检测成本较高。
4.我们知道,抗原抗体检测的灵敏度、特异性和便捷度都比较高,但是目前临床宫颈癌抗原抗体检测的方法尚未普遍,临床hpv检测没有合适的抗体主要有三个原因:1、hpv蛋白在临床组织或细胞样本中表达量较低,需要度高亲和力的抗体进行检测;2、hpv病毒在现有的标准组织培养技术下不能在实验室培养存活;3、e7蛋白本身存在免疫抑制,使得采用e7蛋白免疫动物不能获得很好的免疫反应,另外使制备得到的抗体往往与其他的hpv蛋白存在交叉反应对e7蛋白不具有特异性。因此,本领域有必要研究一种基于抗原抗体检测的、灵敏度高的、操作简便的、成本较低的宫颈癌检测技术。
技术实现要素:
5.为了改善目前宫颈癌抗原抗体检测技术比较缺乏,现行检测技术存在灵敏度不高或操作繁琐、成本较高的问题,本技术的第一个目的在于提供一种宫颈癌检测分子标记物,其为朊蛋白结构中的疾病特异性表位,能够特异性表征宫颈癌疾病,且其基于朊蛋,很容易获得。
6.本技术的第二个目的在于提供一种单克隆抗体及其制备方法,能够特异性识别宫颈癌细胞系或宫颈癌组织细胞,可用于宫颈癌的检测,检测灵敏度比较高。
7.本技术的第三个目的在于提供一种免疫磁珠和一种基于抗原抗体免疫检测的宫颈癌检测试剂盒,具有检测操作简便、成本较低的优点。
8.为了实现本技术的第一个目的,本技术提供一种宫颈癌检测的分子标记物,采用如下的技术方案:
9.一种宫颈癌检测的分子标记物,其特征在于,所述分子标记物为朊蛋白结构中的疾病特异性表位,所述疾病特异性表位在prpc中被包埋,在prpsc中被暴露,所述疾病特异性表位的氨基酸序列为mdeysnqmvfvhdc。
10.肮病毒(prion)是一类可引起人和动物的可转移性神经退化疾病的感染因子,病原为致病型肮蛋白(prpsc),它是由宿主体内正常表达的肮蛋白(prpc)空间结构异常变化而形成的。prpc和prpsc来源于同一基因,具有相同的氨基酸序列和共价修饰,但在空间结构上存在很大的差异,导致理化性质发生了显著的改变,已经发现肿瘤病变发生时,细胞表面prpc发生构型变化,转化为prpsc。基于此,发明人在进一步的研究中发现了上述技术方案中的疾病特异性表位的氨基酸序列,其在prpc中被包埋,在prpsc中被暴露,在宫颈癌细胞系和宫颈癌组织中都可以检测到,能够作为特异性表征宫颈癌疾病的分子标记物。
11.实现方式可以包括以下任何特征或全部特征。
12.在另一实施例中,所述分子标记物的n端和c端分别叠加所述疾病特异性表位的氨基酸序列。
13.通过序列的叠加,能够增加本技术方案中分子标记物的免疫源性,以提高该分子标记物动物免疫的成功率。
14.在另一实施例中,所述分子标记物与免疫载体白细胞素偶联。
15.通过采用上述技术方案来增加本技术方案中分子标记物的免疫刺激性,以提高该分子标记物动物免疫的成功率。
16.为了实现本技术的第二个目的,本技术提供一种单克隆抗体及其制备方法,采用如下的技术方案:
17.一种单克隆抗体,其特征在于,所述单克隆抗体可与上述的分子标记物特异性结合。
18.本技术方案中的抗体可和prpsc的特异性表位相结合,通过抗体-抗原表位的特异性结合来检测宫颈癌细胞的存在。
19.进一步地,本技术提供一种单克隆抗体的制备方法,包括制备目标抗原、动物免疫、细胞融合和单抗筛选的步骤,其特征在于,所述制备目标抗原步骤中包括:
20.s1,合成疾病特异性表位序列mdeysnqmvfvhdc;
21.s2,在疾病特异性表位序列的n端和c端各叠加四次所述的疾病特异性表位序列,获得目标多肽序列;
22.s3,将所述目标多肽序列与具有强免疫刺激的免疫载体白细胞素偶联,获得免疫复合物;
23.s4,将所述免疫复合物克隆到表达载体中并进行表达、纯化,获得目标抗原。
24.通过上述技术方案所制备的构象型单克隆抗体特异性极强,可以特异性识别宫颈癌病变发生时所引起的病变蛋白中结构异常位点,而不识别正常结构蛋白,从而可以实现检测宫颈癌细胞的目的,可以作为宫颈癌疾病早期诊断的辅助手段。
25.为了实现本技术的第三个目的,本技术首先提供一种免疫磁珠,进一步提供一种含有上述单克隆抗体或免疫磁珠的宫颈癌检测试剂盒,采用如下的技术方案:
26.一种免疫磁珠,其特征在于,采用链霉亲和素修饰的纳米磁珠与上述的单克隆抗体偶联得到。
27.通过上述技术方案处理抗体获得的免疫磁珠在应用于宫颈癌检测时,免疫磁珠捕获抗原后,由于其在磁场中具有与其他组分不同的磁响应性,在磁力作用下,带有抗原的细胞容易被分离,能够减少检测步骤,提高检测效率。
28.一种宫颈癌检测试剂盒,其特征在于,包含权利要求4所述的单克隆抗体或所述单克隆抗体的活性片段或所述单克隆抗体的融合蛋白。
29.一种宫颈癌检测试剂盒,其特征在于,包含权利要求5所述的免疫磁珠。
30.相对现行的宫颈癌检测技术,上述技术方案中的宫颈癌检测剂盒基于抗原抗体免疫检测,在检测的灵敏度、特异性、便捷性及检测成本上达到了一定的平衡,能够在比较低的检测成本下获得相对准确的检测结果,适合在经济不发达的地区作为宫颈癌早期筛查手段广泛使用。
31.综上所述,本技术提供了一种宫颈癌检测分子标记物及基于其的单克隆抗体与应用,具有以下有益效果:本技术依据朊蛋白在多种肿瘤细胞中的表达和调控特点,利用在多种宫颈癌细胞系和宫颈癌组织中都可以检测到特异性表位制备单克隆抗体,通过抗体-抗原表位的特异性结合检测宫颈癌细胞的存在。所制备构象型单克隆抗体特异性极强,可以特异性识别宫颈癌变发生时所引起的病变蛋白中结构异常位点,而不识别正常结构蛋白,从而可以作为肿瘤疾病早期诊断的辅助手段。且本技术在检测的灵敏度、特异性、便捷性及检测成本上达到了一定的平衡,能够达到在比较低的检测成本下获得相对准确检测结果的效果。
附图说明
32.图1是实施例2中elisa检测单克隆抗体滴度结果;
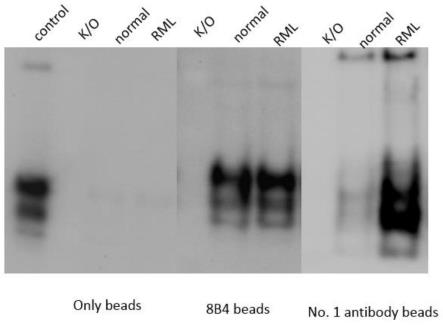
33.图2是实施例3中免疫共沉淀法检测单克隆抗体特异性结果;
34.图3是实施例1制备的单克隆抗体检测宫颈癌细胞系样品的阳性细胞数(纵坐标为阳性细胞数对数值)。
具体实施方式
35.以下对本技术一种宫颈癌检测分子标记物及基于其的单克隆抗体与应用作进一步详细说明。
36.本技术首先公开了一种宫颈癌检测的分子标记物,所述分子标记物为朊蛋白结构中的疾病特异性表位,所述疾病特异性表位在prpc中被包埋,在prpsc中被暴露,所述疾病特异性表位的氨基酸序列为mdeysnqmvfvhdc(seq id no.1)。其中氨基酸序列中的大写字母与现行的氨基酸单字母缩写表中的氨基酸单字母符号所代表的氨基酸相同。
37.进一步地,所述分子标记物的n端和c端至少一端叠加所述疾病特异性表位的氨基酸序列。例如可以仅在n端连续叠加一至多段疾病特异性表位的氨基酸序列,也可以仅在c端连续叠加一至多段疾病特异性表位的氨基酸序列,还可以同时在n端和c端连续叠加一至多段疾病特异性表位的氨基酸序列。
38.进一步地,所述分子标记物与免疫载体白细胞素偶联。其中免疫载体白细胞素可以使用白细胞介素il-2。
39.本技术还提供了一种单克隆抗体,所述单克隆抗体能够与上述的分子标记物特异
性结合,所述单克隆抗体是基于免疫反应与作为抗原的上述分子标记物结合的。所述单克隆抗体是以上述的疾病特异性表位氨基酸序列为抗原、通过本领域熟知的免疫小鼠-杂交瘤细胞的方法表达获得的。
40.进一步地,本技术还提供了一种单克隆抗体的制备方法,包括制备目标抗原、动物免疫、细胞融合和单抗筛选的步骤,所述制备目标抗原步骤中包括:
41.s1,合成疾病特异性表位序列mdeysnqmvfvhdc;
42.s2,在疾病特异性表位序列的n端和c端各叠加四次所述的疾病特异性表位序列,获得目标多肽序列;
43.s3,将所述目标多肽序列与具有强免疫刺激的免疫载体白细胞素偶联,获得免疫复合物;
44.s4,将所述免疫复合物克隆到表达载体中并进行表达、纯化,获得目标抗原。
45.在s1步骤中,所述疾病特异性表位的氨基酸序列为人工合成,可以通过基因工程合成、化学合成等本领域已知的多肽合成方法来合成。例如所述疾病特异性表位的氨基酸序列可以由j.m.stewart and j.d.young,solid phase peptide synthesis(pierce chemical co.,rockford,ill.1984)和g.barany and r.b.merrifield,thepeptides:analysis,synthesis,biology,editors e.gross and j.meienhofer,vol.2,(academic press,new york,1980),pp.3-254所记载固相合成法来合成。还可以由m.bodansky,principles of peptide synthesis,(springer-verlag,berlin1984)和e.gross and j.meienhofer,eds.,the peptides:analysis,synthesis,biology,vol.1所记载的经典溶液合成法来制备所述疾病特异性表位的氨基酸序列。
46.在s2步骤中,利用larson方法在疾病特异性表位序列的n端和c端连续叠加疾病特异性表位序列。
47.在s4步骤中,所述表达载体可以使用质粒,噬菌体等本领域常用的表达载体,优选地,表达载体可以使用白细胞毒素质粒,利用克隆有免疫复合物的白细胞毒素质粒转染大肠杆菌进行表达。本制备方法中所涉及的其他实验技术均为本领域常见的实验操作方法。
48.本技术还提供了一种免疫磁珠,所述免疫磁珠采用链霉亲和素修饰的纳米磁珠与上述的单克隆抗体偶联得到。其中链霉亲和素修饰的纳米磁珠可以为购买的商品化磁珠,也可以依照本领域熟知的纳米磁珠修饰技术手段用链霉亲和素修饰纳米磁珠获得。所述修饰后的纳米磁珠和所述单克隆抗体偶联的方法可以依照本领域的常规技术手段进行。
49.本技术还提供了一种宫颈癌检测试剂盒,所述宫颈癌检测试剂盒可以包含上述的单克隆抗体或所述单克隆抗体的活性片段或所述单克隆抗体的融合蛋白,还可以包含上述的免疫磁珠。所述单克隆抗体用于所述宫颈癌检测试剂盒时,可以将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,这类水性载体介质包括但并不限于盐水、缓冲液、无菌水。优选地,所述宫颈癌检测试剂盒包含上述单克隆抗体或上述免疫磁珠,所用水性载体介质为无菌水。
50.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。下列实施例中所涉
及生物材料及常规化学试剂如无特别说明均可从市售渠道获得。
51.实施例1:单克隆抗体制备
52.s1,利用固相合成技术,合成疾病特异性表位序列mdeysnqmvfvhdc。
53.s2,为增加免疫源性,利用larson方法在疾病特异性表位序列的n端和c端连续反复叠加四次疾病特异性表位序列,获得目标多肽序列。
54.s3,将s2叠加后的目标多肽序列与具有强免疫刺激的免疫载体白细胞素偶联,形成具有免疫活性的免疫复合物。此免疫复合物呈现很强的免疫源性,并携带有特定结构特异性。
55.s4,将s3获得的免疫复合物克隆到白细胞毒素质粒中并转染大肠杆菌进行表达,利用得到的纯化重组蛋白免疫小鼠。取产生免疫反应的小鼠淋巴细胞与ns1小鼠骨髓瘤细胞进行杂交,培养出稳定的杂交瘤细胞系,取得单克隆抗体,即为1号抗体(no 1)。
56.实施例2:elisa检测抗体滴度
57.参考hedlin et al.,vaccine(2010)28:981-988所记载的方法,利用elisa对免疫血清,载体和prpc特异性抗体定量检测。elisa滴度表示为最高血清稀释度的倒数,读数超过免疫前阴性对照两个标准偏差,结果如图1所示。图1中,利用实施例1合成的单克隆抗体免疫小鼠10周,分别取0,3,4,7及10周的小鼠血清,elisa检测抗体滴度,结果显示1号抗体在第10周达到峰值。
58.实施例3:免疫共沉淀法检测单克隆抗体
59.利用免疫共沉淀法来检测免疫血清样品与prpsc特异性相互作用。
60.在免疫沉淀之前,使用柱亲和纯化从血清中分离免疫球蛋白以减少背景。
61.以瘙痒病感染的小鼠组织(rml)、prp敲除的小鼠组织(k/o)、野生型小鼠组织(normal)为样本,prpsc为空白对照组。利用与链霉亲和素修饰的纳米磁珠偶联的免疫球蛋白为实验组(no.1antibody beads),与预先用蛋白酶k(proteinase k)消化的(100ug/ml)小鼠脑匀浆进行免疫共沉淀。mmp-2抗体(8b4)是小鼠单克隆抗体igg1κ,作为阳性对照,可以结合prpc和prpsc;仅加入磁珠(only beads)的样本是阴性对照。采用western blot分析,确定免疫血清中的抗体为只结合prpsc的目标单克隆抗体,即1号抗体。western blot结果如图2所示,rml中使用1号抗体可以检测到prpsc。
62.根据图2结果可知,本发明制备获得的1号抗体可以有效识别prpsc,并不识别野生型小鼠组织中的prpc。
63.实施例4:单克隆抗体在宫颈癌检测中的应用
64.用实施例1制备的单克隆抗体与采用链霉亲和素修饰的纳米磁珠偶联,获得免疫磁珠,再用流式荧光细胞检测技术,利用连有荧光剂的6d11检测阳性磁珠。检测之前,先用终浓度为100ug/ml蛋白酶k消化,检测稳定的宫颈癌细胞系和,其中,宫颈癌细胞系:siha,skov-3,ncl、adr-res,es-2。
65.用1号抗体检测宫颈癌细胞表面的prpsc,结果如图3所示。结果显示本发明所述的单克隆抗体在稳定的宫颈癌细胞系中可以检测到多种宫颈癌细胞,可用于宫颈癌的早期筛查。
66.当然上述实施例为本技术最佳的实施例,只为说明本技术的技术构思及特点,其目的在于让熟悉此项技术的人能够了解本技术的内容并据以实施,并不能以此限制本技术
的保护范围。凡根据本技术主要技术方案的精神实质所做的修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1