高保真性限制性内切核酸酶的制作方法
背景技术:
技术实现思路
1、在本发明的实施方式中,提供了确定限制性内切核酸酶及其变体的保真性指数(fi)的方法,其包括选择反应缓冲液和含有限制性内切核酸酶的结合和切割位点的dna底物;允许连续稀释的限制性内切核酸酶或其变体切割dna底物;和测定限制性内切核酸酶和一种或多种其变体的每一种的fi。
2、在实施方式中,该方法还包括比较限制性内切核酸酶及其变体的fi,以获得变体的改进因子,例如大于2。
3、在本发明的实施方式中,选择缓冲液,其包含醋酸钾、三羟甲基氨基甲烷醋酸盐和醋酸镁;或氯化镁。
4、另外的实施方式包括:
5、(a)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.1的酶,其中,一个或多个突变的位置选自s36、k77、p154、e163、y165和k185。
6、(b)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.2的酶,其中,一个或多个突变的位置选自k198和q148。
7、(c)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.3的酶,其中,一个或多个突变的位置选自s15、h20、e34、m58、q95、r106、k108、t181、r187和r199。
8、(d)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.4的酶,其中,一个或多个突变的位置选自d16、d148和e132。
9、(e)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.5的酶,其中,一个或多个突变的位置选自k75、n146和d256。
10、(f)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.6的酶,其中,一个或多个突变的位置选自e198和d200。
11、(g)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.7的酶,其中,一个或多个突变的位置选自k229、e025、r034和q261。
12、(h)组合物,其包括:包含其中突变位置是k225的seq id no.8的酶。
13、(i)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.9的酶,其中,一个或多个突变的位置选自h137、d177、k363、k408、r411、q215、q226和q230。
14、(j)组合物,其包括:包含其中突变位置是f376的seq id no.10的酶。
15、(k)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.11的酶,其中,一个或多个突变的位置选自r78、t140、e152、r199和f217。
16、(l)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.12的酶,其中,一个或多个突变的位置选自g26、p105、t195、q210、y147、y193、k114、t197、s245、d252和y027。
17、(m)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.13的酶,其中,一个或多个突变的位置选自h10、n208、k48、k74、r75、y56、k58和m117。
18、(n)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.14的酶,其中,一个或多个突变的位置选自k014、q069、e099、r105、r117、g135和y035。
19、(o)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.15的酶,其中一个或多个突变的位置选自n106、q169、e314和r126。
20、(p)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.16的酶,其中,一个或多个突变的位置选自t20、p52、y67、k68、r75、e86、q90、s91、q93、h121和g172。
21、(q)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.17的酶,其中,一个或多个突变的位置选自e059、p065、s108、n172、k174、q179、g182和y055。
22、(r)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.18的酶,其中,一个或多个突变的位置选自n212和l213。
23、(s)组合物,其包括:包含突变位于位置n65的seq id no.19的酶。
24、(t)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.20的酶,其中,一个或多个突变的位置选自e007、d011、e049、r073、r114、g137、s210和r213。
25、(u)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.21的酶,其中,一个或多个突变的位置选自p079、e086、h096和e218。
26、(v)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.22的酶,其中,一个或多个突变的位置选自e32、s081、g132、f60和s61。
27、(w)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.23的酶,其中,一个或多个突变的位置选自g013、g016、k018、p052、r053、k070、e071、d072、g073、s84、e086、r090、k094、r095、p099、p103、k113、n135、s151、p157、g173、t204、s206、k207、e233、n235、e237、s238、d241、k295、s301和s302。
28、(x)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.24的酶,其中,一个或多个突变的位置选自s64、s80、s162、t77/t96和n178。
29、(y)组合物,其包括:包含其中位置r232被突变的seq id no.25的酶。
30、(z)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.26的酶,其中,一个或多个突变的位置选自s50、y81、n93和w207。
31、(aa)组合物,其包括:包含在g26处具有突变的seq id no.27的酶。
32、(bb)组合物,其包括:包含在e112/r132处具有突变的seq id no.28的酶。
33、(cc)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.29的酶,其中,一个或多个突变的位置选自n016、s33、p36、h76、p87、n89、r90、t138、k141、k143、q221、q224、n253、q292、r296、t152、g326和t324。
34、(dd)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.30的酶,其中,一个或多个突变的位置选自k024、p214、e146、n251和y095。
35、(ee)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.31的酶,其中,一个或多个突变的位置选自g075、q099、g155、p022和r90。
36、(ff)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.32的酶,其中,一个或多个突变的位置选自s097和e125。
37、(gg)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.33的酶,其中,一个或多个突变的位置选自k021、i031和t120。
38、(hh)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.34的酶,其中,一个或多个突变的位置选自k7、t10、n11、n14、q232和t199。
39、(ii)组合物,其包括:包含其中一个或多个氨基酸已经被突变的seq id no.35的酶,其中,一个或多个突变的位置选自p92、p144、g197和m198。
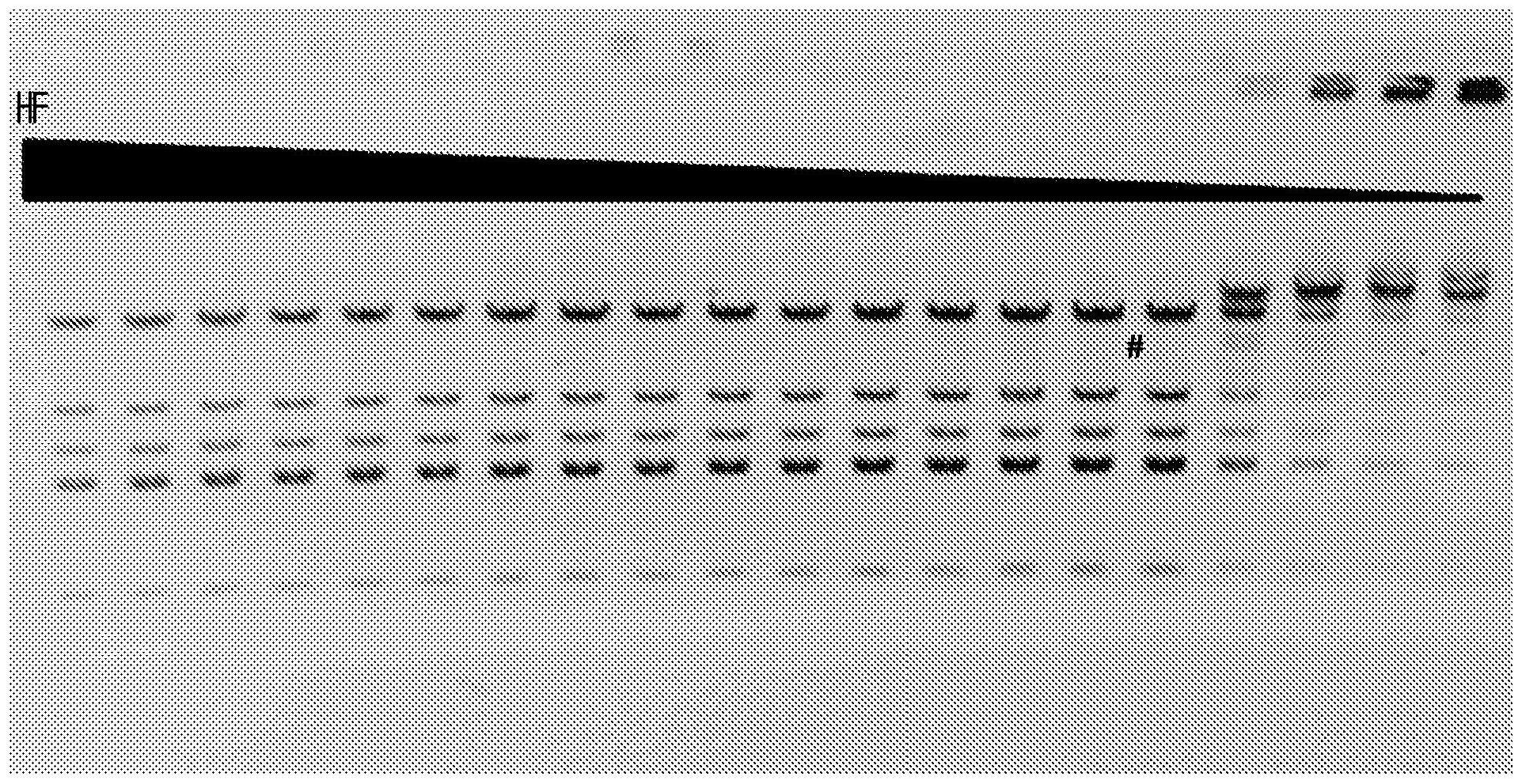
40、任何上述组合物进一步的特征在于:突变酶在预定缓冲液中的fi大于在预定缓冲液中没有突变的酶的fi。
41、附图简述
42、图1a和1b显示pvui-hf和pvui-wt活性的比较。
43、在图1a中,星号(*)符号表示左边的泳道(泳道2),其中不再检测到星号活性。数字(#)符号表示右边的泳道(泳道8),其中发生部分消化。pvui-wt的起始浓度被计算为77单位。
44、在图1b中,直到泳道15才观察到完全消化,然后,观察到星号活性。允许完全消化的稀释窗口(window of dilution)在系列中从6倍稀释扩展到15倍稀释。pvui-hf的起始浓度被计算为至少9600单位。
45、图2a和2b显示hindiii-hf和hindiii-wt活性的比较。
46、在图2a中,星号(*)符号表示左边的泳道(泳道9),其中不再检测到星号活性。数字(#)符号表示右边的泳道(泳道15),其中发生部分消化。hindiii-wt的起始浓度被计算为9,600单位。
47、在图2b中,直到泳道13才观察到完全消化,然后,观察到星号活性。允许完全消化的稀释窗口在系列中从6倍稀释扩展到13倍稀释。hindiii-hf的起始浓度被计算为至少2,400单位。
48、图3a和3b显示draiii-hf和draiii-wt活性的比较。
49、在图3a中,星号(*)符号表示左边的泳道(泳道12),其中不再检测到星号活性。数字(#)符号表示右边的泳道(泳道12),其中发生部分消化。没有观察到星号活性和部分消化的dna。draiii-wt的起始浓度被计算为1,200单位。
50、在图3b中,直到泳道12才观察到完全消化,然后,观察到星号活性。draiii-hf的起始浓度被计算为至少1,200单位。
51、图4a和4b显示kpni-hf和kpni-wt活性的比较。
52、在图4a中,*符号表示左边的泳道(泳道9),其中不再检测到星号活性。#符号表示右边的泳道(泳道13),其中发生部分消化。在图4a中,kpni-wt的起始浓度被计算为2,000单位。
53、在图4b中,自始至终都观察到完全消化而没有发生星号活性或部分消化。kpni-hf的起始浓度被计算为大于12,000单位。
54、图5a-5b显示styi-hf和styi-wt的比较。
55、在图5a中,*符号显示星号活性在其左侧(泳道6)开始,#符号显示部分活性在其右侧(泳道12)开始。sty-wt的起始量被计算为1,000单位。
56、在图5b中,在最初2个泳道中观察到星号活性,并且,从泳道14或15观察到部分消化。styi-hf的起始量被计算为4,000单位。
57、图6显示bgli-hf和bgli-wt对pxba的比较。bgli-hf的fi至少为8,000,而bgli-wt的fi为32,提供至少为250的改进因子(improvement factor)。右边的图为理论消化图式。
58、图7显示bsrdi-hf和bsrdi-wt对pbr322的比较。bsrdi-hf的fi在neb4中至少为1,000,而bsrdi-wt的fi为1/2,提供至少2,000的改进因子。右边的图是理论消化图式。
59、图8显示在neb4中bcli-hf和bcli-wt对λ(dam-)的比较。bcli-hf的fi为至少2,000,而bcli-wt的fi为32,提供至少64的改进因子。右边的图是理论消化图式。
60、图9显示bglii-hf和bglii-wt对pxba的比较。bglii-hf的fi为至少32,000,而bglii-wt的fi为16,提供至少2,000的改进因子。右边的图是理论消化图式。
61、图10显示bsteii-hf和bsteii-wt对λdna的比较。bsteii-hf的fi为至少2,000,而bsteii-wt的fi为4,提供至少500的改进因子。右边的图是理论消化图式。
62、图11显示sfii-hf和sfii-wt对pbc4的比较。sfii-hf在neb4中的fi为至少8,000,而sfii-wt的fi为64,提供至少120的改进因子。右边的图是理论消化图式。
63、图12显示smai-hf和smai-wt对pxba的比较。smai-hf的fi为至少256,000,而smai-wt的fi为64,提供至少4,000的改进因子。右边的图是理论消化图式。
64、图13显示bsmbi-hf和bsmbi-wt对λdna的比较。bsmbi-hf的fi在neb4中为250,而bsmbi-wt的fi为4,提供至少64的改进因子。右边的图是理论消化图式。
65、图14显示bstni-hf和bstni-wt对pbr322的比较。bstni-hf在neb4中的fi为500,而bstni-wt的fi为4,提供至少120的改进因子。右边的图是理论消化图式。
66、图15显示mlui-hf和mlui-wt对λdna的比较。mlui-hf在neb4中的fi为至少32,000,而mlui-wt的fi为32,提供至少1,000的改进因子。右边的图是理论消化图式。
67、图16显示nspi-hf和nspi-wt对puc19的比较。nspi-hf在neb4中的fi为500,而nspi-wt的fi为32,提供至少16的改进因子。右边的图是理论消化图式。
68、图17显示bsrfi-hf和bsrfi-wt对pbr322的比较。bsrfi-hf在neb4中的fi为至少500,而bsrfi-wt的fi为16,提供至少32的改进因子。右边的图是理论消化图式。
69、实施方式的详细描述
70、对单一序列具有提高的特异性的限制性内切核酸酶突变体的产生并不一帆风顺。遇到了许多问题。这些问题包括以下:突变酶具有降低的活性或没有活性,不具有降低的星号活性或实际上具有提高的星号活性。可选地,突变酶不能被克隆,因此不能被分析。
71、不能产生突变体是由各种可能的原因中的任意一种原因引起的,包括以下任意一种。这可能是由于失败的反向pcr。也有可能产生新比活的突变对宿主细胞有毒性,即使它在对于非突变限制性内切核酸酶的表达通常是保护性的条件下表达相关的甲基化酶。在这些情况下,不能获得可存活的突变克隆。可选地,突变体可能偏爱特定的缓冲液,因此当在另一缓冲液中被测试时,不能检测到活性。遇到的另一困难是尽管每一次突变的粗溶解产物(lyzate)通常被检测,但在一些情况中,酶需要被纯化以检测活性,当在溶解产物中没有检测到活性时,将分析记分为负值。
72、在若干实例中令人惊奇地注意到,脯氨酸向丙氨酸的变化产生这样的变体,其具有至少大于250的期望的fi并产生至少两倍的改进因子。这在pvui、bamhi、nrui和spei的变体中示例。
73、产生高保真性突变体的其它挑战包括编码某些限制性内切核酸酶的dna的大小。假设模板的大小大,则该dna会难以通过pcr进行扩增。此外,在一些情况下,pcr产物并不容易转化到新的宿主中。即使宿主细胞转化是成功的,但转化的细胞不总是产生菌落,因此不容易被检测到。在一些情况下,即使通过转化获得了菌落,它们也不能在任何条件下被培养。
74、突变体的比活性降低的原因可能缘于以下任何一种:突变干扰蛋白质的折叠,这大大降低表达水平,或突变影响特异性酶的活性。
75、例如,这对styi突变体:n34a、f35a、d58a、f65a、k66a、k67a、f100a、n148a、e213a、f250a、t251a、d258a、d262a、n283a、r293a、f294a、r295a、r296a、d298a、d299a、m304a、m310a、d318a、s337a、s346a和f371a被观察到。
76、酶活性的丧失可能是由于包括以下任何一种的原因引起的:突变缺失了在催化作用中重要的残基;或突变改变在折叠中重要的残基,因此错折叠的突变蛋白质失活。
77、例如,这对styi突变体:m33a、d37a、f41a、d55a、d71a、n77a、r79a、e80a、f81a、t82a、e83a、f97a、f101a、e136a、w137a、m138a、m140a、k144a、q145a、r151a、r255a、r259a、s261a、t264a、f278a、r281a、t284a、m297a、h305a、n306a、d314a、d338a和e382a被观察到。
78、产生高保真性突变体要求辛苦的工作。选择和测试多个突变体,并且,仅相对少数的突变体显示高保真性。不可能通过推断来预测哪一个突变体可能显示改进的特性。
79、进行识别限制性内切核酸酶的高保真性变体的分析的实例显示在图1-17中。所述图显示在单一缓冲液中野生型和高保真性变体的结果。所有图均显示在凝胶上从左到右一系列两倍稀释之后dna切割的数量和类型,同时酶的浓度沿着三角形的方向降低。表1详细说明33种示例性酶的结果。实例中使用的限制性内切核酸酶反应缓冲液(缓冲液1-4)在,例如在neb目录(2009/10)中被限定。可以根据使用者的偏爱来选择其它的缓冲液。
80、分析产生的fi是最高限制酶浓度——不显示通过与星号活性有关的条带的存在所确定的明显星号活性——与在标准neb缓冲液中在限定的温度下在50μl反应中于1小时内完全消化1μg标准dna底物的限制酶浓度的比率。在图6-17中,在图中设置框以显示星号活性条带。在本发明的实施方式中,fi为,例如优选至少250,例如大于500,例如大于1000,例如大于5000。
81、保真性改进值被计算为变体的fi除以非突变型酶的fi的比。在本发明的实施方式中,改进值为,例如优选至少2,例如至少4,例如至少8,例如至少16。
82、在一个实施方式中,fi是指不显示明显的星号活性的最高限制酶的量与在标准neb缓冲液中在特定温度下在50μl反应中于1小时内完全消化1μg标准dna底物的量的比率。
83、表1:hf酶的特性概括
84、
85、稀释剂(dil)a、b和c以及缓冲液1-4在neb目录2009/10,第87页中限定。
86、本文引用的所有参考文献,以及2010年2月5日提交的美国临时申请号61/301,666和2010年9月29日提交的61/387,800通过引用被并入本文。
87、实施例
88、实施例1:工程化高保真性(hf)pvui
89、1.pvui的表达
90、在转化有puc19-pvuir和pacyc184-pvuim——均含有pvui内切核酸酶和甲基化酶基因——的大肠杆菌(e.coli)中表达pvui。使细胞在30℃下在具有amp和cam的lb中生长过夜。
91、2.pvui-hf的诱变
92、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr均在以下位置处变成ala:7、8、11、12、16、17、20、21、22、23、26、28、29、30、31、34、35、36、38、40、42、44、45、46、48、49、53、55、57、59、61、63、65、66、67、69、70、71、72、73、77、78、80、81、82、87、88、90、92、93、96、97、101、102、104、106、107、108、109、110、111、115、116、119、120、121、122、126、127、129、131、132、135、138、139、144、146、147、148、150、151、152、154、155、157、158、160、161、162、163、167、169、170、172、173、174、178、180、182、183、184、185、186、187、189、192、194、195、196、201、202、203、205、206、210、211、214、215、218、219、220、221、226、230、231、232、233、235、236、238、239、240、241、246、247、248、249、251、253、254;而tyr在以下位置处变成phe:18、52、56、84、91、130、143、165、204、242。
93、诱变方法为用成对引物进行反向pcr,接下来进行dpni消化。然后,将处理的产物转化到大肠杆菌菌株er2683中。
94、3.pvui-hf的选择
95、用pxba dna作为底物,利用在neb3和neb4(new england biolabs,inc.,ipswich,ma(neb)中活性的比较实现对pvui-hf的选择。pvui-wt在neb3中更有活性。选择在neb4中更有活性的。发现6个突变体在neb4中更有活性:s36a、k77a、p154a、e163a、y165f和k185a。p154a在neb4中比wt具有更高的活性。通常,在neb4中具有最高活性的是具有改进的星号活性的。pvui(p154a)被命名为pvui-hf。这是有效突变是脯氨酸向丙氨酸突变的首次。
96、4.pvui-hf的纯化
97、使两升细胞er2683(puc19-pvui(p154a)、pacyc184-pvuim))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)中。然后,通过以下程序将体系加载到柱:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mmtris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)浓缩并在丙三醇中储存于-20℃。
98、5.pvui-hf和pvui-wt的比较
99、已在四种neb缓冲液中用稀释剂b针对pxba dna分别测定pvui-hf和pvui-wt的fi。比较显示在图1中,而结果列于表2(下面)中。
100、表2:pvui-hf和pvui-wt的比较
101、
102、pvui-hf在neb2和neb4中表现最好,其中fi≥16,000;wt pvui在neb3中表现最好,其中fi为32。所以,总的改进因子为≥16,000/32=≥500。
103、实施例2:工程化hfhindiii
104、hindiii识别a/agctt并在a/agctt处消化,如在国际公开号wo 2009/009797的实施例21中描述的。突变体hindiii(k198a)被选择作为hf形式的hindiii。该突变体的进一步的表征揭示,尽管hindiii(k198a)的性能在一小时的范围内是优异的,但它在过夜消化中表现并不好。在寻找更多地突变体时,也发现hindiii(q148a)是部分优良的。针对更大改进的进一步的步骤是将丙氨酸变成所有其它的氨基酸残基。在这些之中,发现hindiii(q148i)在一个小时和过夜反应中均表现优异,并且,其被命名为hindiii-hf(图2)。
105、hindiii-hf在er3081(puc19-hindiiir(q148i)m)中表达。根据wo/2009/009797进行生长和纯化方法。
106、下表(表3)比较了hindiii-hf和hindiii-wt的fi。
107、表3:hindiii-hf和hindiii-wt的比较
108、
109、hindiii-hf在neb4中具有最佳活性;hindiii-hf在neb4中的fi≥520000;wthindiii在neb2中具有最佳活性。hindiii-wt在neb2中的fi为250。所以,总的改进因子≥2,000。
110、实施例3:工程化hfdraiii
111、1.draiii的表达
112、draiii识别cacnnn/gtg并在cacnnn/gtg处进行消化。draiii在具有pagr3-draiiir()和pacyc-draiiim()的大肠杆菌er3081中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
113、2.draiii的诱变
114、draiii蛋白质的长度为227个氨基酸。draiii蛋白质的所有132个氨基酸位点最初被设计为突变成ala(或phe)。cys、asp、glu、phe、his、lys、met、asn、gln、arg、ser、thr、gly和trp突变成ala。try突变成phe。这些是:7、9、10、11、12、14、15、16、17、18、20、21、22、23、28、29、31、32、34、35、37、40、42、43、44、45、47、51、54、55、57、58、59、60、64、65、66、67、68、72、73、74、76、77、82、83、84、88、89、90,91、93、94、95、96、99、101、102、104、106、107、108、111、112、113、114、115、117、120、121、123、124、127、128、130、136、137、138、139、140、141、142、144、145、146、147、150、154、155、156、157、158、160、161、165、167、169、170、171、172、173、175、176、180、181、183、184、185、187、189、190、192、193、196、198、199、200、201、202、205、207、208、209、211、212、213、214、216、217、218、219、22和223。
115、选择的突变的点诱变通过反向pcr进行。pcr反应的反应体积为100μl,包含2μl的每种pcr引物、1μl pagr3-draiiir、400μm dntp、4单位deep venttm dna聚合酶(neb)和10μl10×thermopol缓冲液,以及余量的水。
116、pcr反应条件是94℃进行5min,然后25个循环的94℃30sec、55℃60sec、72℃4min,并且在72℃下最后延伸时间为7mins。用20单位dpni消化pcr产物1小时。将消化的产物转化入大肠杆菌er3081(pacyc-draiiim)。
117、3.draiii-hf的选择
118、每种突变的四个菌落在37℃下在具有amp和cam的lb中生长过夜。利用pxba作为底物在neb4缓冲液和10%丙三醇中进行draiii的标准相关分析和星号活性分析。
119、在筛查分析中挑取突变体s15a、h20a、e34a、m58a、q95a、r106a、k108a、t181a、r187a、r199a、n202d、t181g、t181n、t181q、t181c、t181v、t181l、t181i、t181m、d55a、d55s、d55c、d55g、d55n、t12a、h20a、e34a、h45a、t57a、m58a、t60a、s66a、r76a、f90a、m94a、t101a、c115a、f169a、n172a、r173a、h189a、n193a和q95a/k104a。在不同条件和底物中数轮比较后,发现draiii(t181a)是优选突变体,其保留高的切割活性,但是显示大量减少的星号活性。draiii(t181a)被标记为draiii-hf。
120、4.draiii-hf和draiii-wt的比较
121、draiii-wt和draiii-hf(t181a)蛋白质利用肝素和源(source)15s柱来纯化。用于详细比较的分析条件如下:neb4(或neb1、2、3),37℃,1h;在20μl反应体系中存在2μl纯化的蛋白质;λdna作为底物。比较显示在图3a和3b中,并且,结果列于表4中。
122、表4:draiii-hf和draiii-wt的比较
123、
124、draiii-hf在neb4中最有活性,其中,fi为至少64,000;draiii-wt在neb2中最有活性,其中,fi为2。总的fi改进因子为至少32,000倍。
125、实施例4:工程化hfkpni
126、kpni识别ggtac/c并在ggtac/c处消化,如在国际公开号wo 2009/009797的实施例26中所描述的。选择三突变体kpni(d16n/e132a/d148e)作为高保真形式的kpni。虽然d148e和e132a通过位点定向诱变被引入,但d16n通过pcr被引入。该三突变体中突变的进一步表征揭示,去除e132a将进一步改进限制酶,尤其在酶的比活方面。三突变体kpni(d16n/e132a/d148e)的比活为200,000单位/mg蛋白质,而kpni(d16n/d148e)的比活为1,800,000单位/mg蛋白质。双突变体比前述三突变体活性大9倍,所以双突变体kpni(d16n/d148e)被命名为kpni-hf。
127、kpni-hf在er2523(pagr3-kpni(d16n/d148e),psyx20-kpnim)中表达。根据wo/2009/009797进行生长和纯化方法。
128、下表(表5)比较了kpni-hf和kpni wt的fi。
129、表5:kpni-hf和kpni-wt的比较
130、
131、kpni wt在neb1中最有活性,kpni-wt在neb1中的fi为16;kpni-hf在neb1、neb2和neb4中最有活性。kpni-hf在这三种缓冲液中的fi均为最高,≥1,000,000。总的改进因子为≥62,500。
132、实施例5:工程化hfstyi
133、1.styi的表达
134、styi识别c/cwwgg并在c/cwwgg处进行消化。styi在具有pacyc-styim和placzz1-styir的大肠杆菌(er2833)中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
135、2.styi的诱变
136、选择的突变的点诱变通过反向pcr进行。在styi中进行如下237个氨基酸突变:cys、asp、glu、phe、his、lys、met、asn、gln、arg、ser、thr、trp突变成ala。tyr突变成phe。这些突变在以下位置:7、9、10、11、12、14、16、22、23、24、25、26、28、30、31、32、33、34、35、36、37、38、39、40、42、43、49、51、52、53、54、57、58、59、61、62、64、65、66、69、70、73、75、76、78、79、80、81、82、85、91、92、93、95、96、97、98、99、100、102、103、104、105、106、109、111、112、114、116、118、119、122、123、124、125、126、128、129、130、131、135、136、137、139、140、141、142、143、144、145、146、147、150、151、152、153、155、157、158、159、163、164、165、166、167、170、172、173、175、176、177、178、181、183、187、188、192、193、194、195、196、200、203、204、205、207、209、211、212、213、214、216、218、219、220、221、222、227、229、230、232、234、235、236、237、238、239、241、242、245、247、248、249、250、252、253、254、256、257、258、259、260、261、263、266、267、269、272、274、277、280、282、283、284、286、288、289,291、292、293、294、295、296、297、298、303、304、305、307、308、309、313、317、318、319、320、323、324、326、327、329、331、335、336、337、339、340、343、345、346、347、349、350、351、353、355、356、359、360、361、363、365、366、368、369、370、372、373、376、377、379、381和382。
137、引物设计方法和pcr可以按照公开的pct申请wo 2009/0029376(实施例1)中描述地进行。pcr产物用dpnl消化,并转化入感受态er2833(pacyc-styim)。
138、3.styi-hf的选择
139、每种突变的四个菌落在37℃下在具有amp和cam的lb中生长过夜。利用λ分别在neb4和exoi缓冲液以及20%丙三醇中进行styi的相关活性分析和星号活性分析。
140、在筛查分析中挑取突变体k75a、n146a和d256a。在不同条件和底物中数轮比较后,发现k75a是优选的突变体,其保留高的切割活性,但是显示大量减少的星号活性。styi(k75a)被标记为styi-hf。
141、4.styi-hf和styi-wt的比较
142、styi-hf和styi-wt在neb4中的比较显示在图5a和5b中,结果列于表6中。
143、表6:styi-hf和styi-wt的比较
144、
145、styi-wt和styi-hf在neb2中最有活性。styi-wt的fi为16,而styi-hf的fi为2000。总的fi改进因子为125。
146、实施例6:工程化hfbsaji
147、1.bsaji的表达
148、bsaji在转化有prrs-bsajir+m——在相同的质粒中含有bsaji内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
149、2.bsaji-hf的诱变
150、所有的残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr、phe、trp在如下位置变成ala:9、10、14、17、18、19、20、22、23、24、27、30、32、35、39、42、43、48、50、51、52、53、55、56、57、60、61、65、66、67、68、70、71、72、73、78、79、81、83、84、86、87、88、90、91、92、94、95、99、101、103、104、106、110、111、113、114、117、119、120、121、123、127、129、131、132、134、136、138、140、141、142、147、152、153、157、158、159、162、163、165、166、167、169、170、175、178、181、183、184、185、186、187、188、189、194、196、197、198、199、200、202、203、204、206、211、212、213、214、215、216、218、220、222、225、226、227、228、229、230、231、233、238、239、240、241、246、247、249、250、251、252、253、254、255、257、260、262、265、267、268、269、270、271、273、274、276、277、280、281、282、283、285、287、288、290、291、293、294、295、298和299;而tyr在如下位置变成phe:21、59、62、77、89、105、130、191、208、272、286和296。
151、诱变方法是用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后被转化到大肠杆菌菌株er3081中。
152、3.bsaji-hf的选择
153、利用pbr322 dna作为底物,用在neb3和neb4中的活性比较来完成bsaji-h的选择。e198a和d200a具有最高活性。d200a在neb4中比wt具有低得多的星号活性。bsaji(d200a)被命名为bsaji-hf。
154、4.bsaji-hf的纯化
155、使两升细胞er3081(prrs-bsajir(d200a)+m)在具有100μg/ml amp、33μg/ml cam和0.5mm iptg的lb中,在37℃下生长过夜。收获细胞并在50ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过ultra 30kda(millipore,u.s.a,现为merck,germany)进一步浓缩。浓缩的bsaji-hf然后加入相同体积的丙三醇并储存于-20℃。
156、5.bsaji-hf和bsaji-wt的比较
157、用稀释剂a,在四种neb缓冲液中,在pbr322 dna上分别测定bsaji-hf和wt bsaji的fi。结果列于表7中。
158、表7:bsaji-hf和bsaji-wt的比较
159、
160、bsaji-hf在neb 2、3和4中表现最好,其中,fi≥4000;wt bsaji在neb 1、2和4中表现最好,其中,fi为64。所以,改进因子在neb4中为≥4000/64≥64。
161、实施例7:工程化hfbsawi
162、1.bsawi的表达
163、bsawi在转化有placzz1-bsawir和pacyc-mspim的大肠杆菌中进行表达,placzz1-bsawir和pacyc-mspim均含有bsawi内切核酸酶和甲基化酶基因。细胞在30℃下在具有amp和cam的lb中生长过夜,并在30℃下用0.5mm iptg诱导18小时。
164、2.bsawi-hf的诱变
165、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:9、10、13、16、17、18、20、23、24、25、26、28、29、30、31、34、35、36、39、42、43、45、46、48、51、54、58、60、62、63、64、65、66、69、70、71、74、75、78、80、81、82、84、85、86、88、89、92、93、96、99、100、101、102、104、105、107、109、113、114、115、117、121、112、123、124、127、128、129、130、131、133、136、137、138、140、141、142、145、149、151、152、153、154、155、156、160、163、164、165、166、167、169、170、171、173、174、175、176、177、178、179、181、184、189、195、196、197、200、202、203、209、210、211、212、213、214、216、218、219、221、222、228、229、230、231、233、234、237、239、241、243、247、248、250、251、254、255、258、259、260、261、264和266;而tyr在以下位置变成phe:11、57、106、147、157、215、224、236和265。
166、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er3081。
167、3.bsawi-hf的选择
168、利用λdna作为底物,用在neb3和neb4中的活性比较来完成bsawi-hf的选择。以下突变体显示变化:k229a、e025a、r034a和q261a。当在小培养物(small culture)中生长时,wt bsawi在两种缓冲液中均可完全消化;注意到q261a仅产生稳定的部分式样。这可能是由于这样的事实:即突变体在小培养物中生长差。当在大培养物中生长并被纯化时,部分式样被消除,并且,底物反而被完全消化,而且,当在底物pxba上测试时结果也证明是高保真性突变体。
169、4.bsawi-hf的纯化
170、使两升细胞er3081(placzz1-bwawi(q261a),pacyc-mspim))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。8小时之后,用0.5mm iptg诱导培养物。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(gehealthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步通过15r(vivascience,现为sartoriusvivascience gmbh,goettingen,germany)浓缩。浓缩的bsawi-hf然后加入等体积的丙三醇并储存于-20℃。
171、5.bsawi-hf和bsawi-wt的比较
172、用稀释剂a,在四种neb缓冲液中,在pxba dna上分别测定bsawi-hf和bsawi-wt的fi。结果列于表8(下面)中。
173、表8:bsawi-hf和bsawi-wt的比较
174、
175、bsawi-hf在neb2和neb4中最有活性,其中最佳fi为≥4000;bsawi-wt在neb4中最有活性,其中fi为16。总的改进因子为≥4000/16=~250。
176、实施例8:工程化高保真性bgli
177、1.bgli的表达
178、bgli在转化有puc19-bglir和psyx20-bglim——均含有bgli内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和kan的lb中生长过夜。
179、2.bgli-hf的诱变
180、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、12、14、15、16、17、18、19、22、23、24、25、27、28、29、31、34、36、39、40、43、44、45、4647、48、50、52、54、5、57、60、61、65、67、68、70、71、72、73、75、76、77、78、79、81、84、86、87、88、91、92、94、95、96、99、100、101、102、103、105、107、108、110、112、113、114、115、116、117、118、122、123、124、125、128、130、131、132、134、135、136、152、158、159、160、161、163、164、165、166、167、170、172、173、174、176、177、178、179、180 181、183、184、185、186、187、188、189、193、194、196、197、202、203、204、205、208、211、215、216、221、222、224、225、226、227、228、229、230、231、234、236、239、241、242、243、245、249、250、251、255、256、259、263、264、265、266、267、268、269、270、271、272、275、276、277、279、281283、286、287、289、290和291;而tyr在以下位置变成phe:19、13、33、53、66、119、127、153、199、218、233、252和258。
181、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2566。
182、3.bgli-hf的选择
183、利用λdna作为底物,用在neb4中的活性比较来完成bgli-hf的选择。bgli-wt在neb4中活性低,所以选择在neb4中具有与wt相似的活性或活性比wt高的任何突变体,然后,以丙三醇对其进行检查,以比较星号活性水平。只有一个突变体——k225a在neb4中显示与wt相似的活性,同时在丙三醇中测试时星号活性也降低。bgli(k225a)被命名为bgli-hf。
184、4.bgli-hf的纯化
185、使两升细胞er2566(puc19-bgli(k225a),psyx20-bglim)在37℃下在具有100μg/ml amp和33μg/ml kan的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bgli-hf然后加入等体积的丙三醇并储存于-20℃。
186、5.bgli-hf和bgli-wt的比较
187、用稀释剂b,在四种neb缓冲液中,在λdna上分别测定bgli-hf和wt bgli的fi。结果列于表9(下面)中。
188、表9:bgli-hf和bgli-wt的比较
189、
190、bgli-hf在neb2和neb4中最有活性,其中fi为≥8000;bgli-wt在neb3中最有活性,其中fi为250。总的改进因子为≥8000/250=≥32。
191、实施例9:工程化hfbsrdi
192、1.bsrdi的表达
193、bsrdi酶含有两个亚基(subunit):bsrdia和bsrdib。
194、为了获得纯的bsrdia亚基,impact(使用亲和性壳多糖结合标签的内含肽介导的纯化(intein-mediated purification with an affinity chitin-binding tag))体系(neb cat:e6901)被用于bsrdia的一步纯化。简言之,bsrdia基因被亚克隆到ptxb1载体中,该载体然后被转化入感受态菌株,其含有t7 rna聚合酶,由lac操纵子(neb#er2566)控制。在筛选和测序之后,选择正确的菌株。细胞在37℃下在含有氨苄青霉素(100μg/ml)的lb中生长,直到od600达到0.5。然后,加入iptg,达到终浓度为0.4mm,以诱导bsrdia 3小时。然后,将细胞培养物制成颗粒,重新悬浮于冰冷的柱缓冲液(20mm tris-hcl,ph 8.5、500mmnacl)中,并通过超声处理裂解。然后离心所得细胞溶解产物,以去除细胞碎片。接下来,将上清液加载到平衡的壳多糖柱中。用加样缓冲液洗涤之后,用切割缓冲液(20mm tris-hcl,ph 8.5、500mm nacl和50mm dtt)在4℃下温育柱过夜。最后,通过针对储存缓冲液(10mmtris-hcl,ph 7.4、0.1mm edta、1mm dtt、50mm kcl和50%丙三醇)进行透析洗脱btsi.a蛋白质。
195、bsrdib亚基在转化有puc19-bsrdibr和plg-bsrdim1m2——均含有bsrdi内切核酸酶和甲基化酶基因——的大肠杆菌中表达。细胞在37℃下在具有amp和kam的lb中生长过夜。
196、2.bsrdi-hf的诱变
197、所有bsrdib的残基,包括cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、11、12、14、15、17、21、22、25、28、29、30、33、34、35、37、40、45、46、47、51、52、56、58、62、64、65、67、68、71、72、74、75、81、83、90、91、92、93、99、100、101、106、108、109、112、113、115、116、120、122、123、124、132、133、136、137、138、139、142、143、144、145、146、150、155、157、158、161、162、164、168、170、171、173、174、176、177、179、180、182、185、189、190、193、197、200、202、203、206、210、213、215、217、218、221、224、225、226、228、229、230、232、237、238、241、242、243、244、245、246、249、253、258、259、261、264、265、268、271、272、273、274、276、278、279、281、285、287、288、292、294、295、299、300、301、306、307、308、312、314、315、317、318、320、321、324、325、326、327、328、331、332、335、337、341、343、345、347、352、353、354、355、356、360、361、362、363、364、370、373、374、376、380、381、385、387、389、392、393、395、396、397、405、406、408、411、415、418、420、422、425、426、430、431、432、434、437、445、446、449、450、454、455、456、457、458、459、460、463、465、466、467、469、470、475、481;而tyr在以下位置变成phe:9、38、63、87、118、129、169、178、198、216、251、286、291、303、357、358、367、371、402、442、443、448。
198、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2566。
199、3.bsrdi-hf的选择
200、利用在neb4中与bsrdia混合的wt bsrdib和与bsrdia混合的突变体bsrdib之间对作为底物的pbr322 dna的星号活性的比较来实现bsrdi-hf的选择。发现8个突变体在neb4中具有较小的星号活性:h137a、d177a、k363a、k408a、r411a、q215a、q226a、q230a。
201、为了进一步降低星号活性,我们将上述突变组合以产生双突变:k363a/q230a、k363a/k408a、q230a/k408a。然后,在q230a/k363a的bsrdib上具有突变的bsrdi被命名为bsrdi-hf。
202、4.bsrdi-hf的纯化
203、使两升细胞er2566(puc19-bsrdi(q230a/k363a),plg-bsrdim1m2))在37℃下在具有100μg/ml amp和33μg/ml kam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mmtris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bsrdi-hf然后加入相同体积的丙三醇并储存在-20℃条件下。
204、5.bsrdi-hf和bsrdi-wt的比较
205、用稀释剂a,在四种neb缓冲液中,在pbr322 dna上分别测定bsrdi-hf和bsrdi-wt的fi。结果显示在图7中,并列于表10(下面)中。
206、表10:bsrdi-hf和bsrdi-wt的比较
207、
208、
209、bsrdi-hf在neb4中表现最好,其中fi为≥1000;bsrdi-wt在neb2和neb3中表现最好,其中fi为64。所以总的改进因子为≥1000/0.5=≥2000。
210、实施例10:工程化hfnsii
211、1.nsii的表达
212、nsii在转化有placzz1-nsiir和pacyc-nsiim——均含有nsii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
213、2.nsii-hf的诱变
214、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr、phe、trp在以下位置变成ala:8、9、10、11、12、13、18、21、22、23、24、26、27、32、34、35、42、44、45、46、47、49、50、52、53、54、55、57、58、60、61、69、70、73、74、79、80、84、85、87、90、91、92、93、95、96、97、98、99、100、102、103、105、106、108、109、110、113、114、115、117、118、119、120、121、122、123、124、126、134、135、137、138、139、140、142、144、145、146、149、151、153、154、155、156、159、160、161、162、163、166、167、170、173、174、175、178、179、180、181、182、183、184、186、188、189、190、191、192、195、197、198、199、200、201、202、203、206、207、209、210、211、213、215、216、217、219、221、222、225、230、231、232、234、235、236、237、239、242、243、244、245、246、249、250、251、256、257、259、260、261、263、264、268、269、271、272、273、276、277、278、279、281、282、283、285、287、288、290、292、294、295、297、298、299、302、303、306、307、308、309、310、312、315、316、319、320、323、325、327、329、333、334、336、337、338、340、341、344、347、349、350、352、353、354、355、358、359、360、362、363、365、366、367、371、372、373、375、376和377;而tyr在以下位置变成phe:30、40、62、65、71、76、83、86、141、226、233、255、289、311、326、335、351、357、378。
215、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er3081。
216、3.nsii-hf的选择
217、利用pxba dna作为底物,用在neb3和neb4中的活性比较来完成nsii-hf的选择。nsii-wt在neb3中更有活性,选择在neb4中更有活性的。发现148个突变体在neb4中更有活性。f376a在neb4中比wt具有高得多的活性。通常,在neb4中具有最高活性的是具有改进的星号活性的。nsii(f376a)被命名为nsii-hf。
218、4.nsii-hf的纯化
219、使两升细胞er3081(placzz1-nsii(f376a),pacyc-nsiim))在37℃下在具有100μg/ml amp、33μg/ml cam和0.5mm iptg的lb中生长过夜。收获细胞并在50ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过amicon ultra 30kda(millipore,u.s.a,现为merck,germany)进一步浓缩。浓缩的nsii-hf然后加入相同体积的丙三醇并储存在-20℃条件下。
220、5.nsii-hf和nsii-wt的比较
221、用稀释剂a,在四种neb缓冲液中,在pxba dna上分别测定nsii-hf和wt nsii的fi。结果列于表11(下面)中。
222、表11:nsii-hf和nsii-wt的比较
223、
224、nsii-hf在neb4中表现最好,其中fi为≥8000;wt nsii在neb3中表现最好,其中fi为32。所以,在neb4中的改进因子为≥8000/32=≥250。
225、实施例11:工程化hf dpnii
226、1.dpnii的表达
227、dpnii在转化有pbad241-dpnii rm的大肠杆菌3081中进行表达。细胞在30℃下在具有amp的lb中生长过夜。
228、2.dpnii的诱变
229、选择的突变的点诱变通过反向pcr进行。在dpnii中进行如下189个氨基酸突变。cys、asp、glu、phe、his、lys、met、asn、gln、arg、ser、thr、trp突变成ala。try突变成phe。这些是:7、8、9、10、12、13、14、15、16、17、19、20、21、22、23、24、25、26、27、29、31、32、33、35、36、38、40、42、44、45、46、50、51、52、54、55、56、57、59、61、62、63、64、66、69、76、77、78、80、81、82、86、87、90、91、92、93、94、95、96、97、98、99、100、101、102、104、105、106、107、108、109、111、112、113、116、117、118、120、121、122、125、126、129、130、132、135、138、139、140、141、143、144、145、146、147、149、150、151、152、153、156、157、158、160、161、162、164、168、169、171、172、173、175、176、177、178、180、181、183、184、186、188、189、191、192、193、195、196、198、199、200、201、202、205、206、207、208、211、214、216、217、218、219、221、223、224、226、227、228、229、230、231、232、233、234、236、237、238、239、240、241、244、246、247、248、249、251、252、254、256、257、258、259、260、261、262、264、265、266、267、268、272、274、275、277、278、280、281和282。
230、引物设计方法和pcr与之前所述的类似。用dpnl消化pcr产物并转化入感受态大肠杆菌3081。
231、3.dpnii-hf的选择
232、每种突变的四个菌落在37℃下在具有amp的lb中生长过夜。利用dam-λ底物在neb4缓冲液和5%丙三醇中进行dpnii的标准筛查分析。
233、从筛查分析中挑取突变体r78a、t140a、e152a、r199a和f217a。在不同条件和底物中数轮比较后,选择r199a作为候选突变体,其保留高规范酶活性,但是显示大量减少的星号活性。r199a被标记为dpnii-hf。
234、4.dpnii-hf的纯化
235、使两升细胞大肠杆菌3081(pbad241.dpnii.rm(r199a))在30℃下在具有100ug/mlamp的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步被浓缩。浓缩的bmt-hf然后加入相同体积的丙三醇并储存在-20℃条件下。
236、5.dpnii-hf和dpnii-wt的比较
237、dpnii-hf用b进行2倍连续稀释,并在四种neb缓冲液中进行反应,并且,dpnii-wt被2倍连续稀释,并在四种neb缓冲液中进行反应。结果列于表12。
238、表12:dpnii-hf和dpnii-wt的比较
239、
240、dpnii-hf在neb4中表现最好,其中优选的fi=8000;dpnii在neb3中表现最好,其中fi为32。总的fi改进因子为8000/32=250。
241、实施例12:工程化高保真性bcli
242、1.bcli的表达
243、bcli在转化有prrs-bclir和pacyc184-bclim——均含有bcli内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp的lb中生长过夜。
244、2.bcli-hf的诱变
245、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:9、10、11、12、19、22、23、24、26、28、29、30、31、35、37、38、40、42、44、46、47、49、51、53、54、55、58、59、62、65、67、69、72、73、74、75、76、80、82、83、85、86、89、93、94、95、96、97、98、99、101、103、105、107、108、109、110、111、112、113、114、115、120、124、128、129、130、132、136、137,、138、139、143、144、145、149、150、151、152、154、156、160、162、163、164、166、167、170、171、172、174、175、178、179、180、182、183、188、190、191、195、196、197、199、200、201、204、205、208、209、210、212、213、215、217、218、220、221、222、223、224、225、226、228、229、234、235、237、238、241、243、244、245、249、252、255、257、260、261、265、266、267、270、271、273、274和277;而tyr在以下位置变成phe:17、27、36、63、66、77、87、100、116、118、133、142、147、157、192、193、194、207、212、231、236和246。
246、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2984。
247、3.bcli-hf的选择
248、利用dam-λdna作为底物,用在丙三醇和neb4中活性的比较来完成bcli-hf的选择。当较低星号活性受到怀疑时,也在相同底物上在水和neb4中比较突变体与正常活性。选择在neb4中具有与wt相似活性而且也可能具有较低星号活性的突变体。发现6个突变体具有这样的特性:g26a、p105a、t195a、q210a、y147f和y193f。若干突变体(k114a、t197a、s245a、d252a和y027f)在水中显示较低的活性以及降低的星号活性,在高丙三醇条件下,它们通常比wt具有更高的活性相关活性。显示比wt活性高以及较低星号活性的突变体:y192f.bcli(y192f)被命名为bcli-hf。
249、4.bcli-hf的纯化
250、使两升细胞er2984(prrs-bcli(y192f),pacyc184-bclim))在37℃下在具有100μg/ml amp的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bcli-hf然后加入等体积的丙三醇并储存于-20℃。
251、5.bcli-hf和bcli-wt的比较
252、用稀释剂a,在四种neb缓冲液中,在dam-λdna上分别测定bcli-hf和bcli-wt的fi。比较显示在图8中,并且,结果列于表13(下面)中。
253、表13:bcli-hf和bcli-wt的比较
254、
255、bcli-hf在neb2和neb4中表现最好,其中最佳fi为≥2000;bcli-wt在neb2和neb4中表现最好,其中fi为32。总的改进因子为≥2000/32=≥64。
256、实施例13:工程化hf bglii
257、1.bglii的表达
258、bglii在转化有placzz-bgliir和pacyc-bgliim——均含有bglii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
259、2.bglii-hf的诱变
260、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:2、4、6、7、9、10、12、13、16、18、20、21、22、24、25、26、29、30、33、35、37、38、39、41、42、45、48、49、53、54、55、58、59、60、64、65、66、67、68、69、74、75、76、77、78、81、82、84、85、87、88、89、90、93、95、96、97、98、101、104、105、106、108、109、110、112、113、114、115、116、117、118、120、121、122、124、125、131、132、134、135、136、139、140、141、142、146、147、149、150、151、153、154、157、159、161、162、166、172、173、174、175、176、177、179、182、183、184、187、188、189、191、192、193、195、196、197、198、199、201、203、206、207、208、209、211、212、213、214、215、216、217、219、222;而tyr在以下位置变成phe:8、56、99、144、145、158、185和190。
261、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er3081。
262、3.bglii-hf的选择
263、利用pxba dna作为底物,用在neb3和neb4中的活性比较来完成bglii-hf的选择。bglii-wt在neb3中更有活性,所以选择在neb4中更有活性的突变体。所有的更有活性的突变体然后在丙三醇中与wt活性进行比较,以检查星号活性。通常,在neb4中具有最高活性的突变体是具有改进的星号活性的突变体。最有希望的(promising)突变体(h10a、n208a、k48a、k74a、r75a、y56f、k58a、m117a)最终在水中用exoi缓冲液检测,水会促进bgli-wt中的星号活性。一个突变体——n208a在neb4中显示降低的星号活性和提高的总体活性。在小培养物中,该突变体可以看起来具有稳定的部分活性,经过我们测定,其是保真性发生变化的另一指示。bglii(n208a)被命名为bglii-hf。
264、4.bglii-hf的纯化
265、使两升细胞er3081(placzz-bglii(n208a),pacyc-bgliim))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bglii-hf然后加入等体积的丙三醇并储存于-20℃。
266、5.bglii-hf和bglii-wt的比较
267、用稀释剂b,在四种neb缓冲液中在pxba dna上分别测定bglii-hf和bglii-wt的fi。比较显示在图9中,并且结果列于表14(下面)。
268、表14:bglii-hf和bglii-wt的比较
269、
270、bglii-hf在neb2中表现最好,其中fi为≥128000;bglii-wt在neb3中表现最好,其中fi为120。总的改进因子为≥128000/120=≥1000。
271、实施例14:工程化hfbsteii
272、1.bsteii的表达
273、bsteii在转化有puc19-bsteiir和pacyc-bsteiim——均含有bsteii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
274、2.bsteii-hf的诱变
275、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、9、10、14、17、20、21、22、25、26、29、30、32、36、37、40、41、44、47、48、49、50、51、52、54、57、58、60、61、62、63、64、65、67、68、69、72、75、76、79、80、81、82、83、85、88、89、90、91、92、94、95、98、99、101、102、103、105、106、111、112、113、116、117、118、119、120、121、122、123、130、132、133、134、135、136、137、138、140、142、143、147、150、151、152、154、155、157、160、161、162、163、165、166、167、171、172、175、176、178、179、180、182、184、189、190、191、192、193、194、195、199、202、204、205、206、207、208、209、211、212、213、214、215、216、217、218、219、220、221、222、224、225、227、228、232、233、234、236、238、243、244、245、246、247、251、252、255、256、258、261、262、264、265、266、272、274、277、278、279、281;而tyr在以下位置变成phe:8、15、24、27、35、43、77、129、131、139、156、188、203、229、257和263。
276、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2683。
277、3.bsteii-hf的选择
278、利用λdna作为底物,用在neb3和neb4中的活性比较来完成bsteii-hf的选择。wtbsteii在neb3中更有活性,所以选择在neb4中更有活性的突变体。发现7个突变体在neb4中具有改进的活性:k014a、q069a、e099a、r105a、r117a、g135a和y035f。r105a在neb4和水中与wt相比活性最不同,而且,在用exoi缓冲液在丙三醇中测试时还显示降低的星号活性,exoi缓冲液是在wt中显示星号活性的条件。bsteii(r105a)被命名为bsteii-hf。
279、4.bsteii-hf的纯化
280、使两升细胞er2683(puc19-bsteii(r105a),pacyc-bsteiim))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bsteii-hf然后加入等体积的丙三醇并储存于-20℃。
281、5.bsteii-hf和wt bsteii的比较
282、用稀释剂a,在四种neb缓冲液中在λdna上分别测定bsteii-hf和wt bsteii的fi。比较显示在图10中,并且结果列于表15(下面)。
283、表15:bsteii-hf和bsteii-wt的比较
284、
285、
286、bsteii-hf在neb4中表现最好,其中fi为≥2000;bsteii-wt在neb2和neb4中表现最好,其中fi为4。总的改进因子为≥2000/4=≥500。
287、实施例15:工程化hfbanii
288、1.banii的表达
289、banii在转化有puc19-baniir和pacyc1-baniim——均含有banii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
290、2.banii-hf的诱变
291、所有残基——除了tyr(以及已经是ala的那些残基)以外——在以下位置变成ala:7、8、9、10、12、16、17、20、21、23、24、25、26、28、29、24、31、32、35、38、39、43、44、45、47、49、54、59、61、63、64、66、67、71、72、73、74、75、77、78、81、83、84、87、88、92、94、95、96、97、99、100、103、104、105、106、107、108、111、112、113、115、117、118、120、121、122、123、126、127、128、129、130、131、135、139、142、143、145、146、147、148、149、152、153、155,156、163、166、167、168、169、170、171、173、175、176、178、179、180、181、183、184、186、190、191、194、195、196、198、199、200、207、208、211、213、214、215、216、219、220、221、222、224、226、229、230、231、232、234、235、236、237、239、240、242、245、246、247、248、252、254、256、257、258、259、261、262、263、264、266、267、270、271、272、274、276、278、279、281 284、285、286、287、289、291、292、293、294、295、296、300、302、303、305、309、311、312、314、317、318、319、322、326、327、328、330、331、334、338、339、341、342、344、346、347、348、349、351、352、355、356和358;tyr在以下位置变成phe:27、50、80、160、182、197、244、251、260、307和313。
292、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2566。
293、3.banii-hf的选择
294、利用λdna作为底物,通过比较在具有水的neb4中的活性与在exoi缓冲液和丙三醇中的星号活性来完成banii-hf的选择。在水和neb4中与wt相比显示类似或改进的活性同时还显示改进的星号活性的突变体被选择用于进一步测试。这些突变体包括n106a、q169a和e314a。也选择r126a,因为它显示一致的部分式样,我们也证明它是高保真性的指示。纯化后,r126a显示星号活性降低最多。banii(r126a)被命名为banii-hf。
295、4.banii-hf的纯化
296、使两升细胞er2566(puc19-banii(r126a),pacyc-baniim))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的banii-hf然后加入等体积的丙三醇并储存于-20℃。
297、5.banii-hf和banii-wt的比较
298、用稀释剂a,在四种neb缓冲液中在dam-λdna上分别测定banii-hf和banii-wt的fi。结果列于表16(下面)。
299、表16:banii-hf和banii-wt的比较
300、
301、banii-hf在neb1中表现最好,其中fi为≥4000;banii-wt在neb1、neb2和neb4中表现最好,其中最佳fi为64。所以,在neb1中的总的改进因子为≥4000/64=≥64。
302、实施例16:工程化hf pspgi
303、1.pspgi的表达
304、pspgi在转化有prrs-pspgirm——含有pspgi内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在30℃下在具有amp的lb中生长过夜。
305、2.pspgi-hf的诱变
306、pspgi蛋白的长度为272个氨基酸。pspgi蛋白的全部166个aa位点最初被设计为突变成ala(或phe)。cys、asp、glu、phe、his、lys、met、asn、gln、arg、ser、thr、trp突变成ala。try突变成phe。这些是:8、10、11、12、13、14、15、16、18、19、20、21、22、25、26、29、30、32、34、35、38、39、42、43、44、45、46、47、48、51、52、53、54、57、60、61、62、65、68、69、71、72、73、75、76、80、82、84、85、86、87、89、90、91、93、94、96、98、99、100、101、102、105、109、110、113、134、135、136、137、138、142、143、145、149、150、151、152、153、158、160、161、162、164和165。诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株2984。
307、3.pspgi-hf的选择
308、利用pbc4 dna作为底物,用突变体和wt在neb4中活性的比较来实现pspgi-hf的选择。利用pbc4作为底物在neb4中(在69℃下进行2h消化)进行pspgi的选择分析。发现11个突变体在neb4中比wt更有活性:t20a、p52a、y67f、k68a、r75a、e86a、q90a、s91a、q93a、h121a和g172a。pspgi(r75a)在neb4中比wt具有高得多的活性。通常,在neb4中具有最高活性突变体的是具有改进的星号活性的突变体。在不同条件和底物中数轮比较后,发现pspgi(r75a)是优选的突变体,其保留高的切割活性,但是显示大量减少的星号活性。pspgi(r75a)被命名为pspgi-hf。
309、4.pspgi-hf的纯化
310、使两升细胞大肠杆菌2984(prrs-pspgirm(r75a))在30℃下在具有100μg/ml amp的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步被浓缩。浓缩的pspgi-hf然后加入相同体积的丙三醇并储存在-20℃条件下。
311、5.pspg-hf和pspgi-wt的比较
312、用稀释剂a,在四种neb缓冲液中,在pbc4 dna上分别测定pspg-hf和pspgi-wt的fi。结果列于表17(下面)。
313、表17:pspg-hf和pspgi-wt的比较
314、
315、
316、pspgi-hf在neb2、neb3和neb4中表现最好,其中优选的fi为≥4000;pspgi-wt在neb2、neb3和neb4中表现最好。pspgi-wt在neb3中的优选fi为8。总的fi改进因子≥4000/8=≥500。
317、实施例17:工程化hf spei
318、1.spei的表达
319、spei在转化有prrs-spei和pasyx20-speim9——均含有spei内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在30℃下在具有amp和kan的lb中生长过夜。
320、2.spei-hf的诱变
321、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、9、10、17、18、20、21、22、24、25、26、29、30、31、32、33、34、36、40、43、45、46、49、50、51、52、53、54、57、58、59、61、65、66、70、73、74、75、76、77、78、80、81、84、86、87、88、89、90、92、96、97、101、102、103、105、107、108、109、110、112、113、115、116、118、121、122、125、126、128、130、131、137、138、139、140、142、146、149、151、152、154、157、158、159、160、161、163、166、167、169、170、172、174、175、179、180和182;tyr在以下位置变成phe:13、19、28、55、104、120、129和164。
322、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er1038。
323、3.spei-hf的选择
324、通过比较每个突变体在neb4——具有水和作为底物先前用saci-hf消化的pxbadna——与具有exoi和正常pxba的丙三醇反应物中的活性,实现spei-hf的选择。saci-hf消化的pxba使得在与wt比较测试突变体的活性时更清楚。丙三醇反应被用于比较星号活性结果。若干突变体显示高的相关活性同时星号活性降低:e059a、p065a、s108a、n172a、k174a、q179a、g182a和y055f。比较纯化的样品之后,spei(p065a)被命名为spei-hf。
325、4.spei-hf的纯化
326、使两升细胞er3081(prrs-speim7(p065a),psyx20-speim9))在30℃下在具有100μg/ml amp和33μg/ml的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的spei-hf然后加入等体积的丙三醇并储存于-20℃。
327、5.spei-hf和spei-wt的比较
328、用稀释剂c,在四种neb缓冲液中,在pxba dna上分别测定spei-hf和spei-wt的fi。并且,结果列于表18(下面)。
329、表18:spei-hf和spei-wt的比较
330、
331、spei-hf在neb4中最有活性,其中fi为≥8000;spei-wt在neb1中最有活性,其中fi为1000。所以,总的改进因子为≥8。
332、实施例18:工程化hfbsmai
333、1.bsmai的表达
334、bsmai在转化有pbad241-bsmair和pacyc-bsmaim——均含有bsmai内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜,然后用阿拉伯糖诱导4小时。
335、2.bsmai-hf的诱变
336、由于bsai、bsmbi和bsmai之间的同源性,选择bsmai区域210-227中的氨基酸突变成ala,一次一个,因为发现bsai和bsmbi的高保真性突变体在该类似的区域内。
337、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er3081。
338、3.bsmai-hf的选择
339、以fx174 dna作为底物,用突变体bsmai和wt bsmai在neb4中的星号活性的比较实现bsmai-hf的选择。两个突变体比wt bsmai具有较小的星号活性:n212a和l213a。突变体bsmai(n212a)被命名为bsmai-hf。
340、4.bsmai-hf的纯化
341、使两升细胞er2566(pbad241-bsmai(n212a),pacyc184-bsmaim))在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。然后,细胞用阿拉伯糖——终浓度为0.2%——诱导4小时。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bsmai-hf然后加入相同体积的丙三醇并储存于-20℃。
342、5.bsmai-hf和bsmai-wt的比较
343、用稀释剂b,在四种neb缓冲液中,在fx174 dna上分别测定bsmai-hf和bsmai-wt的fi。结果列于表19(下面)。
344、表19:bsmai-hf和bsmai-wt的比较
345、
346、bsmai-hf在neb1和neb4中表现最好,其中fi为≥4000;bsmai-wt在neb4中表现最好,其中fi为250。所以总的改进因子为≥4000/250=≥16。
347、实施例19:工程化hfbstxi
348、bstxi识别ccannnnn/ntgg并在ccannnnn/ntgg处消化,如在国际公开号wo 2009/009797的实施例19中所描述的。突变体bstxi(n65a)被选择作为高保真形式的bstxi。寻找具有较小星号活性的更好bstxi的进一步步骤是将n65突变成所有其它氨基酸残基。在这些之中,发现bstxi(n65t)具有较小的星号活性,并被命名为bstxi-hf。
349、bstxi-hf在er2833(pbad241-bstxi(n65t)、pacyc-bstxim中进行表达。根据wo/2009/009797进行生长和纯化方法。
350、下表(表20)比较了bstxi-hf和bstxi wt的fi。
351、表20:bstxi-hf和bstxi-wt的比较
352、
353、bstxi-hf在neb2、neb3和neb4中最有活性,bstxi-hf的最佳fi为≥1000;wt bstxi在neb2、neb3和neb4中最有活性。wt bstxi在neb2和neb4中的fi为32。所以,总的改进因子≥32。
354、实施例20:工程化hfsfii
355、1.sfii的表达
356、sfii在转化有prrs-sfiir和psx33-sfiim——均含有sfii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在30℃下在具有amp和kan的lb中生长过夜。
357、2.sfii-hf的诱变
358、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、9、11、12、14、15、17、18、19、20、22、23、26、29、30、32、33、34、36、37、40、41、42、45、46、47、48、49、55、56、58、59、63、66、67、69、71、72、73、76、79、81、82、84、87、88、89、90、91、94、95、100、102、104、105、106、107、108、109、110、111、113、114、115、116、118、120、122、124、125、126、127、128、129、130、133、135、137、140、141、145、146、148、149、150、153、156、157、158、162、166、167、169、170、172、173、174、176、177、179、180、185、187、188、190、192、193、194、196、197、198、199、200、201、202、205、207、208、209、210、211、213、214、215、218、220、224、225、227、228、231、233、235、236、238、240、242、243、244、246、247、248、249、251、252、254、255、257、258、259、261、262、263;tyr在以下位置变成phe:31、60、68、80、164、165、175、182、195、222、239和245。
359、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2169。
360、3.sfii-hf的选择
361、利用以ecori-hf预消化的pxba dna作为底物,用突变体和wt在具有neb exoi缓冲液和bsa的水中的活性之间的比较来实现sfii-hf的选择。选择与野生型相比具有类似或更大的活性同时与wt相比在限定缓冲液中还显示星号活性变化的突变体。发现若干突变体在neb4中更有活性:e007a、d011a、e049a、r073a、r0114a、g137a、s210a和r213a。纯化之后,p114a被证明其星号活性降低最明显。sfii(r114a)被命名为sfii-hf。
362、同样值得注意的是星号活性提高的突变:n071a、d079a、h162a、r225a、k227a、y068f和y182f。y068f之前被注意到与wt具有不同的切割。
363、4.sfii-hf的纯化
364、使两升细胞er2169(prrs-sfii(r114a),psx33-sfiim))在30℃下在具有100μg/mlamp和33μg/ml kan的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的sfii-hf然后加入等体积的丙三醇并储存于-20℃。
365、5.sfii-hf和sfii-wt的比较
366、用稀释剂c,在四种neb缓冲液中在pbc4 dna上分别测定sfii-hf和sfii-wt的fi。比较显示在图11中,并且,结果列于表21(下面)。
367、表21:sfii-hf和sfii-hf的比较
368、
369、sfii-hf在neb4中表现最好,其中fi为≥8000;wt sfii在neb3中表现最好,其中fi为2000。总的改进因子≥8000/2000=≥4。
370、实施例21:工程化hfpmei
371、1.pmei的表达
372、pmei在转化有prrs-pmeir和pacyc184-esas9im——均含有pmei内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
373、2.pmei-hf的诱变
374、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、10、13、14、17、20、21、22、25、28、29、30、32、33、35、37、39、41、42、43、46、47、49、50、51、54、55、60、62、63、64、66、67、68、69、71、72、73、77、79、80、81、82、83、86、87、91、94、95、96、97、98、100、104、106、107、108、109、110、112、113、114、115、116、117、118、121、123、124、127、130、131、132、133、134、135、137、138、145、147、148、149、151、152、153、154、155、157、160、162、165、166、167、169、170、171、172、177、180、181、182、183、185、186、188、190、191、192、193、194、199、200、201、202、204、207、208、209、210、211、212、215、218、219、221、222、223、225;tyr在以下位置变成phe:111、129、146和161。
375、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2426。
376、3.pmei-hf的选择
377、利用以λdna作为底物,wt和突变体在水neb4中的活性与以pxba作为底物,相同突变体在丙三醇和neb thermopol缓冲液中的活性之间的比较来实现pmei-hf的选择。突变体和wt pmei在水中在λdna上的测试允许参考相关活性,并且与wt相比在neb4中具有类似或更高活性的被选择。如果在丙三醇条件下用thermopol缓冲液和pxba测试时不显示星号活性变化,具有可接受活性的突变体则随后被淘汰。若干突变体显示具有星号活性差异:p079a、e086a、h096a和e218a。pmei(e086a)被命名为pmei-hf。
378、4.pmei-hf的纯化
379、使两升细胞er2426(prrs-pmei(p154a),pacyc184-esas9im))在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的pmei-hf然后加入等体积的丙三醇并储存于-20℃。
380、5.pmei-hf和pmei-wt的比较
381、用稀释剂a,在四种neb缓冲液中在pxba dna上分别测定pmei-hf和pmei-wt的fi。结果列于表22(下面)。
382、表22:pmei-hf和pmei-wt的比较
383、
384、pmei-hf在neb4中表现最好,其中fi为≥8000;pmei-wt在neb1和neb2中表现最好,其中fi为250。总的改进因子为≥8000/250=≥16。
385、实施例22:工程化hfsmai
386、1.smai的表达
387、smai在转化有prrs-smair和psyx20-smaim——均含有smai内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和kan的lb中生长过夜。
388、2.smai-hf的诱变
389、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr变成ala;所有tyr变成phe。
390、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2428。
391、3.smai-hf的选择
392、利用以pxba dna作为底物与星号活性产生丙三醇条件与neb标准taq缓冲液在水neb4中的活性的比较来实现smai-hf的选择。选择在指定缓冲液中显示星号活性变化同时保持与wt相比类似或高的相关活性的突变体。发现若干突变体:e32r、s081a、g132a和双突变体f60l/s61r。smai(f60l/s61r)被命名为smai-hf。
393、4.smai-hf的纯化
394、使两升细胞er2428(prrs-smai(f60l/s61r)、psyx20-smaim))在37℃下在具有100μg/ml amp和33μg/ml kan的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的smai-hf然后加入等体积的丙三醇并储存于-20℃。
395、5.smai-hf和smai-wt的比较
396、用稀释剂a,在四种neb缓冲液中在pxba dna上分别测定smai-hf和wt的fi。比较显示在图12中,并且,结果列于表23(下面)。
397、表23:smai-hf和smai-wt的比较
398、
399、nd:不可测定
400、smai-hf在neb4中表现最好,其中fi为≥256000;smai-wt在neb2和neb4中表现最好,其中fi为64。总的改进因子为≥256000/64=≥4000。
401、实施例23:工程化高保真性aatii
402、1.aatii的表达
403、aatii在转化有prrs-aatiir和pacyc184-aatiim——均含有aatii内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
404、2.aatii-hf的诱变
405、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:8、9、11、12、13、16、17、18、20、22、26、29、32、33、35、36、37、38、40、43、45、46、49、52、53、54、56、57、58、60、61、62、64、65、69、70、71、72、73、74、75、77、79、80、83、84、86、87、90、92、93、94、95、97、99、100、103、104、106、107、111、113、114、117、121、123、124、125、126、128、129、131、132、133、135、136、140、141、143、144、145、146、148、149、150、151、153、155、156、157、160、164、165、167、169、171、172、173、174、175、176、177、179、181、182、186、189、191、192、193、194、196、198、200、201、203、204、205、206、207、208、210、211、213、214、216、217、219、220、221、222、226、228、230、231、233、235、236、237、238、240、241、244、247、248、249、250、251、252、253、256、262、264、265、266、268、269、272、273、275、280、281、282、283、286、298、292、293、295、296、297、298、301、302、308、309、311、312、313、314、315、317、319、321、325、327、329、330、333、334、335、336;tyr在以下位置变成phe:82、89、98、112、232、305和306。
406、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2426。
407、3.aatii-hf的选择
408、利用pxba dna作为底物,用neb4在水中与neb exoi缓冲液在丙三醇中活性的比较来实现aatii-hf的选择。在丙三醇条件下显示星号活性变化的突变体被选择用于进一步测试,只要在正常条件下在水中它们与wt相比具有类似的或更高的活性。在初始筛选之后选择若干突变体用于进一步测试:g013a、g016a、k018a、p052a、r053a、k070a、e071a、d072a、g073a、s84a、e086a、r090a、k094a、r095a、p099a、p103a、k113a、n135a、s151a、p157a、g173a、t204a、s206a、k207a、e233a、n235a、e237a、s238a、d241a、k295a、s301a和s302a。aatii(n235a)被命名为aatii-hf。
409、4.aatii-hf的纯化
410、使两升细胞er2426(prrs-aatii(n235a)、pacyc184-aatiim))在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的aatii-hf然后加入等体积的丙三醇并储存于-20℃。
411、5.aatii-hf和aatii-wt的比较
412、用稀释剂a,在四种neb缓冲液中,在pbr322 dna上分别测定aatii-hf和wt aatii的fi。结果列于表24(下面)。
413、表24:aatii-hf和aatii-wt的比较
414、
415、nc:不可完成;nd:不可检测
416、aatii-hf在neb4中表现最好,其中fi为≥1000;wt aatii在neb2中表现最好,其中fi为1/4。总的改进因子为≥1000/1/4=≥4000。
417、实施例24:工程化hf apoi
418、1.apoi的表达
419、apoi在转化有prrs-apoir和pacyc184-apoim——均含有apoi内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
420、2.apoi-hf的诱变
421、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln和arg在以下位置变成ala:8、9、10、11、13、14、17、18、19、20、21、22、23、24、26、28、29、33、35、36、37、39、41、43、47、48、49、50、51、56、57、60、62、63、64、66、67、69、71、72、73、75、76、77、80、81、82、83、84、87、92、93、94、95、96、97、102、103、105、106、107、108、109、110、111、113、115、116、117、119、120、121、124、125、128、129、131、132、133、136、137、143、144、145、148、153、155、157、159、160、161、162、163、166、167、169、170、175、176、178、179、181、184、185、186、187、188、189、192、193、194、195、199、201、202、204、206、207、209、210、214、216、217、218、221、226、227、229和230。
422、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2426。
423、3.apoi-hf的选择
424、利用λdna作为底物,用在neb3和neb4中的活性比较来完成apoi-hf的选择。选择在neb4中比wt具有更高活性的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现以下突变体在neb4中更有活性:s64a、s80a、s162a、t77a/t96a和n178a。apoi(t77a/t96a)被命名为apoi-hf。
425、4.apoi-hf的纯化
426、使两升细胞er2426(prrs-apoi(t77a/t96a)、pacyc184-apoim))在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜,生长8小时之后,用0.5mm itpg进行诱导。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1mnacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartoriusvivascience gmbh,goettingen,germany)进一步浓缩。浓缩的apoi-hf然后加入等体积的丙三醇并储存于-20℃。
427、5.apoi-hf和apoi-wt的比较
428、用稀释剂a,在四种neb缓冲液中,在pxba dna上分别测定apoi-hf和apoi-wt的fi。结果列于表24(下面)。
429、表24:apoi-hf和apoi-wt的比较
430、
431、apoi-hf在neb2中表现最好,其中fi为≥4000;wt apoi在neb2和neb3中表现最好,其中,最佳fi为64。总的改进因子为≥4000/64=≥64。
432、实施例25:工程化高保真性bsmbi
433、bsmbi识别cgtctcn1/n5并在cgtctcn1/n5处消化,如在国际公开号wo 2009/009797的实施例23中所描述的。突变体bsmbi(r232a)被选择作为高保真性形式的bsmbi。该突变体的进一步的表征揭示,尽管bsmbi(r232a)的性能在一个小时的范围内是优异的,但它过夜消化中表现并不好。在寻找更多的突变体时,发现bsmbi(w238a)在一个小时和过夜反应中均是优异的,其被命名为bsmbi-hf(图13)。
434、bsmbi-hf在er3081(pbad241-bsmbir(w238a)/pacyc-bsmaim)中进行表达。根据wo/2009/009797执行生长和纯化方法。
435、下表(表26)比较了bsmbi-hf和bsmbi-wt的fi。
436、表26:bsmbi-hf和bsmbi-wt的比较
437、
438、bsmbi-hf在neb4中最有活性,bsmbi-hf在neb4中的fi为250;bsmbi-wt在neb3中最有活性。wt bsmbi在neb2中的fi为120。所以,总的改进因子为2。
439、实施例26:工程化hfbmti
440、1.bmti的表达
441、bmti在转化有pacyc-bmtim和placzz1-bmtir的大肠杆菌中进行表达。pacyc是低拷贝相容性质粒。细胞在37℃下在具有amp和cam的lb中生长过夜。
442、2.bmti-hf的诱变
443、选择的突变的点诱变通过反向pcr进行。在bmti中进行如下150个氨基酸突变。cys、asp、glu、phe、his、lys、met、asn、gln、arg、ser、thr、trp突变成ala。try突变成phe。这些是:5、9、11、12、16、19、20、23、24、25、26、27、30、32、33、34、35、36、39、45、46、49、50、51、53、56、58、59、60、63、65、69、71、72、73、74、75、76、78、79、80、81、83、85、86、88、89、90、92、93、94、95、97、98、99、101、104、105、106、108、110、111、112、113、116、118、119、120、121、122、124、128、129、131、132、133、134、136、138、139、140、141、142、144、145、146、147、148、150、151、152、154、156、157、161、162、163、165、166、167、168、169、171、172、173、175、178、179、180、181、185、186、189、190、191、193、194、195、196、199、200、201、202、203、204、205、206、207、208、210、211、213、214、216、217、218、219、220、221、222、226、228、229、230、231、234、236、237、238、239和241。诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株3081。
444、3.bmti-hf的选择
445、每种突变的四个菌落在37℃在具有amp和cam的lb中生长过夜。利用pbc4在exoi缓冲液和10% dmso中进行bmti的标准相关活性和星号活性分析。
446、在筛查分析中挑取突变体s50a、y81f、n93a和w207a。在不同条件和底物中数轮比较后,发现s50a是优选的突变体,其保留高的规范酶活性,但是显示大量减少的星号活性。bmti(s50a)被标记为bmti-hf。
447、4.bmti-hf的纯化
448、使两升细胞大肠杆菌3081(placzz1-bmtir(s50a)、pacyc-bmtim)在37℃下在具有100μg/ml amp和30μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步被浓缩。浓缩的bmti-hf然后加入相同体积的丙三醇并储存于-20℃。
449、5.bmti-hf和bmti-wt的比较
450、bmti-hf用a以2倍连续稀释并在pxba上反应。结果显示在表27中。
451、表27:bmti-hf和bmti-wt的比较
452、
453、bmti-hf在neb4中表现最好,其中优选的fi为≥1000000;bmti-wt在neb2和neb4中表现最好,其中fi为16。总的fi改进因子为≥1000000/16=≥62500。
454、实施例27:工程化hfbstni
455、1.bstni的表达
456、bstni在转化有pbad241-bstnir和pacyc184-bstnim——均含有bstni内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜,用lb稀释到1/10,然后通过阿拉伯糖诱导4小时。
457、2.bstni-hf的诱变和选择
458、在产生一系列bstni突变的试验过程中,发现bstni(g26n)比wt bstni具有较小的星号活性。为了寻找具有甚至更小的星号活性的更好bstni突变体,将g26突变成所有其它氨基酸。在所有这些突变体之中,bstni(g26t)具有最小的星号活性,其被命名为bstni-hf。
459、3.bstni-hf的纯化
460、使两升细胞er2833(pbad241-bstni(g26t)、pacyc184-bstnim)在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。然后用lb将细胞稀释为1至10,随后用终浓度为0.2%的阿拉伯糖诱导4小时。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bstni-hf然后加入相同体积的丙三醇并储存于-20℃。
461、4.bstni-hf和wt bstni的比较
462、用稀释剂a,在四种neb缓冲液中,在pbr322 dna上分别测定bstni-hf和wt bstni的fi。比较显示在图14中,并且,结果列于表28(下面)。
463、表28:bstni-hf和bstni-wt的比较
464、
465、bstni-hf在neb2和neb4中表现最好,其中,最佳fi为≥500;bstni-wt在neb2和neb3中表现最好,其中,最佳fi为250。所以,总的改进因子为≥500/250=≥2。
466、实施例28:工程化hfmlui
467、1.mlui的表达
468、mlui在转化有puc19-mluir和pacyc184-mluim——均含有mlui内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在30℃下在具有amp和cam的lb中生长过夜。
469、2.mlui-hf的诱变
470、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、10、11、13、16、21、23、24、26、27、30、31、33、34、35、36、37、39、42、44、48、50、51、54、57、59、60、61、67、68、71、72、74、75、78、79、81、83、84、85、86、89、90、93、94、95、97、99、101,102、104、106、108、111、112、114、116、117、119、120、121、123、125、128、130、131、132、134、136、137、139、140、141、142、144、145、146、148、152、154、155、156、157、159、161、163、165、166、170、172、173、174、176、177、179、180、181、182、183、184、186、189、192、195、196、197、200、206、207、208、210、211、214、216、218、219、220、221、223、227、228、230、232、233、234、236、237、238、240、243、244、247、249、255、256、257、258、261、263、264、265、266、269;tyr在以下位置变成phe:14、28、47、53、77、107、175、198、217、239和248。
471、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er1582。
472、3.mlui-hf的选择
473、利用λdna作为底物,用在neb3和neb4中的活性比较来完成mlui-hf的选择。选择在neb4中比wt更具有活性的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现符合我们的标准的唯一突变体是e112a/r132;mlui(e112a/r132a)被命名为mlui-hf。
474、4.mlui-hf的纯化
475、使两升细胞er1582(puc19-mlui(e112a/r132a)、pacyc184-mluim))在30℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的mlui-hf然后加入等体积的丙三醇并储存于-20℃。
476、5.mlui-hf和mlui-wt的比较
477、用稀释剂a,在四种neb缓冲液中,在λdna上分别测定mlui-hf和wt mlui的fi。比较显示在图15中,并且,结果列于表29(下面)。
478、表29:mlui-hf和mlui-wt的比较
479、
480、mlui-hf在neb2和neb4中表现最好,其中fi为≥32000;mlui-wt在neb3中表现最好,其中fi为2000。总的改进因子为≥32000/2000=≥16。
481、实施例29:工程化hfbani
482、1.bani的表达
483、bani在转化有puc19-banir和pacyc184-banim——均含有bani内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
484、2.bani-hf的诱变
485、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、9、11、12、14、15、16、19、22、23、27、28、29、30、31、32、33、36、37、40、41、42、43、47、50、52、53、54、55、56、58、61、64、66、67、69、70、71、75、76、81、82、84、85、86、87、89、90、92、93、94、96、97、100、103、105、106、107、109、110、111、112、114、115、117、121、122、123、124、126、130、131、133、135、136、138、139、140、141、143、145、146、148、150、151、152、154、156、157、160、161、169、171、174、175、176、178、179、182、183、185、187、188、191、192、193、194、195、197、198、201、202、203、208、209、211、212、213、215、217、218、220、221、224、225、226、229、232、233、234、236、237、238、240、242、243、244、245、246、248、249、251、252、253、254、255、256、257、259、260、262、266、267、268、269、270、271、275、277、279、281、282、283、284、285、287、288、289、291、292、294、296、298、301、302、303、304、305、312、313、315、316、318、319、320、321、324、325、328、329、330、331、333、337、338、339、340、342、346;tyr在以下位置变成phe:104、125、127、156、159、204、239、297、306和336。
486、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2683。
487、3.bani-hf的选择
488、利用λdna作为底物,用在水和neb4对比在丙三醇和neb exoi缓冲液中活性的比较来实现bani-hf的选择。选择在neb4中具有与wt相比同样高或更高活性的突变体,如果它们在丙三醇条件下测试时也显示星号活性变化。用于选择这些突变体的另一指示是这样的事实:即去除星号活性在相关切割中产生迟钝位点(slow site)。发现许多突变体的星号活性和所得的迟钝位点有变化:n016a、s33a、p36a、h76a、p87a、n89a、r90a、t138a、k141a、k143a、q221a、q224a、n253a、q292a、r296a、t152i、g326a和t324a。bani(q292a)被命名为bani-hf。
489、4.bani-hf的纯化
490、使两升细胞er2683(puc19-bani(p154a)、pacyc184-banim))在37℃下在具有100μg/ml amp和33μg/mlcam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bani-hf然后加入等体积的丙三醇并储存于-20℃。
491、5.bani-hf和bani-wt的比较
492、用稀释剂a,在四种neb缓冲液中,在λdna上分别测定bani-hf和wt bani的fi。结果列于表30(下面)。
493、表30:bani-hf和bani-wt的比较
494、
495、
496、bani-hf在neb4中表现最好,其中fi为≥2000;wt bani也在neb4中表现最好,但fi仅为16。总的改进因子为≥2000/16=≥125。
497、实施例30:工程化hfkasi
498、1.kasi的表达
499、kasi在转化有placzz-kasir和pacy-sfoim——均含有kasi内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在30℃下在具有amp和cam的lb中生长过夜。
500、2.kasi-hf的诱变
501、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、9、11、13、14、17、18、21、24、26、28、29、31、32、33、34、36、37、39、42、43、44、47、48、51、52、54、55、56、58、60、62、63、64、65、66、69、70、73、76、77、78、79、83、85、86、88、89、90、91、92、93、94、98、100、101、102、103、104、108、110、111、114、115、116、117、118、119、122、123、124、125、126、128、129、134、137、138、139、140、142、143、144、145、146、149、150、152、153、154、156、158、161、162、163、164、165、167、168、173、177、178、180、181、182\、184、185、188、189、190、191、192、195、197、198、200、202、203、204、210、211、212、214、215、216、217、218、219、220、221、222、223、225、226、228、229、231、234、237、238、241、243、244、245、246、248、251、253、255、257、258、259、260、261、263、264、265、266、269、270、271、274、275、276、277和278;tyr在以下位置变成phe:19、41、74、80、95、207和256。
502、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2683。
503、3.kasi-hf的选择
504、利用pbr322 dna作为底物,用在neb3和neb4中的活性比较来完成kasi-hf的选择。选择在neb4中具有比wt活性高的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现以下突变体在neb4中更有活性:k024a、p214a、e146a、n251a和y095f。kasi(n251a)被命名为kasi-hf。
505、4.kasi-hf的纯化
506、使两升细胞er2683(placzz-kasi(m251a)、pacyc-sfoim))在30℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的kasi-hf然后加入等体积的丙三醇并储存于-20℃。
507、5.kasi-hf和kasi-wt的比较
508、用稀释剂b,在四种neb缓冲液中,在pbr322 dna上分别测定kasi-hf和kasi-wt的fi。结果列于表31(下面)。
509、表31:kasi-hf和kasi-wt的比较
510、
511、kasi-hf在neb2和neb4中表现最好,其中fi为≥16000;kasi-wt在所有缓冲液中表现相同,其中,最佳fi为8。总的改进因子为≥16000/8=≥2000。
512、实施例31:工程化hfnrui
513、1.nrui的表达
514、nrui在转化有puc19-nruir和pacyc-sbo13im——均含有nrui内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
515、2.nrui-hf的诱变
516、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:8、10、12、13、15、16、19、20、21、22、23、25、26、30、34、36、38、39、44、45、46、47、49、50、53、54、55、56、57、58、59、60、61、62、63、64、68、70、71、72、73、75、77、79、80、82、83、84、85、87、89、90、91、92、93、95、96、97、99、101、103、104、106、107、112、113、114、115、117、118、119、124、125、127、132、134、137、138、139、141、146、147、148、149、152、154、155、157、158、159、162、163、165、166、168、169、170、171、174、175、177、178、180、182、184、186、188、189、190、191、193、196、197、200、201、202、204、205、206、207、208、209、211和213;tyr在以下位置变成phe:11、31、52、69、98、64和187。
517、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2683。
518、3.nrui-hf的选择
519、利用dam-λdna作为底物,用在neb3和neb4中的活性比较来完成nrui-hf的选择。选择在neb4中比wt更有活性的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现以下突变体在neb4中更有活性:g075a、q099a、g155a和p022a/r90a。p154a nrui(p022a/r90a)被命名为nrui-hf。
520、4.nrui-hf的纯化
521、使两升细胞er2683(puc19-nrui(p022ar90a)、pacyc184-sbo13im)在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml10mm tris-hcl,ph7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分进一步通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)浓缩。浓缩的nrui-hf然后加入等体积的丙三醇并储存于-20℃。
522、5.nrui-hf和nrui-wt的比较
523、用稀释剂a,在四种neb缓冲液中,在dam-λdna上分别测定nrui-hf和nrui-wt的fi。结果列于表32(下面)。
524、表32:nrui-hf和nrui-wt的比较
525、
526、
527、nrui-hf在neb4中表现最好,其中fi为≥16000;nrui-wt在neb3中表现最好,其中fi为500。总的改进因子为≥16000/500=≥32。
528、实施例32:工程化高保真性nspi
529、1.nspi的表达
530、nspi在转化有puc19-nspir和pacyc-fatim——均含有nspi内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
531、2.nspi-hf的诱变
532、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:9、10、12、13、14、16、17、18、19、20、21、23、26、29、30、31、32、34、36、37、39、40、41、42、44、45、46、47、50、51、52、53、55、56、58、59、60、61、62、63、64、65、66、70、71、72、73、74、77、78、80、81、82、83、85、86、87、89、90、91、93、94、96、97、99、100、102、104、107、108、111、114、116、117、120、121、122、123、124、125、126、127、128、132、133、134、136、138、139、141、143、144、145、146、147、149、150、152、153、154、155、157、158、159、161、164、165、166、167、168、169、170、171、172、175、176、177、178、180、181、184、185、186、187、188、189、191、193、195、199、200、201、202、203、205、206、208、209、210、211、212、213、215、216、217、220、222、225、227、230、231、234、235、236和238;tyr在以下位置变成phe:48、75、113、115、198和224。
533、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2566。
534、3.nspi-hf的选择
535、利用pbr322 dna作为底物,用在neb3和neb4中的活性比较来完成nspi-hf的选择。选择在neb4中比wt更有活性的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现以下突变体在neb4中更有活性:s097a和e125a。nspi(s097a)被命名为nspi-hf。
536、4.nspi-hf的纯化
537、使两升细胞er2566(puc19-nspi(s097a),pacyc-fatim))在37℃下在具有100μg/ml amp和33μg/ml cam的lb中生长过夜。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mmnacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mmnacl、100ml 10mm tris-hcl,ph 7.5、50mm-1m nacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartorius vivascience gmbh,goettingen,germany)进一步浓缩。浓缩的nspi-hf然后加入等体积的丙三醇并储存于-20℃。
538、5.nspi-hf和nspi-wt的比较
539、用稀释剂a和bsa,在四种neb缓冲液中在puc19 dna上分别测定nspi-hf和nspi-wt的fi。比较显示在图16中,并且,结果列于表33(下面)。
540、表33:nspi-hf和nspi-wt的比较
541、
542、nspi-hf在neb1和neb4中表现最好,其中,最佳fi为≥4000;wt nspi在neb1和neb2中表现最好,其中,最佳fi为250。总的改进因子为≥4000/250=≥16。
543、实施例33:工程化hfbsrfi
544、1.bsrfi的表达
545、bsrfi在转化有pbad-bsrfir和psyx33-hpaiim——均含有bsrfi内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和kan的lb中生长过夜,用阿拉伯糖诱导。
546、2.bsrfi-hf的诱变
547、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、9、12、13、15、16、17、18、19、20、21、23、25、26、28、32、35、36、37、39、40、41、42、44、45、46、48、49、51、52、56、59、61、62、64、65、66、68、72、73、74,75、76、77、80、86、87、89、91、93、94、95、97、98、103、105、106、108、109、111、113、114、117、118、119、120、121、122、123、126、128、129、130、133、134、135、136、137、139、142、143、144、145、146、151、152、153、154、157、158、159、161、162、163、165、166、168、169、170、171、173、174、177、180、181、183、184、185、187、189、190、194、196、198、199、200、202、203、204、205、206、208、211、212、213、214、217、218、222、224、226、229、230、231、233、235、238、240、241、242、243、245、246、248、249、250、253、254、257、258、259、262、264、265、266、267、268、269、272、273、276、278、279、281、282、284和285;tyr在以下位置变成phe:14、34、53、90、96、99、125、160、227、236、237。
548、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er2566。
549、3.bsrfi-hf的选择
550、利用pbr322 dna作为底物,用在neb3和neb4中的活性比较来完成bsrfi-hf的选择。选择在neb4中比wt更有活性的突变体,因为在neb4中提高的活性是改进的保真性的指示。发现以下突变体在neb4中更有活性:k021a/i031r和t120a。bsrfi(k021a/i031r)被命名为bsrfi-hf。
551、4.bsrfi-hf的纯化
552、使两升细胞er2566(pbad-bsrfi(k021a/i031r),psyx33-hpaiim)在37℃下在具有100μg/ml amp和33μg/ml kan的lb中生长过夜,在8小时后用0.2%阿拉伯糖进行诱导。收获细胞并在20ml 10mm tris-hcl,ph 7.5、50mm nacl中进行超声处理。以15,000rpm离心30分钟之后,通过注射器注射,将上清液加载到由相同的缓冲液预平衡的5ml hitraptm肝素hp柱(ge healthcare,现为pfizer,inc.,piscataway,nj)上。然后,通过以下程序将柱加载体系:48ml 10mm tris-hcl,ph 7.5、50mm nacl、100ml 10mm tris-hcl,ph 7.5、50mm-1mnacl线性梯度,接下来为10ml 10mm tris-hcl,ph 7.5、1m nacl步骤。然后,测试洗脱部分的活性。具有最高活性的部分通过15r(vivascience,现为sartoriusvivascience gmbh,goettingen,germany)进一步浓缩。浓缩的bsrfi-hf然后加入等体积的丙三醇并储存于-20℃。
553、5.bsrfi-hf和wt bsrfi的比较
554、用稀释剂a,在四种neb缓冲液中,在pbr322 dna上分别测定bsrfi-hf和bsrfi-wt的fi。比较显示在图17中,并且,结果列于表35(下面)。
555、表35:bsrfi-hf和bsrfi-wt的比较
556、
557、
558、bsrfi-hf在neb1和neb4中表现最好,其中fi为≥500;bsrfi-wt在neb2中表现最好,其中fi为4。总的改进因子为≥500/4=≥120。
559、实施例34:工程化hf bspei
560、1.bspei(seq id no.34)的表达
561、bspei在转化有plazz1-bspeir和pacyc184-bspeim——均含有bspei内切核酸酶和甲基化酶基因——的大肠杆菌中进行表达。细胞在37℃下在具有amp和cam的lb中生长过夜。
562、2.bspei-hf的诱变
563、所有残基cys、asp、glu、gly、his、lys、asn、pro、gln、arg、ser、thr在以下位置变成ala:7、8、10、11、12、13、14、17、19、20、21、22、23、27、30、31、33、34、35、36、37、39、42、43、44、45、46、48、49、51、52、53、54、55、56、58、59、60、62、63、64、66、67、68、71、72、73、74、75、78、79、81、82、84、85、88、89、91、92、93、94、95、96、98、101、102、103、106、107、108、110、111、113、114、115、117、121、122、124、126、127、128、129、132、133、135、136、137、138、140、141、148、149、151、153、155、156、157、160、162、164、166、167、168、169、172、174、175、176、177、178、182、183、184、185、186、187、189、192、193、195、196、197、198、199、200、201、203、204、208、209、212、213、214、216、217、218、219、221、222、228、229、231、232、233、234、235、236、237、238、239、240、242、244、245、246、250、251、253、254、255、256、258、260、261、263、264、266、267、269、270、271、272、273、275、276、277、281、282、283、285、286、288、289、293、294。
564、诱变方法为用成对引物进行的反向pcr,接下来进行dpni消化。处理的产物然后转化入大肠杆菌菌株er3081。
565、3.bspei-hf的选择
566、利用未甲基化的λ(λ-)dna作为底物,用在neb3和neb4中的活性比较来完成bspei-hf的选择。wt bspei在neb3中更有活性,选择在neb4中更有活性的。发现6个突变体在neb4中更有活性:k7a、t10a、n11a、n14a、q232a和t199a。t199a在neb4中比wt具有高得多的活性。bspei(t199a)被命名为bspei-hf。
567、实施例35:工程化高保真性bamhi(另外的突变体)
568、bamhi(seq id no.35)识别g/gatcc并在g/gatcc处消化,如在国际公开号wo2009/009797的实施例1中所描述的。突变体bamhi(e163a/e167t)被选择作为高保真性形式的bamhi。
569、在bamhi上进行突变的完全覆盖。除了之前的专利和申请中报道的残基之外,剩下的残基在以下位置也被突变成ala:3、7、8、15、16、21、22、23、24、27、29、31、33、34、35、37、38、39、45、47、48、49、53、54、55、56、57、58、59、60、63、64、67、68、73、74、79、80、82、83、85、90、91、92、93、95、99、100、102、105、108、109、110、112、115、116、117、124、125、127、128、129、130、131、134、136、138、140、141、142、143、144、145、147、148、151、152、156、158、159、162、164、166、168、171、172、173、174、175、176、177、178、179、180、185、187、188、189、190、191、192、194、197、198、203、206、210和212。
570、在这些突变体中,p92a、p144a、g197a和m198a比野生型bamhi具有更高的保真性。p92a可以是可选的高保真性bamhi。
- 还没有人留言评论。精彩留言会获得点赞!