一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法
1.本发明属于生物工程技术领域,尤其涉及一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法。
背景技术:
2.目前,类胡萝卜素产业具有强大的发展潜力,其中叶黄素(lutein)被认为是具有各种医疗保健应用的商业类胡萝卜素之一。叶黄素是含氧类胡萝卜素——类叶黄素(xanthophyl)中的一种,广泛存在于花卉、水果、蔬菜、藻类以及一些光合细菌和真菌中。叶黄素具有较强的抗氧化活性和稳定的着色能力,在医药和食品等行业中被广泛应用。目前叶黄素的商业化生产以万寿菊为基础,然而大规模的万寿菊栽培,存在占地面积大、生产效率低等问题,而且受到季节、气候以及地域等条件的限制。寻找和开发新的叶黄素来源以及如何提高现有叶黄素源的利用率成为当前的研究热点。由于微藻中更高的叶黄素含量、生长速度,具有易于进行规模化培养、不受季节变化影响以及生物质综合利用等多方面的优势,微藻被认为是生产叶黄素的潜力来源。
3.目前研究者们在叶黄素高产藻种筛选、生物合成代谢调控、培养参数优化及提取工艺等方面都取得了较大进展。但是微藻细胞中的叶黄素含量仍相对偏低。近年来,植物激素由于其对藻类的细胞内代谢具有积极的调节作用被用于改善微藻中类胡萝卜素的生物合成。因此,外源添加植物激素可能是一种提高微藻中叶黄素产量的可行策略。
4.褪黑素(mt)是色氨酸的天然衍生物,存在于藻类、微生物和高等植物中。作为一种植物激素,褪黑素可以在植物和微藻的各种生化途径中发挥功能,包括参与改善生理过程、激活抗氧化系统、缓解非生物胁迫、调节不同的代谢途径等。同时,褪黑激素作为一种植物主调节器,可以调节不同的植物激素水平,其中,乙烯受内部信号调节,以响应包括生物和非生物胁迫在内的环境刺激,而乙烯的生物合成可能介导激活类胡萝卜素生物合成。已有研究发现,在不利条件下,外源添加乙烯促进剂—乙烯利(ethephon)可以提高微藻的虾青素含量和脂质含量。但乙烯利对微藻叶黄素合成的影响尚不清楚。
5.通过上述分析,现有技术存在的问题及缺陷为:微藻细胞中的叶黄素含量仍相对偏低,后续研究应致力于如何提高产率、降低成本,且现有技术中乙烯利对微藻叶黄素合成的影响尚不清楚。
技术实现要素:
6.针对现有技术存在的问题,本发明提供了一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法。
7.本发明是这样实现的,一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法包括:培养栅藻到达对数生长期作为诱导种子液;用无水乙醇配制浓度100mmol/l的褪黑素母液,用纯水配制浓度10g/l的乙烯利母液,将褪黑素母液和乙烯利母液添加到种子液中;将种子液接种到鼓泡塔式光生物反应
器中,诱导藻细胞积累叶黄素。
8.进一步,利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法包括以下步骤:
9.步骤一,种子液的制备:使用bg-11液体培养基培养栅藻到达对数生长期,收集藻细胞,用灭菌后的bg-11培养基稀释重悬浮藻液作为诱导种子液;
10.步骤二,母液的配置:用无水乙醇配制褪黑素母液,用纯水配制乙烯利母液,在超净台中,将褪黑素母液和乙烯利母液添加到诱导种子液中,稀释褪黑素浓度为7.5μm,稀释乙烯利浓度为10-40mg/l,得到最终的培养液;
11.步骤三,诱导栅藻积累叶黄素:将最终的培养液接种到鼓泡塔式光生物反应器中并持续鼓入无菌空气,置于冷光灯照下培养,诱导藻细胞积累叶黄素。
12.进一步,步骤一中,在温度为25℃,光强为2400~2500lux条件下培养栅藻。
13.进一步,步骤一中的栅藻采用栅藻菌株acutodesmus sp.hlgy。
14.进一步,栅藻菌株acutodesmus sp.hlgy为ncbi:mw383261。
15.进一步,步骤一中,用bg-11培养基稀释重悬浮藻液至0.05g/l作为种子液。
16.进一步,步骤二中的褪黑素母液浓度为100mmol/l,乙烯利母液浓度为10g/l。
17.进一步,步骤三中,将最终的培养液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气。
18.进一步,步骤三中的培养条件为:置于冷光灯照下25℃培养7天。
19.进一步,步骤三中的光照强度为15000lux。
20.结合上述的技术方案和解决的技术问题,本发明所要保护的技术方案所具备的优点及积极效果为:
21.第一,针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
22.本发明提供了一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,培养栅藻到达对数生长期,作为诱导种子液;用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液和乙烯利母液添加到种子液中;将该种子液接种到鼓泡塔式光生物反应器中,诱导藻细胞积累叶黄素。本发明的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法简单易行,能大幅提高栅藻中叶黄素含量,从而提高叶黄素的产率。
23.本发明在褪黑素条件下又添加乙烯利可有效促进微藻细胞中叶黄素的积累,藻细胞中叶黄素含量有较大幅度的提升,最高叶黄素含量达到20.49mg/g,是比对照组的1.32倍,从而证明褪黑素联合乙烯利能够显著促进栅藻的叶黄素积累。
24.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
25.本发明提供了一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,利用褪黑素联合乙烯利条件可很大程度上提高叶黄素的产率。本发明简单易行,低投入、高产出,原材料为自己筛选的栅藻菌株,可按常规方法培养。同时也为利用微藻生产叶黄素提高了新的思路。
26.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
27.本发明的技术方案转化后的预期收益和商业价值为:
28.叶黄素是高价值-低产量的商业类胡萝卜素,并且这个市场仍在增长。在欧盟,叶黄素市场价值估计为2.55亿欧元,预计到2027年将达到4.05亿欧元。因此,本发明利用褪黑素联合乙烯利诱导微藻高产叶黄素,对于叶黄素的规模化生产,具有一定的经济社会效益。
附图说明
29.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
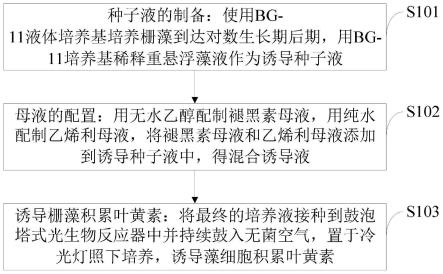
30.图1是本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法流程图;
31.图2是本发明实施例1、2、3、4和对比例提供的微藻的叶黄素含量示意图。
具体实施方式
32.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
33.针对现有技术存在的问题,本发明提供了一种利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,下面结合附图对本发明作详细的描述。
34.为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
35.如图1所示,本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法包括以下步骤:
36.s101,种子液的制备:使用bg-11液体培养基培养栅藻到达对数生长期,用bg-11培养基稀释重悬浮藻液作为诱导种子液;
37.s102,母液的配置:用无水乙醇配制褪黑素母液,用纯水配制乙烯利母液,将褪黑素母液和乙烯利母液添加到诱导种子液中,得最终的培养液;
38.s103,诱导栅藻积累叶黄素:将最终的培养液接种到鼓泡塔式光生物反应器中并持续鼓入无菌空气,置于冷光灯照下培养,诱导藻细胞积累叶黄素。
39.作为优选实施例,本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法具体包括以下步骤:
40.(1)种子液的制备:使用bg-11液体培养基,在温度为25℃,光强为2400~2500lux条件下培养栅藻,待栅藻生长至对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
41.(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液和乙烯利母液添加到步骤(1)的种子液中;将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯照下,25℃培养7天,诱导藻细胞积累叶黄素。
42.本发明实施例提供的步骤(1)中的栅藻为栅藻菌株acutodesmus sp.hlgy(ncbi:mw383261)。
43.本发明实施例提供的步骤(2)中的光照强度为15000lux。
44.为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
45.实施例1
46.本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,具体步骤如下:
47.(1)种子液的制备:使用bg-11液体培养基,在25℃,光强为2400~2500lux条件下培养栅藻,栅藻采用栅藻菌株acutodesmus sp.hlgy,培养到达对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
48.(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液添加到种子液中,褪黑素浓度达到7.5μm后停止添加褪黑素母液,将乙烯利母液添加到种子液中,乙烯利浓度达到10mg/l后停止添加乙烯利母液,然后将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯光照强度为15000lux,温度为28℃培养7天,诱导藻细胞积累叶黄素。
49.本发明实施例培养后的细胞液利用高效液相色谱法检测藻细胞中的叶黄素含量,其具体步骤为:
50.(1)将培养后的藻细胞悬浮液以3500
×
g离心5min,去上清,沉淀用蒸馏水洗涤2次,收集在50ml离心管中,在-80℃的真空冷冻干燥机中冷冻干燥24h直至获得恒重得到干藻粉质量;
51.(2)通过高效液相色谱(hplc)检测叶黄素含量:取0.01g冻干后的干藻粉与1ml 60%(v/v)氢氧化钾溶液一起研磨,匀浆液超声波处理20min,40℃水浴处理1h,加入乙醚萃取直至乙醚层无色,收集上清液,通过氮气流吹干,所得黄色沉淀溶解于1ml甲醇中,将20μl样品注入hplc中检测,洗脱梯度由洗脱液a(乙腈:甲醇=9:1,v:v)和洗脱液b(乙酸乙酯)组成,洗脱梯度1ml/min等梯度洗脱,检测波长445nm处的峰面积,30min进样一次;
52.(3)以叶黄素标准品浓度10、50、100、250、500μg/ml为横坐标,及每个标准品浓度对应波长445nm处的峰面积为纵坐标构建叶黄素标准曲线,得到叶黄素标准曲线:
53.y=76.23x+394.44(1)
54.其中,y为峰面积,mau.s;x为叶黄素浓度,mg/l,曲线拟合度r2=0.9978,说明标准曲线的拟合度高;将步骤(2)检测到的峰面积代入公式(1)叶黄素标准曲线中,即可得到叶黄素浓度c;
55.(4)用将步骤(3)得到的叶黄素浓度c代入以下公式计算栅藻叶黄素含量:
[0056][0057]
其中,c为叶黄素浓度,mg/l;v为定容体积,取1ml;m为干藻粉质量,g,检测过程为0.01g。
[0058]
检测结果:当褪黑素浓度为7.5μm、乙烯利浓度为10mg/l时,微藻的叶黄素含量最高为17.33mg/g。
[0059]
实施例2
[0060]
本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,具体步骤如下:
[0061]
(1)种子液的制备:使用bg-11液体培养基,在25℃,光强为2400~2500lux条件下培养栅藻,栅藻采用栅藻菌株acutodesmus sp.hlgy,培养到达对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
[0062]
(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液添加到种子液中,褪黑素浓度达到7.5μm后停止添加褪黑素母液,将乙烯利母液添加到种子液中,乙烯利浓度达到20mg/l后停止添加乙烯利母液,然后将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯光照强度为15000lux,温度为28℃培养7天,诱导藻细胞积累叶黄素。
[0063]
按照本发明实施例1的方法进行检测的结果:当褪黑素浓度为7.5μm、乙烯利浓度为20mg/l时,微藻的叶黄素含量最高为18.37mg/g。
[0064]
实施例3
[0065]
本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,具体步骤如下:
[0066]
(1)种子液的制备:使用bg-11液体培养基,在25℃,光强为2400~2500lux条件下培养栅藻,栅藻采用栅藻菌株acutodesmus sp.hlgy,培养到达对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
[0067]
(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液添加到种子液中,褪黑素浓度达到7.5μm后停止添加褪黑素母液,将乙烯利母液添加到种子液中,乙烯利浓度达到20mg/l后停止添加乙烯利母液,然后将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯光照强度为15000lux,温度为28℃培养7天,诱导藻细胞积累叶黄素。
[0068]
按照本发明实施例1的方法进行检测的结果:当褪黑素浓度为7.5μm、乙烯利浓度为30mg/l时,微藻的叶黄素含量最高为20.68mg/g。
[0069]
实施例4
[0070]
本发明实施例提供的利用褪黑素联合乙烯利促进栅藻积累叶黄素的方法,具体步骤如下:
[0071]
(1)种子液的制备:使用bg-11液体培养基,在25℃,光强为2400~2500lux条件下培养栅藻,栅藻采用栅藻菌株acutodesmus sp.hlgy,培养到达对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
[0072]
(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,用纯水配制浓度为10g/l的乙烯利母液,将褪黑素母液添加到种子液中,褪黑素浓度达到7.5μm后停止添加褪黑素母液,将乙烯利母液添加到种子液中,乙烯利浓度达到20mg/l后停止添加乙烯利母液,然后将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯光照强度为15000lux,温度为28℃培养7天,诱导藻细胞积累叶黄素。
[0073]
按照本发明实施例1的方法进行检测的结果:当褪黑素浓度为7.5μm、乙烯利浓度为40mg/l时,微藻的叶黄素含量最高为15.45mg/g。
[0074]
对比例
[0075]
(1)种子液的制备:使用bg-11液体培养基,在25℃,光强为2400~2500lux条件下培养栅藻,栅藻采用栅藻菌株acutodesmus sp.hlgy,培养到达对数生长期收集藻液,用bg-11培养基稀释重悬浮藻液至0.05g/l作为诱导种子液;
[0076]
(2)诱导栅藻积累叶黄素:用无水乙醇配制浓度为100mmol/l的褪黑素母液,将褪黑素母液添加到种子液中,褪黑素浓度达到7.5μm后停止添加褪黑素母液,然后将该种子液接种到鼓泡塔式光生物反应器中,持续鼓入0.1vvm的无菌空气,冷光灯光照强度为15000lux,温度为28℃培养7天,诱导藻细胞积累叶黄素。
[0077]
按照本发明实施例1的方法进行检测的结果:当褪黑素浓度为7.5μm、乙烯利浓度为0mg/l时,微藻的叶黄素含量最高为15.72mg/g。
[0078]
本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0079]
利用hplc测定对比例和实施例1~4中微藻的叶黄素含量,图2中的含量是每个实施例中的三个平行实验取均值,结果显示:实施例1、2、3中藻细胞叶黄素积累量均高于对比例中没有添加乙烯利的情况;但是实施例4当乙烯利浓度达到40mg/l时,乙烯利对微藻积累叶黄素没有促进作用,藻细胞积累叶黄素的量低于对比例中没有加入乙烯利的情况;当乙烯利浓度为10~30mg/l时,乙烯利对微藻积累叶黄素具有促进作用,在微藻培养的第5天,当乙烯利浓度为30mg/l时,微藻内叶黄素含量达到最大为20.68mg/g,是对照组的1.32倍。
[0080]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1