一种结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测试剂及其试剂盒和方法与流程
1.本发明涉及生物检测领域,具体而言,涉及一种结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测试剂及其试剂盒和方法。
背景技术:
2.结核病(tuberculosis,tb)是一种慢性传染性疾病,多发生在肺部,以肺结核最为常见。当普通肺结核患者治疗依从性不好、治疗方案不合理、消化系统吸收障碍等原因,导致体内的结核分枝杆菌变得更加厉害,不能被一种或多种抗结核药物所杀死(即对抗结核药物出现耐药)。如果病人感染的结核分枝杆菌对一种或一种以上的抗结核药物产生了耐药性,即为耐药结核病。据who/iuatld的最新耐药监测估计,在新病人中,10.2%的病人至少对一种抗结核药物耐药,1.1%为多重耐药结核(mdr-tb);在复治病人中,18.4%的病人至少对一种抗结核药物耐药,mdr-tb耐药率7.0%。多重耐药结核病为结核病的防治带来巨大的挑战。
3.氟喹诺酮类药物是人工合成药物,应用于耐药结核的临床治疗中,在治疗中起着核心的作用。氟喹诺酮类药物目前在临床上在尝试是否可以作为一线药物,缩短tb治疗的疗程,氟喹诺酮类药物在长期的一段时间都会被使用。它们的使用会伴随着抗药性的产生,需要发展早期、灵敏、准确的检测技术进行监测。
4.氟喹诺酮耐药肺结核需通过传统药物敏感性试验或是分子生物学快速检测技术来诊断。传统药物敏感性实验报告周期长达6~8周,不利于结核分枝杆菌感染的快速诊疗。
5.目前,市面上应用的结核耐药分子诊断试剂存在一些问题;例如,厦门致善生物的结核分枝杆菌耐药突变检测试剂,其专利(cn201110137832.4)发明不可区分氟喹诺酮耐药的具体突变位点类型;现有的结核耐药分子诊断试剂还存在检测时间长,成本高,检测灵敏度不高、特异性不强等问题。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供一种结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测试剂及其试剂盒和方法。
8.本发明是这样实现的:
9.第一方面,本发明实施例提供了一种核酸组合物,其包括:核苷酸序列如seq id no.1~2所示的引物对。
10.可选地,所述核酸组合物还包括探针,探针的核苷酸序列如seq idno.3。
11.可选地,所述探针5’端有1~5个与靶标不配对的碱基序列。
12.第二方面,本发明实施例提供了一种检测试剂,其包括前述实施例所述的核酸组合物。
13.第三方面,本发明实施例提供了一种检测试剂盒,其包括前述实施例所述的核酸组合物或前述实施例所述的检测试剂。
14.第四方面,本发明实施例提供了如前述实施例所述的核酸组合物在制备结核分枝杆菌氟喹诺酮类药物耐药性或结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测试剂或试剂盒中的应用。
15.第五方面,本发明实施例提供了一种结核分枝杆菌氟喹诺酮类药物耐药基因突变的分子检测方法,其包括:采用前述实施例所述的核酸组合物或前述实施例所述的检测试剂或前述实施例所述的检测试剂盒对样本进行pcr检测,所述方法不以疾病的诊断或治疗为直接目的。
16.本发明具有以下有益效果:
17.本发明提供的引物探针组合用于检测氟喹诺酮类药物耐药性,扩增片段对氟喹诺酮类药物耐药基因突变的覆盖率均可达90%以上;并且采用了一种5’端特殊修饰的探针,能够检测并区分痰液、肺泡灌洗液或分离培养物样本中结核分枝杆菌gyra基因的a90v、d94g、d94a和d94n四种氟喹诺酮耐药突变;根据临床经验,初步判断具体突变位点及类型在临床中出现的耐药情况(耐药基因类型及浓度),为结核分枝杆菌感染的患者提供更为准确科学的辅助诊疗依据。
附图说明
18.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
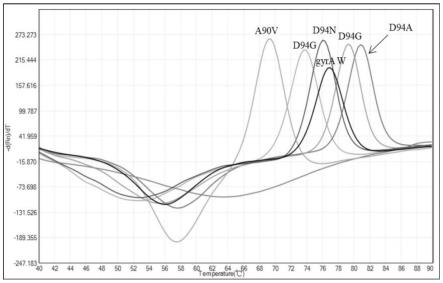
19.图1为gyra基因a90v、d94g、d94a和d94n四种耐药突变基因检测结果;
20.图2为5’端有2个翘尾碱基的探针与普通探针的比较结果;
21.图3为5’端有5个翘尾碱基的探针与普通探针的比较结果;
22.图4为gyra a90v突变位点检出比例考察;
23.图5为gyra d94g突变位点检出比例考察;
24.图6为gyra d94a突变位点检出比例考察;
25.图7为gyra d94n突变位点检出比例考察;
26.图8为gyra w野生(敏感型)最低检测限考察;
27.图9为gyra a90v最低检测限考察;
28.图10为gyra d94g最低检测限考察;
29.图11为gyra d94a最低检测限考察;
30.图12为gyra d94n最低检测限考察。
具体实施方式
31.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产
品。
32.首先,本发明实施例提供了一种核酸组合物,其包括:核苷酸序列如seq id no.1~2所示的引物对。
33.本发明提供的引物对覆盖了氟喹诺酮类药物耐基因gyra基因的90和94两个氨基酸位点,可用于检测以下至少一种突变位点:gyra a90v、gyra d94g、gyra d94a和gyra d94n,相对于现有的其他引物组合而言,本发明的引物对具有更好的检测特异性和灵敏度。
34.在一些实施例中,所述核酸组合物还包括用于检测gyra基因a90v、d94g、d94a和d94n中的至少一种突变位点的探针。
35.可选地,所述探针的核苷酸序列如seq id no.3所示。
36.在一些实施例中,该探针的5’端引入了1~5个与靶标序列不配对的碱基序列,使得dna聚合酶无法水解5’翘尾探针,进而达到节约探针用量,提高荧光信号的目的。
37.优选地,所述探针的核苷酸序列如seq id no.4或seq id no.5所示。
38.本发明提供的探针可检测并区分gyra基因a90v、d94g、d94a、d94n四种耐药突变,在3小时内快速鉴定结核分枝杆菌感染患者是否存在氟喹诺酮类药物耐药情况,并可根据检测结果判读出的具体突变类型,初步确定感染者对氟喹诺酮类药物耐药类型及耐药浓度等。
39.在一些实施例中,所述探针的5’端连接有荧光报告基团,3’端连接有荧光淬灭基团。
40.在一些实施例中,所述荧光报告基团选自:5-fam、6-fam、hex、tet、vic、joe、cy3、cy3.5、ned、tamra、rox、texas red、cy5、cy5.5和quasar670中的任意一种。
41.在一些实施例中,所述荧光淬灭基团选自:tamra、bhq1、bhq2、bhq3和mgb中的任意一种。
42.在一些实施例中,上游引物和下游引物的摩尔比为1:(1~10)。具体地,该摩尔比可以为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9和1:10中的任意一种或任意两种之间的范围。
43.另一方面,本发明实施例提供了一种检测试剂,其包括前述任意实施例所述的核酸组合物。
44.在一些实施例中,所述检测试剂用于检测结核分枝杆菌氟喹诺酮类药物耐药性或结核分枝杆菌氟喹诺酮类药物耐药基因突变。
45.另一方面,本发明实施例提供了一种检测试剂盒,其包括前述任意实施例所述的核酸组合物或前述任意实施例所述的检测试剂。
46.在一些实施例中,所述试剂盒还包括:pcr检测试剂。
47.在一些实施例中,所述pcr检测试剂包括:pcr反应缓冲液、taq酶、镁离子、dntp和水中的至少一种。
48.另一方面,本发明实施例提供了如前述任意实施例所述的核酸组合物在制备结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测试剂或试剂盒中的应用。
49.此外,本发明实施例还提供了一种结核分枝杆菌氟喹诺酮类药物耐药基因突变的检测方法,其包括:采用前述任意实施例所述的核酸组合物或前述任意实施例所述的检测试剂或前述任意实施例所述的检测试剂盒对样本进行pcr检测。
50.在一些实施例中,所述检测方法不以疾病的诊断或治疗为直接目的。
51.在一些实施例中,所述检测方法通过荧光pcr溶解曲线法对检测结果进行判断:根据各通道检测的tm值和溶解峰判断是否发生对应的突变。
52.本发明通过对氟喹诺酮类药物耐药聚决定区gyra基因序列分析并设计出可针对耐药基因突变检测的引物探针组合,同时采用不对称pcr扩增法并结合荧光pcr-溶解曲线法在一个反应体系中同时实现检测包含a90v、d94g、d94a和d94n四种耐药突变基因的pcr反应体系。该方法具有检测时间短,成本低,检测灵敏度高、特异性强等优点,且结果判定便利且直观,可实现耐药性和耐药基因突变的有效检测。
53.在一些实施例中,进行pcr检测时,所述上游引物和所述下游引物的摩尔比为1:(1~10)。该摩尔比具体可以同前述任意实施例所述。
54.在一些实施例中,进行pcr检测时,上游引物和下游引物的作用浓度独立地为0.01~1μm,作用浓度具体可以为0.01μm、0.05μm、0.1μm、0.2μm、0.4μm、0.6μm、0.8μm和1μm中的任意一种或任意两种之间的范围,优选为0.04~0.4μm。
55.在一些实施例中,进行pcr检测时,探针的作用浓度为0.1~0.5μm,具体可以为0.1μm、0.2μm、0.3μm、0.4μm和0.5μm中的任意一种或任意两种之间的范围。
56.在一些实施例中,所述pcr的反应程序如下:94~96℃4.8~5.2min;94~96℃10~20s,58~62℃,收集荧光信号15~25s,70~74℃15~25s,45~50个循环;94~96℃0.8~1.2min,33~37℃2~3min;35~90℃,每0.04℃/s持续收集荧光信号。
57.在一些实施例中,进行pcr检测时,dntp的作用浓度为0.1~5mm,具体可以为0.1mm、0.5mm、1mm、2mm、3mm、4mm和5mm中的任意一种或任意两种之间的范围。
58.在一些实施例中,进行pcr检测时,taq酶的作用浓度为0.01u、0.02u、0.04u、0.06u、0.08u、0.1u、0.2u、0.4u、0.6u、0.8u和1.0u中的任意一种或任意两种之间的范围。
59.在一些实施例中,样本可以为核酸样本、含核酸样本的环境样本或人工配置的样本(比如阴性对照或阳性对照)。
60.以下结合实施例对本发明的特征和性能作进一步的详细描述。
61.实施例1
62.氟喹诺酮类药物突变基因检测试剂引物探针的设计方法。
63.其技术原理为:探针在游离转态下呈柔性状态,荧光基团与淬灭基团较为靠近,荧光基团的荧光被淬灭,此时检测不到荧光。当靶序列存在时,探针可与靶序列互补,发光基团与淬灭基团由因伸展而远离,荧光基团的荧光无法被淬灭基团淬灭,此时就可以检测到荧光信号。在熔解分析的检测过程中,随着温度的升高,探针与靶序列呈现由完全结合到解离的过程,因此可以通过熔点的差异识别探针与靶序列的匹配程度。另外当同一个通道检测不同突变位点时,需把不同的检测探针的tm值设计为5~10度的差值。
64.使用ncbi数据库搜索相关基因序列,根据结核分枝杆菌氟喹诺酮类药物耐药决定区gyra基因设计引物探针,用软件oligo 7设计引物和探针,避免产生二级结构和核酸序列间的相互配对而导致的非特异性扩增或扩增效率低下的问题。引物在探针两端,探针覆盖gyra a90v、d94g、d94a、d94n和位点。探针采用5’翘尾的特殊设计,即在探针5’端引入1~5个与靶标序列不配对的碱基序列,避免探针发生水解反应。
65.探针采用荧光报告基团和荧光淬灭基团修饰。
66.氟喹诺酮类药物突变基因检测试剂引物和探针的序列如下。
67.表1引物探针序列
[0068][0069][0070]
备注:primer为引物,f为上游引物,r为下游引物,probe为探针;probe-p1的5’端(加粗)的ta碱基为与靶标不配对的2个翘尾碱基;
[0071]
probe-p2的5’端(加粗)的tatat碱基为引入的5个翘尾碱基。
[0072]
实施例2
[0073]
一种结核分枝杆菌氟喹诺酮类药物耐药性或耐药基因突变的检测试剂,具体包括如下。
[0074]
1、引物和探针的组合如下所示。
[0075][0076]
2、pcr反应液包含:pcr反应缓冲液,0.1mmol/l~0.5mmol/l脱氧核糖核苷三磷酸,靶标基因的上游引物以及下游引物0.1μmol/l~1μmol/l,正反引物比例为1:10,靶标基因的探针0.1μmol/l~1μmol/l,0.005u/μl~0.05u/μl taq dna聚合酶。具体试剂按照下表配置如下。
[0077][0078][0079]
本组合可检测出单管检测gyra a90v、d94g、d94a、d94n四种耐药突变基因及其不
同突变组合。检测结果如附图1所示。
[0080]
实施例3
[0081]
一种结核分枝杆菌氟喹诺酮类药物耐药性或耐药基因突变的检测方法,其包括以下步骤。
[0082]
1.样本采集:结核分枝杆菌培养物。
[0083]
2.样本前处理:
[0084]
2.1痰液处理方式:样本和液化液1:1混合进行液化,直到样品达到所需的流动性。取200μl液化液用于后续核酸提取。
[0085]
2.2结核分枝杆菌分离培养物处理方式:
[0086]
固体培养基上生长的结核分枝杆菌,用22swg标准接种环收集细菌1环,并重悬于200μl tb dna提取液中用于后续核酸提取。
[0087]
液体培养基中生长的结核分枝杆菌取1ml,12000rpm离心15min,丢弃上清,沉淀物重悬于200μl tb dna提取液中,用于后续核酸提取。
[0088]
2.3肺泡灌洗液处理方式:取1~5ml肺泡灌洗液,以10000rpm离心1分钟,弃上清,沉淀物重悬于200μl tb dna提取液中用于后续核酸提取。
[0089]
3.样本核酸提取:
[0090]
可使用商业化核酸dna提取试剂盒(如qiagen dna mini kit等),提取过程应按照商业试剂盒的说明书进行操作,纯化后的核酸可用于后续pcr扩增。
[0091]
本实施例采用qiagen dna mini kit,具体操作步骤如下:
[0092]
3.1向已装有样本处理液200μl的1.5mlep管中加入180μl buffer atl和20μl蛋白酶k,涡旋震荡10s后孵育10min。
[0093]
3.2前述ep管中加入200μl buffer al。混合均匀涡旋振荡15s。
[0094]
3.3 70℃孵育10min。加入200μl酒精(95%-100%)涡旋振荡15s。短暂离心后,将上清移至qiaamp微型柱中,并将微型柱置于2ml收集管中,盖上盖子。
[0095]
3.4将上述收集管6000
×
g离心1min。将旧的收集管与滤液一起丢弃。
[0096]
3.5将qiaamp微型柱置于新的2ml收集管中。向qiaamp微型柱中加500μl缓冲液aw1。盖上盖子,6000
×
g离心1min。将旧的收集管与滤液一起丢弃;
[0097]
3.6将qiaamp微型柱置于新的2ml收集管中。向qiaamp微型柱中加500μl缓冲液aw2。盖上盖子,20000
×
g离心3min。
[0098]
3.7将qiaamp微型柱放入一个新的2毫升收集管,并将旧的收集管与滤液一起丢弃。以6000
×
g离心1分钟。
[0099]
3.8将qiaamp微型柱置于干净的1.5ml ep管中。丢弃含有滤液的旧收集管。小心打开盖子并添加200μl缓冲液ae。盖上盖子,然后室温静置1分钟。
[0100]
3.9以8000rpm离心1分钟。丢弃qiaamp微型柱,保留含有洗脱液的ep管,后续可用于pcr扩增。
[0101]
3.试剂加样:
[0102]
3.1按照实施例2配置的检测试剂,取20μl的pcr试剂加入到pcr管中;
[0103]
3.2取5μl提取的核酸加入到pcr扩增体系中,混匀,盖上pcr管盖子,待上机。
[0104]
4.pcr扩增程序设置及运行:
[0105]
4.1在荧光定量pcr仪器如roche lightcycler 480,slan-96p等上进行pcr扩增。
[0106]
4.2打开仪器,放入待检测的pcr管。
[0107]
4.3设置扩增程序。选择相应的荧光通道fam通道(reporter:fam,quencher:none)。进行样本编辑。
[0108]
4.4运行扩增程序。
[0109]
4.5具体扩增程序如下:
[0110]
第一步:95℃5min;
[0111]
第二步:95℃15s,55℃30s,72℃30s,50个循环,55℃30s处收集荧光信号;
[0112]
第五步:40~90℃持续收集荧光信号,荧光通道选用fam。
[0113]
5.结果分析:
[0114]
5.1反应结束后,仪器自动保存结果,可以利用仪器自带的软件进行自动分析。
[0115]
5.2通过比较所检测样品与野生对照之间熔解曲线熔点(tm)的差异,判断样品是否发生突变;当检测样品的熔点与野生对照的熔点差值δtm≤
±
1℃时判定为野生型;4个通道中任一通道中检测样品的熔点与野生对照熔点差值δtm≥
±
2℃时判定为耐药突变型,再根据相应通道与野生型熔点的差值,判断具体耐药突变位点信息。
[0116]
6.结果判读:
[0117]
检测结果具体判读规则可参照下表:
[0118]
样本类型fam结果判读野生对照74.20
±
1℃敏感株阴性对照
‑‑
gyra a90v-8.42氟喹诺酮类药物耐药gyra d94g+2.91氟喹诺酮类药物耐药gyra d94a+4.67氟喹诺酮类药物耐药gyra d94n-3.52氟喹诺酮类药物耐药
[0119]
注:1
“‑”
表示无信号;2“\”表示该项无参考意义;
[0120]
实施例4
[0121]
本实施例提供5’翘尾设计探针和无5’翘尾设计探针使用效果的比较。
[0122]
1.设计普通探针、翘尾探针1和翘尾探针2,其核酸序列分别为seq idno.3、seq id no.4和seq id no.5。
[0123]
2.采用实施例3的方法对野生型和gyra a90v、d94g、d94a、d94n突变位点进行检测。
[0124]
3.检测结果显示,采用翘尾探针1和翘尾探针2的检测效果均优于普通探针的检测效果。检测结果如附图2、图3所示。
[0125]
实施例5
[0126]
本实施例用质粒模拟临床样本,考察不同突变位点在混合模板条件下的检出比例,及不同突变位点的最低检测限。
[0127]
1.将野生型质粒gyra w与gyra a90v、d94g、d94a、d94n突变型质粒稀释至工作浓度1
×
105cp/μl,利用不同体积的野生型质粒与突变型质粒混合,按照0%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的突变比例制备成不同的混合样本。
[0128]
2.将gyra基因的野生型、a90v、d94g、d94a、d94n突变型质粒稀释至工作浓度1
×
107cp/μl、1
×
106cp/μl、1
×
105cp/μl、1
×
104cp/μl、1
×
103cp/μl不同浓度的样本。
[0129]
3.按实施例3的方法对上述不同样本进行扩增,并进行溶解曲线分析,考察不同突变型样本的最低检出比例及检测限。
[0130]
4.结果显示,gyra基因的a90v最低检测比例为5%、d94g最低检测比例为30%、d94a最低检测比例为5%、d94n最低检测比例为20%。检测结果如附图4~7所示。
[0131]
5.结果显示,gyra基因a90v、d94g、d94a、d94n四种耐药突变基因最低检测限均为1x10
4 cp/ml。检测结果如附图8~12所示。
[0132]
实施例6
[0133]
一种结核分枝杆菌培养物进行氟喹诺酮类药物耐药基因突变核酸检测方法的临床应用实例。
[0134]
1.在成都市公共卫生临床医疗中心收集结核分枝杆菌感染患者的痰液培养物共计26例,同时与培养法药敏试验结果进行比对,样本排除其他类型耐药株。
[0135]
2.氟喹诺酮类药物基因核酸检测按照实施例3的方法进行检测。检测结果如下:
[0136]
本实施例收集的痰液样本共计26例,其中氟喹诺酮类药物耐药样本为7例,氟喹诺酮类药物耐药未检出样本1例,敏感样本18例。其中差异结果样本经测序进行验证,结果表明该样本为氟喹诺酮类药物耐药稀有突变位点,不包含在本发明检测范围内。
[0137]
临床样本检测结果统计如下表:
[0138][0139]
综上所述,本发明方法与药敏法比较,操作简单,耗时短,准确性较好,该方法可满足结核分枝杆菌氟喹诺酮类药物突变基因检测在临床辅助诊断的要求。
[0140]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1