检测ATF3表达量的试剂在制备高尿酸血症肾脏病筛查试剂盒中的用途
检测atf3表达量的试剂在制备高尿酸血症肾脏病筛查试剂盒中的用途
技术领域
1.本发明属于诊断试剂盒技术领域,具体涉及检测atf3表达量的试剂在制备高尿酸血症肾脏病筛查试剂盒中的用途。
背景技术:
2.高尿酸血症肾脏病(hyperuricemia nephropathy,hn)人群发病率在5.46%-19.30%,患病人数众多且发病人群趋于年轻化,成为继糖尿病之后的第二大代谢病。血液中升高的尿酸及沉积在肾脏中的尿酸结晶可破坏肾脏结构,影响肾脏功能,最终导致尿酸性肾脏病。肾间质纤维化是高尿酸血症肾脏病最为典型的病理改变,也是疾病进展至终末期最常见病理学途径之一,表观遗传调控机制在肾脏纤维化进程中发挥了重要作用。因此,利用多组学技术手段,挖掘高尿酸血症肾脏病关键致病因子,对高尿酸血症肾脏病的准确的诊断,寻找新的药物干预靶点,阻断肾间质纤维化发展,治疗高尿酸血症肾脏病,具有潜在的应用价值。
3.目前,高尿酸血症肾脏病诊断标准包括:为高尿酸血症,男性血尿酸水平>420μmol/l,女性在360μmol/l以上;对于肾脏损伤需要检查尿常规、肾脏结构,以及肾功能,如肾脏肾小球滤过率、血肌酐、血尿素氮的异常。其诊断需要根据多个指标进行综合研判,而由于血尿酸水平和肾损伤的相关指标还受到其他疾病的影响,因此为了提高高尿酸血症肾脏病的诊断准确性,仍然有必要开发更多的诊断指标。
4.转录激活因子3(atf3)是常见的应激反应基因,在机体遭受刺激损伤时表达快速升高,参与多种疾病细胞免疫、炎症反应、器官纤维化等病理过程。目前,atf3与高尿酸血症肾脏病的关联尚未见到任何文献报道。
技术实现要素:
5.针对现有技术的问题,本发明提供检测atf3表达量的试剂在制备高尿酸血症肾脏病筛查试剂盒中的用途,为高尿酸血症肾脏病的诊断提供新的筛查指标。
6.检测atf3表达量的试剂在制备高尿酸血症肾脏病筛查试剂盒中的用途。
7.优选的,所述atf3的gene id为ensg00000162772。
8.优选的,所述试剂包括:
9.easyspin plus组织/细胞rna快速提取试剂、
10.hiscript iii rt supermix for qpcr、
11.chamq sybr color qpcr master mix、
12.atf3引物序列。
13.优选的,所述atf3引物序列包括正向引物和反向引物,所述正向引物的核苷酸序列如seq id no.1所示,所述反向引物的核苷酸序列如seq id no.2所示。
14.优选的,所述高尿酸血症肾脏病具有肾小管损伤或肾间质纤维化中的至少一种症
状。
15.本发明的发明人团队在前期研究工作中发现,小鼠在高尿酸血症肾脏病疾病状态下差异变化的组蛋白修饰位点上存在大量转录因子的富集。因此本发明提出了充分利用致病因子基于tad重塑的调控机制,并整合多组学数据,加入转录因子基序富集分析,从而提出了一种新的方法来识别新型的高尿酸血症肾脏病致病因子。基于该方法,本发明首次通过实验筛选出atf3是高尿酸血症肾脏病的致病因子,因此通过对受试者atf3的表达量进行检测,可对其是否患有高尿酸血症肾脏病进行初步筛查。本发明为高尿酸血症肾脏病的诊断提供了一种新的指标,有利于高尿酸血症肾脏病的准确诊断,具有较好的应用前景。
16.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
17.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
18.图1为本发明挖掘筛选新的高尿酸血症肾脏致病因子流程示意图,其中,tad:拓扑相关结构域;pei:增强子与启动子互作;p:启动子;b:边界;e:增强子。
19.图2为各种检测方法挖掘现有技术中已知致病因子的准确度。
20.图3为野生型小鼠正常对照组和野生型小鼠高尿酸血症肾脏病组小鼠肾脏多组学测序结果。
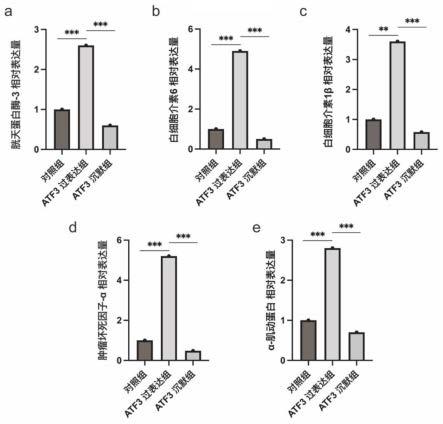
21.图4为在tcmk-1细胞中分过表达或沉默atf3后肾脏炎症标志物(a.胱天蛋白酶3;b.白细胞介素6;c.白细胞介素1β.)、肾损伤标志物(d.肿瘤坏死因子-α)、肾纤维化指标(e.α-肌动蛋白)基因表达量变化结果。
22.图5为致病因子atf3在四组小鼠肾脏中的表达量。
23.图6为体内敲除atf3前后小鼠肾脏内atf3及肾纤维化标志物(fn:纤维粘连蛋白;col i:胶原蛋白i;gapdh:甘油醛-3-磷酸脱氢酶)wb检测结果。分组为wt c:野生型小鼠对照组;wt m:野生型小鼠高尿酸血症肾病模型组;atf3 ko c:atf3基因敲除小鼠对照组;atf3 ko m:atf3基因敲除小鼠高尿酸血症肾病模型组;
24.图7为体内敲除atf3前后四组小鼠尿酸(ua)水平检测结果。
25.图8为体内敲除atf3前后后四组小鼠肌酐(scr)水平检测结果。
26.图9为四组小鼠肾脏病理(masson染色及pas染色)检测结果。
具体实施方式
27.需要特别说明的是,实施例中未具体说明的数据采集、传输、储存和处理等步骤的算法,以及未具体说明的硬件结构、电路连接等均可通过现有技术已公开的内容实现。
28.实施例1高尿酸血症肾脏病的筛查试剂盒
29.本实施例提供一种检测人的肾组织、动物肾组织及细胞样本中atf3表达量的试剂盒,其组成为:
30.1.easyspin plus组织/细胞rna快速提取试剂;
31.2.hiscript iii rt supermix for qpcr;
32.3.chamq sybr color qpcr master mix;
33.4.atf3引物序列。
34.其中,atf3引物序列具体如下:
35.正向引物(seq id no.1):5'-cctctgcgctggaatcagtc-3';
36.反向引物(seq id no.2):5'-ttctttctcgtcgcctcttttt-3'。
37.上述试剂盒的使用方法为:
38.1.利用easyspin plus组织/细胞rna快速提取试剂,经过裂解细胞,灭活细胞rna酶,清除dna,漂洗离心去除蛋白液及细胞代谢物等步骤,获取待检肾组织或细胞中的rna;
39.2.使用hiscript iii rt supermix for qpcr中的4x g dna wiper与5x hiscript iii qrt supermix先后加入获取的rna中,去除基因组dna并配制成逆转录反应体系在pcr仪上进行逆转录反应,将rna逆转为cdna待检测;
40.3.使用chamq sybr color qpcr master mix按照chamq sybr color qpcr master mix:rnase freeh2o:atf3 forward primer:atf3 reverse primer=5:3:0.5:0.5的比例配置qpcr混合液,pcr点样板每孔9ul混合液加入1ul cdna上机检测atf3表达量。
41.通过上述试剂盒检测受试者的atf3表达量,可对受试者患有高尿酸血症肾脏病的风险进行筛查,atf3表达量可作为指标之一,对受试者是否患有高尿酸血症肾脏病进行诊断。
42.下面通过实验例对本发明的技术方案作进一步的说明。
43.需要特别说明的是,由于实验例中实验对象为小鼠,因此检测atf3表达量所用的试剂中,atf3引物序列与实施例1不同,小鼠的atf3引物序列如下:
44.正向引物(seq id no.3):5'-tttgctaacctgacaccctttg-3';
45.反向引物(seq id no.4):5'-agaggacatccgatggcaga-3'。
46.实验例1高尿酸血症肾脏病致病因子atf3的预筛选和实验验证
47.一、实验方法
48.1、预筛选方法和系统
49.高尿酸血症肾脏病致病因子预筛选系统包括:
50.数据获取模块,用于对高尿酸血症肾脏病动物模型进行检测得到检测结果;检测包括in situ hic、hichip、chip-seq和rna-seq检测。
51.数据分析模块,用于对高尿酸血症肾脏病致病因子预筛选方法对检测结果进行分析;
52.数据输出模块,用于输出数据分析模块的分析结果。
53.其中,数据分析模块进行高尿酸血症肾脏病致病因子预筛选方法流程示意如图1所示,包括以下步骤:
54.步骤1,对高尿酸血症肾脏病小鼠模型进行in situ hic、hichip、chip-seq和rna-seq检测;
55.这四种检测都属于现有技术,具体的:
56.rna-seq技术:核糖核酸测序,简称rna测序。首先提取生物样品的全部转录的rna,然后反转录为c-dna后进行的二代高通量测序,在此基础上进行片段的重叠组装,从而可得
到一个个的转录本。在本专利中,主要用于找差异表达的基因,并且将这些差异表达基因作为致病因子的候选。
57.chip-seq技术:染色质免疫沉淀测序,简称chip-seq。此技术被用于分析蛋白质与dna的交互作用。该技术将染色质免疫沉淀(chip)与大规模并行dna测序结合起来以鉴定与dna相关蛋白的结合部位。该技术可被用于精确绘制任意目的蛋白在全基因组上的结合位点。
58.in situ hic技术:high-through chromosome conformation capture,是以整个细胞核为研究对象,利用高通量测序技术,结合生物信息分析方法,研究全基因组范围内整个染色质dna在空间位置上的关系,获得高分辨率的染色质调控元件相互作用图谱。因小鼠肾脏组织量有限,课题组通过对建库方法的优化,降低了对细胞数量的要求,同时建库、测序数据可靠性检验合格,克服了技术上的壁垒,使微量hic成为可能。
59.hichip技术:in situ hic followed by chromatin immunoprecipitation,是2016年出现的一种以蛋白为中心的染色质构象分析方法,其结合了hic技术和chia-pet技术,用更小的数据量获取更高分辨率的染色质三维结构信息。hichip通过裂解细胞前就在细胞核中交联,从而降低假阳性,最大化提高dna contact的捕获效率。然后收集细胞核,在原位产生hic交联,利用生物素标记dna末端。接着进行细胞核的裂解,超声打断dna,后续用特异性的抗体进行chip实验。得到dna蛋白复合物后,进行dna洗脱和反向交联。随后,进行生物素捕获hic交联和文库制备,上机测序。得到测序数据后数据预处理与hic类似,通过软件hichipper进行序列比对来鉴定被保护性因子所富集的loop,其中只有fdr《0.05的loop留作进一步分析。
60.步骤2,根据步骤1的检测结果分析转录因子是否为致病因子;
61.其中,确定因子为致病因子的标准是满足如下四个条件:
62.1)根据所述in situ hic检测的结果,所述因子在重组tad中受增强子调控;
63.2)根据所述in situ hic和hichip检测的结果,所述因子通过pax8环与增强子相互作用;
64.3)根据所述chip-seq检测的结果,所述因子及其增强子与pax8相结合;
65.4)根据所述rna-seq检测的结果,所述因子高表达。
66.确定所述因子高表达的标准是:
67.4.1)按照因子的表达量对所有因子排序,所述因子位于前10%;
68.4.2)与正常对照组动物模型相比,所述因子的表达量的变化大于等于10倍。
69.2、实验分组:
70.a组:野生型小鼠正常对照组(wt c);
71.b组:野生型小鼠高尿酸血症肾脏病组(wt m);
72.c组:atf3基因敲除小鼠正常对照组(atf3 ko c);
73.d组:atf3基因敲除小鼠高尿酸血症肾脏病组(atf3 ko m)。
74.3、实验过程
75.c57bl/6及atf3基因敲除鼠购买于集萃药康生物科技公司,将c57bl/6小鼠随机分配为a组(野生型小鼠正常对照组)和b组(野生型小鼠高尿酸血症肾脏病组),其中,b组为通过腺嘌呤(160mg/kg)和氧嗪酸钾(2400mg/kg)混合物连续灌喂21天诱导建立的高尿酸血症
肾脏病小鼠模型,实验结束后处死收取血、肾脏组织。各组小鼠均使用全自动生化分析仪检测血肌酐、尿素氮、血尿酸,pas、manson染色观察肾脏组织病理变化;利用western blot、pcr检测肾纤维化相关蛋白变化。rna-seq获取基因表达谱变化,go、kegg对差异基因进行功能富集分析,筛选肾纤维化相关基因;基于h3k27ac为抗体的chip-seq鉴定增强子功能状态;利用great软件匹配疾病特异增强子及差异表达基因相应调控关系,motif analysis挖掘上游参与调控增强子活性状态的关键致病因子。
76.通过上述第1部分的方法和系统进行分析,筛选得到致病因子。
77.此外,b组小鼠肾脏组织进行atf3为抗体的chip-seq获得疾病状态下基因组上结合位点,in situ hic明确基因组三维染色质结构,此外以atf3为抗体开展hichip以明确atf3对染色质三维构象的调控。最后,在c57bl/6背景的atf3基因敲除小鼠正常对照组(c组)与c57bl/6背景的atf3基因敲除小鼠高尿酸血症肾脏病组(d组),进行肾脏组织rna-seq与h3k27ac为抗体的chip-seq测序,并检测肾脏纤维化相关因子表达。利用co-ip筛选atf3互作蛋白,并设计引物进行chip-qpcr验证atf3对相应基因的调控。
78.二、实验结果
79.图2为利用实施例1的方法(hyperuricemia nephropathy-transcription factor mining analysis,hn-tfman)与其他几个技术(hic,hichip,chip-seq,rna-seq)对现有技术已知的致病因子进行筛选的性能比较结果,hn-tfman预筛选致病因子的准确度显著比其他几个技术更高。结果表明,本发明的方法预筛选致病因子的准确度较高。
80.通过实施例1提供的方法发现了11个致病因子(图3)。图3整合了a组和b组小鼠肾脏多组学测序数据,利用hn-tfman发现了11个潜在的高尿酸血症肾病致病因子。
81.图4在tcmk-1细胞中分别过表达或沉默11个因子中富集强度排分最靠前的致病因子(atf3),发现这种因子参与高尿酸血症肾病关键的炎症反应及纤维化过程,相较于正常对照组,过表达atf3时肾脏炎症标志物(a胱天蛋白酶3;b.白细胞介素6;c.白细胞介素1β)、肾损伤标志物(d.肿瘤坏死因子-α)、肾纤维化指标(e.α-肌动蛋白)基因表达量显著升高,相应的沉默atf3则观察到相反的作用。
82.图5为atf3基因敲除小鼠高尿酸血症肾脏病组(d组)与野生型小鼠高尿酸血症肾脏病组(b组)的qrt-pcr的结果,结果表明疾病状态下atf3表达升高。
83.图6为atf3基因敲除小鼠高尿酸血症肾脏病组(d组)与野生型小鼠高尿酸血症肾脏病组(b组)的wb结果,结果提示疾病状态下纤维化标志物fn、col i表达增高,进一步通过体内实验验证了atf3是参与高尿酸血症肾脏病肾纤维化的关键致病因子。
84.图7发现atf3基因敲除小鼠高尿酸血症肾脏病组(d组)相比野生型小鼠高尿酸血症肾脏病组(b组)的尿酸(ua)水平显著降低。
85.图8发现atf3基因敲除小鼠高尿酸血症肾脏病组(d组)相比野生型小鼠高尿酸血症肾脏病组(b组)的肌酐(scr)水平显著降低。
86.图9为小鼠肾脏病理检测结果,发现atf3的敲除(c组和d组)对肾小管损伤、肾间质纤维化有明显的改善作用。
87.综上所述,经过造模实验发现敲除atf3可有效缓解高尿酸血症肾脏病小鼠肾脏纤维化程度。由此可见,由实施例1预筛选出的高尿酸血症肾脏病致病因子atf3,经过实验验证得以确认其准确度和可靠度。
88.本实验例的结果表明,atf3是高尿酸血症肾脏病致病因子。
89.根据上述实施例和实验例,本发明实现了一种新的预筛选高尿酸血症肾脏病致病因子的方法,并基于该方法发现了一种新的高尿酸血症肾脏病致病因子atf3。由此可知,通过对受试者atf3的表达量进行检测,可对其是否患有高尿酸血症肾脏病进行筛查。本发明为高尿酸血症肾脏病的诊断提供了一种新的指标,有利于高尿酸血症肾脏病的准确诊断,具有很好的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1