一种具有选择性抗真菌作用的抗菌肽及其应用
1.本发明涉及抗菌新材料技术领域。更具体地,涉及一种具有选择性抗真菌作用的抗菌肽及其应用。
背景技术:
2.真菌感染是一种临床上常见的疾病,根据发病部位的不同可分为四类,分别为浅表感染、皮肤感染、皮下感染和侵袭性系统感染。其中以皮肤感染最为常见,如人们常说的足癣、头癣等,但其危害性相对较低;而侵袭性系统感染则最为严重,它会使病原体入侵人体的各个组织、器官,或在血液循环系统中进行散播感染,从而对机体造成严重的损伤并引起严重的炎性反应。尤其是近年来,伴随着抗生素、激素、免疫抑制剂等药物广泛使用、器官移植和导管介入等手术的推广应用、肿瘤患者的放化疗和新疗法、新型冠状病毒(covid-19)及其变异体的肆意蔓延等多种因素的影响,导致侵袭性致病真菌感染引发的疾病及并发症呈逐年上升的趋势,对全球公共卫生安全造成了严重的威胁。在致病性真菌中,念珠菌是最常见的种类之一,而白色念珠菌则是临床上最常见的念珠菌,是造成感染的主要病原之一。它是一种机会性致病菌,可以在健康人群的黏膜、口腔、胃肠道等部位与人体共存,不造成机体的损伤。然而,对于一些患有基础疾病的人群,尤其是免疫功能受损的(如艾滋病患者、接受免疫治疗的患者等),轻则只造成浅表感染,重则会引起严重的全身性的系统感染,血液感染最为常见。当所处的微环境不同(如盐环境、ph环境、co2水平等)或受到外来物质的干扰时,白色念珠菌会在它的两种主要形态——“酵母态”和“菌丝态”之间发生转换。许多研究表明,白色念珠菌的酵母态是与宿主共生的形态,而菌丝态则是它的致病形态,会通过表达许多毒力相关因子、降低宿主的免疫应答等方式,对正常组织细胞进行破坏。
3.相比于细菌,真菌所造成的感染通常更难治疗。因为它是一种真核细胞,跟人体的正常细胞在生理结构等方面都较为相近,所以许多抗真菌药物即使在体外具有较好的杀菌效果,但其生物相容性往往较差。在过去的几十年里,尽管有一些抗真菌药物(如两性霉素b、酮康唑、氟康唑等)已经被广泛地应用于治疗真菌所造成的感染,但它们通常对人体的毒副作用较大,而且无区别对一些益生细菌也具有抗菌效果,因此会造成菌群失衡,引起更多疾病。同时,随着大量广谱抗生素等药物的滥用,还使得真菌对药物产生了耐药性。
4.抗菌肽在自然界中广泛分布,是一类具有抗菌活性的多肽分子。它的抗菌性能优异、生物相容性好,而且不同的抗菌肽具有不同的作用靶点和抗菌机理,多模式的抗菌机理使抗菌肽不易产生耐药性,是一种理想的抗生素替代物,因而越来越受到了人们广泛的关注。但天然抗菌肽也存在一些应用上的问题,例如不具有抗菌选择性,对哺乳动物细胞较高的毒副作用,不具备酸响应性等,阻碍了其进一步的发展和应用,因此,设计开发高效、低毒的抗菌肽,不仅能解决天然抗菌肽的相关缺陷,也开辟了抗菌药物研发的新方向。
技术实现要素:
5.真菌对现有抗真菌药物已经产生了越来越多的耐药性,天然抗菌肽细胞毒性大,
并且现有抗菌药物在杀灭真菌的同时也会对很多细菌益生菌造成伤害,会造成菌群失调,引起更多疾病。因此,本发明的第一个目的是设计一种新型抗菌肽,可以通过多重作用机制抗真菌而不易产生耐药性,并有较高生物安全性,且最重要的是,该抗菌肽只选择性抗真菌而不抗细菌。
6.本发明的第二个目的在于提供一种上述抗菌肽在选择性抗真菌中的应用。
7.本发明的第三个目的在于提供一种包括上述抗菌肽的药物。
8.为达到上述目的,本发明采用下述技术方案:
9.第一方面,本发明提供了一种具有选择性抗真菌作用的抗菌肽,所述抗菌肽的氨基酸序列选自下述序列中的一种:
10.(1)whrihhikihw,如seq id no.1所示;
11.(2)wkrikkikikw,如seq id no.2所示;
12.(3)wrrirrikirw,如seq id no.3所示;
13.(4)whrlhhlklhw,如seq id no.4所示;
14.(5)whrvhhvkvhw,如seq id no.5所示。
15.本发明的抗菌肽通过非破膜的方式转运到真菌细胞内部,作用于细胞核,与dna相结合,将其细胞周期阻滞在了g1期,抑制了dna的合成,从而抑制了其增殖;并且会进一步影响线粒体,使得线粒体膜电位去极化,诱导ros的产生,进而对真菌细胞造成氧化损伤;结果将导致细胞膜受损,使得膜电位去极化,破坏其选择透过性,导致内容物(如蛋白质、核酸等)泄露到外部坏境中,并容易造成形貌塌陷等现象。
16.本发明的抗菌肽具有非常好的选择性抗真菌作用,可在真菌性感染中只抗真菌而不抗细菌。
17.进一步的,所述抗菌肽的n端乙酰化,c端酰胺化。
18.进一步的,根据本发明的具体实施方式,当本发明的抗菌肽为whrihhikihw、whrlhhlklhw或whrvhhvkvhw时,具有较好的ph响应性,可在微酸环境下选择性抗真菌而不伤害哺乳动物细胞。因为这些抗菌肽中富含组氨酸,组氨酸中含有咪唑基团,具有很强的供质子能力和接受质子能力。当处于酸性条件下时,组氨酸会发生质子化,从而带上正电荷,提高了多肽整体的穿膜能力和抗菌能力。另一方面,当组氨酸处于中性条件下时,组氨酸不带电荷,从而降低了对正常组织细胞的生物毒性。
19.第二方面,本发明提供了上述抗菌肽在下述至少一种中的应用:
20.1)在制备抑制真菌活性的产品中的应用;
21.2)在制备抗真菌感染的产品中的应用;
22.3)在制备预防和/或治疗真菌所致疾病的产品中的应用。
23.进一步的,在本发明中,所述真菌为酵母真菌、丝状真菌、二态真菌或皮肤癣菌等。
24.可选的,所述酵母真菌为白色念珠菌、新型隐球菌、阿萨希丝孢酵母、耳念珠菌或酿酒酵母等。
25.可选的,所述丝状真菌为曲霉菌、毛霉菌或青霉菌等。
26.可选的,所述二态真菌为腐皮镰孢菌、芽生菌或组织胞浆菌等。
27.可选的,所述皮肤癣菌为毛癣菌、小孢子菌或表皮癣菌等。
28.第三方面,包括上述抗菌肽的药物也属于本发明所要保护的范畴。所述药物中除
了上述抗菌肽,还包括药学上可接受的辅料,制成各种药物剂型,例如膏剂、栓剂、气雾剂、洗剂、注射剂或贴剂等。
29.本发明的有益效果如下:
30.本发明提供了一种新型抗菌肽,可以通过多重作用机制进行抗真菌而不易产生耐药性,并有较高生物安全性,且最重要的是,该抗菌肽只选择性抗真菌而不抗细菌。
附图说明
31.下面结合附图对本发明的具体实施方式作进一步详细的说明。
32.图1示出多肽wh在不同ph环境下随时间对白色念珠菌的抗菌活性;
33.图2示出生理盐水组和多肽组的白色念珠菌死活染色;(a-c)空白对照组,(d-f)wh组,(g-i)whv组(绿色:活细胞,红色:死细胞,比例尺:30μm);
34.图3示出不同多肽对兔血红细胞的溶血毒性及对小鼠成纤维细胞l929的细胞毒性;(a)wh对兔血红细胞的溶血毒性;(b)wh对小鼠成纤维细胞的细胞毒性;(c)不同多肽对兔血红细胞的溶血毒性指标;(d)不同多肽对小鼠成纤维细胞的细胞毒性指标;
35.图4示出wh的非破膜抗菌机理;(a)wh在不同环境下的圆二色谱图;(b)wh抗菌过程的能量依赖性,用pi的阳性率表征wh的抗菌率;(c)外源渗透压保护剂对多肽wh抑菌性能的影响;(d)外源麦角固醇对多肽wh抑菌性能的影响;(e)白色念珠菌与fitc-wh、pi共孵育,随时间延长而拍摄的clsm图片(绿色:fitc-wh;红色:pi;比例尺:5μm);
36.图5示出wh与dna的相互作用;(a-h)示出fitc-wh与真菌细胞壁和细胞核的共定位实验及相对应区域的荧光分布数据;(i)示出dna与不同浓度wh的凝胶阻滞分析;(j和k)示出dna与不同浓度wh混匀后,在0小时和24小时时对dna紫外吸收的影响;(l)示出多肽wh对白色念珠菌细胞周期的影响(绿色:fitc-wh;红色:细胞壁;蓝色:细胞核;比例尺:5μm);
37.图6示出不同多肽对白色念珠菌线粒体及细胞膜造成的伤害;(a)示出不同浓度多肽wh作用于白色念珠菌后,其线粒体膜电位的去极化情况;(b、j和m)示出不同浓度多肽wh、whl和whv作用于白色念珠菌后,其细胞质膜电位的去极化情况;(c、i和l)示出不同浓度多肽wh、whl和whv作用于白色念珠菌后,其细胞内活性氧的产生情况;(d、h和k)示出不同浓度多肽wh、whl和whv作用于白色念珠菌后,其细胞质膜通透性随多肽浓度增大的改变情况;(e)示出不同浓度多肽wh作用于白色念珠菌后,其细胞质膜通透性随wh作用时间的改变情况;(f和g)示出加入不同浓度的抗氧化剂(谷胱甘肽gsh或抗坏血酸vc),对多肽wh抑菌性能的影响;
38.图7示出白色念珠菌的扫描电子显微镜照片;(a-f)示出白色念珠菌经多肽wh和whv处理后的扫描电子显微镜照片;(g-l)示出白色念珠菌经多肽wh和whv处理后的透射电子显微镜照片;(m和n)示出白色念珠菌经多肽wh处理后,其内部可溶性蛋白和核酸的泄露情况;
39.图8示出多肽wh对小鼠外阴阴道念珠菌病的治疗效果;(a)示出不同组别的阴道组织匀浆液的白色念珠菌菌落计数;(b)示出乳酸杆菌菌落计数;(c)示出tnf-α的累积水平。(d-g)示出h&e染色结果,生理盐水组(d)、10mg/ml克霉唑组(e)、2.5mg/ml wh组(f)、10mg/ml wh组(g)。
具体实施方式
40.为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
41.各实施例中所用到的多肽名称及其序列分别为:
42.wh:whrihhikihw,如seq id no.1所示;
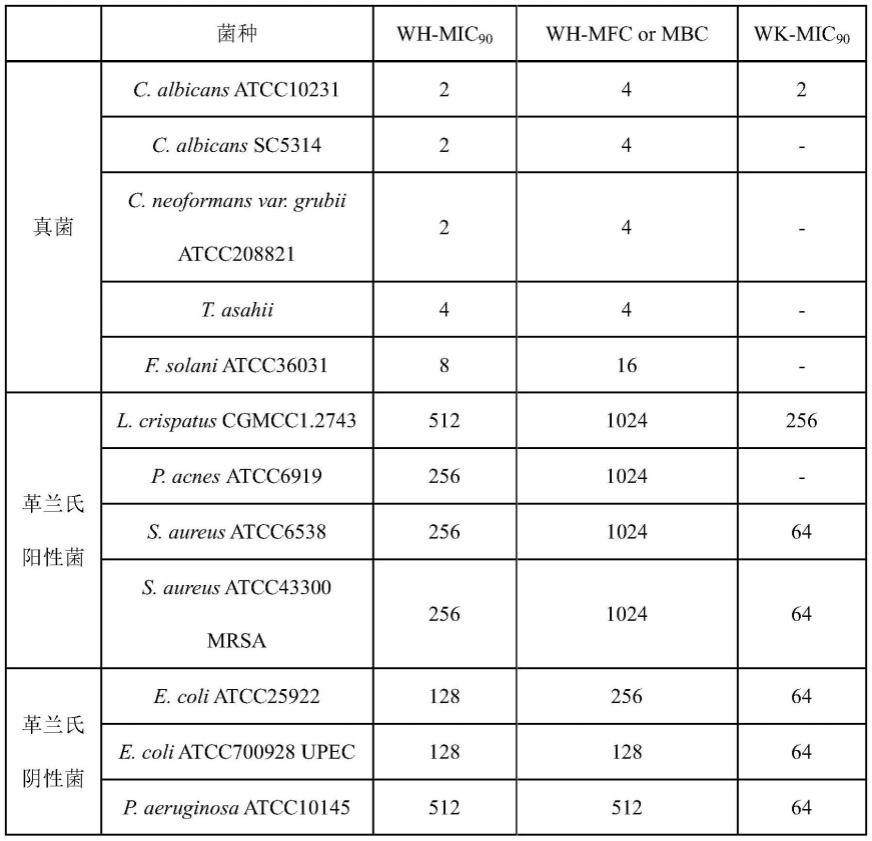
43.wk:wkrikkikikw,如seq id no.2所示;
44.wr:wrrirrikirw,如seq id no.3所示;
45.whl:whrlhhlklhw,如seq id no.4所示;
46.whv:whrvhhvkvhw,如seq id no.5所示。
47.上述抗菌肽可以采用现有技术中已知的合成方法制备,例如固相合成法。
48.实施例1多条抗菌肽对不同菌种抑菌性能的测试
49.通过微量肉汤稀释法分别测定对真菌(白色念珠菌c.albicans atcc10231、白色念珠菌c.albicans sc5314、新型隐球菌c.neoformans var.grubii atcc208821、阿萨希丝孢酵母t.asahii、腐皮镰孢菌f.solaniatcc36031),革兰氏阳性菌(卷曲乳杆菌l.crispatuscgmcc1.2743、痤疮丙酸杆菌p.acnes atcc6919、金黄色葡萄球菌s.aureus atcc6538、金黄色葡萄球菌s.aureus atcc43300 mrsa),革兰氏阴性菌(大肠杆菌e.coli atcc25922、大肠杆菌e.coli atcc700928 upec、绿脓杆菌p.aeruginosa atcc27853、绿脓杆菌p.aeruginosa pao1)的抗菌活性。
50.样品配置:用生理盐水配置特定浓度的多肽母液。在96孔板中,第一列加入200μl该多肽,其余每列均加入100μl生理盐水,然后用多通道移液枪从第一列孔吸取100μl多肽,将其打入第二列孔中,吹打混匀;然后再用多通道移液枪从第二列孔吸取100μl多肽,将其打入第三列孔中,吹打混匀
……
以此类推,二倍梯度稀释,直至第十列孔混匀后,吸取100μl弃掉。第十一列作为阴性对照,第十二列作为阳性对照。
51.菌液的配置和加入:c.albicans用沙氏培养基培养,c.neoformans用ym培养基培养,t.asahii用ypd培养基培养,f.solani用pda培养基培养,l.crispatus用mrs培养基厌氧培养,p.acnes用含5%脱纤维羊血的tsb培养,其余细菌均用lb培养基培养。通过血球计数板或酶标仪,将真菌悬液调整至103cfu/ml,细菌悬液调整至105cfu/ml(阳离子调节的mh培养基),再用多通道移液枪吸取100μl该菌悬液加入上一步经过梯度样品孔和阳性孔中(即除第十一列外的所有列),第十一列的阴性孔则加入100μl相对应的培养基。
52.培养读数:将上述加好样品和菌液的96孔板至于恒温培养箱中以28℃(真菌)或37℃(细菌)的条件孵育18~24小时,目测其液体浑浊度,并将由明显浑浊向明显澄清转变的该澄清孔浓度定义为90%最小抑菌浓度(90%minimal inhibitory concentration,mic
90
);然后再将阳性孔、阴性孔、1/2
×
mic
90
孔、mic
90
孔、2
×
mic
90
孔、4
×
mic
90
孔,用多通道移液枪吹打混匀后,吸取3.5μl菌液滴加于相应的琼脂培养基上,待其静置吸收干后,倒置于培养箱中培养24小时,观察菌落生长情况,无菌落生长的浓度定义为其最小杀真菌浓度(minimum fungicidal concentration,mfc)或最小杀细菌浓度(minimum bactericidalconcentration,mbc)。
53.结果如表1-1和表1-2所示,所测试的五条抗菌肽均仅对真菌表现出优异的选择性
抗真菌活性,mic
90
或mfc值均很低,而不管对革兰氏阳性菌还是革兰氏阴性菌均不具备抗菌活性。
54.表1-1多肽wh、wk分别对真菌、革兰氏阳性菌和革兰氏阴性菌的抗菌活性(μg/ml)
[0055][0056][0057]
注
“‑”
是指该项数据没有测试。
[0058]
表1-2多肽whl、whv、wr分别对真菌、革兰氏阳性菌和革兰氏阴性菌的抗菌活性
[0059]
(μg/ml)
[0060]
[0061]
注
“‑”
是指该项数据没有测试。
[0062]
实施例2多条抗菌肽在不同ph条件下对白色念珠菌的抑菌性能测试
[0063]
在配置沙氏液体培养基时,加入0.165m mops,并用1m naoh将其ph值分别调至7.5、6.5和5.5,再高温高压灭菌,从而得到不同ph值的培养基用于抑菌实验。
[0064]
参照“实施例1”的方法修改进行,在配置菌悬液时将培养基分别改为上述不同ph的培养基,并且在稀释菌液时改为稀释100倍,得到105cfu/ml的菌悬液,再吸取100μl加入到配好样品的96孔板中进行共培养。其余步骤和判定标准均一致,得到其对105cfu/ml菌液的90%抑菌浓度。
[0065]
结果如表2所示,只有含组氨酸的抗菌肽(wh、whl、whv),才具有ph响应性,随着ph的降低,组氨酸侧链基团上的咪唑基团质子化,正电性增强,提高了它的抗菌活性。而含赖氨酸和精氨酸的抗菌肽则不具备ph响应性,在酸性条件下,由于更适宜白色念珠菌生存,还会导致它们的抗菌性能下降。
[0066]
表2 wh、wk和wr在不同ph值下对105cfu/ml白色念珠菌的抑菌性能(μg/ml)
[0067][0068]
注
“‑”
是指该项数据没有测试。
[0069]
实施例3流式细胞术(flow cytometry,fcm)分析多肽wh在不同ph环境下随时间对白色念珠菌抗菌效果的差异:
[0070]
参照“实施例2”配置ph值分别为7.5和5.5的沙氏液体培养基用于该实验。将32μg/ml的多肽wh和106cfu/ml的白色念珠菌菌悬液(分别用上述不同ph值的培养基配置并稀释)置于28℃/130rpm环境下,相互作用不同时长。结束后加入终浓度为30μm的pi溶液(e
x
/em:535/617nm),孵育10分钟后,用流式细胞仪(bd accuri c6 plus,下同)测定fl2通道(488nm,585nm/40nm)的荧光阳性率。
[0071]
结果如图1所示,杀菌动力学实验表明,在ph等于5.5时,wh的抗菌效率要远高于ph等于7.5,仅1.5小时,抗菌率就大于60%。
[0072]
实施例4激光扫描共聚焦显微镜(clsm)观察白色念珠菌的死活染色(syto 9/pi):
[0073]
将107cfu/ml的菌液与0.4mg/ml的多肽wh和whv置于28℃/130rpm条件下相互作用7个小时,然后离心清洗掉多肽溶液,并用适量的生理盐水重悬,再加入提前预混好的syto 9/pi混合溶液(e
x
/em:syto 9:485/498nm、pi:535/617nm;按1:1预混,每1ml菌液加入3μl染色工作液),黑暗下孵育15分钟,然后再离心清洗掉染色液,并用适量的生理盐水重悬。用移液枪吸取适量菌液滴加于多聚赖氨酸包被的盖玻片上,让其静置沉降吸附约15分钟后,用滤纸吸掉多余液体,并将其盖于滴加有封片剂的载玻片上,然后用共聚焦显微镜进行观测。
[0074]
syto9/pi是核酸染料,syto9不管对活细胞还是死细胞都可以进行染色,而pi只能穿过死细胞的细胞膜,再与核酸结合。绿色代表活细胞,红色代表死细胞。结果如图2所示,
空白对照组基本只有绿色荧光,表明绝大部分真菌细胞为正常状态;而多肽wh和whv处理后的真菌细胞,同时也发出强烈的红色荧光,表明几乎全部死亡。进一步证明了它们的抗菌能力。
[0075]
实施例5不同多肽对兔血红细胞的溶血毒性测试:
[0076]
样品配置:用生理盐水配置64mg/ml的wh多肽母液。准备12支1.5ml ep离心管,其中10支作为不同梯度浓度的样品组,第1支加入200μl多肽母液,第2至第10支加入100μl生理盐水,用移液枪将第1支离心管中的100μl多肽吸取并加入到第2支离心管中,涡旋混匀,再从第2支离心管中将100μl多肽吸取并加入到第3支离心管中,涡旋混匀
……
以此类推,二倍梯度稀释,直至第十支混匀后,吸取100μl弃掉。第十一支加入100μl生理盐水作为阴性对照,第十二支加入100μl纯水作为阳性对照。一式三份。
[0077]
红细胞的配置和加入:将5ml新鲜兔血至于50ml离心管中用生理盐水离心清洗3~5次(离心条件:1000g/10min/室温),直至其上层清液基本为清澈状态,无过于明显的溶血现象。然后按体积比,加入生理盐水,将红细胞稀释至5%(v/v)。再吸取100μl该5%的红细胞加入上述各支离心管中,涡旋混匀。
[0078]
培养读数:将上述加好样品和红细胞的离心管至于37℃培养箱中,静置孵育1小时,再将其离心(1000g/10min/室温)后取50μl上清液和50μl生理盐水混匀加入一块96孔板中,用酶联免疫检测仪测定其od
540
值,并按照以下公式计算其溶血率:
[0079][0080]
od
540
(多肽)表示含有红细胞和多肽的组;
[0081]
od
540
(阳性)表示含有红细胞和超纯水的组;
[0082]
od
540
(阴性)表示含有红细胞和生理盐水的组。
[0083]
结果如图3中的a和c所示,多肽wh的hc
20
值为9.55mg/ml,其选择性指标(selectivity=hc
20
/mic
90
)为4775,说明wh的溶血毒性非常低。同时,wk、wr、whv的hc
20
值分别为14.89、9.22、>32(mg/ml),选择性指标分别为7445、2305、>8000,也都表现出非常低的溶血毒性。
[0084]
实施例6不同多肽对小鼠成纤维细胞l929的细胞毒性测试:
[0085]
实验中所用到的培养基、pbs、胰酶等均需提前置于37℃水浴锅中预热。
[0086]
l929细胞的复苏、传代、培养与种板:从液氮罐中取出一管冻存的l929细胞,立即将其置于37℃水浴锅中,使其迅速溶解;然后向冻存管中加入适量的dmem-h培养基(含10%胎牛血清、1%链霉素、1%青霉素,下同并简称“dmem”),混匀后转移至离心管中离心(800rpm/5min);去上清后,用约5ml的dmem重悬细胞后,将其转移25ml培养瓶中,并置于37℃/5%co2的细胞培养箱中培养。待其贴壁并生长到一定密度后,进行传代操作。简单而言,将培养瓶中的旧培养基抽吸干净后,对着侧壁打入1ml pbs,轻晃清洗,再抽吸干净后,加入0.5ml 0.25%胰酶,轻晃消化约30~60秒,将细胞从培养瓶底消化下来,再转移至离心管中离心(800rpm/5min);去上清后,用适量的dmem重悬并稀释细胞至适宜浓度后,取5ml转移至25ml培养瓶中,并将其置于37℃/5%co2的细胞培养箱中培养。复苏后的细胞约传2代之后进行“种板”操作。其清洗、消化、离心等步骤与传代一致。用适量的dmem重悬并稀释细胞后,取10μl置于血球计数板中进行细胞计数,并根据计数结果将细胞稀释到约50000~80000
个/ml。然后取一块96孔板,除第10列加dmem培养基外(作为阴性对照列),其余每列均加入100μl该细胞悬浮液,使每孔的细胞数约为5000~8000个(为保持细胞生长环境和减少误差,96孔板的周边一圈孔加入100μl生理盐水)。然后再将其置于37℃/5%co2的细胞培养箱中培养24个小时。
[0087]
样品的配置与加入:用dmem配置2mg/ml的wh多肽母液。在一块新的96孔板中,第二列加入250μl该多肽,其余每列均加入125μl的dmem培养基,然后按照“实施例1”中的方式,用多通道移液枪以125μl的体积二倍梯度稀释样品至第九列,混匀后吸取100μl弃掉。第10列作为阴性对照,第11列作为阳性对照。然后从培养箱中取出种好细胞的96孔板,将孔中的旧培养基抽吸干净,再按设计的板型加入100μl上述已在96孔板中配置好的多肽样品及培养基,并将其置于37℃/5%co2的细胞培养箱中培养24个小时。
[0088]
cck-8测定细胞活性:用dmem培养基将cck-8稀释10倍,然后从培养箱中取出种好细胞的96孔板,将孔中的旧培养基抽吸干净,每孔再加入含10%cck-8的dmem培养基,继续培养约1个小时后,每孔吸取80μl上清液至一块新的96孔板中,用酶联免疫检测仪测定其od
450
值,并按照以下公式计算其细胞存活率:
[0089][0090]
od
450
(多肽)表示含有l929细胞、多肽和培养基的孔;
[0091]
od
450
(阳性)表示含有l929细胞和培养基的孔;
[0092]
od
450
(阴性)表示只含有培养基的孔。
[0093]
结果如图3中的b和d所示,多肽wh的ic
50
值为1.057mg/ml,其选择性指标(selectivity=ic
50
/mic
90
)为640,说明其对哺乳动物细胞的毒性也很低。同时,wk、wr、whv的ic
50
值分别为0.640、0.517、>2(mg/ml),选择性指标分别为320、129.25、>500,也都表现出很低的细胞毒性。
[0094]
实施例7多肽wh在不同环境下的圆二色谱:
[0095]
分别用超纯水、25mm sds、50%tfe来配置终浓度为0.4mg/ml的wh溶液,并置于室温下放置过夜,待其稳定。然后再将其加入1cm光程的石英比色皿中,用圆二色光谱仪(jasco-j815)测定在190~250nm范围的cd值。
[0096]
结果如图4中的a所示,分别用25mm sds模拟菌膜负电环境,用50%tfe模拟菌膜疏水环境。结果表明,wh在这些模拟菌膜的条件下,构象均保持不变,主要以无规构象为主,在197nm~202nm处具有负的特征峰,并不会形成α螺旋等二级构象(通常形成α螺旋等二级构象的抗菌肽都会具备破膜杀菌机理)。
[0097]
实施例8流式细胞术分析多肽wh抗菌过程的能量依赖性:
[0098]
该实验主要是通过控制温度(4℃和28℃)来控制白色念珠菌的呼吸作用,进而分析多肽wh的抗菌过程是否依赖于能量的产生。首先,将106cfu/ml的菌液与32μg/ml的多肽wh(相当于该条件下的4
×
mic
90
)分别置于4℃冰箱或28℃培养箱中相互作用不同时长(0.5h、1h、1.5h、2h、2.5h、3h、3.5h、4h),然后用生理盐水离心清洗1~2次,再加入终浓度为30μm的pi溶液,孵育10分钟后,用流式细胞仪测定fl2通道的荧光阳性率。
[0099]
结果如图4中的b所示,置于4℃冰箱进行的抗菌实验,wh在4个小时内,基本保持非常低的抗菌率。而置于28℃培养箱进行的抗菌实验,wh表现出随时间延长,抗菌率逐渐上升
的趋势,作用2.5小时的时候便超过了50%的抗菌率。表明wh的抗菌过程需要能量的参与,也表明其可能涉及相关跨膜转运过程,进而作用于真菌内部,而非破膜抗菌。
[0100]
实施例9微量肉汤稀释法分析加入外源麦角固醇和渗透压保护剂后对多肽wh抗菌效果的影响:
[0101]
参照“实施例1”和“实施例2”的方法和步骤测定对105cfu/ml的菌液的mic
90
值。在作用体系中分别加入不同终浓度的外源麦角固醇(0.1mg/ml和0.5mg/ml)和0.8m山梨醇,并且与菌液预孵育约30分钟后,再加入孔板与多肽相互作用。其余的操作步骤与判定标准均一致。
[0102]
以细胞膜为作用靶点的抗菌剂,通常在加入外源的渗透压保护剂和外源麦角固醇后,会降低其抗菌效果。结果如图4中的c和d所示,它们加入后,wh对105cfu/ml白色念珠菌的抑菌活性保持不变,表明细胞膜不是其主要作用的靶点。
[0103]
实施例10 fitc-wh与pi进入白色念珠菌内部的顺序:
[0104]
将终浓度30μm的pi染液与106cfu/ml的白色念珠菌于聚赖氨酸包被的共聚焦皿上预先孵育10分钟,再加入fitc-wh。然后每间隔一定时间,通过在共聚焦显微镜的488nm、561nm激发波长和明场通道下,观察荧光在真菌细胞内出现的前后顺序。
[0105]
结果如图4中的e所示,随着时间的延长,fitc-wh先进入到了真菌细胞内部,约20分钟之后,才发生了pi染料的渗透,表明真菌细胞死亡发生在fitc-wh摄取之后。所以,wh是通过相关跨膜转运过程先进入到了真菌细胞内部,进而发挥抗菌作用,导致真菌死亡。
[0106]
实施例11激光扫描共聚焦(clsm)观察荧光标记多肽wh(fitc-wh)与白色念珠菌细胞壁和细胞核的共定位情况:
[0107]
将107cfu/ml的菌液与0.4mg/ml的fitc(e
x
/em:495/525nm)标记的多肽wh(fitc-wh)置于28℃/130rpm条件下相互作用7个小时,然后离心清洗掉多肽溶液,并用适量的生理盐水重悬后,分别加入终浓度为25μm的calcofluor white m2r染色液(e
x
/em:365/435nm,用于标记真菌细胞壁),或终浓度为4μg/ml的dapi染色液(e
x
/em:358/461nm,用于标记细胞核),均染色30分钟后,离心清洗掉染色液,并用适量的生理盐水重悬。用移液枪吸取适量菌液滴加于多聚赖氨酸包被的盖玻片上,让其静置沉降吸附约15分钟后,用滤纸吸掉多余液体,并将其盖于滴加有封片剂的载玻片上,然后用共聚焦显微镜进行观测,并通过nikon nis-element软件分析特定区域各荧光通道随位置的荧光强度分布值。
[0108]
结果如图5中的a-h所示,绿色的wh基本位于红色的细胞壁内部,基本不表现出共定位现象,但绿色的wh与蓝色的细胞核则表现出共定位(如红色箭头所指),作用于细胞核。另外,它们相应的荧光强度分布也表现出同样的结果,绿色荧光的强度分布与红色荧光相关性不大,仅与蓝色荧光的分布表现出强相关性。因此,我们推断wh的作用位点主要是细胞核。
[0109]
实施例12琼脂糖凝胶电泳测定多肽wh与dna的相互作用:
[0110]
将多肽wh与dna按照不同的质量比混合均匀(分别为0、0.25、0.5、1、2、4、8),置于室温下共孵育30分钟,然后将其与6x dna loading buffer按5:1体积比混匀,并将其加入提前预制的0.8%浓度琼脂糖凝胶的上样孔中,在避光环境下,以100v电压在水平电泳仪中进行电泳,结束后用凝胶成像仪进行荧光成像。
[0111]
结果如图5中的i所示,当多肽与dna的质量比为2:1时,就能完全阻滞dna在琼脂糖
中的迁移,当为8倍dna质量时,条带的荧光变淡,说明其向反方向电泳。表明多肽wh具有与dna相结合的能力。
[0112]
实施例13紫外-可见分光光度计分析多肽wh与dna的相互作用:
[0113]
将多肽wh与dna按照不同的质量比在超纯水中混合均匀后,置于1cm石英比色皿中,然后用紫外-可见分光光度计(hitachi u-3900)立刻测定其在240~340nm间的吸光度。并且在间隔24个小时之后,再次以相同条件进行测定。
[0114]
结果如图5中的j和k所示,当多肽wh与dna按1:1质量比混合后,会使dna在260nm处产生增色效应,表明其破坏了dna紧密堆积的双螺旋结构。并且在放置24小时后,260nm处的吸收基本消失,且在混合溶液中可目测到明显的颗粒形成,表明其发生了聚集沉降。
[0115]
实施例14流式细胞术分析多肽wh对白色念珠菌细胞周期的影响:
[0116]
利用dna含量检测试剂盒(细胞周期)(solarbio,ca1510)测定白色念珠菌的细胞周期。首先,将106cfu/ml的白色念珠菌菌悬液分别与不同浓度的多肽(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)置于28℃/130rpm环境下相互作用10个小时后,用生理盐水离心清洗掉培养基和样品,并用70%预冷乙醇重悬,置于4℃冰箱固定过夜。固定结束后,用生理盐水离心清洗掉乙醇,再加入100μl rnase,置于37℃消化rna一小时,再加入400μl试剂盒中的pi染色液,置于4℃孵育30分钟后,用流式细胞仪的fl2通道分析其荧光信号。
[0117]
结果如图5中的l所示,与空白对照组相比,wh作用于白色念珠菌后,将其细胞周期阻滞在了g1期,抑制了dna的合成,从而抑制了其细胞增殖。
[0118]
实施例15流式细胞术分析不同浓度多肽wh作用于白色念珠菌后线粒体膜电位的变化:
[0119]
利用线粒体膜电位检测试剂盒(jc-1)(solarbio,m8650)检测粒体膜电位状态。首先,将106cfu/ml的白色念珠菌菌悬液分别与不同浓度的多肽(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)置于28℃/130rpm环境下相互作用10个小时后,再按照说明书进行清洗、染色等步骤,最后用流式细胞仪测定fl1/fl2荧光通道的比值。
[0120]
jc-1是一种线粒体膜电位依赖性染料,它存在单体和多聚体两种状态。对于正常的细胞,线粒体膜电位较高时,它会聚集在线粒体基质中,主要以多聚体形式存在,可发出红色荧光;而当线粒体膜电位较低时,则无法在线粒体基质中聚集,主要以单体形式存在,可发出绿色荧光。结果如图6中的a所示,随wh浓度增加,jc-1单体的荧光强度增加,使得jc-1单体/多聚体的荧光强度比值增加,表明线粒体膜电位去极化。
[0121]
实施例16流式细胞术分析不同浓度多肽wh、whl和whv作用于白色念珠菌后细胞质膜电位的变化:
[0122]
利用dibac4(3)(e
x
/em:490/505nm)荧光探针检测细胞质膜电位的变化。首先,将106cfu/ml的白色念珠菌菌悬液分别与不同浓度的多肽(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)置于28℃/130rpm环境下相互作用10个小时后,用生理盐水离心清洗1~2次,再加入终浓度为50μg/ml的dibac4(3)探针,置于4℃冰箱中孵育1个小时,用生理盐水离心清洗1~2次,再用流式细胞仪测定fl1通道的荧光阳性率。
[0123]
dibac4(3)是一种膜电位敏感的亲脂性阴离子染料。它本身无荧光,且无法进入到正常细胞内部。但是当细胞膜去极化时,可导致其流入细胞内部,并与富含脂质的物质相结合,发出绿色荧光,可用流式细胞术的fitc通道进行检测。结果如图6中的b、j、m所示,随wh、
whl和whv浓度的增加,dibac4(3)荧光强度增强,表明细胞膜去极化程度增加。
[0124]
实施例17流式细胞术分析不同浓度多肽wh、whl和whv作用于白色念珠菌后活性氧(reactive oxygen species,ros)的产生:
[0125]
利用dcfh-da荧光探针检测细胞内活性氧的产生。首先,将106cfu/ml的白色念珠菌菌悬液分别与不同浓度的多肽(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)置于28℃/130rpm环境下相互作用10个小时后,用生理盐水离心清洗1~2次,再加入终浓度为20μm的dcfh-da探针,置于28℃和黑暗条件下孵育30分钟,用生理盐水离心清洗1~2次,再用流式细胞仪测定fl1通道(488nm,533/30nm)的荧光阳性率。
[0126]
dcfh-da本身无荧光,它可以穿透细胞膜,进入细胞内并被细胞内的酯酶水解生成dcfh。而细胞内的活性氧可进一步将其氧化成dcf,结合流式细胞术的fitc通道检测其荧光强度的变化,即可得知活性氧的产生情况。结果如图6中的c、i、l所示,与空白对照组相比,随着多肽wh、whl和whv浓度的增加,ros的累积水平增加。
[0127]
实施例18流式细胞术分析不同浓度多肽wh、whl和whv作用于白色念珠菌后细胞质膜通透性的变化:
[0128]
利用pi荧光探针检测细胞质膜通透性的变化。首先,将106cfu/ml的白色念珠菌菌悬液分别与不同浓度的多肽(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)置于28℃/130rpm环境下相互作用10个小时后,用生理盐水离心清洗1~2次,再加入终浓度为30μm的pi溶液,黑暗中孵育10分钟后,用流式细胞仪测定fl2通道的荧光阳性率。
[0129]
结果如图6中的d、h、k所示,随多肽wh、whl和whv浓度的增加,真菌细胞的pi阳性率增加。说明多肽会诱导ros产生,进一步导致细胞膜受损,破坏膜的完整性。
[0130]
实施例19荧光分光光度计分析多肽wh作用于白色念珠菌后细胞质膜通透性随时间的变化:
[0131]
将107cfu/ml的菌液与终浓度为30μm的pi溶液在黑暗中预孵育10分钟后,加入终浓度为0.4mg/ml的多肽wh,并通过荧光分光光度计随时间检测在535nm激发波长下,617nm发射波长处的荧光强度。
[0132]
结果如图6中的e所示,在4
×
mic的wh浓度下,随时间的延长,pi荧光强度呈逐渐增加的趋势。说明多肽wh作用于dna并损伤线粒体后,诱导ros产生,会进一步导致细胞膜受损,破坏膜的完整性。
[0133]
实施例20微量肉汤稀释法分析加入抗氧化剂后对多肽wh抗菌效果的影响:
[0134]
参照“实施例1”和“实施例2”的方法和步骤测定对105cfu/ml的菌液的mic
90
值。在作用体系中分别加入不同浓度的抗氧化剂(8mm、32mm的谷胱甘肽gsh;8mm、64mm的抗坏血酸vc),并且菌液与这些抗氧化剂预孵育约30分钟后,再加入孔板与多肽相互作用。其余的操作步骤与判定标准均一致。
[0135]
结果如图6中的f和g所示,随着抗氧化剂浓度的增加,多肽wh的mic
90
也随之提高,说明ros的累积是引起真菌死亡的重要原因之一。
[0136]
实施例21白色念珠菌的扫描电子显微镜(sem)测试:
[0137]
为了便于后续的实验操作,提高了共培养时的菌液浓度和多肽浓度,用160μg/ml的多肽wh和whv与106cfu/ml的菌液在28℃下相互作用约10个小时,然后用生理盐水离心清洗2次后(4000g/3min/室温),加入1ml 2.5%戊二醛于4℃冰箱中固定过夜,再用生理盐水
离心清洗掉固定液后,进行乙醇梯度脱水操作(20%、50%、70%、80%、90%、100%、100%),各梯度均脱水10分钟,最后用适量无水乙醇重悬,并滴加于通过导电胶贴在铜台的硅片上,室温干燥后,喷金,用s-4800扫描电子显微镜观察其细胞形貌。
[0138]
结果如图7中的a-f所示,空白对照组的真菌细胞形貌完整,成球状或椭球状;而经过多肽wh处理后,细胞膜遭到氧化损伤,其细胞整体形貌遭到破坏,不再光滑完整,多呈凹陷状。
[0139]
实施例22白色念珠菌的透射电子显微镜(tem)测试:
[0140]
首先,将106cfu/ml的菌液与160μg/ml的多肽wh和whv在28℃下相互作用约10个小时,然后用生理盐水离心清洗2次后(4000g/3min/室温),用2.5%戊二醛(0.1m pb,ph7.2)于4℃冰箱中固定过夜,再用生理盐水离心清洗掉固定液后,进行乙醇梯度脱水,然后将其渗透并包埋在spi-pon
tm
812环氧树脂中。再用leica ultracut超薄切片机(leica em uc7)进行70nm厚度切片,并用乙酸铀酰和柠檬酸铅进行染色。最后用ht-7700透射电子显微镜再100kv加速电压下进行成像。
[0141]
结果如图7中的g-l所示,空白对照组可见其细胞内部结构完整,细胞质充盈饱满,细胞器清晰可见;而多肽wh处理后,其内部结构不再完整,细胞器也遭到破坏,并导致了细胞质等内容物的外流。
[0142]
实施例23白色念珠菌内部可溶性蛋白和核酸的外泄测试:
[0143]
可溶性蛋白:将107cfu/ml的菌液与256μg/ml的多肽wh(相当于该条件下的4
×
mic
90
)在纯生理盐水/28℃/130rpm的条件下相互作用不同时长(1h、2.5h、4h、5.5h、7h、8.5h、10h),然后离心,取其上清液,并用0.22μm滤膜过滤,再通过lowry蛋白含量测定法测定泄露于细胞外的可溶性蛋白溶度(需扣除多肽背景)。
[0144]
核酸外泄:将107cfu/ml的菌液分别与不同浓度的多肽wh(1/2
×
mic
90
、mic
90
、2
×
mic
90
、4
×
mic
90
)在纯生理盐水/28℃/130rpm的条件下相互作用8个小时,然后离心,取其上清液,并用0.22μm滤膜过滤,再通过微量分光光度计测定泄露于细胞外的核酸浓度(需扣除多肽背景)。
[0145]
结果如图7中的m和n所示,在4
×
mic
90
的多肽wh浓度下,随时间的延长,泄露到细胞外的蛋白浓度呈增加趋势;而在相同的作用时间下,随多肽wh浓度的增加,泄露到细胞外的核酸浓度也呈增加趋势。
[0146]
实施例24多肽wh对小鼠外阴阴道念珠菌病(vulvovaginal candidiasis,vvc)的治疗作用:
[0147]
感染模型的建立:选取昆明雌性小白鼠(20
±
2g),从感染白色念珠菌的前6天开始,以后的每2天大腿皮下注射0.1ml苯甲酸雌二醇(1mg/ml in橄榄油)(空白对照组注射0.1ml橄榄油),以诱导假发情状态,直至试验结束。感染的前一天将白色念珠菌用沙氏液体培养基于28℃恒温摇床以180rpm震荡培养16~20小时,至对数生长期,再用灭菌生理盐水离心清洗2~3次,并用生理盐水将菌悬液调整为107cfu/ml。在第7天时,即注射第4次苯甲酸雌二醇后,用移液枪将20μl上述制备好的菌液注入小鼠阴道内(空白对照组注入20μl 0.9%生理盐水),接种后,将小鼠向后仰倒约5分钟,用镊子轻轻捏住小鼠阴道口,以确保悬浮液留在阴道中而不会流出。第8天,按同样的方法重复感染一次。
[0148]
实验分组与给药:实验的第9天,将小鼠随机分为5组,分别为对照组(不感染白色
念珠菌)、生理盐水组、克霉唑组(10mg/kg)、低剂量wh组(2.5mg/kg)和高剂量wh组(10mg/kg)。每次给药20μl,连续给药一周。用移液枪将20μl药物注入小鼠阴道内,仰倒约30秒,尽量不让药物流出,在给药后的第8天作为实验终点。
[0149]
评价指标:
①
白色念珠菌和乳酸杆菌的负载量:第16天(当天不给药),将所有小鼠断颈处死并摘取其阴道组织,立即称重,每0.1g组织加入1ml预冷的生理盐水,4℃充分匀浆后,分别稀释涂布于沙氏琼脂培养基(28℃,48小时)和mrs琼脂(37℃,48小时,厌氧)中。待其菌落形成后,计数菌落数并分析小鼠阴道内白色念珠菌和乳酸杆菌的含量。
②
阴道组织中相关细胞因子的累积水平:将收集的匀浆液离心(10000rpm/4℃/15min)后,收集上清液,并用elisa试剂盒(sekm-0034,solarbio)检测其肿瘤坏死因子(tnf-α)的累积水平。
③
苏木精-伊红(h&e)染色:将阴道组织置于10%福尔马林中固定24小时后,进行脱水、包埋、切片、he染色等操作,然后再在显微镜下检查其病理学变化。
[0150]
结果如图8中的a和b所示,对于白色念珠菌来说,与生理盐水组相比,克霉唑处理后,能明显降低菌落数,抗菌率几乎为100%;而wh处理后,随用药剂量增加,抗菌率也随之增加,10mg/kg时大约为80%的抗菌率。对于乳酸杆菌来说,与空白组相比,感染组的菌落数会增多,我们认为可能是感染程度较轻,乳酸杆菌仍是优势菌群,能扩增数量来抵抗其它菌种的入侵。但我们也注意到,与生理盐水组相比,克霉唑处理组的乳酸杆菌数量仅为生理盐水组的35%,而低剂量wh组为321%,高剂量wh组为830%。说明wh有利于阴道中的乳酸杆菌增殖,进而抵御白色念珠菌的感染。
[0151]
结果如图8中的c所示,白色念珠菌感染后,tnf-α的表达水平显著升高,但经过克霉唑或wh治疗后,均能显著降低其炎症水平,并且wh组的tnf-α表达量最低,仅为生理盐水组的42%。
[0152]
结果如图8中的d-g所示,白色念珠菌感染后,其阴道上皮下有大量炎性细胞浸润的现象,但经过克霉唑或wh治疗后,均能在一定程度上缓解其炎症浸润情况,明显改善阴道局部发炎症状。
[0153]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1