一种手性α-叔胺化合物的制备方法与流程
一种手性
α-叔胺化合物的制备方法
技术领域
1.本发明涉及有机化学合成技术领域,具体为一种手性α-叔胺化合物的制备方法。
背景技术:
2.手性胺类化合物在自然界中广泛分布,并且也是许多生物活性分子和药物分子的重要组成部分。在这些化合物中,含氮结构单元对其生物活性和药效起着重要作用(chem.rev.2016,116,4441-4557)。经过几十年来手性合成技术的不断发展,手性α-仲胺的合成方法已经得到非常广泛的发展。但对于手性α-叔胺来说,由于其亲电性更弱以及前手性碳原子空间结构上更为拥挤导致手性控制更加困难,它的合成策略的发展相对缓慢。
3.过渡金属催化的有机金属试剂对n-磺酰基酮亚胺的不对称加成反应,是构建手性α-叔胺类化合物的直接和高效的方法。其中,使用有机硼试剂对n-磺酰基酮亚胺不对称加成实现了很多成功的例子。
4.例如,hayashi、mondschein、xu、zhou和zhang等人先后建立了rh或pd催化的不对称芳基化反应
5.(j.am.chem.soc.2012,134,5056-5059;angew.chem.int.ed.2014,53,9936-9939;org.lett.2015,17,5520-5523;
6.j.am.chem.soc.2013,135,971-974;chem.commun.2016,52,10882-10885;angew.chem.int.ed.2013,52,7540-7544),使用各种芳基硼试剂对环状或非环状n-磺酰基酮亚胺进行不对称加成,包括芳基硼酸、芳基硼酸酐和四芳基硼酸钠等。lam和zhang等人开发了rh、ni或co催化环状n-磺酰基酮亚胺不对称烯基化和烯丙基化
7.(angew.chem.int.ed.2012,51,6762-6766;angew.chem.int.ed.2012,51,8309-8313;angew.chem.int.ed.2014,53,11605-11610;nat.commun.2018,9,2258-2268;chem.eur.j.2018,24,1241-1245.),使用烯基/烯丙基三氟硼酸钾作为亲核试剂。jarvo等使用联烯基硼酸频那醇酯在银催化下实现了环状n-磺酰基酮亚胺的高效丙炔基化(org.lett.2015,17,5340-5343.)。尽管使用有机硼试剂取得了这些重要进展,但由于烷基金属络合物的易发生β-氢消除,使用烷基硼试剂对n-磺酰基酮亚胺的对映选择性烷基化至今很少报道。
8.harutyunyan等人另辟蹊径,采用烷基格氏试剂在cu催化下实现了非环状n-磺酰基酮亚胺的不对称的烷基化(angew.chem.int.ed.2017,56,3041-3044),但底物普适性非常有限,仅适用于芳基烷基酮亚胺,且烷基为甲基时ee值仅有74%,二芳基酮亚胺只能得到消旋体,并且也不适用于环状n-磺酰基酮亚胺。
技术实现要素:
9.(一)解决的技术问题
10.本发明的目的在于针对现有技术存在的问题,提供一种手性α-叔胺化合物的制备方法,以n-磺酰基酮亚胺和烷基格氏试剂作为原料,在铜盐和手性pnp配体的催化下进行不
对称加成来制备手性α-叔胺。该方法原料简单易得,底物范围广,立体选择性高,可高效制得所述手性α-叔胺化合物。
11.(二)技术方案
12.为实现上述目的,本发明提供如下技术方案:本发明提供了一种手性α-叔胺的制备方法,具有这样的特征,反应式为:
[0013][0014]
包括如下步骤:
[0015]
化合物i与化合物ii在铜盐以及手性pnp配体l*的存在下进行反应,得到手性α-叔胺化合物iii,
[0016]
式中,r1为c1-12烷基、苄基或取代苄基、苯基或取代苯基、1-萘基、2-萘基、杂芳基,所述取代苄基或取代苯基的取代基数量为1~5,所述取代苄基或取代苯基的取代基为c1~c8的烷烃基、c1~c6的烷氧基、卤素、三氟甲基或多个所述取代基之间键接成环;
[0017]
r2为氢、卤素、芳基、c1-6烷基、c1-30烷氧基中的任意一种;
[0018]
r3为c1-12链状烷基,且r2≠r3;
[0019]
手性配体l*的化学结构式如下式所示:
[0020][0021]
其中,r4和r7的数量为1个或2个,r4和r7的数量为1个时,r4和r7分别独立地选自氢、卤素、芳基、c1-6烷基或c1-6烷氧基;r4和r7数量为2个时,r4和r7分别独立地选自于卤素、芳基、c1-6烷基、c1-6烷氧基或键接成环;
[0022]
r5和r8分别独立地选自选自苯基或取代苯基、1-萘基、2-萘基、杂芳基,所述取代苯基的取代基数量为1~5,所述取代苯基的取代基为c1~c8的烷烃基、c1~c6的烷氧基、卤素、三氟甲基或多个所述取代基之间键接成环;
[0023]
r6为环己基或通过c2~c4的碳链,含氮、氧、硫的碳链、芳香环、或杂芳香环与r7键接成环。
[0024]
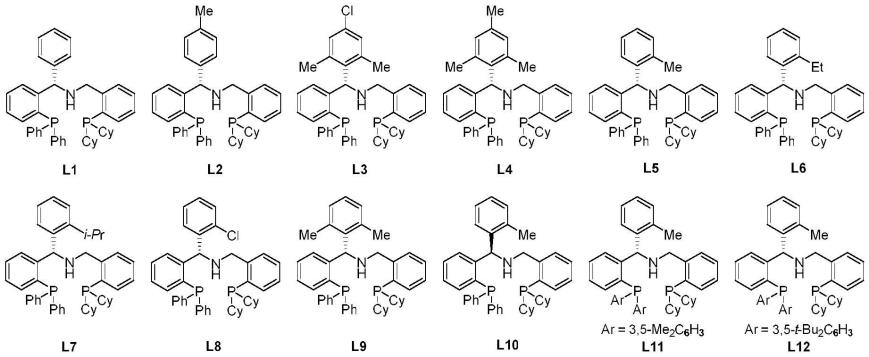
优选的,所述手性pnp配体l*为下述化学物中的任意一种或多种:
[0025][0026]
优选的,所述铜盐为噻吩-2-甲酸亚铜(cutc)、六氟磷酸四乙腈铜(cu(ch3cn)4pf6)、四氟硼酸四乙腈铜(cu(ch3cn)4bf4)、溴化亚铜(cubr)、碘化亚铜(cui)、氯化亚铜(cucl)、三氟甲磺酸亚铜(cuotf)、溴化亚铜二甲硫醚(cubr
.
sme2)、三氟甲磺酸铜(cu(otf)2)、醋酸铜(cu(oac)2)、氟化铜(cuf2)、氯化铜(cucl2)或溴化铜(cubr2)中的任意一种或多种。
[0027]
优选的,所述铜盐与所述手性pnp配体l*的摩尔比为1:(1-2)。
[0028]
优选的,所述化合物i与所述化合物ii的摩尔比为1:(1-5)。
[0029]
优选的,所述化合物i与所述铜盐的摩尔比为1:(0.01-1)。
[0030]
优选的,所述溶剂为二氯甲烷、四氢呋喃、2-甲基四氢呋喃、甲苯、乙醚、甲基叔丁基醚、苯甲醚、异丙醚、正丁醚、环戊基甲基醚中的任意一种或多种。
[0031]
优选的,手性α-叔胺的制备方法的反应步骤如下:在惰性气氛下,将所述铜盐以及所述手性配体l*加入到溶剂中,室温下搅拌反应0.5小时-1小时。然后将上述铜盐与手性pnp配体l*的混合溶液降温至-100℃-0℃,加入所述化合物i和化合物ii进行反应,反应结束后进行后处理,分离得到手性α-叔胺化合物。
[0032]
(三)有益效果
[0033]
与现有技术相比,本发明提供了一种,具备以下有益效果:
[0034]
1、本发明所涉及的手性α-叔胺的制备方法,包括采用铜盐与手性pnp配体作为催化剂,实现烷基格氏试剂对n-磺酰基酮亚胺的不对称催化加成,得到手性α-叔胺类化合物,具有原料廉价易得,底物范围广,立体选择性高等特点。
[0035]
2、本发明所制备的手性α-叔胺类化合物,包括苯并五元环状磺酰胺、苯并六元环状磺酰胺以及非环状磺酰胺,作为重要的有机合成子,在药物分子及其中间体和生物活性分子的修饰中具有较大的实施价值和良好的应用前景。
具体实施方式
[0036]
下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0037]
实施例1:
[0038]
本实施例利用式1a所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3a所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0039][0040]
具体制备步骤如下:
[0041]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0042]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1a(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3a,收率:84%,ee值为96%。
[0043]
对制备的产品3a进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0044]1h nmr(400mhz,cdcl3)δ7.73(d,j=7.8hz,1h),7.65-7.58(m,1h),7.49(t,j=7.4hz,1h),7.33(d,j=7.8hz,1h),4.79(s,1h),1.88-1.80(m,2h),1.61(s,3h),1.47-1.38(m,1h),1.24-1.22(m,4h),1.14-1.04(m,1h),0.82(t,j=6.8hz,3h).
[0045]
13
c nmr(100mhz,cdcl3)δ145.1,135.4,133.4,129.2,123.1,121.4,64.1,41.9,31.8,28.5,23.8,22.5,14.1.
[0046]
hrms(esi)m/z calculated for c
13h19
nnao2s[m+na]
+
=276.1029,found
[0047]
=276.1034.
[0048]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=93/7,1.0ml/min,220nm,25℃),tr(minor)=15.3min,tr(major)=23.5min,96%ee.
[0049]
实施例2:
[0050]
本实施例利用式1b所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3b所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0051][0052]
具体制备步骤如下:
[0053]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0054]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1b(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3b,收率:63%,ee值为95%。
[0055]
对制备的产品3b进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0056]1h nmr(400mhz,cdcl3)δ7.73(d,j=7.8hz,1h),7.61(t,j=7.6hz,1h),7.49(t,j=7.6hz,1h),7.29(d,j=7.8hz,1h),4.71(s,1h),1.88-1.81(m,4h),1.45-1.33(m,2h),1.27-1.15(m,6h),0.99-0.87(m,2h),0.84-0.76(m,6h).
[0057]
13
c nmr(100mhz,cdcl3)δ143.2,135.9,133.3,129.2,123.2,121.4,67.6,41.1,40.9,31.8,25.8,23.3,22.7,22.4,14.0,13.9.
[0058]
hrms(esi)m/z calculated for c
16h25
nnao2s[m+na]
+
=318.1498,found
[0059]
=318.1497.
[0060]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=16.7min,tr(major)=18.4min,95%ee.
[0061]
实施例3:
[0062]
本实施例利用式1c所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3c所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0063][0064]
具体制备步骤如下:
[0065]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0066]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1c(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3c,收率:57%,ee值为92%。
[0067]
对制备的产品3c进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0068]1h nmr(400mhz,cdcl3)δ7.73(d,j=7.8hz,1h),7.64(t,j=7.6hz,1h),7.52(t,j=7.6hz,1h),7.39(d,j=7.8hz,1h),4.27(s,1h),2.01-1.86(m,2h),1.47-1.39(m,1h),1.23(dd,j=8.8,4.4hz,5h),0.98-0.90(m,1h),0.83-0.80(m,3h),0.60-0.49(m,2h),0.43-0.27(m,2h).
[0069]
13
c nmr(100mhz,cdcl3)δ143.3,135.2,133.4,129.4,123.5,121.5,66.7,40.7,31.9,23.4,22.5,21.3,14.1,2.3.
[0070]
hrms(esi)m/z calculated for c
15h21
nnao2s[m+na]
+
=302.1185,found
[0071]
=302.1194.
[0072]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(major)=15.8min,tr(minor)=31.8min,92%ee.
[0073]
实施例4:
[0074]
本实施例利用式1d所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3d所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0075][0076]
具体制备步骤如下:
[0077]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0078]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1d(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3d,收率:70%,ee值为97%。
[0079]
对制备的产品3d进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0080]1h nmr(400mhz,cdcl3)δ7.61(d,j=7.9hz,1h),7.30(d,j=7.9hz,1h),7.05(s,1h),4.47(s,1h),2.46(s,3h),1.91-1.80(m,4h),1.40(dd,j=8.9,5.6hz,1h),1.22(d,j=3.0hz,4h),1.01-0.92(m,1h),0.84-0.77(m,6h).
[0081]
13
c nmr(100mhz,cdcl3)δ144.3,143.2,133.5,130.3,123.3,121.6,67.9,40.9,34.0,31.9,23.4,22.5,22.0,14.1,8.2.
[0082]
hrms(esi)m/z calculated for c
15h23
nnao2s[m+na]
+
=304.1342,found
[0083]
=304.1336.
[0084]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=18.9min,tr(major)=26.0min,97%ee.
[0085]
实施例5:
[0086]
本实施例利用式1e所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3e所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0087][0088]
具体制备步骤如下:
[0089]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0090]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1e(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3e,收率:76%,ee值为97%。
[0091]
对制备的产品3e进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0092]1h nmr(400mhz,cdcl3)δ7.75(d,j=7.7hz,1h),7.62-7.58(m,1h),7.54-7.47(m,1h),7.27-7.20(m,3h),7.17(t,j=7.3hz,1h),7.11-7.05(m,2h),4.63(s,1h),2.62-2.49(m,2h),1.92-1.81(m,4h),1.77-1.70(m,1h),1.39-1.28(m,2h),1.24-1.14(m,4h),0.96-0.88(m,
[0093]
13
c nmr(100mhz,cdcl3)δ142.8,141.6,135.9,133.3,129.3,128.49,128.46,126.0,123.2,121.5,67.5,41.1,40.5,35.6,31.8,25.2,23.3,22.4,14.0.
[0094]
hrms(esi)m/z calculated for c
21h27
nnao2s[m+na]
+
=380.1655,found
[0095]
=380.1657.
[0096]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=96/4,1.0ml/min,220nm,25℃),tr(major)=43.3min,tr(minor)=51.1min,97%ee.
[0097]
实施例6:
[0098]
本实施例利用式1f所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3f所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0099][0100]
具体制备步骤如下:
[0101]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0102]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1f(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3f,收率:88%,ee值为95%。
[0103]
对制备的产品3f进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0104]1h nmr(400mhz,cdcl3)δ7.74(d,j=7.8hz,1h),7.63(t,j=7.4hz,1h),7.51(t,j=7.5hz,1h),7.31(d,j=7.8hz,1h),5.77-5.61(m,1h),4.98-4.86(m,2h),4.76(s,1h),2.21-2.14(m,1h),2.03-1.93(m,2h),1.91-1.83(m,2h),1.77-1.69(m,1h),1.45-1.36(m,1h),1.20(s,4h),0.99-0.90(m,1h),0.80(t,j=6.5hz,3h).
[0105]
13
c nmr(100mhz,cdcl3)δ142.7,137.4,135.9,133.4,129.3,123.2,121.5,115.3,67.4,41.2,40.2,31.8,28.1,23.3,22.4,14.0.
[0106]
hrms(esi)m/z calculated for c
16h23
nnao2s[m+na]
+
=316.1342,found
[0107]
=316.1348.
[0108]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=18.0min,tr(major)=21.3min,95%ee.
[0109]
实施例7:
[0110]
本实施例利用式1g所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3g所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0111][0112]
具体制备步骤如下:
[0113]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0114]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1g(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3g,收率:66%,ee值为91%。
[0115]
对制备的产品3g进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0116]1h nmr(400mhz,cdcl3)δ7.70(d,j=7.8hz,1h),7.59(dd,j=11.1,3.9hz,1h),7.47(t,j=7.5hz,1h),7.28(d,j=7.8hz,1h),5.10(s,1h),3.29-3.25(m,2h),3.23(s,3h),1.92-1.78(m,4h),1.53-1.33(m,4h),1.22-1.12(m,4h),1.08-0.98(m,1h),0.96-0.85(m,1h),0.77(t,j=6.7hz,3h).
[0117]
13
c nmr(100mhz,cdcl3)δ142.9,135.9,133.2,129.1,123.2,121.3,72.4,67.5,58.4,41.0,40.7,31.7,29.3,23.2,22.3,20.4,14.0.
[0118]
hrms(esi)m/z calculated for c
17h27
nnao3s[m+na]
+
=348.1604,found
[0119]
=348.1605.
[0120]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=90/10,1.0ml/min,220nm,25℃),tr(minor)=16.1min,tr(major)=20.1min,91%ee.
[0121]
实施例8:
[0122]
本实施例利用式1h所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3h所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0123][0124]
具体制备步骤如下:
[0125]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0126]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1h(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3h,收率:86%,ee值为95%。
[0127]
对制备的产品3h进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0128]1h nmr(400mhz,cdcl3)δ7.75(d,j=7.7hz,1h),7.60(d,j=7.5hz,1h),7.51(d,j=7.5hz,1h),7.37-7.26(m,6h),5.20(s,1h),4.47(q,j=12.0hz,2h),3.44-3.36(m,2h),2.09-1.97(m,2h),1.89-1.80(m,2h),1.68-1.58(m,1h),1.47-1.33(m,2h),1.27-1.17(m,4h),1.04-0.94(m,1h),0.82(t,j=6.7hz,3h).
[0129]
13
c nmr(100mhz,cdcl3)δ143.2,138.2,136.3,133.3,129.2,128.5,127.9,127.8,123.3,121.5,73.1,69.7,67.3,41.6,37.5,31.8,24.0,23.4,22.5,14.1.
[0130]
hrms(esi)m/z calculated for c
22h29
nnao3s[m+na]
+
=410.1760,found
[0131]
=410.1769.
[0132]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(major)=33.3min,tr(minor)=35.8min,95%ee.
[0133]
实施例9:
[0134]
本实施例利用式1i所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3i所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0135][0136]
具体制备步骤如下:
[0137]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0138]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1i(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3i,收率:63%,ee值为97%。
[0139]
对制备的产品3i进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0140]1h nmr(400mhz,cdcl3)δ7.84-7.79(m,1h),7.59-7.53(m,2h),7.48-7.46(m,1h),7.26-7.22(m,2h),7.16-7.12(m,1h),7.09-7.06(m,1h),4.82(s,1h),2.49-2.41(m,1h),2.33-2.24(m,1h),2.01(s,3h),1.61-1.51(m,1h),1.36-1.28(m,4h),1.24-1.15(m,1h),0.86(t,j=7.1hz,3h).
[0141]
13
c nmr(100mhz,cdcl3)δ144.2,138.0,138.0,135.5,133.9,133.2,129.3,128.9,127.8,126.0,124.7,121.6,68.8,41.5,31.9,24.6,22.5,21.5,14.1.
[0142]
hrms(esi)m/z calculated for c
19h23
nnao2s[m+na]
+
=352.1342,found
[0143]
=352.1336.
[0144]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=9.7min,tr(major)=13.5min,97%ee.
[0145]
实施例10:
[0146]
本实施例利用式1j所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3j所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0147][0148]
具体制备步骤如下:
[0149]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干
燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0150]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1j(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3j,收率:78%,ee值为93%。
[0151]
对制备的产品3j进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0152]1h nmr(400mhz,cdcl3)δ7.75(d,j=7.6hz,1h),7.56-7.54(m,1h),7.51-7.47(m,1h),7.45-7.41(m,2h),7.25(d,j=7.9hz,1h),6.89-6.83(m,2h),4.92(s,1h),3.77(s,3h),2.41-2.34(m,1h),2.30-2.23(m,1h),1.52-1.41(m,1h),1.33-1.24(m,4h),1.09-1.00(m,1h),0.83(t,j=7.0hz,3h).
[0153]
13
c nmr(100mhz,cdcl3)δ159.3,144.1,134.6,133.5,129.3,127.5,124.4,121.4,114.3,68.7,55.4,40.5,31.8,23.8,22.5,14.1.
[0154]
hrms(esi)m/z calculated for c
19h23
nnao3s[m+na]
+
=368.1291,found
[0155]
=368.1290.
[0156]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=90/10,1.0ml/min,220nm,25℃),tr(major)=18.6min,tr(minor)=28.6min,93%ee.
[0157]
实施例11:
[0158]
本实施例利用式1k所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3k所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0159][0160]
具体制备步骤如下:
[0161]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0162]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1k(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3k,收率:82%,ee值为98%。
[0163]
对制备的产品3k进行1h nmr、
13
c nmr、
19
f nmr、hrms以及hplc表征,结果如下:
[0164]1h nmr(400mhz,cdcl3)δ7.83-7.78(m,1h),7.60-7.53(m,2h),7.42(dd,j=8.8,5.7hz,1h),7.09-7.04(m,1h),6.92-6.87m,1h),6.85-6.82(m,1h),4.88(s,1h),2.46-2.38
(m,1h),2.31-2.23(m,1h),1.99(s,3h),1.58-1.50(m,1h),1.34-1.25(m,4h),1.22-1.13(m,1h),0.85(t,j=7.1hz,3h).
[0165]
13
c nmr(100mhz,cdcl3)δ162.3(d,j=246.9hz),143.9,141.1(d,j=7.9hz),135.5,134.0(d,j=3.4hz),133.2,129.5(d,j=8.5hz),129.4,124.5,121.6,120.3(d,j=20.9hz),112.3(d,j=20.5hz),68.2,41.6,31.9,24.5,22.5,21.6,14.1.
[0166]
19
f nmr(377mhz,cdcl3)δ-114.33.
[0167]
hrms(esi)m/z calculated for c
19h22
fnnao2s[m+na]
+
=370.1247,found
[0168]
=370.1240.
[0169]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=93/7,1.0ml/min,220nm,25℃),tr(minor)=12.6min,tr(major)=14.6min,98%ee.
[0170]
实施例12:
[0171]
本实施例利用式1l所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3l所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0172][0173]
具体制备步骤如下:
[0174]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0175]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1l(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3l,收率:80%,ee值为98%。
[0176]
对制备的产品3l进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0177]1h nmr(400mhz,cdcl3)δ7.30-7.25(m,1h),7.21-7.19(m,2h),6.98(d,j=7.9hz,1h),4.78(s,1h),2.12-2.03(m,1h),1.85-1.78(m,1h),1.69(s,3h),1.36-1.24(m,6h),0.86(t,j=6.8hz,3h).
[0178]
13
c nmr(100mhz,cdcl3)δ145.0,129.2,127.8,126.6,125.8,119.3,63.1,42.5,31.7,28.7,23.1,22.5,14.1.
[0179]
hrms(esi)m/z calculated for c
13h19
nnao3s[m+na]
+
=292.0978,found
[0180]
=292.0970.
[0181]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(major)=11.2min,tr(minor)=13.3min,98%ee.
[0182]
实施例13:
[0183]
本实施例利用式1m所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的
格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3m所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0184][0185]
具体制备步骤如下:
[0186]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0187]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1m(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3m,收率:73%,ee值为95%。
[0188]
对制备的产品3m进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0189]1h nmr(400mhz,cdcl3)δ7.33-7.28(m,2h),7.27-7.25(m,1h),7.23-7.15(m,5h),7.05(dd,j=8.1,1.0hz,1h),4.74(s,1h),2.78-2.69(m,1h),2.67-2.58(m,1h),2.49-2.41(m,1h),2.20-2.06(m,2h),1.97-1.88(m,1h),1.29(d,j=14.2hz,6h),0.88-0.85(m,3h).
[0190]
13
c nmr(100mhz,cdcl3)δ150.7,141.0,129.4,128.8,128.5,126.6,126.5,126.4,125.9,119.5,66.1,42.9,40.7,31.8,30.0,23.1,22.5,14.1.
[0191]
hrms(esi)m/z calculated for c
20h25
nnao3s[m+na]
+
=382.1447,found
[0192]
=382.1438.
[0193]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=16.9min,tr(major)=18.6min,95%ee.
[0194]
实施例14:
[0195]
本实施例利用式1n所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3n所示的手性苯并六元磺酰胺类化合物。反应式如下:
[0196][0197]
具体制备步骤如下:
[0198]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0199]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1n(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3n,收率:94%,ee值为99%。
[0200]
对制备的产品3n进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0201]1h nmr(400mhz,cdcl3)δ7.06(d,j=8.3hz,1h),6.96(s,1h),6.86(d,j=8.3hz,1h),4.76(s,1h),2.33(s,3h),2.08-2.02(m,1h),1.83-1.75(m,1h),1.67(s,3h),1.35-1.25(m,6h),0.87(t,j=6.6hz,3h).
[0202]
13
c nmr(100mhz,cdcl3)δ147.9,135.4,129.9,127.4,126.8,119.0,63.1,42.4,31.8,28.6,23.1,22.5,21.1,14.1.
[0203]
hrms(esi)m/z calculated for c
14h21
nnao3s[m+na]
+
=306.1134,found
[0204]
=306.1128.
[0205]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=8.8min,tr(major)=10.4min,99%ee.
[0206]
实施例15:
[0207]
本实施例利用式1o所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3o所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0208][0209]
具体制备步骤如下:
[0210]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0211]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1o(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3o,收率:85%,ee值为89%。
[0212]
对制备的产品3o进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0213]1h nmr(400mhz,cdcl3)δ7.22(t,j=8.3hz,1h),6.74(d,j=8.3hz,1h),6.62(d,j=8.3hz,1h),4.74(s,1h),3.85(s,3h),2.42-2.32(m,1h),1.85(t,j=12.6hz,1h),1.77(s,3h),1.30-1.24(m,5h),1.13(dd,j=10.9,7.1hz,1h),0.85(t,j=6.5hz,3h).
[0214]
13
c nmr(100mhz,cdcl3)δ157.0,151.2,129.2,115.8,112.0,108.5,64.0,55.9,38.8,31.8,25.9,23.4,22.5,14.1.
[0215]
hrms(esi)m/z calculated for c
14h21
nnao4s[m+na]
+
=322.1083,found
[0216]
=322.1078.
[0217]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=8.8min,tr(major)=10.6min,89%ee.
[0218]
实施例16:
[0219]
本实施例利用式1p所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3p所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0220][0221]
具体制备步骤如下:
[0222]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0223]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1p(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3p,收率:65%,ee值为97%。
[0224]
对制备的产品3p进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0225]1h nmr(400mhz,cdcl3)δ7.19(dd,j=8.5,1.9hz,1h),7.12(d,j=8.5hz,1h),6.99(d,j=1.9hz,1h),4.87(s,1h),2.07-2.00(m,1h),1.80-1.76(m,1h),1.67(s,3h),1.35-1.28(m,6h),0.87(t,j=6.6hz,3h).
[0226]
13
c nmr(100mhz,cdcl3)δ150.2,134.3,127.6,126.4,126.1,119.5,63.0,42.4,31.7,28.6,23.1,22.5,14.1.
[0227]
hrms(esi)m/z calculated for c
13h18
clnnao3s[m+na]
+
=326.0588,found
[0228]
=326.0586.
[0229]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=8.6min,tr(major)=10.4min,97%ee.
[0230]
实施例17:
[0231]
本实施例利用式1q所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3q所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0232]
[0233]
具体制备步骤如下:
[0234]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0235]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1q(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3q,收率:80%,ee值为93%。
[0236]
对制备的产品3q进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0237]1h nmr(400mhz,cdcl3)δ7.51(d,j=7.8hz,1h),7.15(d,j=7.9hz,1h),7.07(t,j=7.9hz,1h),4.96(s,1h),2.13-2.03(m,1h),1.86-1.76(m,1h),1.70(s,3h),1.35-1.28(m,6h),0.87(t,j=6.3hz,3h).
[0238]
13
c nmr(100mhz,cdcl3)δ146.8,133.1,129.9,126.3,125.7,113.1,63.5,42.5,31.7,28.7,23.1,22.5,14.1.
[0239]
hrms(esi)m/z calculated for c
13h18
brnnao3s[m+na]
+
=370.0083,found=370.0083.
[0240]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=10.8min,tr(major)=16.1min,93%ee.
[0241]
实施例18:
[0242]
本实施例利用式1r所示的n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3r所示的手性磺酰胺类化合物。反应式如下:
[0243][0244]
具体制备步骤如下:
[0245]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0246]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1r(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3r,收率:85%,ee值为95%。
[0247]
对制备的产品3r进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0248]1h nmr(400mhz,cdcl3)δ7.45(dd,j=8.4,1.1hz,2h),7.35(t,j=7.7hz,2h),7.27-7.23(m,1h),4.04(s,1h),2.04-1.97(m,2h),1.82(s,3h),1.39(s,9h),1.26-1.19(m,
5h),1.12-1.06(m,1h),0.87-0.79(m,3h).
[0249]
13
c nmr(100mhz,cdcl3)δ145.9,128.4,127.1,125.8,63.2,60.1,43.9,32.0,25.8,24.5,24.0,22.5,14.1.
[0250]
hrms(esi)m/z calculated for c
17h29
nnao2s[m+na]
+
=334.1811,found=334.1807.
[0251]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,0.5ml/min,220nm,25℃),tr(major)=11.2min,tr(minor)=13.1min,95%ee.
[0252]
实施例19:
[0253]
本实施例利用式1s所示的n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3s所示的手性磺酰胺类化合物。反应式如下:
[0254][0255]
具体制备步骤如下:
[0256]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0257]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1s(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3s,收率:73%,ee值为95%。
[0258]
对制备的产品3s进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0259]1h nmr(400mhz,cdcl3)δ7.33(d,j=8.2hz,2h),7.15(d,j=8.2hz,2h),3.99(s,1h),2.33(s,3h),2.04-1.93(m,2h),1.80(s,3h),1.39(s,9h),1.25-1.21(m,5h),1.15-1.02(m,1h),0.83(t,j=6.7hz,3h).
[0260]
13
c nmr(100mhz,cdcl3)δ143.0,136.7,129.1,125.6,63.1,60.1,43.8,32.1,25.8,24.5,24.1,22.6,21.0,14.1.
[0261]
hrms(esi)m/z calculated for c
18h31
nnao2s[m+na]
+
=348.1968,found=348.1968.
[0262]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,0.5ml/min,220nm,25℃),tr(major)=11.7min,tr(minor)=10.5min,95%ee.
[0263]
实施例20:
[0264]
本实施例利用式1t所示的n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3t所示的手性磺酰胺类化合物。反应式如下:
[0265][0266]
具体制备步骤如下:
[0267]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0268]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1t(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3t,收率:85%,ee值为94%。
[0269]
对制备的产品3t进行1h nmr、
13
c nmr、
19
f nmr、hrms以及hplc表征,结果如下:
[0270]1h nmr(400mhz,cdcl3)δ7.71-7.65(m,2h),7.49(dt,j=15.4,7.7hz,2h),4.06(s,1h),1.94-1.88(m,2h),1.86(s,3h),1.38(s,9h),1.27-1.18(m,5h),1.10-1.04(m,1h),0.86-0.80(m,3h).
[0271]
13
c nmr(100mhz,cdcl3)δ147.1,130.6(q,j=31.8hz),129.4,128.8,124.3(q,j=270.7hz),123.9(q,j=3.6hz),122.8(q,j=3.8hz),62.6,60.3,44.7,31.9,25.4,24.5,23.7,22.5,14.0.
[0272]
19
f nmr(377mhz,cdcl3)δ-62.54.
[0273]
hrms(esi)m/z calculated for c
18h28
f3nnao2s[m+na]
+
=402.1685,found
[0274]
=402.1686.
[0275]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,0.5ml/min,210nm,25℃),tr(major)=9.5min,tr(minor)=12.7min,94%ee.
[0276]
实施例21:
[0277]
本实施例利用式1u所示的n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3u所示的手性磺酰胺类化合物。反应式如下:
[0278][0279]
具体制备步骤如下:
[0280]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0281]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1u(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3u,收率:72%,ee值为95%。
[0282]
对制备的产品3u进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0283]1h nmr(400mhz,cdcl3)δ7.28(dd,j=5.1,3.0hz,1h),7.17(dd,j=3.0,1.4hz,1h),7.10(dd,j=5.1,1.4hz,1h),3.99(s,1h),1.98(q,j=5.3hz,2h),1.79(s,3h),1.36(s,9h),1.28-1.13(m,6h),0.87-0.81(m,3h).
[0284]
13
c nmr(100mhz,cdcl3)δ147.8,126.1,126.0,120.9,61.4,60.1,43.7,32.0,26.2,24.5,24.1,22.6,14.1.
[0285]
hrms(esi)m/z calculated for c
15h27
nnao2s2[m+na]
+
=340.1375,found
[0286]
=340.1371.
[0287]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,0.5ml/min,220nm,25℃),tr(major)=11.8min,tr(minor)=13.9min,95%ee.
[0288]
实施例22:
[0289]
本实施例利用式1v所示的n-磺酰基酮亚胺类化合物与式2a所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3v所示的手性磺酰胺类化合物。反应式如下:
[0290][0291]
具体制备步骤如下:
[0292]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0293]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1v(0.2mmol)、乙醚(1.0ml)和格氏试剂2a(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3v,收率:76%,ee值为94%。
[0294]
对制备的产品3v进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0295]1h nmr(400mhz,cdcl3)δ7.34(dd,j=1.7,0.7hz,1h),6.30(dd,j=3.3,1.8hz,1h),6.23(dd,j=3.3,0.7hz,1h),4.06(s,1h),2.00-1.91(m,2h),1.73(s,3h),1.30(s,9h),1.28-1.20(m,5h),1.13-1.04(m,1h),0.84(t,j=6.9hz,3h).
[0296]
13
c nmr(100mhz,cdcl3)δ157.2,141.5,110.4,106.6,60.2,59.4,42.2,31.9,24.3,23.9,23.7,22.6,14.1.
[0297]
hrms(esi)m/z calculated for c
15h27
nnao3s[m+na]
+
=324.1604,found
[0298]
=324.1604.
[0299]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,0.5ml/min,220nm,25℃),tr(major)=10.6min,tr(minor)=12.4min,94%ee.
[0300]
实施例23:
[0301]
本实施例利用式1a所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2b所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3w所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0302][0303]
具体制备步骤如下:
[0304]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0305]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1a(0.2mmol)、乙醚(1.0ml)和格氏试剂2b(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3w,收率:89%,ee值为90%。
[0306]
对制备的产品3w进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0307]1h nmr(400mhz,cdcl3)δ7.73(d,j=7.8hz,1h),7.64-7.60(m,1h),7.52-7.48(m,1h),7.34(d,j=7.8hz,1h),4.72(s,1h),1.91-1.81(m,2h),1.61(s,3h),1.45-1.34(m,1h),1.28(dd,j=14.7,7.4hz,2h),1.13-1.02(m,1h),0.84(t,j=7.3hz,3h).
[0308]
13
c nmr(100mhz,cdcl3)δ145.0,135.4,133.4,129.2,123.1,121.4,64.1,41.6,28.5,26.2,22.7,14.0.
[0309]
hrms(esi)m/z calculated for c
12h17
nnao2s[m+na]
+
=262.0872,found
[0310]
=262.0873.
[0311]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=90/10,1.0ml/min,220nm,25℃),tr(minor)=12.1min,tr(major)=16.6min,90%ee.
[0312]
实施例24:
[0313]
本实施例利用式1a所示的苯并五元环状n-磺酰基酮亚胺类化合物与式2c所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3x所示的手性苯并五元环状磺酰胺类化合物。反应式如下:
[0314]
[0315]
具体制备步骤如下:
[0316]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0317]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1a(0.2mmol)、乙醚(1.0ml)和格氏试剂2c(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3x,收率:72%,ee值为90%。
[0318]
对制备的产品3x进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0319]1h nmr(400mhz,cdcl3)δ7.74(d,j=7.8hz,1h),7.64-7.60(m,1h),7.53-7.49(m,1h),7.34(d,j=7.8hz,1h),5.76-5.66(m,1h),5.00-4.91(m,2h),4.69(s,1h),2.02(q,j=7.1hz,2h),1.92-1.81(m,2h),1.62(s,3h),1.59-1.50(m,1h),1.24-1.15(m,1h).
[0320]
13
c nmr(100mhz,cdcl3)δ144.8,138.0,135.4,133.5,129.3,123.1,121.4,115.4,64.0,41.3,33.5,28.5,23.4.
[0321]
hrms(esi)m/z calculated for c
13h17
nnao2s[m+na]
+
=274.0872,found
[0322]
=274.0869.
[0323]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=90/10,1.0ml/min,220nm,25℃),tr(minor)=13.3min,tr(major)=18.3min,90%ee.
[0324]
实施例25:
[0325]
本实施例利用式1l所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2d所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3y所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0326][0327]
具体制备步骤如下:
[0328]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0329]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1l(0.2mmol)、乙醚(1.0ml)和格氏试剂2d(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3y,收率:93%,ee值为91%。
[0330]
对制备的产品3y进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0331]1h nmr(400mhz,cdcl3)δ7.31-7.26(m,1h),7.24-7.17(m,2h),7.03-6.96(m,1h),4.79(s,1h),2.20-2.11(m,1h),1.92-1.83(m,1h),1.69(s,3h),0.94(t,j=7.4hz,3h).
[0332]
13
c nmr(100mhz,cdcl3)δ150.0,129.2,127.6,126.6,125.8,119.2,63.3,35.2,
28.2,7.9.
[0333]
hrms(esi)m/z calculated for c
10h13
nnao3s[m+na]
+
=250.0508,found
[0334]
=250.0502.
[0335]
hplc拆分条件(daicel chiralpak ic,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=18.8min,tr(major)=22.7min,91%ee.
[0336]
实施例26:
[0337]
本实施例利用式1l所示的苯并六元环状n-磺酰基酮亚胺类化合物与式2e所示的格氏试剂在铜盐、手性膦配体以及溶剂存在下,进行不对称加成反应得到式3z所示的手性苯并六元环状磺酰胺类化合物。反应式如下:
[0338][0339]
具体制备步骤如下:
[0340]
步骤1,将手性配体l5(0.015mmol),噻吩-2-甲酸亚铜(cutc)(0.010mmol),加入干燥的史莱克管中,氮气氛围下加入乙醚(1.0ml),室温下搅拌反应1h,制得催化剂[cu]/l5的乙醚溶液;
[0341]
步骤2,在上面所制备的催化剂中[cu]/l5的乙醚溶液,降温至-78℃,依次加入底物1l(0.2mmol)、乙醚(1.0ml)和格氏试剂2e(2mol/l in et2o)(0.3ml,0.6mmol),反应24h后,加入饱和氯化铵(3ml),用乙酸乙酯(10ml
×
3)萃取,分出的有机相经浓缩,柱层析分离制得3z,收率:89%,ee值为98%。
[0342]
对制备的产品3z进行1h nmr、
13
c nmr、hrms以及hplc表征,结果如下:
[0343]1h nmr(400mhz,cdcl3)δ7.32-7.27(m,1h),7.25-7.19(m,2h),7.00(d,j=8.1hz,1h),4.82(s,1h),2.14-2.04(m,1h),1.87-1.81(m,1h),1.71(s,3h),1.34-1.24(m,10h),0.89(t,j=6.7hz,3h).
[0344]
13
c nmr(100mhz,cdcl3)δ150.0,129.2,127.8,126.6,125.8,119.3,63.1,42.5,31.8,29.6,29.2,28.7,23.5,22.7,14.2.
[0345]
hrms(esi)m/z calculated for c
15h23
nnao3s[m+na]
+
=320.1291,found
[0346]
=320.1298.
[0347]
hplc拆分条件(daicel chiralpak od-h,hexane/i-proh=95/5,1.0ml/min,220nm,25℃),tr(minor)=8.8min,tr(major)=11.4min,98%ee.
[0348]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1