三苯基鏻-羟基酪醇及其合成方法以及在制备抑制癌细胞增殖药物中的应用
1.本发明涉及生物学和医药学领域,特别涉及三苯基鏻-羟基酪醇(tpp-ht)及其合成方法以及在制备抑制癌细胞增殖药物中的应用。
背景技术:
2.线粒体是一种存在于大多数细胞中的由两层膜包被的细胞器,是细胞中制造能量的结构,是细胞进行有氧呼吸的主要场所,被称为"发电站"。大量的研究表明,线粒体功能障碍与许多的病理学有关。线粒体的药物靶向性是一种有吸引力的治疗方法,并已证明具有治疗效果。因此,合成和表征选择性靶向线粒体的新化合物具有很高的转化价值。
3.线粒体代谢和功能的改变是癌症的标志,并且伴随着增殖增强和代谢重组。1966年6月30日,warburg发表了题为《癌症的主要原因与预防》(the prime cause and prevention ofcancer)的演讲,明确提到"癌症的主要原因是正常体细胞的有氧呼吸被糖酵解所替代",这一转变也被称为“warburg效应”。此外,癌细胞线粒体在功能上与正常线粒体不同,如活性氧(ros)的异常产生、线粒体生物发生缺陷、线粒体动力学的破坏、细胞atp/adp比率和nad+水平的降低以及线粒体信号通路的改变。因此,靶向线粒体代谢可能是抑制细胞增殖和减少癌发生的分子机制,并有助于揭示新的药理学靶点和开发新的癌症治疗策略。
4.羟基酪醇(ht)是一种具有抗氧化活性的酚类化合物。羟基酪醇处理可抑制结肠癌、乳腺癌、肝癌和前列腺癌细胞的增殖。研究表明,羟基酪醇诱导前列腺癌细胞产生大量的超氧阴离子,导致线粒体数量和线粒体dna含量下降,线粒体功能发生紊乱,如线粒体膜电位降低、细胞内atp含量的减少以及呼吸耗氧能力下降。
5.但是羟基酪醇(ht)在抗癌方面也存在一些缺陷,一是抗癌活性较低需要较高的浓度,二是线粒体靶向性较弱不能在线粒体中选择性积累。因此挖掘更多效能更好的在抗癌方面的天然物质具有重要的意义和前景。
技术实现要素:
6.为了解决上述问题,本发明的目的在于提供三苯基鏻-羟基酪醇及其合成方法以及在制备抑制癌细胞增殖药物中的应用,羟基酪醇衍生物通过与三苯基鏻(tpp)结合生成三苯基鏻-羟基酪醇(tpp-ht),能够选择性地穿过线粒体膜并在线粒体内积累,从而进一步抑制癌细胞的增殖。
7.为了达到上述目的,本发明所采用的技术方案是:
8.三苯基鏻-羟基酪醇,其结构式为:
[0009][0010]
三苯基辚羟基酪醇的合成方法,反应流程如下:
[0011][0012]
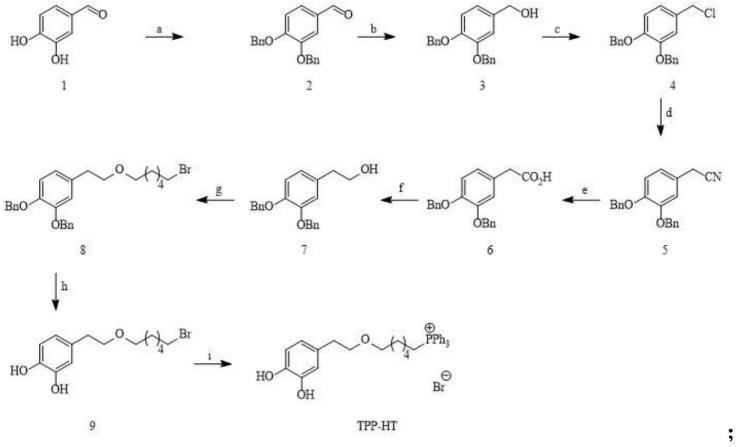
使用3,4-二羟基苯甲醛(1)作为原料,经溴化苄保护反应得到二苄氧基化合物(2);二苄氧基化合物(2)被nabh4还原成苯甲醇(3),苯甲醇(3)被氯化成氯化物(4);氯化物(4)与氰化钾反应得腈类化合物(5);腈类化合物(5)被氢化钠水解得到羧酸化合物(6);用lialh4还原羧酸化合物(6)得到二苄氧基羟基酪醇(7);二苄氧基羟基酪醇(7)与1,6-二溴己烷反应得到溴化物(8);以溴化物(8)为原料,经et3sih还原脱保护反应得到中间体溴化物(9);溴化物(9)与三苯基鏻反应得到目标物三苯基鏻-羟基酪醇三苯基辚羟基酪醇tpp-ht。
[0013]
三苯基鏻-羟基酪醇在制备抑制癌细胞增殖药物中的应用,三苯基辚羟基酪醇tpp-ht穿过线粒体膜并在线粒体内积累,对癌细胞具有抑制增殖和诱导凋亡作用。
[0014]
三苯基辚羟基酪醇tpp-ht对癌细胞糖酵解和tca循环代谢的重塑作用。
[0015]
三苯基辚羟基酪醇tpp-ht对癌细胞线粒体氧化磷酸化具有抑制作用以及对线粒体融合和分裂动力学的损伤作用。
[0016]
三苯基辚羟基酪醇tpp-ht对癌细胞脂肪酸从头合成的抑制作用和对脂滴积累的促进作用。
[0017]
本发明的优点:tpp-ht与羟基酪醇相比,能够选择性地穿过线粒体膜并在线粒体内积累,从而进一步抑制癌细胞的增殖。tpp-ht诱导ros生成和癌细胞凋亡、促进癌细胞糖酵解和tca循环代谢、损伤癌细胞线粒体能量代谢和动态变化以及抑制脂肪酸从头合成并造成脂滴积累,从而抑制线粒体功能和细胞增殖。
附图说明
[0018]
图1是tpp-ht的结构式以及合成过程。
[0019]
图2是tpp-ht对多种癌细胞系增殖的抑制作用示意图,其中图2中的(a)是不同癌
细胞系用不同浓度tpp-ht处理48h后的细胞存活率。图2中的(b)是不同癌细胞系在各自ic50浓度处理不同时间的细胞存活率,图2中的(c)是不同癌细胞系用不同浓度tpp-ht处理后的细胞计数,数据表示为平均值
±
sem(n=4)(***p《0.001,**p《0.01,*p《0.05)。
[0020]
图3是tpp-ht对癌细胞的凋亡和ros诱导作用并调节nrf2依赖的抗氧化防御系统,其中图3中的(a)是tpp-ht(20μm)处理24h后,通过westernblot测定癌细胞中cleaved-parp和cleaved-caspase3的表达水平;图3中的(b)是tpp-ht(20μm)处理24h后,用dcfh-da测定癌细胞中的ros水平;图3中的(c)是tpp-ht(20μm)处理24h后,通过westernblot测定癌细胞中nrf2、catalase和sod2的表达水平,数据表示为平均值
±
sem(n=3)(***p《0.001,**p《0.01,*p《0.05)。
[0021]
图4是tpp-ht对癌细胞糖酵解和tca循环代谢的重塑作用。其中,图4中的(a)是tpp-ht(20μm)处理24h后,通过定量rt-pcr测定癌细胞中葡萄糖代谢相关酶的mrna表达水平;图4中的(b)是tpp-ht(20μm)处理24h后测定癌细胞的乳酸分泌;图4中的(c)是tpp-ht(20μm)处理24h后,通过定量rt-pcr测定癌细胞中tca循环主要代谢酶mrna表达水平;数据表示为平均值
±
sem(n=3)(***p《0.001,**p《0.01,*p《0.05)。
[0022]
图5是tpp-ht对癌细胞线粒体能量代谢和动态变化的损伤作用。其中,图5中的(a)是tpp-ht(20μm)处理24h后,通过jc-1测定癌细胞的mmp水平;n=5;图5中的(b)是tpp-ht(20μm)处理24h后测定癌细胞的atp水平;n=3。图5中的(c)是tpp-ht(20μm)处理24h后,通过westernblot测定癌细胞中etc复合亚基的蛋白表达水平;n=3;数据表示为平均值
±
sem。(***p《0.001,**p《0.01,*p《0.05)。
[0023]
图6是tpp-ht对癌细胞脂肪酸从头合成的抑制作用和脂滴积累作用。其中,图6中的(a)是tpp-ht(20μm)处理24h后,通过westernblot测定癌细胞脂肪酸从头合成酶(acc、fasn和srebp1)的表达水平;图6中的(b)是tpp-ht(20μm)处理24h后,通过定量rt-pcr测定癌细胞中脂肪酸从头合成酶的mrna表达水平;图6中的(c)是tpp-ht(20μm)处理24h后,使用nile red对癌细胞进行脂滴染色;图6中的(d)是tpp-ht(20μm)处理24h后,通过定量rt-pcr测定癌细胞中plin1、plin2和plin3 mrna表达水平;数据表示为平均值
±
sem(n=3)(***p《0.001,**p《0.01,*p《0.05)。
具体实施方式
[0024]
下面结合附图以及实验对本发明做详细叙述。
[0025]
1、tpp-ht合成流程中反应试剂和条件如下:
[0026]
如图1所示。以3,4-二羟基苯甲醛(1)为原料,分9步合成tpp-ht。合成步骤的总收率约为23%。
[0027]
步骤a:3,4-二(苄氧基)苯甲醛(2)
[0028]
向化合物1(15.18g,110mmol)的丙酮(250ml)溶液中加入苄基溴(34.54g,220mmol)和碳酸钾(45.6g,330mmol),在60℃搅拌过夜。反应完成后,将挥发成分真空蒸发,残留物用ch2cl2(3x 200ml)萃取。合并的有机层用无水na2so4干燥并蒸发至干。使用环己烷/乙酸乙酯:4/1的混合物作为洗脱液,在硅胶上进行快速色谱,得到32.5g(93%)化合物3,4-二(苄氧基)苯甲醛(2)。1h nmr(600mhz,cdcl3)δ9.82(s,1h),7.50(d,j=1.8hz,1h),7.46(t,j=7.6hz,2h),7.45(d,j=8.2hz,2h),7.42(dd,j=8.2,1.9hz,1h),7.38(d,j=
8.2hz,2h),7.37(t,j=7.6hz,2h),7.33(t,j=7.6hz,2h),7.32(t,j=7.6hz,2h),7.03(d,j=8.2hz,1h),5.26(s,2h),5.22(s,2h).
13
c nmr(151mhz,cdcl3)δ190.9,154.5,149.4,136.7,136.4,130.5,128.8,128.71,128.6,128.2,128.1,127.5,127.2,126.7,113.4,112.8,71.2,71.1.
[0029]
步骤b:(3,4-二(苄氧基)苯基)甲醇(3)
[0030]
在0℃下向化合物2(18g,56.7mmol)的甲醇(150ml)逐份添加nabh4(3.21g,84.9mmol),并将所得混合物在室温下搅拌2h。反应完成后,加入饱和nahco3(400ml)和乙酸乙酯(800ml),并将混合物在室温下继续搅拌20min。除去有机层后用乙酸乙酯(3x 200ml)洗涤水层。合并洗涤的有机层并用无水na2so4干燥并蒸发至干。使用环己烷/乙酸乙酯:6/1的混合物作为洗脱液,在硅胶上进行快速色谱,得到16.15g(89%)化合物(3,4-二(苄氧基)苯基)甲醇(3)。
[0031]
步骤c:((4-(氯甲基)-1,2-亚苯基)双(氧基))双(亚甲基))二苯(4)
[0032]
在0℃下向化合物3(16g,50mmol)苯溶液(150ml)中滴加亚硫酰氯(7.3ml,100mmol),并将所得混合物在室温下搅拌6h。反应完成后,将混合物小心地倒入冰水(150ml)中并搅拌5min。除去有机层,并用乙酸乙酯(3x100 ml)洗涤水层。合并洗涤的有机层并用无水na2so4干燥并蒸发至干。使用环己烷/乙酸乙酯:10/1的混合物作为洗脱液,在硅胶上进行快速色谱,得到14.2g(84%)化合物((4-(氯甲基)-1,2-亚苯基)双(氧基))双(亚甲基))二苯(4)。1h nmr(600mhz,cdcl3)δ7.45(t,j=7.6hz,4h),7.37(t,j=7.6hz,5h),7.29
–
7.32(m,3h),6.93(d,j=1.8hz,1h),6.91(d,j=8.2hz,1h),6.81(dd,j=8.2,1.8hz,1h),5.15(d,j=8.2hz,4h),3.55(s,2h).
13
c nmr(151mhz,cdcl3)δ177.7,149.2,148.6,137.5,137.3,128.6,127.9,127.6,127.4,126.7,122.6,116.6,115.4,71.6.
[0033]
步骤d:2-(3,4-双(苄氧基)苯基)乙腈(5)
[0034]
向化合物4(14g,42.5mmol)的dmso(30ml)溶液中加入kcn(11g,170mmol),并将混合物在室温下搅拌12h。反应完成后,将混合物倒入冰水(150ml)中,然后用乙酸乙酯(3x 100ml)洗涤。合并洗涤的有机层并用无水na2so4干燥并蒸发至干。使用环己烷/乙酸乙酯:8/1的混合物作为洗脱液,在硅胶上进行快速色谱,得到9.9g(71%)化合物2-(3,4-双(苄氧基)苯基)乙腈(5)。1h nmr(600mhz,cdcl3)δ7.48(t,j=7.6hz,2h),7.47(d,j=8.2hz,2h),7.39(t,j=7.6hz,2h),7.38(d,j=8.2hz,2h),7.35(t,j=7.6hz,1h),7.34(t,j=7.6hz,1h),6.94(d,j=8.2hz,1h),6.93(s,1h),6.83(dd,j=8.2,1.9hz,1h),5.17(d,j=8.2hz,4h),3.61(s,2h).
13
c nmr(151mhz,cdcl3)δ149.5,148.8,137.1,136.9,128.6,128.0,127.9,127.5,127.4,123.1,121.07,118.1,115.5,114.9,71.5,71.42423.1.
[0035]
步骤e:2-(3,4-双(苄氧基)苯基)乙酸(6)
[0036]
向化合物5(7g,20.11mmol)的乙醇(30ml)溶液中加入40ml 40%naoh溶液,并将所得混合物在75℃下搅拌14h。反应完成后,将混合物倒入冰水(200ml)中,用9%hcl酸化,并用ch2cl2(3x 100ml)洗涤。合并洗涤的有机层并用无水na2so4干燥并蒸发至干。使用环己烷/乙酸乙酯:2/1的混合物作为洗脱液,在硅胶上进行快速色谱,得到5.39g(77%)化合物2-(3,4-双(苄氧基)苯基)乙酸(6)。1h nmr(600mhz,cdcl3)δ7.44(t,j=7.6hz,4h),7.35(t,j=7.6hz,4h),7.31(d,j=4.8,1h),7.29(d,j=4.8,1h),6.92(d,j=1.9hz,1h),6.90(d,j=8.2hz,1h),6.80(d,j=8.2,4h).,3.55(s,2h).
13
c nmr(151mhz,cdcl3)δ177.2,149.2,
148.6,137.5,137.3,128.6,127.9,127.6,127.4,126.7,122.6,116.6,115.4,71.6,40.6.
[0037]
步骤f:2-(3,4-双(苄氧基)苯基)乙烷-1-醇(7)
[0038]
将化合物6(672mg,4mmol)加入氢化锂铝(331μl,8mmol)的四氢呋喃溶液中,并在室温下搅拌2h。反应混合物过滤真空蒸发,得到化合物2-(3,4-双(苄氧基)苯基)乙烷-1-醇(7)。1h nmr(600mhz,cdcl3)δ7.45(d,j=8.2hz,4h),7.36(t,j=7.6hz 4h),7.30(d,j=8.2,1h),7.29(d,j=8.2,1h),6.89(d,j=8.2,1h),6.83(d,j=1.9hz,1h),6.74(dd,j=8.2,1.9hz,1h),5.14(t,j=7.1hz,4h),3.78(t,j=7.1hz,2h),2.76(t,j=7.1hz,2h).
13
c nmr(151mhz,cdcl3)δ149.2,148.0,137.6,137.5,132.1,128.6,127.9,127.9,127.6,127.5,122.1,116.5,115.8,71.7,71.6,63.8,38.8.
[0039]
步骤g:((4-(2-((6-溴己基)氧基)乙基)-1,2-亚苯基)双(氧基))双(亚甲基))二苯(8)
[0040]
将化合物7(666mg,2mmol)、nah(85mg,3mmol)和1,6-二溴己烷(461μl,3mmmol)加入二甲基甲酰胺中,并将悬浊液在室温下搅拌24h。反应结束后,将混合物进行真空蒸发,并用柱色谱法(硅胶60mm)纯化残余物,使用环己烷/乙酸乙酯:6/1作为洗脱剂,得到化合物((4-(2-((6-溴己基)氧基)乙基)-1,2-亚苯基)双(氧基))双(亚甲基))二苯(8)。1h nmr(600mhz,cdcl3)δ7.45(t,j=7.3hz,4h),7.36(q,j=6.7hz,4h),7.31(q,j=6.8,6.0hz,2),6.90
–
6.84(m,2h),6.75(d,j=8.0hz,1h),5.14(d,j=9.3hz,4h),3.57(t,j=7.2hz,2h),3.43
–
3.38(m,41h),2.79(t,j=7.2hz,2h),2.07(q,j=7.2hz,1h),1.84
–
1.88(m,1h),1.55
–
1.61(m,2h),1.42
–
1.49(m,2h),1.34
–
1.39(m,21h).
13
c nmr(151mhz,cdcl3)δ149.1,147.7,147.7,138.9,137.7,137.7,137.61,132.9,132.9,128.6,127.9,127.9,127.8,127.5,127.5,121.9,121.9,116.5,116.44,115.62,115.6,114.6,77.4,77.2,76.9,72.0,71.8,71.7,71.6,71.6,71.1,70.9,70.9,36.0,33.9,33.7,32.8,32.6,29.6,29.7,29.3,28.1,27.4,26.2,25.7,25.5.
[0041]
步骤h:4-(2-(6-溴己基)氧基)乙基)苯-1,2-二醇(9)
[0042]
向化合物8(996mg,2mmol)的甲醇溶液中加入钯碳pd/c(200mg)和三乙基硅烷(4.64g,40mmol),室温下将混合物置于氩气中搅拌14h。将混合物进行真空浓缩后,加入水(50ml),并用乙酸乙酯(3x 20ml)洗涤。合并洗涤的有机层并用无水na2so4干燥,通过快速柱色谱法(硅胶60mm)浓缩和纯化,使用环己烷/乙酸乙酯:3/1作为洗脱剂,得到化合物4-(2-(6-溴己基)氧基)乙基)苯-1,2-二醇(9)。1h nmr(600mhz,cdcl3)δ6.74(s,j=8.2hz,1h),6.70(d,j=1.9hz,1h),6.62(m,2h),3.62(t,j=7.1hz 2h),3.46(t,j=7.1hz 2h),3.39(t,j=7.1hz 2h),2.76(t,j=7.1hz 2h),1.(m,2h),1.58(m,2h),1.42(m,2h),1.34(m,2h).
13
c nmr(151mhz,cdcl3)δ143.9,142.3,131.8,121.2,116.1,115.4,72.1,71.4,71.0,68.2,35.6,33.9,32.8,31.8,29.7,29.5,28.1,25.9,25.7,25.4,22.7,14.1.步骤i:(6-(3,4-二羟基苯乙氧基)己基)三苯基溴化鏻(10)(tpp-ht)
[0043]
将化合物9(670mg,234mmol)、三苯基膦(1.1g,4.2mmol)和乙腈混合物在82℃搅拌24h。将混合物进行真空浓缩后,用乙醚洗涤3次并过滤,得到标题化合物(6-(3,4-二羟基苯乙氧基)己基)三苯基溴化鏻(10)(tpp-ht)。1h nmr(600mhz,dmso-d6)δ8.62(s,1h),7.89(tt,j=7.1,1.8hz,1h),7.85
–
7.68(m,6h),6.64
–
6.54(m,1h),6.43(dd,j=7.9,2.1hz,0h),3.61
–
3.49(m,1h),3.44(t,j=7.1hz,1h),3.31(t,j=6.5hz,3h),2.58(t,j=7.1hz,
1h),1.49
–
1.56(m,j=7.8hz,2h),1.49
–
1.37(m,2h),1.27-1.31(m,2h).
13
cnmr(151mhz,dmso-d6)δ144.9,143.4,134.8,134.8,133.5,133.5,130.2,130.1,129.7,119.3,118.8,118.2,116.2,115.3,71.3,69.7,59.7,40.1,39.9,39.9,39.8,39.7,39.5,39.4,39.2,39.1,34.9,29.6,29.5,28.8,24.8,21.7,21.7,20.7,20.4,20.0,14.0.
[0044]
2、tpp-ht处理方法
[0045]
tpp-ht的结构式参照图1。tpp-ht溶解到二甲基亚砜中配成100mm母液。当处理细胞时候用培养基配成相应的工作浓度,对照组用dmso处理。
[0046]
1.c4-2细胞培养与处理方法
[0047]
人前列腺癌细胞系pc3和c4-2细胞、非小细胞肺癌细胞系h1975、卵巢癌细胞系skov3和宫颈癌细胞系hela购于atcc,使用含10%胎牛血清和1%双抗的dmem(hela)和rpmi-1640(pc3、c4-2、h1975和skov3)培养基。所有细胞系培养在含5%co2的37℃培养箱中。当汇合度达到90%左右,用0.25%胰蛋白酶消化,消化结束后加入新鲜完全培养基终止消化。
[0048]
当细胞贴壁24h后汇合度大概为50%,用tpp-ht或者dmso处理细胞,处理时间为24h。
[0049]
3、实验方法
[0050]
1)mtt检测
[0051]
用不同浓度的tpp-ht作用于所有癌细胞系不同时间后,用pbs清洗细胞一遍,加入0.5mg/ml的mtt,在含有95%空气和5%co2的37℃培养箱中孵育4h后,用pbs清洗一遍,再加入dmso溶解,并在490nm的波长下检测其吸光值。
[0052]
2)荧光定量逆转录-聚合酶链式反应(rt-pcr)
[0053]
(1)rna提取
[0054]
生长于6孔板的癌细胞系经tpp-ht或者dmso处理24h后吸去培养基,pbs洗一次。每孔加600μltrizol裂解液吹打,收集细胞至无rna酶的灭菌离心管中。然后加120μl预冷的氯仿,充分混匀15s,室温静置2~3min。待溶液出现明显分层后,12000g,4℃离心15min,小心转移上清约200μl至新的离心管中,注意避免吸到沉淀,使杂质污染rna样品。加等体积预冷的异丙醇,上下颠倒40~60次,室温静置20min或-20℃静置1~3h。待rna析出后,12000g,4℃离心10min,弃上清,得rna沉淀。加100μl预冷的75%乙醇,上下颠倒20~30次,使rna沉淀漂起。12000g,4℃离心10min,弃上清,置于超净工作台中挥干。待rna沉淀由白色开始变透明时,加入适量的depc水,于60℃水浴加热10min溶解。以depc水调零,紫外分光光度法检测rna浓度与纯度。
[0055]
(2)rt-pcr
[0056]
将rna样品调成一致浓度,用ag反转录试剂盒按表1体系加样,混匀后旋转离心,使液体聚集于pcr管底,放入pcr仪,按表2程序进行反转录。
[0057]
表1rt-pcr体系(/20μl)
[0058][0059]
表2rt-pcr程序
[0060][0061]
(3)实时定量pcr
[0062]
目标基因的引物经设计、合成后,用灭菌超纯水溶解成100μm的储备液,-20℃保存。临用前将上、下游引物混合,稀释10倍后得终浓度为10μm的应用液。β-actin作为内参,实验所用的引物序列为:
[0063]
[0064][0065]
将反转录所得的cdna按表3反应体系加样,混匀后旋转离心,使液体聚集于pcr管底,放入pcr仪,按表4中的程序进行实时定量pcr。根据待测样品的ct值计算目的基因的mrna水平。
[0066]
表3实时定量pcr体系(/10μl)
[0067][0068]
表4实时定量pcr程序
[0069][0070]
3)蛋白免疫印迹
[0071]
(1)蛋白样品的制备
[0072]
生长于6孔板的癌细胞系经tpp-ht或者dmso处理24h后吸去培养基,预冷pbs洗两次。每孔加100μlwestern及ip细胞裂解液(临用前加入1%的pmsf),刮取细胞,收集于预冷的1.5ml离心管中,冰浴15~20min使蛋白充分裂解。将蛋白裂解液于13000g,4℃离心6min,
吸取上清至新的离心管中。用bca试剂盒对上清进行蛋白定量,并将样品的蛋白浓度调成一致,随后加入样品体积1/4的加入5x loading buffer和β-巯基乙醇,混匀后于100℃加热10min,制好的样品即可用于电泳,或-20℃暂时保存。
[0073]
(2)电泳
[0074]
将sds-page凝胶置于电泳槽中,加入适当体积的电泳缓冲液,根据样品蛋白浓度,将适当体积的蛋白样品加入凝胶的加样孔中(10~20μg/孔),除蛋白marker加2.5μl外,所有孔的上样体积均相同。接通电源,以40ma恒流电泳至溴酚蓝指示剂距胶板底边5mm左右时停止。
[0075]
(3)转膜
[0076]
电泳结束后,将胶板取出,切除浓缩胶,于转膜液中小心剥离凝胶,同时将转膜所需的滤纸及硝酸纤维素膜置于转膜液中浸润,再将凝胶与硝酸纤维素膜紧密贴合,夹于滤纸和海绵中,放入转膜装置(胶向负极,膜向正极),加转膜液使其浸没凝胶。接通电源,以300ma恒流转膜120min。
[0077]
(4)封闭
[0078]
转膜结束后,取出硝酸纤维素膜,正面向上放入孵育盒中,加入封闭液(10~15ml/盒),置于摇床上,室温下摇动孵育1~2h或4℃封闭过夜。
[0079]
(5)一抗孵育
[0080]
将封闭后的膜用tbst漂洗三次,每次5min。将膜夹于两层保鲜膜中,参照marker的位置,按目的蛋白的分子量切取相应条带,置于孵育盒中。用tbst配制1%bsa溶液,并将一抗按比例稀释后加入相应蛋白的孵育盒内,置于摇床上,4℃摇动孵育过夜。一抗孵育完成后,回收一抗,用tbst洗膜三次,每次15min。
[0081]
(6)二抗孵育
[0082]
根据一抗的来源,将相对应的二抗用tbst按比例稀释,加入孵育盒内,室温下摇动孵育1h。二抗孵育完成后,用tbst洗膜三次,每次15min。
[0083]
(7)检测
[0084]
将膜从tbst中取出,吸去多余溶液,摆放于检测板上,将ecl发光剂的a液与b液等体积混合,均匀滴加到膜上。将检测板送入仪器内,按设定参数曝光并记录图像。用凝胶定量软件quantity one(bio-red)对目的蛋白条带进行灰度分析。
[0085]
4)乳酸分泌测定
[0086]
生长于12孔板的癌细胞系经tpp-ht或者dmso处理24h后收集培养基,5000rpm、4℃离心5min后,使用乳酸测定试剂盒(南京建成#a019-2-1)测定培养基中的乳酸。培养基与反应混合物孵育10分钟后(37℃),用酶标仪(multiskan spectrum,thermo scientific,ma,usa)测定450nm处吸光度。每个样品的乳酸浓度通过对应孔的蛋白含量进行标准化。
[0087]
5)atp水平测定
[0088]
生长于12孔板的癌细胞系经tpp-ht或者dmso处理24h后吸去培养基,预冷pbs洗两次,立即添加100μl细胞裂解液在冰上裂解10min,并在4℃下12000g离心5min。使用atp试剂盒(碧云天#s0026)测量atp水平。取裂解液上清加入反应混合液并在1min内用酶标仪(spark 10m,tecan,switzerland)测定化学发光值。每个样品的atp水平通过对应孔的蛋白含量进行标准化。
[0089]
6)活性氧(ros)水平测定
[0090]
生长于12孔板的癌细胞系经tpp-ht或者dmso处理24h后吸去培养基,pbs洗一次,添加无fbs培养基稀释的10um h2dcf-da(35845,西格玛,美国)溶液,在5%co2和37℃的培养箱中孵育30min。弃去h2dcf-da溶液,用预冷pbs清洗细胞,然后立即添加100μl细胞裂解缓冲液。收集细胞裂解液,12000g离心10min。在激发波长为485nm、发射波长为530nm的条件下,使用酶标仪(spark 10m,tecan,瑞士)测量上清液中的荧光强度。每个样品的ros水平通过对应孔的蛋白含量进行标准化。
[0091]
7)线粒体膜电位(mmp)测定
[0092]
生长于96孔板的癌细胞系经tpp-ht或者dmso处理24h后吸去培养基,pbs洗一次,添加无fbs培养基稀释的10μg/ml jc-1(t4069,西格玛,美国)溶液,在5%co2和37℃的培养箱中孵育1h。弃去jc-1溶液,并用pbs清洗细胞两次。最后,每孔加入100μl pbs中重悬细胞,在488nm的激发(ex)波长下分别读取525nm和590nm发射(em)波长下的荧光值。荧光2(ex 485nm,em 590nm)的值除以荧光1(ex 485nm,em 530nm)的值即为mmp的值。
[0093]
4、统计分析
[0094]
使用graphpad prism9软件进行统计分析。首先采用shapiro-wilk正态性检验检验样本的正态分布。如果符合正态分布,则进一步检验方差齐性。如果数据也通过了方差齐性检验,则使用双尾student t-text或one-wayanova(tukey事后检验)计算p值;否则,使用welch t检验或kruskal-wallis检验计算p值。对于不符合正态分布的样本,使用mann-whitney或kruskal-wallis非参数检验。数据以平均值
±
sem表示。显著统计学意义为*p《0.05,**p《0.01,***p《0.001。
[0095]
5、相关结果
[0096]
(一)tpp-ht抑制癌细胞增殖
[0097]
用不同浓度tpp-ht处理来自人前列腺癌(pc3和c4-2)、人卵巢癌(skov3)、人肺腺癌(nci-h1975)和人宫颈癌(hela)五种不同癌细胞系48h,用mtt方法测定tpp-ht对癌细胞增殖的影响,见图2中的(a),接下来用ic50剂量处理每个癌细胞系24、48和72h,见图2中的(b)。结果表明,tpp-ht以剂量和时间依赖性的方式抑制上述癌细胞系的细胞活性,图2中的(a)、图2中的(b)。细胞计数结果也表明,tpp-ht显著抑制上述癌细胞系的生长,图2中的(c)。总体结果表明,tpp-ht显著抑制癌细胞的增殖。
[0098]
(二)tpp-ht诱导癌细胞凋亡、诱导ros生成和调节nrf2依赖性抗氧化防御
[0099]
接下来进一步探索tpp-ht对癌细胞凋亡的影响。tpp-ht处理显著增加c4-2、skov3和hela细胞中的parp和caspase3剪切水平,但不增加pc3和h1975细胞中的parp和caspase3剪切水平,图3中的(a)。氧化应激通常与细胞凋亡有关,因此我们评估tpp-ht是否能诱导癌细胞产生ros。图3中的(b)结果显示tpp-ht处理显著增加了所有受试癌细胞的ros水平,表明tpp-ht可能通过调节ros诱导癌细胞凋亡。然后,我们测定内源性抗氧化防御途径中关键分子nrf2、过氧化氢酶和sod2的蛋白表达水平,并发现tpp-ht以细胞系特异方式改变这些蛋白的表达,多个癌细胞系表现出升高的nrf2依赖性抗氧化防御体系,见图3中的(c)。但tpp-ht直接或间接增强内源性抗氧化防御体系并不能抑制其在癌细胞中诱导的过度ros生成。综上所述,这些结果表明tpp-ht以细胞系特异性方式诱导ros生成、调节抗氧化防御并诱导癌细胞凋亡。
[0100]
(三)tpp-ht促进癌细胞糖酵解和tca循环代谢
[0101]
为了阐明tpp-ht在癌细胞主要代谢途径中的作用,我们首先分析了葡萄糖代谢关键酶的mrna表达。我们通过qrt-pcr评估了葡萄糖转运体(glut1)、催化糖酵解限速步骤的三种酶(hk2、pfkl、pkm2)和乳酸代谢酶(mct4、ldha)的mrna水平,发现在多个癌细胞系中,glut1、hk2和mct4的mrna表达显著增加,而ldha和pkm2的表达降低,见图4中的(a)。此外,我们发现,tpp-ht处理后所有癌细胞的乳酸分泌显著增加,见图4中的(b),表明糖酵解增强。接下来,我们通过qrt-pcr分析tca循环酶的mrna水平,发现idh1和dlst在所有癌细胞中的表达显著较高见图4中的(c)。总的来说,这些数据表明tpp-ht改变了癌细胞的糖酵解和tca循环代谢。
[0102]
(四)tpp-ht对癌细胞线粒体代谢和动态变化的影响
[0103]
为了确定tpp-ht对癌细胞线粒体呼吸和能量代谢的影响,我们首先评估了tpp-hp对癌细胞的线粒体膜电位(mmp)的影响。如图5中的(a)所示,tpp-ht对癌细胞中mmp的影响表现出细胞系依赖性。tpp-ht处理显著降低pc3、c4-2和h1975细胞的mmp,对skov3细胞无影响,增加了hela细胞的mmp。我们还测定了atp水平,结果也表现出细胞系依赖性的变化。值得注意的是,这些癌细胞中atp水平的变化与mmp的变化一致,如图5中的(b)。接下来,我们分析了tpp-ht对线粒体复合物以及线粒体分裂融合蛋白的影响,如图5中的(c)。我们观察到tpp-ht处理后,pc3、c4-2、skov3、hela和h1975细胞中氧化磷酸化复合物i、复合物ii和复合物iii的亚单位表达降低。有趣的是,tpp-ht处理后,hela细胞中氧化磷酸化复合物i、复合物ii、复合物iii和复合物v亚单位的蛋白质水平降低,而atp水平升高,见图5中的(b)。tpp-ht还显著影响所有这些细胞中裂变和裂变相关蛋白drp1、mfn1和mfn2的表达。总的来说,这些结果表明tpp-ht治疗可导致癌细胞线粒体能量代谢的抑制以及线粒体融合和分裂动力学的损伤。
[0104]
(五)tpp-ht抑制癌细胞脂肪酸从头合成并促进脂滴的积累
[0105]
接下来我们进一步研究tpp-ht对脂肪酸代谢的影响。如图6中的(a)和(b)所示,tpp-ht显著抑制脂肪酸从头合成酶蛋白和mrna水平。在所有的癌细胞系中,tpp-ht显著抑制脂肪酸合成酶(fasn)蛋白和mrna水平。tpp-ht对乙酰辅酶a羧化酶(acc)的影响呈现细胞系依赖性。在pc3细胞系中,acc的蛋白和mrna水平都没有改变;在h1975细胞系中,acc的mrna水平增加但蛋白水平减少。固醇调节元件结合蛋白1a或者1c(srebp1a或1c)的mrna水平在所有细胞系中降低但蛋白水平并没有变化。此外,我们还通过nile red染色观察tpp-ht对脂滴的影响。结果如图6中的(c)所示,tpp-ht促进所有癌细胞系的脂滴积累。同时plin1、plin2或plin3(围脂滴蛋白)的mrna水平也相应表达增加(图6d)。上述结果表明,tpp-ht抑制脂肪酸从头合成酶的表达,但也造成脂滴积累,具体机制还有待进一步研究。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1