一种用于提取大豆油基因组DNA的吸附体系和提取方法
一种用于提取大豆油基因组dna的吸附体系和提取方法
技术领域
1.本发明涉及生物化学技术领域,尤其涉及一种用于提取大豆油基因组dna的吸附体系及其提取方法。
背景技术:
2.大豆油是从大豆中压榨提取出来的一种油,是世界上最常用的食用油之一,大豆油中含有多种维持人体重要生理功能的脂肪酸。我国是传统豆制品消费大国,随着我国大豆制品消费需求越来越强,近年来从国外进口至我国的大豆量巨大,整体呈现上升趋势。2021年我国大豆自产量约为1.64*103万吨,进口大豆量高达1.00*104万吨。我国已成为世界上最大的大豆净进口国,进口至我国的大豆主要是转基因大豆,主要用于制取食用豆油,相应豆粕用于饲料加工,或者用作其他产品的加工原料。
[0003][0004]
在该背景下,为保证我国转基因标识制度有效实施,促进大豆消费市场健康发展,研发并掌握可靠、准确的大豆转基因检测技术显得尤为重要。而以定性或定量pcr为基础的转基因检测技术的顺利完成则需要理想的dna模板。
[0005]
大豆油加工工序较多,加工工艺涉及破碎、高温加热、高压、吸附、有机溶剂和酸碱处理等多个可致使dna降解的操作步骤,dna属于水溶性分子,因此终产品精炼油中dna含量极低,降解也严重,导致对dna提取难度大大增加。
[0006]
目前对大豆油基因组dna的提取方法主要有ctab法和试剂盒法。然而,ctab法提取效率低下,易引起假阴性误判结果;试剂盒法提取效率亦有待提高,且价格高昂,适用性有限。
[0007]
而磁珠法是以磁珠为载体进行核酸提取的新技术,磁珠具有“在高盐低ph溶液环境下吸附核酸,在低盐高ph的溶液环境下洗脱核酸”的特性。利用磁珠这一特点,以一定的溶液条件提供驱动力,可使带负电荷的羧基磁珠吸附核酸,而蛋白质等物质不能吸附于磁珠,从而达到核酸纯化的目的,再利用一定的溶液环境将核酸从磁珠上洗脱下来,就可得到目的核酸溶液。目前市场上涉及到磁珠法都是采用磁珠试剂盒的方式提取核酸,价格较贵。
技术实现要素:
[0008]
本发明为解决现有对大豆油基因组dna提取过程中所存在的上述技术问题,提供了一种能较大提高得率的用于提取大豆油基因组dna的吸附体系及其提取方法,本发明直接采用磁珠而非磁珠试剂盒提取核酸,使大豆油中dna提取的成本大大降低。
[0009]
为实现上述目的,本发明采用以下技术方案:
[0010]
本发明的第一个方面是提供一种用于提取大豆油基因组dna的吸附体系,用于油样粗提液中dna的提取,包括组分:异硫氰酸胍,无水乙醇,羧基磁珠,triton x-100,nacl,适量蒸馏水。
[0011]
优选地,所述吸附体系包括如下浓度和用量比的组分:所述异硫氰酸胍(0.5~2m,
ph 5.5~6.5)1ml,无水乙醇1/2~3/2v,羧基磁珠(300nm、终浓度为0.1mg/ml),2%triton x-100(v/v),nacl(终浓度为2mmol/l),适量蒸馏水。
[0012]
本发明研发的由适量异硫氰酸胍、无水乙醇、羧基磁珠、triton x-100和nacl形成的吸附体系,专门用于提取大豆油基因组dna,能够大大提高大豆油基因组dna的得率。与现有ctab法和试剂盒法对大豆油基因组dna的提取相比,具有提取效率较高、不会引起假阴性误判结果、价格合适和适用性较好的特点。
[0013]
本发明的第二个方面是提供一种大豆油基因组dna的提取方法,主要采用如下试剂:
[0014]
裂解液(释放dna):ctab裂解液(5%ctab(w/v),100mm tris-hcl,20mm edta,1.4m nacl,1%吐温20(v/v),1%pvp 40(w/v),ph 8.0);用于将核酸从细胞中裂解出来。
[0015]
结合液(结合dna):异硫氰酸胍溶液(0.5~2m,ph5.5~6.5);用于促进磁珠吸附dna。
[0016]
洗涤液(洗涤dna):75~85%乙醇溶液;用于去除磁珠-dna复合物上附着的盐离子。
[0017]
洗脱液(洗脱dna):te缓冲液(10mm tris-hcl和1mm edta,ph 8.0);用于将dna从磁珠上洗脱下来。
[0018]
具体地,该大豆油基因组dna的提取方法,采用上述的吸附体系,主要包括如下步骤:
[0019]
(a)将ctab裂解液和油样充分混匀,经离心、破乳使ctab裂解液和油样分离,向分离后的ctab裂解液中加入适量异丙醇沉淀dna,-20℃静置12~18h后,于4℃下16000g离心25min,弃上清,得dna透明沉淀;
[0020]
(b)向步骤(a)得到的dna沉淀中加入适量异硫氰酸胍溶液(结合液),用于直接溶解dna沉淀,借助于涡旋混合器充分溶解混匀,涡旋两次,每次5s,然后转入2ml无菌离心管中;
[0021]
(c)向步骤(b)得到的混合液中加入等体积氯仿-异戊醇溶液,于长轴旋转混匀仪振荡混匀后,12000~14000g常温离心10~15min,转移上清至另一2ml无菌离心管中(抽提步骤);
[0022]
(d)向步骤(c)的离心管中加入适量磁珠、无水乙醇、triton x-100和nacl后,借助于涡旋混合器涡旋3s,室温下培育10min,培养期间再涡旋一次(结合步骤);
[0023]
(e)将步骤(d)中的离心管置于磁性分离器中进行磁性分离,待磁珠聚集且溶液澄清后,吸除溶液,得磁珠-dna复合物(第一次磁分离);
[0024]
(f)将步骤(e)中装有磁珠-dna复合物的离心管移出磁性分离器,并加入适量乙醇溶液(洗涤液)手动颠倒混匀;
[0025]
(g)将步骤(f)中的离心管置于磁性分离器中进行二次磁性分离,并吸除乙醇溶液(第二次磁分离);
[0026]
(h)重复步骤(f)~(g)洗涤步骤,在室温下干燥3~5min,保证乙醇基本挥发完全(第三次磁分离);
[0027]
(i)将步骤(h)中装有晾干的磁珠-dna复合物的离心管移出磁性分离器,并向离心管中加入适量te缓冲液(洗脱液)与磁珠充分混合,借助于涡旋混合器涡旋2s,然后在60℃
水浴中培育10min,以洗脱dna(洗脱步骤);
[0028]
(j)将步骤(i)培养后的溶液立即进行磁分离,待磁珠聚集,且溶液澄清后,吸取溶液至600μl无菌离心管中(第四次磁分离),置-20℃保存,避免反复冻融,即得大豆油基因组dna。
[0029]
优选地,所述步骤(a)中ctab裂解液的组成为5%ctab(w/v),100mm tris-hcl,20mm edta,1.4m nacl,1%吐温20(v/v),1%pvp40(w/v),ph 8.0。
[0030]
优选地,所述步骤(a)中ctab裂解液的加入量和每次油脂加入量体积的比例为5:6。
[0031]
优选地,所述步骤(a)中采用ctab裂解液释放油样中核酸的工艺为:向油样中加入适量65℃预热的ctab裂解液,常温下在长轴混匀器上以45r/min混匀3h;然后将混合液在常温下12000g离心15min,吸除上层油相;
[0032]
步骤(a)中,所述浓缩工艺为:向移除上层油相后的离心管中再加入与最初加入量等体积的大豆油,重复上述裂解细胞步骤进行dna浓缩,浓缩2~4次(即每次浓缩操作只往离心管中加入与最初加入量等体积的大豆油,不再加入ctab裂解液);
[0033]
步骤(a)中,所述破乳工艺为:离心后的溶液中间的乳化层采用热破乳法进行破乳,并移除乳化层;所述热破乳法为采用65~80℃温浴破乳15~25min;
[0034]
步骤(a)中沉淀工艺为:向下层水相中加入适量核酸助沉剂和适量的naac,轻轻摇匀,再加入等体积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h)。
[0035][0036]
较为优选地,所述步骤(a)中采用ctab裂解液释放油样中核酸的工艺为:
[0037]
向20ml油样中加入16.67ml 65℃预热的ctab裂解液,常温下在长轴混匀器上以45r/min混匀3h;然后将混合液在常温下12000g离心15min,吸除上层油相。
[0038]
较为优选地,所述步骤(a)中所述浓缩工艺为:
[0039]
向移除上层油相后的离心管中加入20ml大豆油,重复上述裂解细胞步骤,直至浓缩60ml大豆油。
[0040]
较为优选地,所述步骤(a)中dna浓缩步骤没有使用氯仿或者正己烷等有机溶剂,避免了在提取过程中对dna的二次破坏。
[0041]
较为优选地,所述步骤(a)中破乳工艺为:
[0042]
离心后的溶液中间的乳化层采用热破乳法进行破乳,并移除乳化层,较环保;
[0043]
所述热破乳法为采用70℃温浴破乳20min。
[0044]
较为优选地,所述步骤(a)中沉淀工艺为:
[0045]
向下层水相中加入5/1000v核酸助沉剂和1/10v的naac,轻轻摇匀,再加入等体积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h)。
[0046]
更为优选地,步骤(a)中,采用ctab裂解液裂解释放油样中的核酸,经浓缩、破乳及沉淀的处理工艺为:
[0047]
(a1)裂解细胞:向20ml油样中加入16.67ml 65℃预热的ctab裂解液,常温下在长轴混匀器上以45r/min混匀3h;然后将混合液在常温下12000g离心15min,吸除上层油相;
[0048]
(a2)dna浓缩:再向离心管中加入20ml大豆油,重复上述步骤,直至浓缩60ml大豆油;
[0049]
(a3)破乳:中间的乳化层可以采用70℃温浴破乳20min,并移除乳化层(破乳步骤);
[0050]
(a4)dna沉淀:向下层水相中加入5/1000v核酸助沉剂和1/10v的naac,轻轻摇匀,再加入等体积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h);采用异丙醇能使得细胞裂解后的大豆油dna更好的沉淀;
[0051]
(a5)于4℃下16000g离心混合液20min,倒掉上清,得dna透明沉淀。
[0052]
较为优选地,步骤(b)中,将步骤a沉淀后的dna用结合液直接溶解,将dna浓缩步骤和磁珠纯化dna步骤有机地结合起来。
[0053]
优选地,步骤(b)中,所述异硫氰酸胍溶液的浓度为0.5~2m,ph为5.5~6.5,加入量为1ml。
[0054]
较为优选地,步骤(b)中,所述异硫氰酸胍溶液的浓度为1m、ph为6.0,加入量为1ml。
[0055]
步骤(c)中,所述氯仿异戊醇混合液中氯仿和异戊醇的体积比为24:1;且所述步骤(c)氯仿异戊醇混合液的加入体积和步骤(b)中异硫氰酸胍溶液的加入体积相同。
[0056]
优选地,步骤(d)中,所述磁珠溶液的终浓度为0.1mg/ml;所述磁珠为300nm的羧基磁性纳米颗粒。
[0057]
优选地,步骤(d)中,所述无水乙醇的加入体积和氯仿异戊醇抽提后离心管中上清液的体积比为1/2~3/2v。
[0058]
较为优选地,步骤(d)中,所述无水乙醇的加入体积和氯仿异戊醇抽提后离心管中上清液的体积相同。
[0059]
较为优选地,步骤(d)中,所述triton x-100的终浓度为2%。
[0060]
较为优选地,步骤(d)中,所述nacl的终浓度为2mmol/l。
[0061]
较为优选地,步骤(d)中,所述培养时间为10min,培养温度为常温。
[0062]
较为优选地,步骤(f)中,所述乙醇溶液的质量浓度为75~85%,加入量为0.8~2ml。
[0063]
更为优选地,步骤(f)中,所述乙醇溶液的质量浓度为80%,加入量为1ml。
[0064]
较为优选地,步骤(g)和(h)中,所述吸除乙醇溶液时,离心管一直置于磁性分离器内。
[0065]
较为优选地,步骤(i)中,所述te缓冲液的组成为10mm tris-hcl和1mm edta,ph 8.0,其加入量不能超过100ul;
[0066]
且所述步骤(i)中的培养温度为55~65℃,培养时间为10~15min。
[0067]
更为较为优选地,步骤(i)中,所述te缓冲液的组成为10mm tris-hcl和1mm edta,ph8.0,其加入量为100ul;步骤(i)中的培养温度为60℃,培养时间为10min。
[0068]
较为优选地,步骤(j)中,所述磁分离趁热进行,分离时间为3~5min,涡旋时间为3~5s。
[0069]
本提取方法所采用的异硫氰酸胍溶液在dna吸附于负电磁珠的过程中,具有以下作用:1)屏蔽dna与负电磁珠表面基团之间的静电斥力;2)破坏dna与负电磁珠表面的水化层;3)介导dna与负电磁珠表面基团间氢键的形成。
[0070]
本提取方法步骤(b)中采用由氯仿和异戊醇配置而成的氯仿异戊醇混合液,其中
采用氯仿的作用是去除残存的油脂,采用异戊醇的作用是消除抽提过程中产生的气泡。
[0071]
本提取方法步骤(d)中采用羧基磁性纳米颗粒,磁珠溶液的终浓度为0.1mg/ml,带负电的羧基磁珠可以在外界溶液环境提供驱动力的情况下吸附dna。
[0072]
本提取方法步骤(d)中所采用的triton x-100是一种非离子表面活性剂,triton x-100的终浓度为2%,可以去除磁珠表面附着的油,提高dna产物的纯度。
[0073]
本提取方法步骤(d)所采用的nacl为体系提供一个高盐环境,nacl的终浓度为2mmol/l,可使核酸紧紧地吸附在磁珠上。
[0074]
本提取方法步骤(d)中向离心管中加入无水乙醇,可以降低溶液的极性和dna与负电磁珠间的斥力。
[0075]
本提取方法步骤(f)中加入适量的乙醇溶液作为洗涤液,优选地采用80%的乙醇溶液,乙醇洗涤可以去除磁珠-dna复合物表面附着的盐离子。
[0076]
本提取方法步骤(f)中采用te缓冲液作为洗脱液,能够良好地使得大豆油dna从磁珠上洗脱,从而便于最终的分离提取。
[0077]
本提取方法采用特定的吸附体系,并使用磁珠特异性吸附来达到纯化dna的目的,而不是使用如已经发表专利和文献的试剂盒法,或者文献中传统的理化方法。与试剂盒法相比,磁珠法最明显的优势是成本大大降低,提取效率更高。与理化方法相比,磁珠法提取效率显著提高。本发明整个提取方法步骤简单,所用试剂价格合适,对大豆油dna的提取效率较高,对大豆油dna的提取准确性较好。
[0078]
本发明采用上述技术方案,与现有技术相比,具有如下技术效果:
[0079]
本发明采用由适量的异硫氰酸胍、无水乙醇、羧基磁珠、triton x-100和nacl形成的吸附体系,能够大大提高大豆油基因组dna的得率;且与现有ctab法和试剂盒法对大豆油基因组dna的提取相比,具有提取效率高、准确性好、成本低等优势,将助力于转基因大豆油相关产品标识制度的实施,极大有利于我国转基因生物安全管理工作的推进。
具体实施方式
[0080]
下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
[0081]
实施例1用于提取大豆油基因组dna的吸附体系
[0082]
用于油样粗提液中提取大豆油基因组dna的吸附体系,包括组分:异硫氰酸胍(1m,ph 6.0)1ml,无水乙醇1/1v,羧基磁珠(300nm、终浓度为0.1mg/ml),2%triton x-100(v/v),nacl(终浓度为2mmol/l),适量蒸馏水。采用本实施例中的吸附体系,能够显著提高油样粗提液中大豆油基因组dna的得率。
[0083]
实施例2用于提取大豆油基因组dna的吸附体系
[0084]
用于油样粗提液中提取大豆油基因组dna的吸附体系,包括组分:异硫氰酸胍(0.5m,ph 5.5)1ml,无水乙醇1/2v,羧基磁珠(300nm、终浓度为0.1mg/ml),2%triton x-100(v/v),nacl(终浓度)2mmol/l,适量蒸馏水。采用本实施例中的吸附体系,能够显著提高油样粗提液中大豆油基因组dna的得率。
[0085]
实施例3用于提取大豆油基因组dna的吸附体系
[0086]
用于油样粗提液中提取大豆油基因组dna的吸附体系,包括组分:异硫氰酸胍(2m,
ph 6.5)1ml,无水乙醇3/2v,羧基磁珠(300nm、终浓度为0.1mg/ml),2%triton x-100(v/v),nacl(终浓度)2mmol/l,适量蒸馏水。采用本实施例中的吸附体系,能够显著提高油样粗提液中大豆油基因组dna的得率。
[0087]
实施例4大豆油基因组dna的提取方法
[0088]
以金龙鱼精炼一级大豆油(原材料为转基因大豆,产品标准号为q/bbah0019s)为大豆油原料,该大豆油基因组dna的提取方法主要包括磁珠与dna的吸附和解吸附过程。
[0089]
吸附过程为:将经细胞裂解和异丙醇沉淀后得到的大豆油dna沉淀中加入适量异硫氰酸胍溶液(结合液)涡旋混合;接着加入适量氯仿异戊醇混合液,于长轴旋转混匀仪振荡混匀后,12000~14000g常温离心10~15min取上清液,并转入2ml离心管(抽提步骤);向离心管中加入适量磁珠、无水乙醇、triton x-100和nacl后,涡旋混合后培养,培养期间再涡旋一次(结合步骤);将离心管置于磁性分离器中进行磁性分离,待上清液澄清后弃上清,得磁珠-dna复合物(第一次磁分离);将装有磁珠-dna复合物的离心管移出磁性分离器,并加入适量乙醇溶液(洗涤液)进行手动摇匀洗涤;置于磁性分离器中进行二次磁性分离,并吸除乙醇溶液(第二次磁分离);重复洗涤步骤,将最终的磁珠-dna复合物晾干,保证乙醇基本挥发完全(第三次磁分离)。
[0090]
解吸附过程:将装有晾干的磁珠-dna复合物的离心管移出磁性分离器,并向离心管中加入适量te缓冲液(洗脱液)与磁珠充分混合,涡旋后进行培养,以洗脱dna(洗脱步骤);将培养后的溶液立即进行磁分离,待磁珠聚集且溶液澄清后,吸取澄清溶液(第四次磁分离),即得大豆油基因组dna。
[0091]
一、对吸附体系的筛选
[0092]
为进一步验证本发明吸附体系及提取方法的效果显著性,我们在初期试验阶段分别对结合液的种类、结合液(异硫氰酸胍)的浓度、吸附体系的ph、结合体系极性以及抽提和洗涤方式进行了优化筛选,具体如下文所述。(注:除每一阶段的优化因素外,其余步骤和方法均与本技术所要求保护的方法步骤相同。)
[0093]
(一)基于上述实施例1对磁珠进行筛选:在异硫氰酸胍的ph为6.0、无水乙醇加入量为等体积的条件下。具体如下:
[0094]
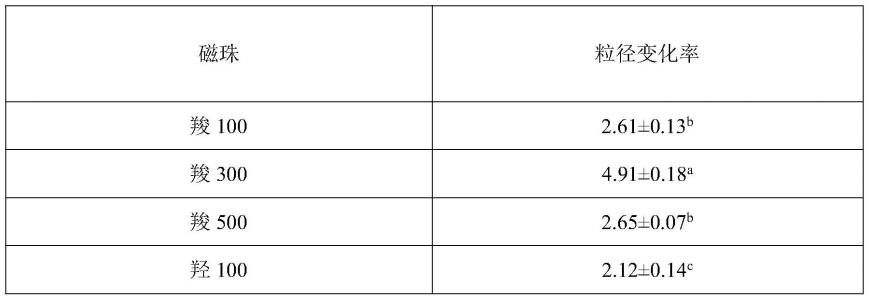
(1)在6个2ml离心管中各自加入等量转基因大豆标准品dna,并在各个离心管中分别加入不同种类和粒径的磁珠,接着加入异硫氰酸胍溶液、无水乙醇、triton x-100、nacl,使磁珠均与dna结合,室温培养后形成磁珠-dna复合物,将得到的磁珠-dna复合物溶液稀释至0.01ug/ul,经涡旋处理使复合物分散均匀。取等量的磁珠,并用无菌水将其稀释至0.01ug/ul,经涡旋、超声处理使磁珠在无菌水中分散均匀。取适量磁珠-dna复合物溶液和磁珠溶液至粒径电位仪以检测磁珠的粒径变化。结果如表1所示(样品均设置三平行)。
[0095]
表1磁珠与dna复合前后粒径变化
[0096][0097][0098]
注:a-c不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0099]
(2)在6个2ml离心管中各自加入已知质量的转基因大豆标准品dna,并在各个离心管中分别加入不同种类和粒径的磁珠,接着加入异硫氰酸胍溶液、无水乙醇、triton x-100、nacl使磁珠均与dna结合。后续磁分离、洗涤、洗脱等步骤按照实施例4进行。对得到的dna检测其浓度、质量,并计算各个磁珠对dna的回收率,结果如表2所示(样品均设置三平行)。
[0100]
表2不同种类和粒径的磁珠回收dna的结果
[0101][0102]
注:a-d不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0103]
由上述表1和表2测试结果可知,在我们初期的实验中,对于不同种类和粒径的磁珠进行筛选,根据对应的结果对比,故与dna结合效果最好的三种磁珠是羧基300nm、羧基500nm、羟基500nm。
[0104]
(3)在实施例1中的吸附过程前预先在离心管中加入一定量的转基因大豆标准品dna,且磁珠分别采用羧基300nm、羧基500nm、羟基500nm,后续步骤均采用实施例4的提取方法进行测试,测试方法相同。对得到的dna检测其浓度、质量,并计算各个磁珠对dna的回收率。测试结果如下表3所示(样品均设置三平行)。
[0105]
表3不同磁珠回收油脂中dna的结果
[0106][0107][0108]
注:a-c不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0109]
由上述表3测试结果可知,在我们初期的实验中,对于不同种类和粒径的磁珠进行进一步筛选,根据对应的结果对比,故与dna结合效果最好的磁珠是羧基300nm,因此后续实验均选择羧基300nm的磁珠进行实验。
[0110]
(二)基于上述实施例1对结合液的种类进行优化(聚乙二醇20000/氯化钠和异硫氰酸胍):在结合液的ph为6.0、无水乙醇加入量为等体积的条件下。具体地,将实施例1中的1m异硫氰酸胍替换为13.5%聚乙二醇20000/3m氯化钠,其他条件不变。并采用实施例4的提取方法进行测试,测试方法相同,测试结果如下表4所示。
[0111]
表4结合液种类对磁珠提取大豆油中基因组dna的影响
[0112][0113]
注:t表示显著性分析的方式(配对样本t检验),*表示显著性水平0.05下呈现差异,**表示显著性水平0.01下呈现差异。
[0114]
研究采用配对样本t检验分析不同结合液对磁珠法提取油脂中dna的影响,由上述表4测试结果可知,不同结合液条件下磁珠法提取油脂中dna的浓度在0.05显著性水平下呈现差异。
[0115]
进一步比较其均值发现采用1m异硫氰酸胍作为结合液在相同的提取方法下其提取的dna质量浓度要高于采用13.5%聚乙二醇20000/3m氯化钠作为结合液提取的油脂中dna的浓度。故优化的最适吸附体系的结合液为异硫氰酸胍。
[0116]
(三)基于实施例1对结合液(异硫氰酸胍)的浓度进行优化:在结合液的ph为6.0、无水乙醇加入量为等体积的条件下。具体地,对实施例1中异硫氰酸胍的浓度进行调整,测试异硫氰酸胍浓度分别为0m、0.5m、1m、2m、3m和4m时的提取效果,其他条件不变。并采用实施例4的提取方法进行测试,测试方法相同,测试结果如下表5所示。
[0117]
表5结合液(异硫氰酸胍)浓度对磁珠提取大豆油中基因组dna的影响
[0118][0119]
注:a-c不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0120]
由上述表5测试结果可知,在我们初期的实验中,对于不同浓度的异硫氰酸胍(0m、0.5m、1m、2m、3m、4m)进行优化,根据对应提取的dna质量浓度对比,故优化的最适异硫氰酸胍浓度为1m。
[0121]
(四)基于实施例1对结合液(异硫氰酸胍)的ph进行优化:在结合液的浓度为1m,无水乙醇加入量为等体积的条件下。具体地,对实施例1中结合液的ph进行调整,测试结合液ph分别为5.0、5.5、6.0、6.5、7.0、7.5和8.0时的提取效果,其他条件不变。并采用实施例4的提取方法进行测试,测试方法相同,测试结果如下表6所示。
[0122]
表6吸附体系ph对磁珠提取大豆油中基因组dna的影响
[0123][0124][0125]
注:a-c不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0126]
由上述表6测试结果可知,在我们初期的实验中,对于不同ph的结合液(异硫氰酸胍)(5.0、5.5、6.0、6.5、7.0、7.5、8.0)进行优化,根据对应提取的dna质量浓度对比,故优化的最适结合液(异硫氰酸胍)的ph为6.0。
[0127]
(五)基于实施例1对结合体系极性进行优化:在结合液的ph为6.0,结合液异硫氰酸胍浓度为1m的条件下。具体地,对实施例1吸附体系中的无水乙醇的加入量及加入种类进行调整,测试无水乙醇加入量分别为1/2体积、等体积、3/2体积以及采用异丙醇进行替换时的提取效果,其他条件不变。并采用实施例4的提取方法进行测试,测试方法相同,测试结果
如下表7所示。
[0128]
表7结合体系极性对磁珠提取大豆油中基因组dna的影响
[0129][0130]
注:a-c不同的小写字母代表同列结果间存有显著差异(p<0.05);a-b不同的大写字母代表同列结果间存有显著差异(p<0.05)。
[0131]
由上述表7测试结果可知,在我们初期的实验中,对不同结合体系极性(无水乙醇加入量1/2体积、等体积、3/2体积,或采用异丙醇替代)进行优化,根据对应提取的dna质量浓度对比,故优化的最适体系极性溶液采用无水乙醇,无水乙醇最优加入量为等体积。
[0132]
二、对提取方法的筛选
[0133]
基于实施例1的吸附体系,对实施例4的抽提和洗涤方式进行优化。具体地,对实施例4所采用的抽提和洗涤方式进行调整。一方面,针对分别采用氯仿异戊醇混合液和加热(不加氯仿异戊醇)的抽提方式;另一方面采用磁分离洗涤和离心洗涤的洗涤方式,其他测试条件相同,测试结果如下表8所示。
[0134]
表8提取方法对磁珠提取大豆油中基因组dna的影响
[0135][0136]
注:t表示显著性分析的方式(配对样本t检验),*表示显著性水平0.05下呈现差异,**表示显著性水平0.01下呈现差异;/表示无扩增结果。
[0137]
研究采用配对样本t检验分别分析抽提方式和洗涤方式对磁珠法提取油脂中dna的影响。由上述表8测试结果可知,不同抽提方式条件下磁珠法提取油脂中dna的浓度在0.01显著性水平下呈现差异,而不同洗涤方式条件下磁珠法提取油脂中dna的浓度在0.05显著性水平下呈现差异。
[0138]
进一步比较其均值,发现采用氯仿异戊醇抽提在相同的提取方法下其提取的dna
质量浓度要高于不采用氯仿异戊醇抽提条件下提取的油脂中dna的浓度,而采用磁分离洗涤在相同的提取方法下其提取的dna质量浓度要高于采用离心洗涤条件下提取的油脂中dna的浓度。故在用磁珠法提取大豆油中dna时要采用氯仿异戊醇抽提以去除溶液中残存的油脂,且洗涤时要选择磁分离洗涤。
[0139]
三、试验对比验证
[0140]
关于大豆油基因组dna的提取,由于大豆油中高含量的油脂和蛋白等成分均会不同程度地影响基因组dna的提取,采用相关标准方法和代表性的试剂盒方法来进行比对。
[0141]
标准方法如农业部1485号公告-4-2010和国家标准19495.3-2004、代表性的试剂盒如树脂型油类基因组dna提取试剂盒和ctab
–
nucleospin foodkit法等进行大豆油基因组dna提取的效果均有待提高。对此,发明人做了大量的试验研究建立本发明适合大豆油基因组dna提取的磁珠法。
[0142]
为了证明本发明大豆油基因组dna的提取方法的良好提取效果,采用如下对比实验来说明和验证。
[0143]
实验例1大豆油基因组dna的提取方法,大豆油原料为金龙鱼精炼一级大豆油(原材料为转基因大豆,产品标准号为q/bbah0019s)
[0144]
采用本发明实施例1中的吸附体系和实施例4中的提取方法进行大豆油dna的提取。提取方法包括油样的dna粗提(步骤a)、磁珠与dna吸附(步骤b至h)和解吸附(步骤i至j)过程,具体包括如下步骤:
[0145]
(a)向20ml油样中加入16.67ml 65℃预热的ctab裂解液(5%ctab(w/v),100mm tris-hcl,20mm edta,1.4m nacl,1%吐温20(v/v),1%pvp40(w/v),ph 8.0),常温下在长轴旋转混匀仪上以45r/min混匀3h,然后将混合液在常温下12000g离心15min,吸除上层油相(裂解细胞步骤);再向离心管中加入20ml大豆油,重复上述步骤,直至浓缩60ml大豆油(dna浓缩步骤);离心后的溶液中间的乳化层可以采用70℃温浴破乳20min,并移除乳化层(破乳步骤);向下层水相中加入5/1000v核酸助沉剂和1/10v的naac,轻轻摇匀,再加入等体积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h)(沉淀dna步骤);在4℃下16000g离心混合液25min,弃上清,得dna透明沉淀;
[0146]
(b)向步骤(a)得到的大豆油dna沉淀中加入适量异硫氰酸胍溶液(结合液)涡旋混合(异硫氰酸胍溶液的浓度为1m、ph为6.0,加入量为1ml),借助于涡旋混合器充分溶解混匀,涡旋两次,每次5s,然后转入2ml无菌离心管中;
[0147]
(c)向步骤(b)得到的混合溶液中加入(与异硫氰酸胍溶液的加入体积)等体积的氯仿-异戊醇溶液,于长轴旋转混匀仪振荡混匀后,12000~14000g常温离心10~15min取上清液,并转移至另一2ml无菌离心管中(抽提步骤),且氯仿异戊醇混合液中氯仿和异戊醇的体积比为24:1;
[0148]
(d)向步骤(c)的离心管中加入适量磁珠、无水乙醇、triton x-100和nacl后,借助于涡旋混合器涡旋3s,室温下培育10min,培养期间再涡旋一次(结合步骤);其中,各用量为羧基磁珠(终浓度0.1mg/ml),无水乙醇1/1v,2%triton x-100(v/v),nacl(终浓度)2mmol/l;
[0149]
(e)将步骤(d)中的离心管置于磁性分离器中进行磁性分离,待磁珠聚集且溶液澄清后(一般需要3~5min),吸除溶液,得磁珠-dna复合物(第一次磁分离);
[0150]
(f)将步骤(e)中装有磁珠-dna复合物的离心管移出磁性分离器,并加入1ml质量分数80%的乙醇溶液(洗涤液)并手动颠倒混匀;
[0151]
(g)将步骤(f)中的离心管置于磁性分离器中进行二次磁性分离,并吸除乙醇溶液(第二次磁分离),且在吸除乙醇溶液时,离心管一直置于磁性分离器内;
[0152]
(h)重复步骤(f)~(g)洗涤步骤,在室温下干燥3~5min,保证乙醇基本挥发完全(第三次磁分离);
[0153]
(i)将步骤(h)中装有晾干的磁珠-dna复合物的离心管移出磁性分离器,并向离心管中加入适量te缓冲液(洗脱液)与磁珠充分混合,借助于涡旋混合器涡旋2s,然后在60℃水浴中培育10min,以洗脱dna(洗脱步骤);te缓冲液的组成为10mm tris-hcl和1mm edta,ph8.0,其加入量不能超过100ul;
[0154]
(j)将步骤(i)培养后的溶液立即趁热进行磁分离,待磁珠聚集,且溶液澄清后,吸取溶液至600μl无菌离心管中(第四次磁分离),分离时间为3~5min,涡旋时间为3~5s,并吸取澄清溶液,即得大豆油基因组dna,获得dna溶液应置-20℃保存,避免反复冻融。
[0155]
对比例1
[0156]
采用鼎国的树脂型油类基因组dna提取试剂盒(产品编号:nep009)。
[0157]
对比例2
[0158]
采用农业部1485号公告-4-2010a.5.3所公开的提取方法。
[0159]
对比例3
[0160]
采用国家标准gb/t 19495.3-2004c.6.3所公开的提取方法。
[0161]
对比例4
[0162]
采用当前代表性文献报道
[1]
所公开的ctab
–
nucleospin foodkit法。(参考文献:[1]xiaym,chen f s,jiang lz,et al.development ofan efficient method to extract dnafrom refined soybean oil[j].foodanalytical methods,2021,14(1):196-207.)
[0163]
对对比例1至对比例4的提取方法进行适当改进:将原料与试剂等比例增加或按照磁珠法的浓缩工艺进行dna浓缩,将实验所用原料固定为60ml大豆油,且最终被提取的dna均溶解在100ul缓冲液中。
[0164]
该实验例1、对比例1至对比例4是直接采用五种方法对装在离心管中的大豆油中的dna进行提取,通过实时荧光定量pcr染料法检测的浓度来比较五种方法。
[0165]
本发明实验例1采用吸附体系的大豆油基因组dna的提取方法与对比例1至4的比对结果如表9所示。
[0166]
表9不同种方法提取大豆油基因组dna的质量浓度
[0167]
实验例质量浓度ng/ul实验例10.038
±
0.012a对比例1/对比例2/对比例3/对比例40.027
±
0.018a[0168]
注:a-b不同的大写字母代表同列结果间存有显著差异(p<0.05);/表示无扩增结果。
[0169]
由表9可知,采用实验例1的方法从大豆油中提取出的dna质量浓度最高,考虑到精炼油中dna含量极低和降解严重的因素,因此本发明的提取方法可作为大豆油dna提取的良好选择。
[0170]
实验例2大豆油基因组dna的提取方法,以大豆油原料为金龙鱼精炼一级大豆油(原材料为转基因大豆,产品标准号为q/bbah0019s)
[0171]
采用本发明实施例1中的吸附体系和实施例4中的提取方法进行大豆油dna的提取。提取方法包括油样的dna粗提(步骤a)、磁珠与dna吸附(步骤b至h)和解吸附(步骤i至j)过程。具体提取方法与实验例1相同,且同样采用实施例1的吸附体系。
[0172]
大豆油原料为金龙鱼精炼一级大豆油(原材料为转基因大豆)为原料,分别采用如上述对比例1至对比例4所示的改进后提取方法对该大豆油原料进行提取,作为对比例5至对比例8。
[0173]
与上述实验例1及对比例1至对比例4不同的是,在采用该实验例2、对比例5至对比例8五种方法进行大豆油基因组dna的提取前,预先加入一定量的转基因大豆标准品(>98.5%)基因组dna,然后加入大豆油,后续按照各方法的提取过程,以此来对比各种方法对基因组dna的回收情况。
[0174]
本发明实验例2采用吸附体系的大豆油基因组dna的提取方法与对比例5至8的比对结果如表10所示;
[0175]
表10不同种方法对大豆油基因组dna的回收结果
[0176]
方法质量浓度ng/ul回收率实验例28.55
±
0.54a76.38%
±
5%a对比例5//对比例6//对比例72.21
±
1.04b6.69%
±
9%b对比例86.96
±
1.22a62.15%
±
11%a[0177]
注:a-b不同的小写字母代表同列结果间存有显著差异(p<0.05);a-b不同的大写字母代表同列结果间存有显著差异(p<0.05);/表示无扩增结果或回收率。
[0178]
由表10可知,实验例2可从大豆油中回收到较多的基因组dna,因此本发明的提取方法更有利于dna的提取。
[0179]
实验例3大豆油基因组dna的提取方法,大豆油原料为金龙鱼精炼一级大豆油(原材料为转基因大豆,产品标准号为q/bbah0019s)
[0180]
采用本发明实施例2中的吸附体系和实施例4中的提取方法进行大豆油dna的提取。提取方法包括油样的dna粗提(步骤a)、磁珠与dna吸附(步骤b至h)和解吸附(步骤i至j)过程,具体包括如下步骤:
[0181]
(a)向20ml油样中加入16.67ml 65℃预热的ctab裂解液(5%ctab(w/v),100mm tris-hcl,20mm edta,1.4m nacl,1%吐温20(v/v),1%pvp40(w/v),ph 8.0),常温下在长轴旋转混匀仪上以45r/min混匀3h,然后将混合液在常温下12000g离心15min,吸除上层油相(裂解细胞步骤);再向离心管中加入20ml大豆油,重复上述步骤,直至浓缩60ml大豆油(dna浓缩步骤);离心后的溶液中间的乳化层可以采用70℃温浴破乳20min,并移除乳化层(破乳步骤);向下层水相中加入5/1000v核酸助沉剂和1/10v的naac,轻轻摇匀,再加入等体
积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h)(沉淀dna步骤);在4℃下16000g离心混合液25min,弃上清,得dna透明沉淀;
[0182]
(b)向步骤(a)得到的大豆油dna沉淀中加入适量异硫氰酸胍溶液(结合液)涡旋混合(异硫氰酸胍溶液的浓度为0.5m、ph为5.5,加入量为1ml),借助于涡旋混合器充分溶解混匀,涡旋两次,每次5s,然后转入2ml无菌离心管中;
[0183]
(c)向步骤(b)得到的混合溶液中加入(与异硫氰酸胍溶液的加入体积)等体积的氯仿-异戊醇溶液,于长轴旋转混匀仪振荡混匀后,12000~14000g常温离心10~15min取上清液,并转移至另一2ml无菌离心管中(抽提步骤),且氯仿异戊醇混合液中氯仿和异戊醇的体积比为24:1;
[0184]
(d)向步骤(c)的离心管中加入适量磁珠、无水乙醇、triton x-100和nacl后,借助于涡旋混合器涡旋3s,室温下培育10min,培养期间再涡旋一次(结合步骤);其中,各用量为羧基磁珠(终浓度0.1mg/ml),无水乙醇1/2v,2%triton x-100(v/v),nacl(终浓度)2mmol/l;
[0185]
(e)将步骤(d)中的离心管置于磁性分离器中进行磁性分离,待磁珠聚集且溶液澄清后(一般需要3~5min),吸除溶液,得磁珠-dna复合物(第一次磁分离);
[0186]
(f)将步骤(e)中装有磁珠-dna复合物的离心管移出磁性分离器,并加入1ml质量分数80%的乙醇溶液(洗涤液)并手动颠倒混匀;
[0187]
(g)将步骤(f)中的离心管置于磁性分离器中进行二次磁性分离,并吸除乙醇溶液(第二次磁分离),且在吸除乙醇溶液时,离心管一直置于磁性分离器内;
[0188]
(h)重复步骤(f)~(g)洗涤步骤,在室温下干燥3~5min,保证乙醇基本挥发完全(第三次磁分离);
[0189]
(i)将步骤(h)中装有晾干的磁珠-dna复合物的离心管移出磁性分离器,并向离心管中加入适量te缓冲液(洗脱液)与磁珠充分混合,借助于涡旋混合器涡旋2s,然后在60℃水浴中培育10min,以洗脱dna(洗脱步骤);te缓冲液的组成为10mm tris-hcl和1mm edta,ph 8.0,其加入量不能超过100ul;
[0190]
(j)将步骤(i)培养后的溶液立即趁热进行磁分离,待磁珠聚集,且溶液澄清后,吸取溶液至600μl无菌离心管中(第四次磁分离),分离时间为3~5min,涡旋时间为3~5s,并吸取澄清溶液,即得大豆油基因组dna,获得dna溶液应置-20℃保存,避免反复冻融。
[0191]
实验例4大豆油基因组dna的提取方法,大豆油原料为金龙鱼精炼一级大豆油(原材料为转基因大豆,产品标准号为q/bbah0019s)
[0192]
采用本发明实施例3中的吸附体系和实施例4中的提取方法进行大豆油dna的提取。提取方法包括油样的dna粗提(步骤a)、磁珠与dna吸附(步骤b至h)和解吸附(步骤i至j)过程,具体包括如下步骤:
[0193]
(a)向20ml油样中加入16.67ml 65℃预热的ctab裂解液(5%ctab(w/v),100mm tris-hcl,20mm edta,1.4m nacl,1%吐温20(v/v),1%pvp40(w/v),ph 8.0),常温下在长轴旋转混匀仪上以45r/min混匀3h,然后将混合液在常温下12000g离心15min,吸除上层油相(裂解细胞步骤);再向离心管中加入20ml大豆油,重复上述步骤,直至浓缩60ml大豆油(dna浓缩步骤);离心后的溶液中间的乳化层可以采用70℃温浴破乳20min,并移除乳化层(破乳步骤);向下层水相中加入5/1000v核酸助沉剂和1/10v的naac,轻轻摇匀,再加入等体
积在-20℃预冷的异丙醇,轻轻摇匀后置于-20℃过夜(8~12h)(沉淀dna步骤);在4℃下16000g离心混合液25min,弃上清,得dna透明沉淀;
[0194]
(b)向步骤(a)得到的大豆油dna沉淀中加入适量异硫氰酸胍溶液(结合液)涡旋混合(异硫氰酸胍溶液的浓度为2m、ph为6.5,加入量为1ml),借助于涡旋混合器充分溶解混匀,涡旋两次,每次5s,然后转入2ml无菌离心管中;
[0195]
(c)向步骤(b)得到的混合溶液中加入(与异硫氰酸胍溶液的加入体积)等体积的氯仿-异戊醇溶液,于长轴旋转混匀仪振荡混匀后,12000~14000g常温离心10~15min取上清液,并转移至另一2ml无菌离心管中(抽提步骤),且氯仿异戊醇混合液中氯仿和异戊醇的体积比为24:1;
[0196]
(d)向步骤(c)的离心管中加入适量磁珠、无水乙醇、triton x-100和nacl后,借助于涡旋混合器涡旋3s,室温下培育10min,培养期间再涡旋一次(结合步骤);其中,各用量为羧基磁珠(终浓度0.1mg/ml),无水乙醇3/2v,2%triton x-100(v/v),nacl(终浓度)2mmol/l;
[0197]
(e)将步骤(d)中的离心管置于磁性分离器中进行磁性分离,待磁珠聚集且溶液澄清后(一般需要3~5min),吸除溶液,得磁珠-dna复合物(第一次磁分离);
[0198]
(f)将步骤(e)中装有磁珠-dna复合物的离心管移出磁性分离器,并加入1ml质量分数80%的乙醇溶液(洗涤液)并手动颠倒混匀;
[0199]
(g)将步骤(f)中的离心管置于磁性分离器中进行二次磁性分离,并吸除乙醇溶液(第二次磁分离),且在吸除乙醇溶液时,离心管一直置于磁性分离器内;
[0200]
(h)重复步骤(f)~(g)洗涤步骤,在室温下干燥3~5min,保证乙醇基本挥发完全(第三次磁分离);
[0201]
(i)将步骤(h)中装有晾干的磁珠-dna复合物的离心管移出磁性分离器,并向离心管中加入适量te缓冲液(洗脱液)与磁珠充分混合,借助于涡旋混合器涡旋2s,然后在60℃水浴中培育10min,以洗脱dna(洗脱步骤);te缓冲液的组成为10mm tris-hcl和1mm edta,ph 8.0,其加入量不能超过100ul;
[0202]
(j)将步骤(i)培养后的溶液立即趁热进行磁分离,待磁珠聚集,且溶液澄清后,吸取溶液至600μl无菌离心管中(第四次磁分离),分离时间为3~5min,涡旋时间为3~5s,并吸取澄清溶液,即得大豆油基因组dna,获得dna溶液应置-20℃保存,避免反复冻融。
[0203]
采用本发明不同吸附体系的实验例3和实验例4的提取方法与实验例1的比对结果如表10所示。
[0204]
表10不同吸附体系提取大豆油基因组dna的质量浓度
[0205]
实验例质量浓度ng/ul实验例10.038
±
0.012a实验例30.020
±
0.011c实验例40.029
±
0.009b[0206]
注:a-b不同的小写字母代表同列结果间存有显著差异(p<0.05)。
[0207]
由上述表10测试结果可知,采用不同吸附体系提取大豆油中基因组dna所得的结果不同,根据对应提取的dna质量浓度对比,故采用实验例1中所述吸附体系提取效果是最优且最显著的。
[0208]
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1