一种谷胱甘肽还原酶测定试剂盒及其制备方法与流程
1.本发明属于生物医学检测技术领域,具体涉及一种谷胱甘肽还原酶测定试剂盒及其制备方法。
背景技术:
2.谷胱甘肽还原酶(gluathione reductase,gr)是人体氧化还原体系中最为重要的酶之一,是维持细胞中还原型谷胱甘肽(gsh)含量的主要黄素酶。在nadph参与下,氧化型谷胱甘肽转化为还原型谷胱甘肽,后者在防止血红蛋白的氧化分解、维持巯基蛋白的活性、保证巯基蛋白的还原性及细胞的完整性具有重要的作用。通过体外定量检测人血清中谷胱甘肽还原酶(gr)的活性,可用于葡萄糖-6磷酸脱氢酶(g-6-pd)缺乏症的辅助诊断。
3.目前,测定谷胱甘肽还原酶的方法主要有elisa法和紫外酶法,前者需要手工操作,耗时较长,步骤繁琐,成本较高,后者步骤简单,成本较低,被广泛推广应用。后者的检测原理在于:谷胱甘肽还原酶(gr)催化氧化型谷胱甘肽(gssg)还原成还原型谷胱甘肽(gsh),同时还原型辅酶ⅱ(nadph)被氧化成为辅酶ⅱ(nadp
+
)。nadph在波长340nm有特异吸收峰,其氧化的速率与血清中gr的活性成正比,在340nm处测定nadph吸光度下降的速率,即可计算出gr活性。为了提高紫外酶法谷胱甘肽还原酶测定试剂盒检测的准确度和保存稳定性,通常需要加入各种抗干扰试剂、防腐剂、抗菌剂、表面活性剂和稳定剂等。
4.如在专利cn 108828215a及cn 114966025 a中,通过加入丙酮酸氧化酶和抗坏血酸氧化酶消除血清中的丙酮酸和抗坏血酸的干扰,提高试剂的准确性。通过加入亚铁氰化钾稳定血红蛋白中的铁离子,减小对试剂检测结果的影响。以及通过加入加可溶性淀粉、海藻糖、甘油的混合物或葡萄糖-6-磷酸、nadp
+
和葡萄糖-6-磷酸脱氢酶提高试剂的稳定性。专利cn 113528609 a还公开了加入水溶性两性霉素b作为第一抑菌剂和盐酸万古霉素作为第二抑菌剂,增强还原酶的稳定性及抗菌能力,并加入牛血清蛋白、山梨醇、核黄素的混合物作为稳定剂,进一步提高试剂的稳定性。专利cn 113984689 a公开了通过试剂r1以及试剂r2中添加定量的聚氧乙烯醚brij58,可以大幅降低血红蛋白的干扰,同时通过在试剂r1中添加定量的egta,解决了因新鲜样本中谷胱甘肽还原酶主要以多聚酶形式存在而导致的酶活性降低的问题,进而有效提升了试剂盒的临床检测准确度。专利cn 114774509 a公开了通过在谷胱甘肽还原酶测定试剂盒的试剂r1以及试剂r2中添加烷基糖苷,增强试剂盒的稳定性。
5.通过以上现有技术可以看出,为了提高谷胱甘肽还原酶测定试剂盒的准确性和稳定性,需要添加各种功能试剂以达到相应效果,造成组分复杂,成本提高。同时功能添加组分过多对于试剂盒的稳定性也带来了新的不可控因素。
技术实现要素:
6.针对以上现有技术存在的缺点和不足之处,本发明的首要目的在于提供一种谷胱甘肽还原酶测定试剂盒。本发明通过在试剂盒的r1试剂和r2试剂中添加一定量脂肽生物表
面活性剂,可同时达到抗干扰、抗菌防腐及提高稳定性的作用。
7.本发明的另一目的在于提供上述谷胱甘肽还原酶测定试剂盒的制备方法。
8.本发明目的通过以下技术方案实现:
9.一种谷胱甘肽还原酶测定试剂盒,由r1试剂和r2试剂组成,其中r1试剂包括氧化型谷胱甘肽(gssg)、三羟甲基氨基甲烷(tris)缓冲液和脂肽;r2试剂包括二核苷酸磷酸(nadph)、磷酸盐(pbs)缓冲液和脂肽。
10.进一步地,所述试剂盒还包括校准品和质控品,所述校准品和质控品为冻干型谷胱甘肽还原酶样品。
11.进一步地,所述r1试剂中gssg的含量为1~10mmol/l。
12.进一步地,所述r1试剂中tris缓冲液的含量为10~100mmol/l。
13.进一步地,所述r1试剂中脂肽的含量为0.1~10g/l。
14.进一步地,所述r2试剂中nadph的含量为0.5~10mmol/l
15.进一步地,所述r2试剂中pbs缓冲液的含量为50~250mmol/l。
16.进一步地,所述r2试剂中脂肽的含量为0.1~10g/l。
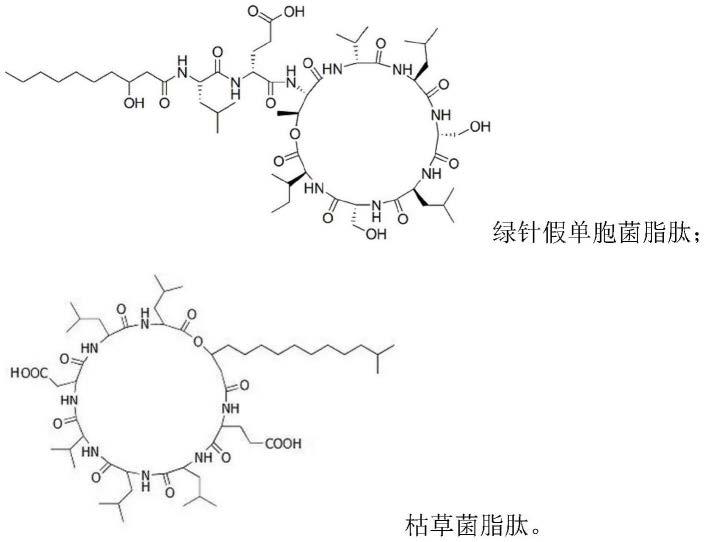
17.进一步优选地,所述脂肽为环状脂肽。
18.更优选地,所述脂肽为绿针假单胞菌脂肽或枯草菌脂肽。其结构分别如下:
[0019][0020]
本发明所采用的脂肽分子中具有由多个氨基酸组成的肽链形成的亲水基和脂肪经链形成的亲油基,其具有较强的表面活性,且具有相比其它合成表面活性剂更好的生物相容性,因而具有更好的稳定作用。同时脂肽还具有一定的抗菌活性,可达到抗菌防腐及进一步提高稳定性的作用。另外环状脂肽对部分重金属离子具有极强的结合作用,其在本发明中可替代常规亚铁氰化钾与血红蛋白中的铁离子作用形成稳定的结合物,并可稳定低分子活性基团化合物如胆红素、维生素c等,提高检测试剂盒的抗干扰作用。
[0021]
本发明试剂盒的检验原理为:试剂中的nadph与氧化型谷胱甘肽(gssg)在待测标本中的谷胱甘肽还原酶(gr)催化作用下发生氧化还原反应,生成还原型谷胱甘肽(gsh)和
nadp
+
。nadph在波长340nm有特异性吸收峰,其氧化的速率与血清中gr的活性成正比。
[0022]
在340nm出测定nadph吸光度下降的速率,即可计算出gr的活性。
[0023][0024]
上述谷胱甘肽还原酶测定试剂盒的制备方法,包括如下制备步骤:
[0025]
(1)配制r1试剂:取设定量的水,依次加入tris缓冲液、gssg和脂肽搅拌溶解均匀,调节ph值至7~8,即得r1试剂;
[0026]
(2)配制r2试剂:取设定量的水,依次加入pbs缓冲液、nadph和脂肽搅拌溶解均匀,调节ph值至9~11,即得r2试剂;
[0027]
(3)将r1试剂和r2试剂按规定剂量组合包装,得到谷胱甘肽还原酶测定试剂盒。
[0028]
与现有技术相比,本发明的有益效果是:
[0029]
(1)本发明试剂盒用于体外定量检测人血清中谷胱甘肽还原酶(gr)的活性。临床上主要用于葡萄糖-6磷酸脱氢酶(g-6-pd)缺乏症的辅助诊断。
[0030]
(2)本发明试剂盒成分组成简单,成本较低且质量可控性高。
[0031]
(3)本发明试剂盒通过在液体双试剂中加入脂肽功能成分,可以同时达到抗干扰、抗菌防腐及提高稳定性的作用,无需添加其它复杂功能助剂。
具体实施方式
[0032]
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0033]
实施例1
[0034]
本实施例的一种谷胱甘肽还原酶测定试剂盒,由r1试剂和r2试剂组成,其中r1试剂规格为40ml
×
2,r2试剂规格为20ml
×
1。r1试剂和r2试剂的成分组成如下:
[0035]
r1试剂:gssg 4mmol/l,tris缓冲液40mmol/l,枯草菌脂肽3g/l。
[0036]
r2试剂:nadph(还原型辅酶ⅱ)2mmol/l,pbs缓冲液80mmol/l,枯草菌脂肽3g/l。
[0037]
本实施例谷胱甘肽还原酶测定试剂盒的制备方法如下:
[0038]
(1)配制r1试剂:取设定量的水,依次加入tris缓冲液、gssg和枯草菌脂肽搅拌溶解均匀,调节ph值至7.5,即得r1试剂;
[0039]
(2)配制r2试剂:取设定量的水,依次加入pbs缓冲液、nadph和枯草菌脂肽搅拌溶解均匀,调节ph值至10,即得r2试剂。
[0040]
(3)将r1试剂以40ml
×
2,r2试剂以20ml
×
1的规格包装,在2~8℃密封条件避光保存,即为本发明谷胱甘肽还原酶测定试剂盒。
[0041]
对本实施例所得测定试剂盒进行如下性能指标测试,测试基本参数及测定方法分别如下表1和表2所示。
[0042]
表1.基本参数
[0043]
主波长340nm样本(s)10μl副波长405nm试剂1(r1)200μl反应类型速率法试剂2(r2)50μl反应方向负反应反应温度37℃
[0044]
表2.测定方法
[0045][0046]
1、空白吸光度测试:
[0047]
使用分光光度计,用试剂盒测定空白样品(纯水),在37℃、340nm波长、1cm光径条件下,测试试剂空白吸光度,重复测试3次取平均值;记录测试启动时的吸光度值(a1)和约5min后的吸光度值(a2),按式(1)计算吸光度变化值(
△
a/min)。结果显示试剂空白吸光度为0.826;试剂空白吸光度变化率(δa/min)为0.001。
[0048][0049]
2、灵敏度测试:
[0050]
用试剂盒测定浓度在50
±
5u/l范围的样品,记录试剂盒在37℃、340nm波长、1cm光径条件下的吸光度差值,按式(2)换算为50u/l的吸光度差值(a),平行测定三次取平均值。结果显示吸光度变化率(
△
a/min)为0.045。
[0051][0052]
式中:
[0053]
a已知样品—已知浓度样品的吸光度差值;
[0054]
c已知样品—已知样品的浓度。
[0055]
3、线性范围测试:
[0056]
用接近线性区间下限的低浓度样品(l)稀释接近线性范围上限的高浓度样品(h),按表3混合成5个稀释浓度(xi),每个稀释浓度各测定3次取平均值,分别求出每个稀释浓度检测结果的均值(yi)。以xi为自变量,以yi为因变量求出线性回归方程。按式(3)计算线性回归的相关系数(r)。结果显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9980。
[0057][0058]
表3稀释比例示例表
[0059]
序号12345空白样品0份1份2份3份4份高浓度样品4份3份2份1份0份
[0060]
将稀释浓度(xi)代入线性回归方程,按式(4)、式(5)计算测试均值(yi)与相应估计值(y)的绝对偏差或相对偏差(s)。结果显示在[10.0,40.0]u/l范围内,绝对偏差为-0.5u/l~0.4u/l;[40.0,300.0]u/l范围内,相对偏差为-2.32%~1.89%。
[0061]s绝对偏差
=y
i-y
…………………………………………………………
(4)
[0062][0063]
4、重复性测试:
[0064]
在重复性条件下,用试剂盒测定使用高(200u/l)、低(10u/l)不同浓度的样本,重复测定10次,分别计算测量值的平均值和标准差(sd),按式(6)计算变异系数(cv)。
[0065]
结果显示重复测量结果的变异系数(cv,%)为1.37(高浓度)和0.75(低浓度)。
[0066][0067]
式中:
[0068]
cv—变异系数;
[0069]
sd—10次测量结果的标准差;
[0070]
—10次测量结果的平均值。
[0071]
5、批间差测试:
[0072]
取三个不同批号的试剂盒,测定浓度在50
±
5u/l范围内的质控样品,每个批号各测定3次,分别计算每批3次测定的均值按式(7)、式(8)计算相对极差(r)。
[0073]
结果显示批间相对极差为2.06%。
[0074][0075][0076]
式中:
[0077]
—三批测试值的均值;
[0078]
r—批间相对极差;
[0079]
的最大值;
[0080]
的最小值。
[0081]
6、准确度测试:
[0082]
用试剂盒测定企业参考品(人源血清样品),重复测定3次,测试结果记为(xi),按式(9)分别计算相对偏差(bi),3次测量结果相对偏差分别为1.57%、-1.64%、2.15%。
[0083][0084]
式中:
[0085]bi
—相对偏差;
[0086]
xi—测试结果;
[0087]
t—标准物质标示值。
[0088]
7、校准品、质控品性能试验:
[0089]
7.1校准品准确度试验
[0090]
用校准品校准试剂盒测量程序后,按照常规样品进行检测,样品测定3次,测试结果标记为(xi),按式(9)分别计算相对偏差(bi),3次测量结果相对偏差分别为1.42%、0.88%、2.69%。
[0091]
7.2均一性试验
[0092]
取10瓶同批号的最小包装单元的校准品或质控品,每包装单元测试1次,按式(10)计算测试结果的平均值按式(11)计算标准差s1;另用上述校准品或质控品中的1个最小包装单元连续测试10次,分别按式(10)和式(11)计算测试结果的平均值和标准差s2;按式(12)、式(13)计算瓶间重复性cv%。结果显示对定值校准品进行测试,瓶间重复性变异系数为1.15%。对定值质控品进行测试,瓶间重复性变异系数为1.36%。
[0093][0094][0095][0096][0097]
当s1《s2时,令cv
瓶间
=0
[0098]
式中:
[0099]
—平均值;
[0100]
s—标准差;
[0101]
n—测量次数;
[0102]
xi—指定参数第i次测量值。
[0103]
8、稳定性测试:
[0104]
将试剂盒置于37℃恒温摇床内,分别在0周、1周、2周、4周、8周、16周检测靶值为50u/l质控品的数值,重复检测三遍,记录并计算平均值(xi),按式(9)分别计算相对偏差(bi),结果如下表4所示。
[0105]
表4
[0106]
序号0周1周2周4周8周16周相对偏差bi1.66%-1.28%-0.98%-2.16%-2.79%-3.28%
[0107]
通过以上结果可见,本发明的谷胱甘肽还原酶测定试剂盒具有良好的准确度、灵敏度和稳定性。
[0108]
对比例1
[0109]
本对比例与实施例1相比,试剂盒中r1试剂不含枯草菌脂肽,其余相同。r1试剂和r2试剂的成分组成如下:
[0110]
r1试剂:gssg 4mmol/l,tris缓冲液40mmol/l。
[0111]
r2试剂:nadph(还原型辅酶ⅱ)2mmol/l,pbs缓冲液80mmol/l,枯草菌脂肽3g/l。
[0112]
按实施例1中的方法进行相应性能指标测试,空白吸光度测试显示试剂空白吸光度为0.817;试剂空白吸光度变化率(δa/min)为0.001。灵敏度测试显示吸光度变化率(
△
a/min)为0.030。线性范围测试显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9586;在[10.0,40.0]u/l范围内,绝对偏差为-3.8u/l~-1.6u/l;[40.0,300.0]u/l范围内,相对偏差为-4.75%~-2.52%。重复性测试显示重复测量结果的变异系数(cv,%)为1.62(高浓度)和2.53(低浓度)。批间差测试显示批间相对极差为2.88%。准确度测试结果显示3次测量结果相对偏差分别为-5.50%、-4.71%、-4.46%。校准品准确度试验结果显示3次测量结果相对偏差分别为-4.57%、-4.74%、-5.59%。均一性试验显示对定值校准品进行测试,瓶间重复性变异系数为2.42%。对定值质控品进行测试,瓶间重复性变异系数为2.28%。稳定性测试结果如下表5所示。
[0113]
表5
[0114]
序号0周1周2周4周8周16周相对偏差b
i-4.65%-4.89%-4.76%-5.85%-6.60%-9.66%
[0115]
通过本对比例与实施例1的比较结果可见,本发明通过在r1试剂中加入枯草菌脂肽,可在一定程度上提高检测灵敏度,可明显改善试剂盒的线性范围和提高试剂盒的检测准确度,并在一定程度上改善试剂盒稳定性。其原因在于本发明采用的环状脂肽可以显著降低血清样品中血红蛋白、胆红素、维生素c等的干扰作用,并有助于检测试剂的稳定。
[0116]
对比例2
[0117]
本对比例与实施例1相比,试剂盒中r2试剂不含枯草菌脂肽,其余相同。r1试剂和r2试剂的成分组成如下:
[0118]
r1试剂:gssg 4mmol/l,tris缓冲液40mmol/l,枯草菌脂肽3g/l。
[0119]
r2试剂:nadph(还原型辅酶ⅱ)2mmol/l,pbs缓冲液80mmol/l。
[0120]
按实施例1中的方法进行相应性能指标测试,空白吸光度测试显示试剂空白吸光度为0.821;试剂空白吸光度变化率(δa/min)为0.0015。灵敏度测试显示吸光度变化率(
△
a/min)为0.045。线性范围测试显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9975;在[10.0,40.0]u/l范围内,绝对偏差为-0.6u/l~0.3u/l;[40.0,300.0]u/l范围内,相对偏差为-3.18%~2.80%。重复性测试显示重复测量结果的变异系数(cv,%)为1.55(高浓度)和2.10(低浓度)。批间差测试显示批间相对极差为2.56%。准确度测试结果显示3次测量结果相对偏差分别为-2.40%、2.52%、2.20%。校准品准确度试验结果显示3次测量结果相对偏差分别为0.80%、-2.37%、1.95%。均一性试验显示对定值校准品进行测试,瓶间重复性变异系数为1.28%。对定值质控品进行测试,瓶间重复性变异系数为1.79%。稳定性测试结果如下表6所示。
[0121]
表6
[0122]
序号0周1周2周4周8周16周相对偏差b
i-1.20%1.00%-3.55%-5.90%-10.67%-18.60%
[0123]
通过本对比例与实施例1的比较结果可见,本发明通过在r2试剂中加入枯草菌脂肽,可明显改善试剂盒的检测稳定性。
[0124]
实施例2
[0125]
本实施例与实施例1相比,将r1试剂和r2试剂中的枯草菌脂肽替换为同等浓度的
绿针假单胞菌脂肽,其余相同。
[0126]
按实施例1中的方法进行相应性能指标测试,空白吸光度测试显示试剂空白吸光度为0.830;试剂空白吸光度变化率(δa/min)为0.0015。灵敏度测试显示吸光度变化率(
△
a/min)为0.045。线性范围测试显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9976;在[10.0,40.0]u/l范围内,绝对偏差为-0.7u/l~-0.1u/l;[40.0,300.0]u/l范围内,相对偏差为-4.05%~1.42%。重复性测试显示重复测量结果的变异系数(cv,%)为2.35(高浓度)和2.20(低浓度)。批间差测试显示批间相对极差为1.75%。准确度测试结果显示3次测量结果相对偏差分别为0.55%、-2.62%、0.99%。校准品准确度试验结果显示3次测量结果相对偏差分别为1.86%、-2.48%、-1.67%。均一性试验显示对定值校准品进行测试,瓶间重复性变异系数为1.90%。对定值质控品进行测试,瓶间重复性变异系数为1.65%。稳定性测试结果如下表7所示。
[0127]
表7
[0128]
序号0周1周2周4周8周16周相对偏差bi0.96%-2.36%-2.44%-2.89%-3.72%-3.66%
[0129]
通过以上结果可见,本发明的谷胱甘肽还原酶测定试剂盒具有良好的准确度、灵敏度和稳定性。
[0130]
对比例3
[0131]
本对比例与实施例2相比,试剂盒中r1试剂不含绿针假单胞菌脂肽,其余相同。r1试剂和r2试剂的成分组成如下:
[0132]
r1试剂:gssg 4mmol/l,tris缓冲液40mmol/l。
[0133]
r2试剂:nadph(还原型辅酶ⅱ)2mmol/l,pbs缓冲液80mmol/l,绿针假单胞菌脂肽3g/l。
[0134]
按实施例1中的方法进行相应性能指标测试,空白吸光度测试显示试剂空白吸光度为0.826;试剂空白吸光度变化率(δa/min)为0.001。灵敏度测试显示吸光度变化率(
△
a/min)为0.025。线性范围测试显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9612;在[10.0,40.0]u/l范围内,绝对偏差为-3.2u/l~-1.5u/l;[40.0,300.0]u/l范围内,相对偏差为-5.78%~-3.92%。重复性测试显示重复测量结果的变异系数(cv,%)为1.58(高浓度)和2.40(低浓度)。批间差测试显示批间相对极差为2.07%。准确度测试结果显示3次测量结果相对偏差分别为-4.85%、-5.50%、-4.64%。校准品准确度试验结果显示3次测量结果相对偏差分别为-5.08%、-4.36%、-4.77%。均一性试验显示对定值校准品进行测试,瓶间重复性变异系数为2.78%。对定值质控品进行测试,瓶间重复性变异系数为3.05%。稳定性测试结果如下表8所示。
[0135]
表8
[0136]
序号0周1周2周4周8周16周相对偏差b
i-4.92%-5.05%-5.53%-6.06%-7.24%-9.12%
[0137]
通过本对比例与实施例2的比较结果可见,本发明通过在r1试剂中加入绿针假单胞菌脂肽,可在一定程度上提高检测灵敏度,可明显改善试剂盒的线性范围和提高试剂盒的检测准确度,并在一定程度上改善试剂盒稳定性。
[0138]
对比例4
[0139]
本对比例与实施例2相比,试剂盒中r2试剂不含绿针假单胞菌脂肽,其余相同。r1试剂和r2试剂的成分组成如下:
[0140]
r1试剂:gssg 4mmol/l,tris缓冲液40mmol/l,绿针假单胞菌脂肽3g/l。
[0141]
r2试剂:nadph(还原型辅酶ⅱ)2mmol/l,pbs缓冲液80mmol/l。
[0142]
按实施例1中的方法进行相应性能指标测试,空白吸光度测试显示试剂空白吸光度为0.819;试剂空白吸光度变化率(δa/min)为0.0015。灵敏度测试显示吸光度变化率(
△
a/min)为0.045。线性范围测试显示在[10.0,300.0]u/l范围内,线性相关系数r=0.9958;在[10.0,40.0]u/l范围内,绝对偏差为0.2u/l~0.5u/l;[40.0,300.0]u/l范围内,相对偏差为-3.72%~1.50%。重复性测试显示重复测量结果的变异系数(cv,%)为1.73(高浓度)和2.26(低浓度)。批间差测试显示批间相对极差为1.95%。准确度测试结果显示3次测量结果相对偏差分别为1.23%、1.88%、-2.22%。校准品准确度试验结果显示3次测量结果相对偏差分别为2.32%、2.14%、2.65%。均一性试验显示对定值校准品进行测试,瓶间重复性变异系数为2.03%。对定值质控品进行测试,瓶间重复性变异系数为2.46%。稳定性测试结果如下表9所示。
[0143]
表9
[0144]
序号0周1周2周4周8周16周相对偏差bi2.12%1.64%-2.75%-6.82%-12.74%-18.94%
[0145]
通过本对比例与实施例1的比较结果可见,本发明通过在r2试剂中加入绿针假单胞菌脂肽,可明显改善试剂盒的检测稳定性。
[0146]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1