长效胰淀素受体激动剂及其用途的制作方法
长效胰淀素受体激动剂及其用途
1.本公开涉及医药学领域。更具体而言,本公开涉及糖尿病、肥胖症和/或长期体重管理、血脂异常和/或非酒精性脂肪性肝炎(nash)的治疗领域。本公开涉及激动胰淀素受体(amylin receptor)的化合物,因此可以降低食物摄入、体重、葡萄糖、hba1c(糖化血红蛋白)和/或甘油三酯,并且可以用于治疗糖尿病、肥胖症和/或长期体重管理、血脂异常和/或nash。本公开还包括含有此类化合物的药物组合物以及此类化合物和药物组合物的治疗用途。
2.在过去几十年里,糖尿病的患病率持续上升。2型糖尿病(“t2dm”)是最常见的糖尿病形式,占所有糖尿病的90%。t2dm表征为高血糖水平,主要与胰岛素抗性有关。糖尿病患者所希望的治疗应降低血糖并稳定hba1c。
3.肥胖症是一种复杂的医学疾病,导致脂肪组织块过度累积。如今,肥胖症是一个全球性的公共卫生问题,通常与不希望的健康结果和发病率有关。肥胖症患者所希望的治疗应减少超重,改善与肥胖症相关的共病(co-morbidities),和/或保持长期的重量降低。
4.血脂异常是血液中胆固醇和其他脂质(也称为脂肪)水平异常。血脂异常增加动脉堵塞(动脉粥样硬化)、心脏病发作、中风或其他循环系统问题的几率,尤其是在吸烟个体中。
5.nash代表非酒精性脂肪性肝炎。它是代谢疾病的肝脏表现,是非酒精性脂肪肝疾病(nafld)最严重的形式。nash与糖尿病和肥胖症的共病密切相关。
6.胰淀素(amylin)是一种37个氨基酸的肽激素,与胰岛素共同从胰腺β-细胞分泌,在糖尿病患者中缺乏。它抑制胰高血糖素分泌,延迟胃排空,并起到饱腹剂的作用。因此,胰淀素有助于调节餐后体内葡萄糖的量。然而,人胰淀素的理化性质使其难以作为药物使用。例如,胰淀素很难配制,因为它在化学上不稳定,并且在生理ph下沉淀,因此必须在酸性溶液中配制。此外,这种药物的半寿期不到一个小时,而且是在用餐时间使用,因此患者一天需要多个剂量来在治疗中使用这种药物。
7.普兰林肽(pramlintide)是一种市售的胰淀素激动剂肽,用于治疗糖尿病,作为胰岛素的添加物。普兰林肽在中性ph下化学不稳定,这是由于存在二硫键(-s-s-)和脱酰胺作用。因此,它以酸性制剂提供。与人胰淀素相比,普兰林肽中位置25、28和29的氨基酸被脯氨酸取代。这些修饰降低了该肽的原纤维形成倾向。然而,普兰林肽的血浆半寿期仍然很短,因此必须每天注射两到三次,这可导致不便和依从性差,随后疗效不完全或低于最佳效果。此外,其低ph制剂与用于胰岛素和glp-1类似物的中性ph制剂不相容,这使得其与这类化合物的共同施用变得复杂,这些化合物可以具有协同作用,从而具有改善的临床功效。
8.人胰淀素与两种不同的受体复合物结合。这两种复合物还包含降钙素受体加受体活性蛋白ramp1或ramp3。降钙素受体见于全身许多组织中,认为其涉及骨代谢的调节。然而,除了骨调节外,对降钙素受体在人类中的生理学知之甚少,因此,对降钙素受体具有高亲和力的分子的脱靶毒性风险可以增加。因此认为,与降钙素受体相比,对胰淀素受体具有增加的选择性的基于胰淀素的多肽可以提供有利的药代动力学和药理学特征。
9.从降钙素受体和胰淀素受体之间的密切关系来看,可以预期胰淀素受体激动剂对
降钙素受体具有一定的交叉反应性。作为实例,胰淀素激动剂肽普兰林肽对降钙素受体具有一定的亲和力,尽管它对胰淀素受体的效力高14倍。
10.已经公开了包含人胰淀素激动剂肽并具有白蛋白结合部分的多肽。参见wo 2010/046357、wo 2009/034119和wo 2009/034119。尽管与普兰林肽相比,这些具有白蛋白结合部分的多肽表现出改善的药代动力学(pk)或药效学(pd)特性,但它们在某些条件下仍可以表现出较差的物理稳定性。此外,该多肽通常未表现出对胰淀素受体的选择性超出对降钙素受体的选择性。us2014/0087995涉及多肽,该多肽包含对胰淀素受体的选择性超出对降钙素受体的选择性的胰淀素激动剂肽。然而,仍然需要具有更高效力、更低可开发性风险、更低免疫原性风险、改进的化学稳定性以及在中性ph下与制剂的相容性的胰淀素激动剂肽候选药物。
11.需要表现出对胰淀素受体超出对降钙素受体的激动选择性的化合物(例如肽)。此外,还需要作用时间延长和效力保持的胰淀素受体激动剂。治疗上所希望的化合物激动胰淀素受体,并提供一种或多种有利特性,如降低以下任何一种:食物摄入、体重、血糖水平、hba1c、甘油三酯和/或胰岛素水平。此外,治疗上所希望的化合物可以具有一种或多种额外的有利特性,如延长作用时间并保持或提高激动胰淀素受体的效力、免疫原性反应风险低和/或纤维性颤动(fibrillation)风险低。
12.此外,希望本公开的胰淀素受体激动剂任选地与肠促胰岛素(incretin)或肠促胰岛素类似物的组合提供糖尿病、肥胖症、nash和/或血脂异常的治疗。这种组合也优选比单独的任一分子更有效。例如,与单独使用每种分子相比,使用这种组合的这种治疗可以允许使用较低剂量的任一种或两种分子,这可能导致副作用较低(或一种或另一种治疗的持续时间更短),同时保持功效。认为本文提供的新组合将是糖尿病、肥胖症、nash和/或血脂异常的有效治疗。
13.因此,本公开提供了一种治疗糖尿病、肥胖症、nash和/或血脂异常的方法,其包括对需要这种治疗的患者施用有效量的本发明的胰淀素受体激动剂和有效量的额外活性剂。
14.因此,本公开描述了激动胰淀素受体并且具有一种或多种以下特性的新化合物(肽):(1)有效减少食物摄入和体重;(2)降低葡萄糖和胰岛素;(3)与普兰林肽相比免疫原性风险降低、纤维性颤动风险低;(4)与普兰林肽相比半寿期大大延长。本公开的化合物的延长的半寿期将使这些化合物能够每周给药一次用于治疗。
15.本公开的一个实施方案是一种化合物,其包含:xaa
1-c-xaa
3-tatcat-xaa
10-xaa
11-xaa
12-ae-xaa
15-lvrss-xaa
21-xaa
22-fgp-xaa
26-lpptevgsnty-nh2,其中xaa1是k或γe;xaa3是e、n或g;xaa
10
是g或q;xaa
11
是orn或k;xaa
12
是l或αmel;xaa
15
是αmef或f;xaa
21
是n或h;xaa
22
是nmed、nmen或n;xaa
26
是i或k,或其可药用盐(seq id no:14)。任选地,包含seq id no:14的化合物进一步包含额外的元件以延长该化合物的时间作用特征。这些额外的元件包括,有或没有接头和在序列中任何适宜的位置处,免疫球蛋白的fc部分、免疫球蛋白fc部分的片段、人血清白蛋白(hsa)、vhh(重链抗体的可变结构域)的变体、纳米抗体、人血清白蛋白的片段、c
20
单酸、c
20
二酸和聚乙二醇(peg)部分或其他类型的高分子量聚合物。优选地,该额外的元件任选地用接头连接到该化合物上的赖氨酸。此外,在本文公开的任何实施方案中,除已经存在的附着到或连接到肽序列并延长时间作用特征或作为现有元件的替代的任何元件之外,该胰淀素激动剂肽和包含该胰淀素激动剂肽的化合物可以进一步包含这
类元件。
16.在包含seq id no:14的化合物的一些实施方案中,xaa
26
是赖氨酸。在包含seq id no:14的化合物的一些实施方案中,位置26处的赖氨酸(如果存在)以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸。在包含seq id no:14的化合物的一些实施方案中,位置26处的赖氨酸(如果存在)以式aeea
2-γe-co-(ch2)
18-co2h通过接头连接到脂肪酸。在包含seq id no:14的化合物的一些实施方案中,位置26处的赖氨酸(如果存在)以式γe-aeea
2-co-(ch2)
18-co2h通过接头连接到脂肪酸。在包含seq id no:14的化合物的一些实施方案中,位置26处的赖氨酸(如果存在)以式(γe)
2-aeea-co-(ch2)
18-co2h通过接头连接到脂肪酸。在包含seq id no:14的化合物的其他实施方案中,位置26处的赖氨酸(如果存在)通过本领域已知的另一种接头连接到脂肪酸。此外,在本文公开的任何实施方案中,该胰淀素激动剂肽和包含该胰淀素激动剂肽的化合物可以包含另一个接头来连接本文化学式的脂肪酸。
17.在包含seq id no:14的化合物的一些实施方案中,xaa1是赖氨酸。在包含seq id no:14的化合物的一些实施方案中,位置1处的赖氨酸(如果存在)以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸。在包含seq id no:14的化合物的其他实施方案中,位置1处的赖氨酸(如果存在)通过本领域已知的另一种接头连接到脂肪酸。
18.在包含seq id no:14的化合物的一些实施方案中,在位置2和7的半胱氨酸之间存在二硫键。在包含seq id no:14的化合物的优选实施方案中,在位置2和7的半胱氨酸之间存在硫缩醛桥。
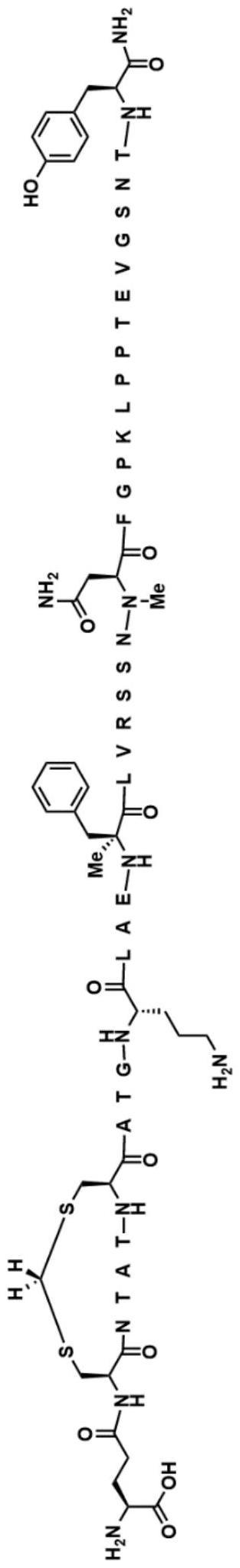
19.本文的实施方案之一包含以下序列:γe-cntatcatg-orn-lae-αmef-lvrssn-nmen-fgpklpptevgsnty-nh2(seq id no:1)。本文的一个备选实施方案由以下序列组成:γe-cntatcatg-orn-lae-αmef-lvrssn-nmen-fgpklpptevgsnty-nh2(seq id no:1)。以下是化合物i的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmen以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
fgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:2)。以下是化合物ii的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmen、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0025][0026]
化合物ii;seq id no:2
[0027]
备选地,该化合物可以与seq id no:2具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:2具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0028]
本文的实施方案之一包含以下序列:γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2(seq id no:3)。本文的备选实施方案由以下序列组成:γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2(seq id no:3)。以下是化合物iii的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用
其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0029][0030]
化合物iii;seq id no:3
[0031]
备选地,该化合物可以与seq id no:3具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:3具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0032]
在包含seq id no:3的化合物的一些实施方案中,位置26处的赖氨酸通过接头连接到脂肪酸。在包含seq id no:3的化合物的优选实施方案中,位置26处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分。
[0033]
本文的实施方案之一包含以下序列:γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:4)。本文的备选实施方案由以下序列组成:γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:4)。以下是化合
物iv的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0034][0035]
化合物iv;seq id no:4
[0036]
备选地,该化合物可以与seq id no:4具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:4具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0037]
本文的实施方案之一包含以下序列:kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2(seq id no:5)。本文的备选实施方案由以下序列组成:kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2(seq id no:5)。以下是化合物v的描述,使用标准单字母氨基酸代码,但除位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0038][0039]
化合物v;seq id no:5
[0040]
备选地,该化合物可以与seq id no:5具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:5具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0041]
在包含seq id no:5的化合物的一些实施方案中,位置1处的赖氨酸通过接头连接到脂肪酸。在包含seq id no:5的化合物的优选实施方案中,位置1处的赖氨酸以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸。
[0042]
本文的实施方案之一包含以下序列:kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置1处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:6)。本文的备选实施方案由以下序列组成:kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置1处的赖氨酸连接到式
orn-αmel-aeflvrsshnfgpilpptevgsnty-nh2(seq id no:7)。以下是化合物vii的描述,除位置2和7处的半胱氨酸、位置11处的orn、位置12处的αmel以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0047][0048]
化合物vii;seq id no:7
[0049]
备选地,该化合物可以与seq id no:7具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:7具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0050]
在包含seq id no:7的化合物的一些实施方案中,位置1处的赖氨酸连接到脂肪酸接头部分。在包含seq id no:7的化合物的优选实施方案中,位置1处的赖氨酸以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸。
[0051]
本文的实施方案之一包含以下序列:kcetatcatg-orn-αmel-aeflvrsshnfgpilpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其
中位置1处的赖氨酸以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:8)。本文的备选实施方案由以下序列组成:kcetatcatg-orn-αmel-aeflvrsshnfgpilpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置1处的赖氨酸以式(γe)
2-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:8)。以下是化合物viii的描述,使用标准单字母氨基酸代码,但除位置1处的赖氨酸、位置2和7处的半胱氨酸、位置11处的orn、位置12处的αmel以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0052][0053]
化合物viii;seq id no:8
[0054]
备选地,该化合物可以与seq id no:8具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:8具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0055]
本文的实施方案之一包含以下序列:γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式aeea
2-γe-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:9)。本文的备选实施方案由
以下序列组成:γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式aeea
2-γe-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:9)。以下是化合物ix的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0056]
[0057]
化合物ix;seq id no:9
[0058]
备选地,该化合物可以与seq id no:9具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:9具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0059]
本文的实施方案之一包含以下序列:γe-cntatcatgklaeflvrssnnfgpklpptevgs nty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式γe-aeea
2-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:10)。本文的备选实施方案由以下序列组成:γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式γe-aeea
2-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:10)。以下是化合物x的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0060]
[0061]
化合物x;seq id no:10
[0062]
备选地,该化合物可以与seq id no:10具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:10具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0063]
本文的实施方案之一包含以下序列:γe-cntatcatgklaeflvrssnn fgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式(γe)
2-aeea-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:11)。本文的备选实施方案由以下序列组成:γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式(γe)
2-aeea-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:11)。以下是化合物xi的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0064]
[0065]
化合物xi;seq id no:11
[0066]
备选地,该化合物可以与seq id no:11具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:11具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0067]
本文的实施方案之一包含以下序列:γe-cntatcatq-orn-laeflvrssnnfgpklppt evgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式aeea
2-γe-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:12)。本文的备选实施方案由以下序列组成:γe-cntatcatq-orn-laeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸以式aeea
2-γe-co-(ch2)
18-co2h通过接头连接到脂肪酸(seq id no:12)。以下是化合物xii的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的鸟氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0068]
[0069]
化合物12;seq id no:12
[0070]
备选地,该化合物可以与seq id no:12具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:12具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0071]
本文的实施方案之一包含以下序列:γe-cgtatcatg-orn-laeflvrss nnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式γe
2-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:13)。本文的备选实施方案由以下序列组成:γe-cgtatcatg-orn-laeflvrssnnfgpklpptevgsnty-nh2,其中在位置2和7的半胱氨酸之间存在硫缩醛桥,并且其中位置26处的赖氨酸连接到式γe
2-co-(ch2)
18-co2h的脂肪酸接头部分(seq id no:13)。以下是化合物xiii的描述,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的鸟氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0072]
[0073]
化合物13;seq id no:13
[0074]
备选地,该化合物可以与seq id no:13具有至少约90%至约99%序列相似性。备选地,该化合物可以与seq id no:13具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列相似性。
[0075]
本公开提供由seq id no:1组成的化合物、由seq id no:2组成的化合物、由seq id no:3组成的化合物、由seq id no:4组成的化合物、由seq id no:5组成的化合物、由seq id no:6组成的化合物、由seq id no:7组成的化合物、由seq id no:8组成的化合物、由seq id no:9组成的化合物、由seq id no:10组成的化合物、由seq id no:11组成的化合物、由seq id no:12组成的化合物和/或由seq id no:13组成的化合物,或其可药用盐。本公开还提供药物组合物,其包含含有seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,以及一种或多种可药用载体、稀释剂或赋形剂。本公开还提供药物组合物,其包含由seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14组成的化合物或其可药用盐,以及一种或多种可药用载体、稀释剂或赋形剂。
[0076]
本公开进一步提供包含seq id no:22、seq id no:23、seq id no:24、seq id no:25的化合物或其可药用盐。在另一个实施方案中,本公开提供由seq id no:22、seq id no:23、seq id no:24、seq id no:25组成的化合物或其可药用盐。优选地,seq id no:22、seq id no:23、seq id no:24、seq id no:25的化合物在位置2和7的半胱氨酸之间包含二硫键或硫缩醛桥。更优选地,包含seq id no:22、seq id no:23、seq id no:24、seq id no:25的化合物在位置2和7的半胱氨酸之间具有硫缩醛桥,并连接到脂肪酸接头部分。优选地,该脂肪酸部分连接到赖氨酸。
[0077]
本公开提供在患者中治疗糖尿病、肥胖症、血脂异常和/或nash的方法,其包括对有需要的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,或包含其的药物组合物。本公开还提供降低食物摄入、降低体重、降低血糖、降低hba1c和/或降低甘油三酯的方法,其包括对有需要的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,或包含其的药物组合物。优选地,本公开提供在患者中治疗糖尿病、肥胖症、血脂异常和/或nash的方法,其包括对有需要的患者施用有效量的包含seq id no:2的化合物或包含其的药物组合物。更优选地,本公开提供在患者中治疗糖尿病的方法,其包括对有需要的患者施用有效量的包含seq id no:2的化合物或包含其的药物组合物。备选地,本公开提供在患者中治疗肥胖症的方法,其包括对有需要的患者施用有效量的包含seq id no:2的化合物或包含其的药物组合物。
[0078]
本技术提供包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:
11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,或包含其的药物组合物,用于治疗。本技术还提供包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,或包含其的药物组合物,用于治疗糖尿病、肥胖症、血脂异常和/或nash。本技术还提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于治疗糖尿病、肥胖症、血脂异常和/或nash。更优选地,本技术提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于治疗糖尿病。备选地,本技术提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于治疗肥胖症。备选地,本技术提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于治疗血脂异常。备选地,本技术提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于治疗nash。
[0079]
本技术提供包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,或包含其的药物组合物,用于降低食物摄入、降低体重、降低血糖、降低hba1c和/或降低甘油三酯。更优选地,本技术提供包含seq id no:2的化合物或其可药用盐,或包含其的药物组合物,用于降低食物摄入、降低体重、降低血糖、降低hba1c和/或降低甘油三酯。
[0080]
本公开还提供包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐的用途,用于制备治疗糖尿病、肥胖症、血脂异常和/或nash的药物。优选地,本公开还提供包含seq id no:2的化合物的用途,用于制备治疗糖尿病、肥胖症、血脂异常和/或nash的药物。
[0081]
本公开还提供包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐的用途,用于制备降低食物摄入、降低体重、降低血糖、降低hba1c和/或降低甘油三酯的药物。优选地,本公开还提供包含seq id no:2的化合物或其可药用盐的用途,用于制备降低食物摄入、降低体重、降低血糖、降低hba1c和/或降低甘油三酯的药物。
[0082]
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的技术人员通常理解的含义相同的含义。尽管类似于或等同于本文所述的方法和材料的任何方法和材料都可用于实施或测试该胰淀素激动剂肽、药物组合物和方法,但本文描述了优选的方法和材料。
[0083]
此外,不定冠词“一”或“一个”提及一个元件并不排除存在一个以上元件的可能性,除非上下文明确要求存在一个且只有一个元件。因此,不定冠词“一”或“一个”通常意指“至少一个”。
[0084]
本文所用的“约”是指在一个或多个值的统计上有意义的范围内,例如,所描述的浓度、长度、分子量、ph、序列相似性、时间范围、温度、体积等。这种值或范围可以在给定值或范围的一个数量级内,通常在20%以内,更通常在10%以内,甚至更通常在5%以内。“约”所涵盖的可允许的变化将取决于所研究的具体系统,并且本领域技术人员可以容易地理
解。
[0085]
如本文所用,并参考一种或多种受体,“活性”、“激活”、“活化”等是指化合物(如本文中的肽)结合受体并在受体处诱导反应的能力,如使用本领域已知的测定法(如下文所述的体外测定法)所测量。
[0086]
本文所用的术语“氨基酸”是指天然存在的氨基酸和非编码氨基酸。如本领域已知,氨基酸是这样的分子,从化学角度来看,其特征在于存在一个或多个胺基和一个或更多个羧酸基团,并且可以包含其他官能团。此外,氨基酸通常使用标准单字母代码(例如l=亮氨酸)以及天然氨基酸的α-甲基取代的残基(例如,α-甲基亮氨酸或αmel和α-甲基苯丙氨酸或αmef)和某些其他非编码氨基酸如“γe”、“nmen”、“nmed”和“orn”等来描述。本公开的非编码氨基酸的结构如下所示:
[0087][0088]
本文所用的“γe”是指γ-谷氨酸(其中肽键使用γ位置而不是典型的α位置的侧链羧酸基团形成)。本文所用的“orn”是指l-鸟氨酸。本文所用的“αmel”是指α-甲基-l-亮氨酸。本文所用的“αmef”是指α-甲基-l-苯丙氨酸。本文所用的“nmen”指n-甲基-天冬酰胺,“nmed”指n-甲基-天冬氨酸。
[0089]
本文所用的“aeea”是指2-[2-(2-氨基-乙氧基)-乙氧基]乙酸。结构如下所示:
[0090][0091]
本文所用的“胰淀素激动剂肽”是指激活靶受体并引发该受体的天然激动剂所引发的至少一种体内或体外效应的化合物,如合成肽或多肽。
[0092]
本文所用的“长期体重管理”是指这样的方法,通过这种方法,人们可以保持体重减轻,作为目前或以前定性为患有肥胖症的人减少热量饮食和增加体育活动的辅助手段。
[0093]
术语“糖尿病”是指身体产生或响应胰岛素的能力受损,导致糖类代谢异常,血液和尿液中葡萄糖水平升高的疾病。本文所用的术语糖尿病可以指影响身体处理血糖或葡萄糖的方式的慢性疾病,例如2型糖尿病(t2dm);胰腺产生很少或不产生胰岛素的慢性疾病,例如1型糖尿病(t1dm);血糖高但不足以成为2型糖尿病的疾病,例如糖尿病前期(pre-diabetes);影响孕妇的一种高血糖形式,如妊娠糖尿病。
[0094]
术语“血脂异常”是指脂蛋白代谢的障碍,包括脂蛋白过量产生或缺乏。血脂异常可表现为血液中总胆固醇、低密度脂蛋白(ldl)胆固醇和甘油三酯浓度升高和/或高密度脂蛋白(hdl)浓度降低。血脂异常可以与糖尿病有关,也可以与糖尿病无关。
[0095]
本文所用的“脂肪酸”由偶数个碳原子的直链组成,氢原子沿着链的长度,在链的一端(单酸)或两端(二酸)有羧基(-cooh)。在一个优选实施方案中,该“脂肪酸”部分是c
20
二酸。
[0096][0097]
本文所用的“硫缩醛桥”是指硫缩醛基团的有机合成,以在肽结构内功能性地重新桥接二硫键。硫缩醛桥(-s-ch
2-s-)如下所示,亚甲基插入两个硫原子之间。
[0098][0099]
本文所用的术语“治疗”是指对患有某种病症的患者的管理和护理,为了对抗或减轻该病症的症状和并发症,需要施用胰淀素受体肽激动剂。治疗包括对有需要的患者施用本公开的化合物或含有本公开的化合物的药物组合物,以防止症状或并发症的发作,减轻症状或并发症,或消除疾病、病症或障碍。优选地,治疗包括对有需要的患者施用本公开的化合物或含有本公开的化合物的药物组合物,以导致体重的净减轻、食物摄入的减少、血糖水平的降低、hba1c的降低和/或甘油三酯水平的降低。待治疗的患者是哺乳动物,并且优选是人类。
[0100]
本文所用的术语“有效量”是指对有需要的个体单个剂量或多个剂量施用时本文的一种或多种化合物的量或剂量,其在这种正在诊断或治疗的个体中提供所希望的效果(即可以在个体的病症中产生临床上可测量的差异,例如体重的净减轻、食物摄入的减少、血糖水平的降低、hba1c的降低和/或甘油三酯水平的降低)。本领域技术人员可以通过使用已知的技术和通过观察在类似情况下获得的结果来容易地证明有效量。在确定个体的有效量时,考虑了许多因素,包括但不限于哺乳动物的种类、其体型大小、年龄和一般健康状况、所涉及的具体疾病或病症、疾病或病症的涉及程度或严重程度、个体的反应、所施用的具体化合物、施用方式、所施用制剂的生物利用度特征、所选择的剂量方案、联合用药的使用以及其他相关情况。优选地,对有需要的患者施用有效量的本公开的化合物或含有本公开的化合物的药物组合物将导致体重的净减轻、食物摄入的减少、血糖水平的降低、hba1c的降低和/或甘油三酯水平的降低。剂量可以包括较高的初始负荷剂量,随后是较低的剂量。本文提供的化合物的有效剂量可以在0.05μg/kg至5000μg/kg或0.01nmol/kg至1000nmol/kg之间。
[0101]
本文所用的“半寿期”或“t
1/2”是指通过生物过程从流体或其他生理空间(如个体的血清或血浆)中去除一半量的化合物(如本文的肽)所需的时间。备选地,t
1/2
也可以指一定量的这种肽失去一半的药理学、生理学或放射学活性所需的时间。
[0102]
本文所用的“半数最大有效浓度”或“ec50”是指导致测定终点(如剂量-反应曲线)50%激活/刺激的化合物浓度。
[0103]
本文所用的“长效”是指本文的组合物的结合亲和力和活性持续比天然肽或蛋白质长的一段时间,允许至少不频繁地给药,如每天一次或甚至每周三次、每周两次、每周一次或每月一次。本文的化合物的时间作用特征可以使用已知的药代动力学测试方法来测量,如下文实施例中描述的那些方法。
[0104]
术语“nash”是指非酒精性脂肪性肝炎,又称脂肪肝病。“nash”也指由肝脏中脂肪堆积引起的肝脏炎症和损伤。“nash”也指非酒精性脂肪肝病(“nafld”)的一种亚型。在一些实施方案中,“nash”可以与“nafld”同义。
[0105]
本文所用的术语“肥胖症”是指一种涉及过量体脂的疾病,它会增加健康问题的风险。术语“肥胖症”也指在给定身高下高于健康体重的体重。术语“肥胖症”还指bmi大于30.0或bmi为27.0或更大(超重),并伴有至少一种与体重相关的合并症(例如高血压、2型糖尿病或血脂异常)。
[0106]
本文所用的体重指数(body mass index,bmi)是指一个人的体重(以千克为单位)除以身高(以米为单位)的平方。
[0107]
本文所用的“患者”和“个体”可互换使用,意指哺乳动物,优选人类。在某些实施方案中,该患者,优选是人,进一步表征为将受益于施用激动胰淀素受体和降钙素受体这两者的化合物的疾病、病症或病状。
[0108]
在一些实施方案中,包含本公开的化合物的药物组合物可以口服对需要这种治疗的患者施用。包含本公开的化合物的药物组合物可以肠胃外对需要这种治疗的患者施用。肠胃外施用可以借助注射器、任选的笔状注射器或机械驱动注射器通过皮下、肌内或静脉注射进行。备选地,肠胃外施用可以借助输注泵进行。本公开的化合物的实施方案提供了适合用于对患者施用的药物组合物,包括对有需要的患者施用治疗有效量的本公开的化合物和一种或多种可药用赋形剂。这种药物组合物可以使用本领域众所周知的用于药物产品的常规赋形剂,通过多种技术中的任何一种来制备(remington’s pharmaceutical sciences,第21版,university of the sciences in philadelphia,philadelphia,pa,usa(2006))。
[0109]
本文所用的“序列相似性”是指生物化合物的两个或多个核酸序列或氨基酸序列的定量性质,例如,在两个或多个序列的整个长度或比较窗上的对应性。序列相似性可以通过(1)同一性百分数或(2)相似性百分数来测量。同一性百分数测量两种生物化合物之间相同残基除以最短序列的长度的百分比,而相似性百分数测量同一性并且此外还包括评估中的序列缺口和残基相似性。用于确定序列相似性的方法和算法在本领域中众所周知,因此不需要在此详尽描述。相同核苷酸或氨基酸位置的指定百分比为至少约75%、80%、85%、86%、76%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高。
[0110]
本公开的化合物可以与一种或多种额外的治疗剂同时、分开或顺次组合使用,该额外的治疗剂用于诱导体重减轻、治疗糖尿病、与糖尿病相关的病症、肥胖症和/或长期体重管理、血脂异常和/或nash。可以与所要求保护的化合物组合的额外的治疗剂的非限制性实例包括:胰岛素或胰岛素类似物;双胍类;磺酰脲类;噻唑烷二酮;二肽基肽酶-4(“dpp-4”)抑制剂;钠依赖性葡萄糖转运蛋白(sglt2)抑制剂;肠促胰岛素化合物,如胰高血糖素样肽-1(glp-1)或glp-1类似物、胃抑制多肽(gip)或gip类似物、泌酸调节肽或泌酸调节肽类似物;生长分化因子-15(gdf15)激动剂化合物;肽yy(pyy)类似物;双重gip/glp-1激动剂;gcg/gip/glp-1三重激动剂(胰高血糖素、gip和glp-1的三重激动剂);或任何前述活性剂的组合。所要求保护的化合物和额外的治疗剂可以通过相同的递送途径和装置共同给药,如单个药丸、胶囊、片剂或注射制剂;或者以分开的递送装置或途径同时分开施用;或顺次施用。
[0111]
本公开的另一个实施方案是在有需要的患者中治疗选自糖尿病、肥胖症、nash和/或血脂异常的疾病的方法,该方法包括对该患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、
seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与有效量的肠促胰岛素或肠促胰岛素类似物组合。优选地,本公开的一个实施方案是在有需要的患者中治疗选自糖尿病、肥胖症、nash和/或血脂异常的病症的方法,该方法包括对该患者施用有效量的包含seq id no:2的化合物或其可药用盐,与有效量的肠促胰岛素或肠促胰岛素类似物组合。
[0112]
本公开的一个具体实施方案是在有需要的患者中治疗选自糖尿病、肥胖症、nash和/或血脂异常的病症的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与glp-1激动剂组合。本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1的化合物或其可药用盐,与包含化合物xvii(seq id no:18)的glp-1激动剂组合。本公开的另一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:2的化合物或其可药用盐,与包含化合物xvii(seq id no:18)的glp-1激动剂组合。
[0113]
本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与泌酸调节肽(oxyntomodulin)类似物组合。本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与包含化合物xviii(seq id no:19)的泌酸调节肽类似物组合。本公开的另一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:2的化合物或其可药用盐,与包含化合物xviii(seq id no:19)的泌酸调节肽类似物组合。
[0114]
本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与胰高血糖素、gip和glp-1的三重激动剂组合。本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与包含化合物xix(seq id no:20)的胰高血糖素、gip和glp-1的三重激动剂组合。本公开的另一个具
体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:2的化合物或其可药用盐,与包含化合物xix(seq id no:20)的胰高血糖素、gip和glp-1的三重激动剂组合。
[0115]
本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与双重gip/glp-1激动剂组合。本公开的一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与包含seq id no:21的双重gip/glp-1激动剂组合。本公开的另一个具体实施方案是治疗患有糖尿病、肥胖症、nash和/或血脂异常的患者的方法,该方法包括对需要这种治疗的患者施用有效量的包含seq id no:2的化合物或其可药用盐,与包含seq id no:21的双重gip/glp-1激动剂组合。
[0116]
本公开的另一个实施方案是包含seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13或seq id no:14的化合物或其可药用盐,与肠促胰岛素或肠促胰岛素类似物分开、同时或顺次组合用于治疗糖尿病、肥胖症、nash和/或血脂异常。优选地,本公开的一个实施方案是包含seq id no:2的化合物或其可药用盐,与肠促胰岛素或肠促胰岛素类似物分开、同时或顺次组合用于治疗糖尿病、肥胖症、nash和/或血脂异常。更优选地,该肠促胰岛素或肠促胰岛素类似物是包含seq id no:21的双重gip/glp-1激动剂。
[0117]
本文中所用的某些缩写定义如下:“acn”指乙腈;“amy1r”指胰淀素受体1;“camp”指环腺苷酸;“ct”指降钙素;“dcm”指二氯甲烷;“diea”指二异丙基乙胺;“dmf”指n,n-二甲基甲酰胺;“dmso”指二甲基亚砜;“dodt”指2,2'-(亚乙基二氧基)二乙硫醇;“fbs”指胎牛血清;“fmoc”指芴甲氧羰基;“gdf15”指生长分化因子15;“gpcr”指g蛋白偶联受体;“hepes”是指4-(2-羟乙基)-1-哌嗪乙磺酸;“htrf”是指均相时间分辨荧光;“ibmx”指1-甲基-3-异丁基黄嘌呤;“mem”指极限必需培养基;“mtt”指4-甲基三苯甲基;“nash”指非酒精性脂肪肝病;“neaa”指非必需氨基酸;“pyaop”指(7-氮杂苯并三唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐;“rp-hplc”指反相高压液相色谱法;“tcep”指三(2-羧乙基)膦盐酸盐;“tfa”指三氟乙酸;“tris”指三(羟甲基)氨基甲烷。
[0118]
实施例1:化合物i和ii的制备和纯化
[0119]
按照以下步骤制备化合物i和化合物ii。首先,使用芴甲氧羰基(fmoc)/叔丁基(t-bu)化学在symphony 12通道多重肽合成仪(protein technologies,inc.tucson,az)上合成化合物i(seq id no:1)。
[0120]
用聚苯乙烯rink amide mbha树脂ll树脂(novabiochem,sub:0.35meq/g,100-200目,目录号855045)进行0.13mmol规模合成。使用标准侧链保护基团。boc-glu-otbu用于位置1。fmoc-lys(mtt)-oh用于位置26处的赖氨酸。在每个偶联步骤(2x7分钟)之前使用dmf中
的20%哌啶去除fmoc基团。所有氨基酸偶联都按相对理论肽负荷7.7倍摩尔过量使用等摩尔比的fmoc氨基酸(0.3m)、二异丙基碳二亚胺(0.9m)和oxyma(0.9m)在60℃下进行30分钟。在位置15处的αmef和位置22处的nmen之后的氨基酸偶联分别在60℃下进行3h和6h。对于化合物i(seq id no:1),此时用切割混合物处理树脂(在添加脂肪酸接头部分以产生化合物ii的程序之后所述的条件)。以下是化合物i(seq id no:1)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmen以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0121]
[0122]
化合物i;seq id no:1
[0123]
然后,用dcm将树脂彻底洗涤6次以去除残留的dmf。使用dcm中的30%六氟异丙醇(oakwood chemical)的两次处理从肽树脂选择性去除位置26处的赖氨酸上的mtt保护基团(2x40分钟处理)。随后通过偶联fmoc-谷氨酸α-叔丁基酯(fmoc-glu-otbu,ark pharm,inc.)、单-otbu-二十烷酸(wuxi apptec,shanghai,china)来达到脂肪酸接头部分的连接。每1小时长的偶联使用3倍过量的试剂(aa:pyaop:diea=1:1:1)。
[0124]
合成完成后,用dcm洗涤肽树脂,然后彻底风干。在室温下用10ml切割混合物(tfa:dodt:tis:h2o=89:3:3:5v/v)处理干燥的树脂2小时。滤弃树脂,每次用2ml纯tfa洗涤两次,合并的滤液用4倍冷乙醚(-20℃)处理以沉淀粗肽。然后将肽/醚悬液以3500rpm离心2分钟,以形成固体沉淀,倒出上清液,并用醚将固体沉淀再研磨两次。为了制备硫缩醛桥,将空气干燥后的沉淀溶解在5ml 20mm磷酸钾缓冲液和3ml acn中。一旦完全溶解,在充分搅拌下,加入h2o中的tcep(30μm,5eq)、二碘甲烷(8eq)和三乙胺(10eq),并搅拌5-30分钟。用lcms监测反应,反应通常在5分钟内完成。反应完成后,向混合物中加入1ml h2o w/0.1%tfa以及6ml乙酸。如果溶液浑浊,则根据需要加入更多的acn。
[0125]
在phenylhexyl柱(5μm,100a,250x21.2mm,部件号:00g-4257-p0-ax)上,以使用100%乙腈和0.1%tfa/水缓冲体系的线性梯度,通过rp-hplc纯化粗肽。使用waters symmetryshield rp18柱(3.5um,6x100mm,part 186000179),使用分析型rp-hplc评估肽的纯度,合并标准为》95%。发现化合物ii(seq id no:2)的主合并池纯度》98.4%。随后对最终主产物池进行冷冻干燥,得到冻干的肽tfa盐。通过lc/ms测定化合物i(seq id no:1)的分子量(发现:[m+3h]
3+
=1315.2;计算[m+3h]
3+
=1315.5;发现mw(平均值)=3942.6;计算mw(平均值)=3943.4)。通过lc/ms测定化合物ii(seq id no:2)的分子量(发现:[m+3h]
3+
=1509.5;计算[m+3h]
3+
=1509.7;发现mw(平均值)=4525.5;计算mw(平均值)=4526.1)。以下是化合物ii(seq id no:2)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmen、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0126][0127]
化合物ii;seq id no:2
[0128]
可以用与上述和本领域技术人员已知的方法类似的方法来合成肽骨架,缀合脂肪酸接头部分,检查纯度,并确认本文所述的本发明化合物的分子量。
[0129]
实施例2:化合物iii和iv的制备和纯化
[0130]
按照实施例1中概述的方法制备化合物iii和iv。
[0131]
以下是化合物iii(seq id no:3)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0132][0133]
化合物iii;seq id no:3
[0134]
通过lc/ms测定化合物iii(seq id no:3)的分子量(发现:[m+3h]
3+
=1314.9;计算[m+3h]
3+
=1315.8;发现mw(平均值)=3941.7;计算mw(平均值)=3944.4)。
[0135]
以下是化合物iv(seq id no:4)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0136][0137]
化合物iv;seq id no:4
[0138]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1509.7;计算[m+3h]
3+
=1510.0;发现mw(平均值)=4526.1;计算mw(平均值)=4527.1)。
[0139]
实施例3:化合物v和vi的制备和纯化
[0140]
按照实施例1中概述的方法制备化合物v和vi。
[0141]
以下是化合物v(seq id no:5)的示意图,使用标准单字母氨基酸代码,但除位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0142][0143]
化合物v;seq id no:5
[0144]
通过lc/ms测定化合物v(seq id no:5)的分子量(发现:[m+3h]
3+
=1314.9;计算[m+3h]
3+
=1315.5;发现mw(平均值)=3941.7;计算mw(平均值)=3943.4)。
[0145]
以下是化合物vi(seq id no:6)的示意图,使用标准单字母氨基酸代码,但除位置1处的赖氨酸、位置2和7处的半胱氨酸、位置11处的orn、位置15处的αmef、位置22处的nmed以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0146][0147]
化合物vi;seq id no:6
[0148]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1509.4;计算[m+3h]
3+
=1509.7;发现mw(平均值)=4525.2;计算mw(平均值)=4526.1)。
[0149]
实施例4:化合物vii和viii的制备和纯化
[0150]
按照实施例1中概述的方法制备化合物vii和viii。
[0151]
以下是化合物vii(seq id no:7)的示意图,使用标准单字母氨基酸代码,但除位置2和7处的半胱氨酸、位置11处的orn、位置12处的αmel以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0152][0153]
化合物vii;seq id no:7
[0154]
通过lc/ms测定化合物vii(seq id no:7)的分子量(发现:[m+3h]
3+
=1317.9;计算[m+3h]
3+
=1318.1;发现mw(平均值)=3950.7;计算mw(平均值)=3951.4)。
[0155]
以下是化合物viii(seq id no:8)的示意图,使用标准单字母氨基酸代码,但除位置1处的赖氨酸、位置2和7处的半胱氨酸、位置11处的orn、位置12处的αmel以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0156][0157]
化合物viii;seq id no:8
[0158]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1512.2;计算[m+3h]
3+
=1512.4;发现mw(平均值)=4533.6;计算mw(平均值)=4534.2)。
[0159]
实施例5:化合物ix的制备和纯化
[0160]
按照实施例1中概述的方法制备化合物ix。
[0161]
以下是化合物ix(seq id no:9)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0162][0163]
化合物ix;seq id no:9
[0164]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1558.3;计算[m+3h]
3+
=1558.8;发现mw(平均值)=4671.9;计算mw(平均值)=4673.3)。
[0165]
实施例6:化合物x的制备和纯化
[0166]
按照实施例1中概述的方法制备化合物x。
[0167]
以下是化合物x(seq id no:10)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0168][0169]
化合物x;seq id no:10
[0170]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1558.5;计算[m+3h]
3+
=1558.8;发现mw(平均值)=4672.5;计算mw(平均值)=4673.3)。
[0171]
实施例7:化合物xi的制备和纯化
[0172]
按照实施例1中概述的方法制备化合物xi。
[0173]
以下是化合物xi(seq id no:11)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0174][0175]
化合物xi;seq id no:11
[0176]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1553.2;计算[m+3h]
3+
=1553.4;发现mw(平均值)=4656.6;计算mw(平均值)=4657.2)。
[0177]
实施例8:化合物xii的制备和纯化
[0178]
按照实施例1中概述的方法制备化合物xii。
[0179]
以下是化合物xii(seq id no:12)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0180][0181]
化合物xii;seq id no:12
[0182]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1577.4;计算[m+3h]
3+
=1577.8;发现mw(平均值)=4729.2;计算mw(平均值)=4730.3)。
[0183]
实施例9:化合物xiii的制备和纯化
[0184]
按照实施例1中概述的方法制备化合物xiii。
[0185]
以下是化合物xiii(seq id no:13)的示意图,使用标准单字母氨基酸代码,但除位置1处的谷氨酸(γe)(其中肽键使用其在γ位置而不是典型的α位置处的侧链羧酸基团形成)、位置2和7处的半胱氨酸、位置11处的orn、位置26处的赖氨酸以及位置37处的酪氨酸之外,其中对这些氨基酸残基的结构进行了扩展:
[0186][0187]
化合物xiii;seq id no:13
[0188]
通过lc/ms测定分子量(发现:[m+3h]
3+
=1481.2;计算[m+3h]
3+
=1481.3;发现mw(平均值)=1440.6;计算mw(平均值)=4441.0)。
[0189]
二硫键桥制备
[0190]
为了形成二硫键,通过向烧瓶中40ml的20%mecn/20%acoh/60%水中加入10滴碘溶液(2%碘于acoh中)来制备氧化溶液。另外,通过将空气干燥后的肽沉淀溶解在5ml acoh中来制备肽溶液。在搅拌下,将肽溶液逐滴加入到氧化溶液中。根据需要加入额外的碘溶液(2%碘于acoh中)以保持烧瓶中的浅黄色溶液。在加入所有肽溶液后,使浅棕色/黄色保持5分钟。通过向氧化溶液中加入一滴饱和抗坏血酸来中和多余的碘。溶液用0.45μm过滤器过滤,肽即可纯化。
[0191]
实施例10:胰淀素激动剂肽的体外功能活性
[0192]
amy1受体和ct受体是在功能上与gαs蛋白偶联的gpcr。刺激这些受体会导致细胞内camp的产生增加,这可以使用标准的体外技术进行检测。通过在人amy1r和ctr过量表达
的细胞中形成的camp的量来测量肽的体外活性。
[0193]
人ct受体在pcdna表达载体的控制下在人膀胱细胞(um-uc-3或umuc3)中稳定表达。umuc3细胞系在补充有10% fbs、1%抗生素/抗真菌溶液、1mm丙酮酸钠、1x mem neaa、1x glutamax-i的mem 1x(meditech inc.,17-305-cv)中培养。使用lipofectamine 2000转染试剂(invitrogen,11668-019)将人cta-pcdna3.1hygro(+)(t2616)dna的质粒转染到umuc3细胞中。在选择20天后,测量来自不同克隆的mrna水平以确认hctr的表达。为了确定过量表达的hctr细胞的功能,测量响应鲑鱼降钙素的胞内camp水平,并将其与每个克隆中hctr mrna的表达进行比较。
[0194]
通过将人ramp1-pcmvpuropb(t14213)进一步转染到umuc3 hctr克隆细胞中来产生人amy1r稳定细胞系。选择后,测量来自不同克隆的人ramp1的mrna水平,以确认人amy1r的表达。
[0195]
hamy1r细胞在补充有10% fbs、1%抗生素/抗真菌溶液、1mm丙酮酸钠、1x mem neaa、1x glutamax-i、200μg/ml潮霉素b和0.4μg/ml嘌呤霉素的mem 1x(corning)中培养。hctr细胞在缺乏嘌呤霉素的相同培养基中培养。培养的细胞生长至70%汇合,然后用新鲜培养基孵育过夜。
[0196]
测定当天,将10μl测定缓冲液(不含酚红的mem(corning,cat#17-305-cv)、0.1%酪蛋白、0.5mm ibmx、5mm hepes、ph 7.4)分配到白色聚-d-赖氨酸包被的384孔板(corning cat#354661)的每个孔中。使用echo声学液体处理机(beckman)加入以1:3稀释系列在dmso中稀释的肽(200nl/孔)。培养的细胞用tryple express(gibco)脱附,重悬在测定缓冲液中,将10μl含有1200个细胞/孔(hctr)或1500个细胞/孔(hamy1r)分配到每个孔中。将平板在室温下孵育1小时。
[0197]
按照供应商的说明使用htrf技术(均相时间分辨荧光;cisbio)定量胞内camp的量。简言之,将裂解缓冲液中的10μl camp-d2缀合物和10μl抗camp-穴状化合物缀合物与处理过的细胞在室温下孵育60分钟。使用envision读板仪(perkin-elmer)立即检测htrf信号,以计算665nm与620nm的荧光比率。使用为每个实验产生的camp标准曲线将原始数据转换为camp量(pmol/孔)。从使用1nm鲑鱼ct(bachem)作为最大值和缓冲液单独作为最小值,使用四参数逻辑曲线拟合程序(genedatav12.0.4)定义的浓度响应曲线的上下范围计算相对ec
50
值。本技术的化合物显示相对于降钙素受体的对胰淀素受体的选择性活性,如表1中所示。
[0198]
表1.对胰淀素受体和降钙素受体的功能活性数据的比较
[0199][0200][0201]
实施例11:胰淀素激动剂肽与hamy1受体和hct受体的体外结合亲和力
[0202]
通过标准方法分离来自人amy1r和ctr过量表达细胞(如实施例10中所述)的膜并用于结合测定。使用如下所述用于化合物测试的相同试剂和缓冲液,从饱和结合分析确定了多种受体/放射性配体相互作用的平衡解离常数(kd)。本研究中使用的针对受体制剂测定的kd值如下:hamy1r,0.067nm;人降钙素受体(hctr),0.046nm。
[0203]
hamy1r结合流程
[0204]
从竞争性放射性配体结合过滤测定法测定ramy、hct和hamy激动剂肽的受体结合亲和力(ki)。测定缓冲液由(以mm计)50hepes、ph 7.1、5mgcl2、5kcl、0.2%(w/v)杆菌肽、0.003%(w/w)皂苷组成,并用于稀释放射性配体和膜制备物。结合反应在总反应体积为0.1ml的聚苯乙烯96深孔测定板中进行。碘化大鼠胰淀素(vitrax定制合成;2200ci/mmol;125i-ramy)最初在测定缓冲液中稀释至约50pm。将测试化合物和非特异性结合(nsb-定义为300nm ramy)加入放射性缓冲液的等分试样中。简言之,将测试化合物稀释至200nm初始浓度,在125i-ramy中以4倍步骤系列稀释,然后将0.05ml稀释的测试化合物、nsb或总结合
物(定义为纯125i-ramy)转移到96孔聚苯乙烯测定板中。通过向放射性物质中加入0.05ml在测定缓冲液中稀释的200μg/ml hamy1r来起始结合反应。轻轻涡旋测定板,用石蜡膜密封,并在rt孵育约20小时。在孵育完成前30分钟,将过滤垫(perkin-elmer印刷过滤垫cat#1450-421)浸泡在由不含皂苷但补充有0.1%(w/v)不含脂肪酸的牛血清白蛋白(faf-bsa)和0.5%(v/v)聚乙烯亚胺(pei)的测定缓冲液组成的溶液中。在孵育结束时,通过加入由100mm nacl、50mm tris-hcl ph 7.1组成的冰冷的淬灭缓冲液将结合配体与游离配体分离,并使用以下过滤流程(干燥时间7;循环3个重复,0;洗涤时间,1;浸泡时间,1;第一次抽吸时间,4;洗涤/抽吸时间,7;第二次抽吸,4;气压2psi),通过tomtec 96孔过滤收集器的真空过滤立即收集在滤垫上。在响应曲线中测试的肽的最终测定浓度范围为100nm-0.00038nm。
[0205]
hctr结合流程
[0206]
通过竞争性放射性配体结合过滤测定法测定ramy、hct和hamy激动剂肽在hctr膜上的受体结合亲和力(ki)。测定程序类似于hamy1r结合测定,不同之处在于使用125i-hct(vitrax定制合成;2200ci/mmol)作为热配体。结合反应在0.2ml总反应体积中用14pm125i-hct和20μg/ml hctr膜进行,并孵育20小时。在响应曲线中测试的肽的最终测定浓度范围为2500nm-0.00128nm。本技术的化合物显示相对于降钙素受体而言对胰淀素受体的选择性活性,如表2中所示。
[0207]
表2.对人胰淀素受体和降钙素受体的体外结合(ki)
[0208][0209]
实施例12:在正常大鼠中对食物摄入和体重的体内影响
[0210]
来自envigo rms(indianapolis,in)的雄性sprague dawley大鼠维持进食饮食(2014;teklad global,envigo rms,indianapolis,in),并单独饲养在具有反向12:12小时光周期(上午10点关闭)的控温设施(72.0℉;22.2℃)中,并可自由获取食物和水。在10周龄时,记录非禁食体重和初始食物重量,并对动物单次皮下注射(sc)溶媒或酰化肽(1ml/kg),然后在给药后4天每天测量体重和食物摄入。计算相对于溶媒而言的体重和食物摄入曲线下面积分析(auc)。
[0211]
表3:sprague dawley大鼠单个剂量的长效胰淀素激动剂肽后4天的体重和食物摄入变化
[0212]
[0213]
[0214][0215]
*与首次用于实验的动物的初始体重相比给药后96小时的平均体重变化。
[0216]
**肽处理的动物在给药后96小时的累积食物摄入对比溶媒处理的动物在给溶媒后96小时的累积食物摄入。
[0217]
实施例13:在饮食诱导的肥胖症大鼠中对食物摄入和体重的体内影响
[0218]
来自envigo rms(indianapolis,in)的14周龄雄性long evan大鼠接受高脂肪饮食(40%的kcal来自脂肪,td.95217;envigo rms,indianapolis,in),直到35-45周龄。动物单独饲养在具有反向12小时光照/黑暗周期(上午10点关闭)的控温设施(75.0℉;23.9℃)中,并可自由获取食物和水。记录体重,并使用定量核磁共振分析(echo mri,3-1组成分析仪;echo medical systems,houston,tx)确定身体组成(脂肪质量),然后随机分入实验组(n=5)。每三天(第1、4、7、10和13天)对大鼠皮下注射溶媒或肽(1ml/kg)。记录每日体重,并将处理结束时(第14天)的变化计算为相对处理前体重(第1天)的百分比。在第14天测定身体组成,脂肪质量和无脂肪质量(体重-脂肪质量)的变化计算为自处理前的值变化的克数。
[0219]
表4:用胰淀素激动剂肽对饮食诱导的肥胖症大鼠进行的为期2周的研究中体重的变化
[0220]
[0221][0222]
*与首次用于实验的动物的初始体重相比2周时平均体重或脂肪质量或无脂肪质量的变化。
[0223]
实施例14:在雄性sprague dawley大鼠中的药代动力学
[0224]
对雄性sprague dawley大鼠单次皮下施用30nmol/kg后,评价化合物ii(seq id no:2)、化合物iv(seq id no:4)、化合物vi(seq id no:6)和化合物viii(seq id n0:8)的药代动力学。在sc给药后1、3、6、12、24、48、72、96小时采集血样。所得到的个体血浆浓度用于计算药代动力学参数。使用测量肽完整质量的合格lc/ms方法测定肽血浆(k3edta)浓度。从血浆提取每种肽和类似物作为内标。用高分辨率thermo q-exactive进行lc/ms检测。平均药代动力学参数如表5中所示。
[0225]
表5.对雄性sprague dawley大鼠单次皮下施用30nmol/kg后肽的平均药代动力学参数。
[0226][0227]
缩写:t
1/2
=半寿期,t
max
=达到最大浓度的时间,c
max
/d=最大血浆浓度除以剂量,aucinf/d=aucinf除以剂量,cl/f=清除率/生物利用度。注:数据为平均值,其中n=3个/组。
[0228]
实施例15:在雄性食蟹猴中的药代动力学
[0229]
评价化合物ii(seq id no:2)、化合物iv(seq id no:4)、化合物vi(seq id no:6)和化合物viii(seq id n0:8)对雄性食蟹猴单次皮下施用20nmol/kg后的药代动力学。在sc给药后1、3、6、12、24、48、72、120、168、240、336、408、504小时采集血样。所得到的个体血浆浓度用于计算药代动力学参数。使用测量肽完整质量的合格lc/ms方法测定肽血浆(k3edta)浓度。从血浆提取每种肽和类似物作为内标。用高分辨率thermo q-exactive进行lc/ms检测。平均药代动力学参数如表6中所示。
[0230]
表6.对食蟹猴单次皮下施用20nmol/kg后肽的平均药代动力学参数。
[0231][0232]
缩写:t
1/2
=半寿期,t
max
=达到最大浓度的时间,c
max
/d=最大血浆浓度除以剂量,aucinf/d=aucinf除以剂量,cl/f=清除率/生物利用度。注:数据为平均值,其中n=3个/组。
[0233]
实施例16:免疫原性风险评估
[0234]
树突状细胞(dc)内化测定法
[0235]
该测定法评估人dc内化测试抗体的能力。培养cd14+细胞,并用il-4和gm-csf分化为未成熟dc。将所测试的抗体、同种型对照或阳性对照与检测试剂(fab-qsy7-tamra)以1:1的比例预孵育以形成复合物,然后添加到培养物中。将细胞孵育一天。在内化和切割后,通过流式细胞术检测阳性tamra信号,并使用igg1-en同种型对照和抗cxcr抗体计算归一化的内化指数。
[0236]
mapps测定法(mhc相关肽蛋白质组学)
[0237]
mapps表征用测试分子处理的人树突状细胞上mhc-ii呈递的肽。培养从正常人供体的pbmc分离的cd14+细胞,并通过用il-4和gm-csf孵育分化为未成熟dc。在第4天,用含有测试分子的新鲜培养基替换培养基。在第5天,加入lps以使细胞转化为成熟dc。在第6天,用蛋白酶抑制剂在ripa缓冲液中裂解细胞。使用与链亲和素珠偶联的生物素化抗mhc-ii抗体进行mhc-ii复合物的免疫沉淀。将结合的复合物洗脱并过滤。通过质谱仪分析所分离的mhc-ii肽。使用不含酶的搜索算法以及测试序列附在数据库的牛/人数据库,通过内部蛋白质组学管线产生肽鉴定。用knime工作流来处理来自样品的鉴定文件。从受试品鉴定的肽该受试分子的亲本序列比对。输出用于确定展示来自测试分子区域的mhc-ii肽的供体的百分比。在mapp测定法中测试了化合物ii、化合物iv、化合物vi、化合物viii、代表us 9023789的化合物(下文中称为“化合物
‘
789”)和普兰林肽。化合物ii、化合物iv、化合物vi、化合物viii在测定法中显示没有肽展示在mhc-ii复合物。化合物
‘
789在mhc-ii复合物上展示跨残基8-23的肽簇。普兰林肽显示总跨度为残基1-34的两个肽簇展示在mhc-ii复合物上。
[0238]
计算机tcem(t细胞暴露基序)分析
[0239]
该分析评估mapps鉴定的特定肽簇激活cd4+t细胞的可能性。将含有非种系残基的mapps鉴定的肽序列输入免疫表位数据库(iedb)分析资源mhcii结合预测页面。选择iedb推荐的预测方法。该预测认为27个最常见的hla-dr、-dp和-dq等位基因覆盖了相当一部分的人群。将长度等于或大于15个残基的每个输入序列划分为偏移1个氨基酸的重叠15聚体以跨越整个序列。对于每种肽,通过将肽的得分与从swissprot数据库选择的500万个随机15
聚体的得分进行比较来产生百分位秩。位于注册的推定p-1、p2、p3、p5、p7和p8位置处的氨基酸产生tcem,并且基于非种系残基在这些位置处的存在来定义风险。非种系残基和核心与多个等位基因结合的可能性在图形绘制中报告,并考虑进行免疫原性风险评估。
[0240]
ms血清结合
[0241]
该测定法评估测试候选物与人血清蛋白的脱靶结合。将所测试的抗体包被在immulon 4hbx微孔板上。封闭后,加入人血清并孵育过夜。洗涤板,并洗脱、还原、烷基化和消化结合的蛋白质。通过质谱仪分析肽。使用具有胰蛋白酶特异性的搜索算法和附有测试分子序列的人数据库,通过内部蛋白质组学管线产生肽鉴定。通过内部蛋白质组学工具(chrom-alignment,metaconsense and quant)定量离子,并在jmp中使用student t检验平台oneway分析/each pair进行分析。使用jmp分析离子的log2auc:fit y by x按照每一离子/比较平均(compare means)/所有对(all pairs),tukey hsd,用x拟合y。
[0242]
t细胞增殖测定法
[0243]
该测定法通过诱导细胞增殖来评估所测试的抗体或所测试的mapps肽激活cd4+t细胞的能力。制备cd8+t细胞耗竭的pbmc并用cfse标记。每个样品用培养基对照、匙孔血蓝蛋白(klh;阳性临床基准对照)、所测试的抗体或所测试的mapps肽进行测试。培养物培养7天。在第7天,通过流式细胞术分析样品。
[0244]
预先存在的反应性(ace测定型式)
[0245]
该测定法评估未进行过处理的正常人血清(nhs)中针对所测试的分子的预先存在的抗体(ada)的存在。将稀释的nhs在包被生物素化测试分子的pierce链亲和素板上孵育过夜。第二天,将捕获的结合蛋白酸洗脱,硬质包被到mesoscale(msd)板上,并用生物素标记的分子和钌标记的链亲和素的组合进行检测。如果存在抗药物抗体,它们将结合标记的药物,所得到的信号称为第1级信号(表示为电化学发光)。通过在检测步骤中添加过量的未标记的测试分子,在第2级中确认该信号,这导致第1级信号的抑制。预先存在的抗药物抗体的存在表示为第2级抑制的第90百分位数的大小。第2级抑制的第90百分位数是评估第1层反应性的特异性大小的统计工具。这个第90百分位数用于根据ada风险对分子进行排序。
[0246]
表7.免疫原性风险评估总结
[0247]
[0248]
缩写:ace=酸捕获洗脱;ada=抗药物抗体;cdr=互补决定区;dc=树突状细胞;h1=vh cdr1;h2=vh cdr2;h3=vh cdr3;l1=vl cdr1;l2=vl cdr2;mapp=mhc相关肽蛋白质组学;mhc=主要组织相容性复合体;ms=质谱法;t2=第2层;tcem=t细胞暴露基序;vh=重链可变区;vl=轻链可变区;vhfr3=重链可变区构架3
[0249]
实施例17:化合物ii与其他肠促胰岛素化合物组合在饮食诱导的肥胖症(dio)大鼠中的体内功效
[0250]
进行本研究来研究化合物ii与其他肠促胰岛素化合物(包括glp-1激动剂(化合物xvii)、泌酸调节肽类似物(化合物xviii)以及胰高血糖素、glp-1和gip(化合物xix)的三重激动剂)组合施用时对dio大鼠中的糖尿病和/或肥胖症病症的影响。自抵达伊莱利利公司(td95217;teklad,madison,wi)以来一直保持高热量饮食的饮食诱导肥胖症(dio)雄性long evans(envigo)大鼠用于以下研究。动物单独饲养在具有12小时光照/黑暗周期(2200开灯)的控温设施(24℃)中,并可自由获取食物(td95217)和水。
[0251]
根据大鼠的体重将其随机分组,使得每个实验组的动物具有相似的体重。体重从529克到823克不等。
[0252]
每组包含5只大鼠。将溶媒和化合物ii(1nmol/kg)溶解在溶媒(20mm tris-hcl ph8+0.02%ps80)中,并在黑暗周期开始前30至90分钟通过皮下(sc)注射(1ml/kg)对随意喂养的dio大鼠施用,每3天一次,持续14天。sc注射在第1、4、7、10和13天进行。在整个研究过程中,每天测量体重和食物摄入。通过减去同一动物在第一次注射分子前的体重来计算体重的绝对变化。
[0253]
在研究结束时,采集血液以测量血糖和血浆胰岛素。血糖通过accuchek血糖仪(roche,indianapolis,in)测量。胰岛素通过elisa(msd,rockville,md)测量。
[0254]
所有数据均表示为每组5只动物的平均值
±
sem。使用单因素方差分析进行统计分析,然后进行tukey多重比较检验来将治疗组与溶媒组或彼此进行比较。p《0.05确定为显著性差异。
[0255]
表8:化合物ii与化合物xvii、化合物xviii或化合物xix组合和不组合对体重和累积食物摄入的影响。
[0256]
[0257][0258]
*在第1、4、7、10和13天,每三天皮下施用一次处理。**每天测量体重。体重变化是从第-1天到第14天的差异,表示为克。***累积食物摄入是在整个14天处理期间所消耗的食物总量。统计分析采用单因素方差分析、然后采用tukey进行。*与溶媒组相比p<0.05;#与化合物xvii、化合物xviii或化合物xix组相比p<0.05;+与化合物ii相比p<0.05。
[0259]
化合物ii与化合物xvii、化合物xviii或化合物xix的组合比单独使用化合物ii具有更大的体重减轻。
[0260]
seq id no:1:化合物i
[0261]
γe-cntatcatg-orn-lae-αmef-lvrssn-nmen-fgpklpptevgsnty-nh2[0262]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0263]
seq id no:2:化合物ii
[0264]
γe-cntatcatg-orn-lae-αmef-lvrssn-nmen-fgpklpptevgsnty-nh2[0265]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0266]
其中位置26处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0267]
seq id no:3:化合物iii
[0268]
γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2[0269]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0270]
seq id no:4:化合物iv
[0271]
γe-cntatcatg-orn-lae-αmef-lvrssn-nmed-fgpklpptevgsnty-nh2[0272]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0273]
其中位置26处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0274]
seq id no:5:化合物v
[0275]
kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2[0276]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0277]
seq id no:6:化合物vi
[0278]
kcetatcatg-orn-lae-αmef-lvrssn-nmed-fgpilpptevgsnty-nh2[0279]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0280]
其中位置1处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0281]
seq id no:7:化合物vii
[0282]
kcetatcatg-orn-αmel-aeflvrsshnfgpilpptevgsnty-nh2[0283]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0284]
seq id no:8:化合物viii
[0285]
kcetatcatg-orn-αmel-aeflvrsshnfgpilpptevgsnty-nh2[0286]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0287]
其中位置1处的赖氨酸连接到式(γe)
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0288]
seq id no:9:化合物ix
[0289]
γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2[0290]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0291]
其中位置26处的赖氨酸连接到式aeea
2-γe-co-(ch2)
18-co2h的脂肪酸接头部分
[0292]
seq id no:10:化合物x
[0293]
γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2[0294]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0295]
其中位置26处的赖氨酸连接到式γe-aeea
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0296]
seq id no:11:化合物xi
[0297]
γe-cntatcatgklaeflvrssnnfgpklpptevgsnty-nh2[0298]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0299]
其中位置26处的赖氨酸连接到式(γe)
2-aeea-co-(ch2)
18-co2h的脂肪酸接头部分
[0300]
seq id no:12:化合物xii
[0301]
γe-cntatcatq-orn-laeflvrssnnfgpklpptevgsnty-nh2[0302]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0303]
其中位置26处的赖氨酸连接到式aeea
2-γe-co-(ch2)
18-co2h的脂肪酸接头部分
[0304]
seq id no:13:化合物xiii
[0305]
γe-cgtatcatg-orn-laeflvrssnnfgpklpptevgsnty-nh2[0306]
其中在位置2和7的半胱氨酸之间存在硫缩醛桥
[0307]
其中位置26处的赖氨酸连接到式γe
2-co-(ch2)
18-co2h的脂肪酸接头部分
[0308]
seq id no:14:化合物xiv
[0309]
xaa
1-c-xaa
3-tatcat-xaa
10-xaa
11-xaa
12-ae-xaa
15-lvrss-xaa
21-xaa
22-fgp-xaa
26-lppte vgsnty-nh2,其中
[0310]
xaa1是k或γe
[0311]
xaa3是e、n或g
[0312]
xaa
10
是g或q;
[0313]
xaa
11
是orn或k;
[0314]
xaa
12
是l或αmel
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1