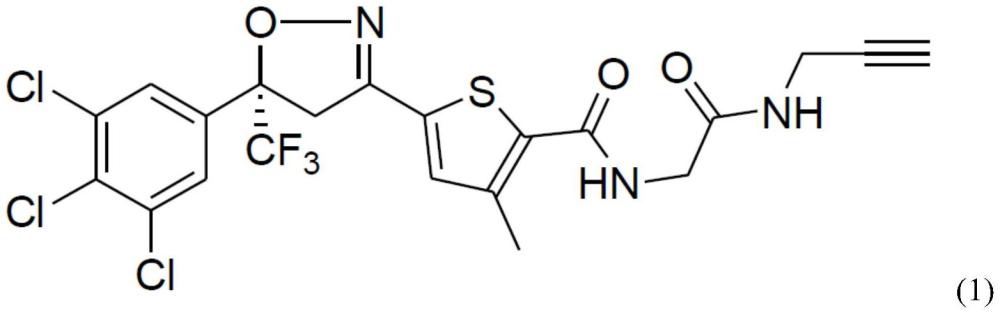
用于制备二芳基异噁唑啉衍生物的方法与流程
背景技术:
技术实现思路
1、一方面,本发明涉及一种用于制备对映异构体纯的式(1)化合物的方法
2、
3、其包括以下步骤
4、(i)使式(2)化合物与羟胺
5、
6、其中x选自由卤素和-c(o)or4组成的组,其中r4是c1-c4烷基,以及合适的碱和式(3)化合物反应,
7、
8、其中yˉ是阴离子,
9、r1选自由氢和甲氧基组成的组,
10、r2选自由乙基和乙烯基组成的组,
11、r3选自由芳基和杂芳基组成的组,该芳基任选地被独立地选自由硝基、卤素、氨基、三氟甲基、c1-c4烷基、c1-c4烷氧基和苄氧基组成的组的1至5个取代基取代,该杂芳基任选地被独立地选自由卤素、三氟甲基、c1-c4烷基和c1-c4烷氧基组成的组的1至3个取代基取代,
12、以得到式(4)化合物,
13、
14、(ii)将式(4)化合物的x转化成羧酸以得到式(5)化合物
15、
16、(iii)任选地用选自由c1-5醇、c2-5烷基氰、c3-9烷基酮、c2-8烷基醚和c2-8烷基乙酸酯组成的组的溶剂以及任选地用选自由水和c5-8烃组成的组的反溶剂使式(5)化合物结晶,
17、和
18、(iv)将式5化合物与合适的胺偶联,
19、其中合适的胺是2-氨基-炔丙基-乙酰胺或由甘氨酸任选地被羧基保护、随后如果需要去保护并与炔丙基胺偶联的顺序反应得到的胺。
20、本发明通过方案1进一步说明。在方案1中,所有产物可以通过本领域熟知的技术分离和纯化,如提取、蒸发、研磨、色谱法和重结晶。
21、
22、方案1的步骤1描述了在式(3)化合物的存在下,使用式(2)化合物(其中x选自由卤素和-c(o)or4组成的组,其中r4是c1-c4烷基)与羟胺和合适的碱的金鸡纳生物碱导向的不对称羟胺/烯酮级联反应,以得到对映异构体纯的式(4)化合物。
23、本领域技术人员将理解,式(2)化合物以几何异构体存在。在式(2)化合物中,从双键到cf3基团的键表示此类几何异构体,包含e-异构体、z-异构体及它们的混合物,并且本发明涵盖使用e-异构体、z-异构体及它们的任何比率的混合物。特别优选的式(2)化合物是其中x是氯或溴,甚至更优选的是溴的那些化合物。其它特别优选的式(2)化合物是其中x是-c(o)or4且r4选自由甲基和乙基组成的组,甚至更优选的甲基的那些化合物。特别优选的式(3)化合物是其中r1是甲氧基的那些化合物。
24、参考式(2)化合物,式(3)化合物通常以0.001至10,更通常0.01至1甚至更通常0.05至0.5的摩尔比使用。
25、合适的碱的实例包含氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钡、氢氧化铯、磷酸钠、磷酸钾、甲醇钠、甲醇钾、叔丁醇钾等。在实施例中,合适的碱选自由氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钡、氢氧化铯、磷酸钠、磷酸钾、甲醇钠、甲醇钾、叔丁醇钾及它们的混合物组成的组。典型地,参考式(2)化合物,碱以1至10,更典型地1至5,甚至更典型地2至4的摩尔比使用。当然,技术人员将理解,如果羟胺用作盐,则可以使用额外的碱。
26、方案1的步骤1中描述的反应在溶剂中进行,该溶剂如低级醇,如甲醇、乙醇和异丙醇,氯化溶剂,如二氯甲烷和氯仿,醚溶剂,如四氢呋喃、2-甲基四氢呋喃、二异丙基醚和甲基-叔丁基醚、叔戊基甲基醚、乙基-叔丁基醚,芳香族溶剂,如甲苯、氯苯和三氟甲苯,或烷烃溶剂,如己烷、庚烷、甲基环己烷和环己烷;和此类溶剂的混合物。可以向反应中加入水。该反应典型地在-50℃至50℃,更典型地-40℃至0℃,更典型地-40℃至-10℃,并且甚至更典型地-30℃至-20℃的温度下进行,并且通常需要1至48小时。
27、典型的式(3)化合物包含(r)-[(2s)-1-[(3,5-双-三氟甲基苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物、(r)-[(2s)-1-[(3,5-双-三氟甲基苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇氯化物、(r)-[(2s)-1-[(3,5-双三氟甲基苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(4-喹啉基)甲醇溴化物、(r)-[(2s)-1-[(2,3,5-三氟苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物、(r)-[(2s)-1-[(3,5-二叔丁基苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物、和(r)-[(2s)-1-[(蒽-9-基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物。
28、方案1的步骤2描述了将式(4)化合物的x转化为式(5)化合物的羧酸。其中x是卤素的式(4)化合物可以通过用格氏试剂金属化x-位置或用烷基锂进行卤素-金属交换,并且使金属化的物质与二氧化碳或可以精制成羧酸的试剂反应而转化为式(5)化合物。此类反应容易进行并且是熟知的。参见wo 2014/090918。其中x是-c(o)or4的式(4)化合物容易通过水解转化为式(5)化合物。此类反应容易进行并且是熟知的。
29、方案1的步骤3描述了式(5)化合物与合适的胺(2-氨基-炔丙基-乙酰胺,其是式(6)化合物,
30、
31、或者由甘氨酸任选地被羧基保护、随后如果需要去保护并与炔丙基胺偶联的顺序反应得到的胺)偶联,以得到式(1)化合物。
32、羧酸或活化的羧酸衍生物如酰卤与胺形成酰胺的此类偶联反应在本领域是熟知的。使用羧基保护的甘氨酸、去保护和酰胺与炔丙基胺的偶联同样容易完成。参见wo 2010/070068和wo 2014/090918。
33、如本文所用,术语“对映异构体纯的”是指以大于90%(即80%或更大的对映异构体过量,或e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于92%(即84%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于94%(即88%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于95%(即90%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于96%(即92%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于97%(即94%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于98%(即96%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于99%(即98%或更大的e.e.)存在的(s)-对映异构体。在一个实施例中,术语“对映异构体纯的”是指,其以大于99.8%(即99.6%或更大的e.e.)存在的(s)-对映异构体。
34、使用反溶剂可能是有利的。如在本上下文中使用的,“反溶剂”是指这样的溶剂,其式(5)化合物相对于所选择的溶剂明显更难溶。优选地,当使用反溶剂时,它与所选择的溶剂是可混溶的。
35、本发明还提供了一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c1-5醇/水中结晶。在优选的实施例中,c1-5醇与水的比率为约9:1(v/v)。在优选的实施例中,c1-5醇是异丙醇。在甚至更优选的实施例中,c1-5醇是异丙醇并且异丙醇与水的比率是9:1(v/v)。
36、本发明还提供了一种用于制备对映异构体纯的式(1)化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c3-9烷基酮/水中结晶。在优选的实施例中,c3-9烷基酮与水的比率为约9:1(v/v)。在优选的实施例中,c3-9烷基酮是丙酮。在甚至更优选的实施例中,c3-9烷基酮是丙酮并且丙酮与水的比率是9:1(v/v)。
37、优选的反溶剂是c5-8烃和水。特别地,优选的反溶剂选自由水、戊烷、己烷、庚烷、环己烷和甲基环己烷组成的组。特别优选的反溶剂是甲基环己烷。所选的溶剂和反溶剂的比率并不重要,并且典型地在2:1至1:6(v/v)的范围内。
38、本发明还提供了一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c1-5醇和c5-8烃中结晶。在优选的实施例中,c1-5醇选自由乙醇和异丙醇组成的组。
39、本发明还提供了一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c2-8烷基醚和c5-8烃中结晶。在优选的实施例中,c2-8烷基醚选自由四氢呋喃和2-甲基四氢呋喃组成的组。
40、本发明还提供了一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c2-8烷基乙酸酯和c5-8烃中结晶。在优选的实施例中,c2-8烷基乙酸酯选自由乙酸乙酯和乙酸异丙酯组成的组。
41、本发明还提供了一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其特征在于提高式(5)化合物的对映异构体纯度,该方法包括:从c3-9烷基酮和c5-8烃中结晶。在优选的实施例中,c3-9烷基酮选自由丙酮和甲基乙基酮组成的组。
42、如本文所用,术语“卤素”是指氟、氯、溴和碘原子。特别地,术语“卤素”是指氟、氯和溴原子。甚至更特别地,术语“卤素”是指氯和溴原子。
43、与yˉ相关的术语“阴离子”是指带负电荷的有机或无机基团。例如,yˉ可以是甲苯磺酸根、对溴苯磺酸根、甲磺酸根、硝基苯磺酸根(nosylate)、三氟甲磺酸根、乙酸根等,或者可以是卤化物、硫酸根、磷酸根、氢氧化物、四氟化硼等。在一个实施例中,yˉ是卤化物。在一个实施例中,yˉ是氯化物或溴化物。
44、术语“芳基”是指苯基、萘基、蒽基等。在一个实施例中,“芳基”是苯基。在一个实施例中,“芳基”是蒽-9-基。
45、术语“杂芳基”是指含有至少一个选自由氮、氧和硫组成的组的杂原子的完全不饱和环,包含吡啶基、嘧啶基、吡嗪基、吲哚基、喹啉基、吖啶基等。
46、术语“c1-c4烷基”是指具有一至四个碳原子的直链或支链烷基。
47、术语“c1-c4烷氧基”是指通过氧原子连接的c1-c4烷基。
48、当与可测量的数值变量结合使用时,术语“约”是指该变量的指示值以及在该指示值的实验误差内或在该指示值的±10%内的所有变量值,以较大者为准。
49、术语“c1-5醇”是指具有一个至五个碳原子的直链或支链烷醇,例如甲醇、乙醇、正丙醇、异丙醇、1-丁醇、1,3-丙二醇等。
50、术语“c2-5烷基氰”是指总共具有二个至五个碳原子的直链或支链烷基氰化物,例如乙腈、丙腈和丁腈。
51、术语“c3-9烷基酮”是指具有氧代基团并且总共具有三个至九个碳原子的直链、支链或环状烷基基团,例如丙酮、甲基乙基酮和环己酮。
52、术语“c2-8烷基醚”是指总共具有二至八个碳原子的直链、支链或环状烷基醚,例如乙醚、甲基叔丁基醚、叔戊基甲基醚、乙基叔丁基醚、四氢呋喃(thf)、2-甲基thf、二噁烷等。
53、术语“c3-8烷基乙酸酯”是指总共具有三个至八个碳的直链或支链的乙酸烷基酯,例如乙酸甲酯、乙酸乙酯、乙酸异丙酯、乙酸丁酯、乙酸异丁酯等。
54、术语“c5-8烃”是指直链、支链或环状饱和烷基烃,例如戊烷、己烷、庚烷、辛烷、环戊烷、环己烷、甲基环己烷等。
55、应当理解,术语“结晶(crystallize)”、“结晶(crystallizing)”和“结晶(crystallization)”是指完全溶解,然后是不涉及完全溶解的沉淀和浆料方法。浆料方法包含涵盖在完全溶解后沉淀后继续搅拌的方法。
56、式(1)化合物在本领域中已知(wo2016/077158)作为用于害虫控制的有价值的活性成分。术语“害虫”包括动物体表和体内以及卫生领域的体内寄生虫,且优选包括体外寄生虫。体外寄生虫被理解为特别是昆虫、螨类(螨虫和壁虱)以及鱼寄生的甲壳类动物(海虱)。特定的害虫是跳蚤、壁虱、螨虫、苍蝇、蠕虫、虱子和甲壳类动物。甚至更特别的害虫是跳蚤、壁虱、虱子和海虱。
57、此处描述的动物被理解为包括脊椎动物。术语脊椎动物在本文中被理解为包括例如鱼、两栖动物、爬行动物、鸟类和包括人类在内的哺乳动物。根据本发明的优选的一组脊椎动物包括恒温动物,包括农场动物如牛、马、猪、绵羊和山羊,家禽如鸡、火鸡、珍珠鸡和鹅,毛皮动物如貂、狐狸、龙猫、兔等,以及伴侣动物如雪貂、豚鼠、大鼠、仓鼠、猫和狗,以及人类。根据本发明的另一组优选脊椎动物包括鱼类,包括鲑科鱼类,例如鲑鱼、鳟鱼或白鲑。
58、式(1)化合物可以单独施用或以组合物的形式施用。在实践中,化合物通常以组合物的形式施用,即,与至少一种可接受的赋形剂掺合。任何可接受的赋形剂的比例和性质由要治疗的病症或病况和其它相关情况、所选择的施用途径以及兽医领域和制药领域的标准实践来进行确定。
59、通过以下实例进一步说明本发明。这些实例仅旨在是说明性的,而不是以任何方式限制本发明。
60、实例1
61、(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑
62、
63、在氮气下,将在二氯甲烷(100ml)中的(z/e)-1-(5-溴-4-甲基-2-噻吩基)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮(1.0g,2.1mmol)和(r)-[(2s)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(135mg,0.2138mmol,0.1eq.)合并。将溶液冷却至-15℃至-10℃的范围内,并且将在水中的羟胺(386μl,6.25mmol,16.2mol/l,3.0eq.)和氢氧化钠(0.70ml,7.0mmol,10m,3.3eq.)的溶液缓慢地添加到内部温度保持为-10℃的反应混合物中。在-10℃搅拌7小时后,关闭冷却器并将反应在室温搅拌过夜以完成反应。手性hplc表明90.3%的s-异构体和9.7%的r-异构体。将反应混合物转移到圆底烧瓶中,并在室温下在减压下浓缩,以得到固体。将固体溶解在乙酸乙酯(3ml)中,并且通过硅胶上的自动快速色谱法通过用etoac与己烷(1:1)洗脱进行纯化。在40℃在减压下从含有级分的产物中除去溶剂,以得到淡黄色固体(0.833g,81%)。
64、实例2
65、(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑
66、
67、在氮气下,将在二氯甲烷(250ml)中的(z/e)1-(5-溴-4-甲基-2-噻吩基)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮(10.0g,20.9mmol)和(r)-[(2s)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(2.14mmol,0.1eq.)合并。将溶液冷却至-10℃至-15℃的范围内,并且缓慢地添加在水中的羟胺(3.9ml,63.2mmol,16.2mol/l,3.0eq.)和氢氧化钠(7.0ml,70mmol,10m,3.3eq.)的溶液,将内部温度保持在-10℃至-15℃的范围内。在-15℃至-10℃搅拌18小时后,将反应混合物转移至圆底烧瓶中并在室温减压浓缩,以得到固体。然后在50℃下将固体溶解在乙醇(90ml)中,在50℃下(水浴)搅拌30分钟,然后在搅拌下缓慢滴加水(300ml)以得到悬浮液。过滤悬浮液并重复重结晶一次,以得到自由流动的固体。将固体在25-30℃的真空烘箱中干燥,以得到10.34g产物。通过手性hplc评价固体,其表明91.0%的s-异构体和9.0%的r-异构体。
68、实例3a
69、(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑
70、
71、将在二氯甲烷(100ml)和乙基叔丁基醚(400ml)中的(z/e)1-(5-溴-4-甲基-2-噻吩基)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯-1-酮(50.0g,104.5mmol)和(r)-[(2s)-1-[[3,5-双(叔丁基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(0.11eq.)合并。将反应混合物在30℃搅拌30分钟,然后冷却至-20℃的范围,然后缓慢地添加在水中的羟胺(50%,40ml,313mmol,3.0eq.)和氢氧化钠(34.5ml,345mmol,10m,3.3eq.)的溶液,将内部温度保持在-15℃至-20℃的范围内。在-15℃至-20℃搅拌18小时后,添加水性盐酸(1n,500ml),并将反应混合物在15℃至20℃搅拌,然后停止搅拌,且30分钟后将各相分离。用水性盐酸(1n,75ml)萃取有机层,将各层分离并再次用水性盐酸(1n,100ml)萃取有机层。将有机层分离并用饱和水性碳酸氢钠(75ml)萃取,且将各层分离并再次用饱和水性碳酸氢钠(100ml)萃取有机层。将各层分离并用硫酸钠(10g)干燥有机层。过滤有机层,用乙基叔丁基醚(50ml)洗涤滤饼,然后添加蒙脱石粘土(50g),并将混合物在10℃至20℃搅拌。2小时后,过滤反应混合物,用乙基叔丁基醚(50ml)冲洗滤饼,并将滤液浓缩至约100ml,添加thf两次并再次浓缩至约100ml,然后添加thf(150ml)以获得在thf中的溶液形式的标题化合物。通过手性hplc评价溶液,其表明96.5%的s-异构体和3.5%的r-异构体。
72、实例3b
73、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸
74、
75、将(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑(185.0g,374.8mmol)在thf中的22%溶液冷却至0℃至5℃。滴加乙基氯化镁在thf中的溶液(2m,300ml,1.6eq),将内部温度保持低于10℃。将反应混合物在15℃至20℃搅拌2至4小时。然后,在通过浓硫酸(50ml)后,在0℃至5℃下将二氧化碳气体(58g,3.5eq)引入到液面下。将反应混合物在0℃至5℃下搅拌2小时,并在低于10℃下滴加8%氯化钠水溶液(601g),随后在低于0℃下加入37%hcl水溶液(92.5g),以得到标题化合物。
76、实例4a
77、(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑
78、
79、在-30℃,向冷却至约-30℃的丁烯酮溴噻吩(658g)、(r)-[(2s)-1-[(3,5-二叔丁基苯基)甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(57g)、二氯甲烷(1120g)和甲基叔丁基醚(mtbe)(2586g)的混合物中添加盐酸羟胺(261g)在水(333g,预冷至0℃)中的溶液中,随后也在-30℃添加氢氧化钠水溶液(32%,548g)。将反应混合物在-30℃搅拌若干小时,直到转化完成。将反应混合物加热至0-5℃并且转移到由盐酸(37%,286g)、乙醇(468g)和水(600g)组成的骤冷溶液中。将混合物加热至40℃,检查ph为ph=5-6,并且分离各相。有机层在减压下浓缩,并且馏出物用新鲜的甲基叔丁基醚代替(2个循环,每个循环1777g)。随后,将混合物短暂加热至回流,然后冷却至-10℃以引发催化剂的沉淀。过滤所得的悬浮液,并且任选地用盐酸(37%,240g)、氯化钠(240g)和水(1080g)的溶液提取,并且任选地用漂白土的滤床过滤。滤液用饱和碳酸氢盐溶液(1200g)洗涤,并且有机层作为含有产物(s)-异噁唑溴噻吩的mtbe溶液储存。
80、实例4b
81、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸
82、
83、将由实例4a(在mtbe中的(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑)产生的反应混合物加入到反应器中并且浓缩。用新鲜thf(2个循环,每个循环2136g)替换馏出物。冷却至it-10℃后添加乙基氯化镁(~25%在四氢呋喃中,933g)。反应完成后(hplc),在内部温度-1℃尽可能快地将气态二氧化碳(236g)添加到表面以下。将反应混合物在内部温度0℃搅拌。反应完成后(hplc),通过在环境温度将反应混合物缓慢添加至含有氯化钠(110g)、水(2235g)和37%盐酸(283g)的混合物中来猝灭反应混合物。在混合和沉降后,分离各相。浓缩有机层,并且用新鲜的乙腈代替馏出液(2个循环,每个循环1915g)。在冷却至-10℃之前,将反应混合物短暂加热以获得澄清溶液,并且通过离心分离产物,并用预冷的乙腈(460g)洗涤。湿的(s)-异噁唑噻吩羧酸在真空干燥器中在50℃、≤100毫巴下干燥。干燥产率是理论产率的82%。纯度:100%,手性纯度为99.8a%。
84、实例4c
85、3-甲基-n-[2-氧代-2-[(2-丙炔-1-基)氨基]乙基]-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-甲酰胺
86、
87、将干燥的s-异噁唑噻吩羧酸(来自实例4b,10g)和甲苯(125g)装填到反应器中,并且将混合物加热到110℃。将亚硫酰氯(7.0g)缓慢投加到反应混合物中。反应完成后,在nmt50℃真空蒸馏出甲苯,并将残余物用新鲜二氯甲烷(82.5g)稀释。
88、在单独的反应器中,将2-氨基-炔丙基-乙酰胺hcl(3.4g)悬浮在二氯甲烷(100g)中,并在环境温度添加三乙胺(6.9g)。将所得的混合物冷却至0℃,并在0℃下在45分钟内加入在二氯甲烷中的酰氯反应混合物。将合并的反应混合物在0℃下搅拌额外的1-8小时,并且用ipc检查转化率。
89、在充分转化(ipc)后,用1m盐酸(37%hcl(4.8g)和水(38.7g)的混合物)萃取混合物,然后用饱和碳酸氢钠溶液(在48g水中的4.2g碳酸氢钠)萃取,且最后用水(52.5g)萃取。将大部分有机层在40℃真空除去,并添加叔丁基甲基醚(23.8g)。将混合物在25℃搅拌并缓慢添加庚烷(47.6g)以沉淀产物。将产物3-甲基-n-[2-氧代-2-[(2-丙炔-1-基)氨基]乙基]-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-甲酰胺通过过滤分离,并用叔丁基甲基醚(4.3g)和庚烷(20.7g)的混合物洗涤。将产物在45℃真空干燥。可以根据需要进行产物的结晶。产量:11.2g。纯度:>98.7%,手性纯度>99.87%。1h nmr与真实样品一致。
90、通过使用手性柱(daicel chiralpak as-3r,150x4.6mm,3μm)的hplc来确定产物的对映异构体纯度。在每种情况下,保留时间(见下表1)与使用包含水/乙腈55:45(v/v)混合物的溶剂体系有关。在等度模式下以1.5ml/min的流速使用洗脱液。图1描绘了3-甲基-n-[2-氧代-2-[(2-丙炔-1-基)氨基]乙基]-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-甲酰胺产物(底线)的手性色谱重叠图。中间线描绘了3-甲基-n-[2-氧代-2-[(2-丙炔-1-基)氨基]乙基]-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-甲酰胺的参考样品(即,对映异构体纯)的色谱图。顶线描绘了3-甲基-n-[2-氧代-2-[(2-丙炔-1-基)氨基]乙基]-5-[(5r)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-甲酰胺的参考样品(即,对映异构体纯)的色谱图。图1的峰结果在下表1中提供。
91、表1
92、 保留时间,rt(分钟) 面积 面积% 高度(au) 1 10.914 6175934 99.87 290256 2 13.752 8269 0.13 308
93、图2描绘了与空白(底线)相比,实例4c的产物(顶线)的hplc纯度。图2中产物的峰结果在下表2中提供:
94、表2
95、 rt(分钟) 面积 面积% 高度(au) 1 6.446 1766115 98.70 1050661 2 7.300 23324 1.30 13764
96、图3描绘了实例4c的产物(底线)与api参考样品(顶线)之间的1h nmr比较。
97、图4描绘了实例4c的产物的1h nmr数据。
98、实例5
99、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸
100、
101、将(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑(185.0g,374.8mmol)在thf中的22%溶液冷却至0℃至5℃。滴加乙基氯化镁在thf中的溶液(2m,300ml,1.6eq),将内部温度保持低于10℃。将反应混合物在15℃至20℃搅拌2至4小时。然后,在通过浓硫酸(50ml)后,在0℃至5℃下将二氧化碳气体(58g,3.5eq)引入到液面下。将反应混合物在0℃至5℃搅拌2小时,并且在低于10℃滴加8%氯化钠水溶液(601g),随后在低于0℃添加37%hcl水溶液(92.5g)。
102、将反应混合物在10℃至15℃搅拌30分钟,然后停止搅拌,并且在30分钟后将各相分离。将有机层真空浓缩至约370ml,随后重复三次添加thf(1850ml)并真空浓缩至约370ml至555ml。在确认反应混合物干燥后,进行三个循环的乙腈(925ml)添加,然后真空浓缩至约555ml至740ml。将反应混合物加热至75℃,并在一小时内逐渐冷却至50℃。在50℃下加入产物晶种(1.85g),并将反应混合物在50℃下搅拌30分钟。批料在三小时内逐渐冷却至-10℃,并在-10℃下保持两小时。过滤批料并用冷乙腈(93至185ml)洗涤滤饼。在将湿滤饼在50℃真空干燥12小时后获得110g标题化合物。通过手性hplc评估该产物,其表明>99.9%的s-异构体。
103、上面提到的产物晶种制备如下。将(5s)-3-(5-溴-4-甲基-2-噻吩基)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑(48.93g,99.1mmol)在300ml thf中的溶液冷却至0℃至5℃。滴加乙基氯化镁在thf中的溶液(2m,80ml),将内部温度保持低于10℃。将反应混合物在15℃至20℃搅拌2至4小时。然后,在通过浓硫酸(50ml)后,在0℃至5℃下将二氧化碳气体(25g,3.5eq)引入到液面下。将反应混合物在0℃至5℃搅拌6小时,并且在低于10℃滴加5%氯化钠水溶液(157g),随后在低于0℃添加37%hcl水溶液(25g)。将反应混合物在10℃至15℃搅拌30分钟,然后停止搅拌,并在30分钟后将各相分离。将有机层浓缩以除去溶剂。向混合物中加入50ml的庚烷,然后除去溶剂。在40℃,将粗产物溶解在50ml的ea和100ml的庚烷中。向混合物中缓慢滴加额外的1000ml的庚烷。然后将混合物在40℃搅拌15h。过滤混合物,并且得到湿滤饼。在20℃下,用丙酮将湿滤饼制浆。过滤混合物,并将湿滤饼在50℃真空干燥3h,以得到9.7g产物。通过手性hplc评估该产物,其表明>99.9%的s-异构体。
104、实例6
105、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸
106、
107、将在甲苯(120ml)中的2-溴-3-甲基-5-乙酰基噻吩(20g)、对甲苯磺酸一水合物(2.3g)和乙二醇(11.3g)合并,并且在搅拌下在115℃下加热12小时,同时用迪安-斯达克榻分水器(dean-stark trap)收集水。然后将反应混合物冷却并且用饱和碳酸氢钠水溶液(40ml)淬灭。分离有机层,并用水(40ml)洗涤两次,并在60℃下在真空下浓缩,以得到2-(5-溴-4-甲基-2-噻吩基)-2-甲基-1,3-二氧戊环。
108、将2-(5-溴-4-甲基-2-噻吩基)-2-甲基-1,3-二氧戊环(25.2g)和thf(50ml)合并,并且在冰/水浴中冷却。在搅拌下,加入在thf(2.0m,75ml)中的乙基氯化镁,同时用冰/水浴将温度保持在10℃至30℃。然后将反应混合物加热至环境温度。在90分钟后,用冰/水浴将反应混合物冷却至0℃至5℃,并在5℃至14℃下将气态二氧化碳鼓入反应液面下30分钟。允许反应混合物升温至环境温度并且搅拌过夜。将反应混合物冷却至0℃至10℃并在10℃至35℃添加75ml饱和盐水溶液。然后用37%水性hcl将ph调节至约ph 1。加入乙酸乙酯(50ml)和水(25ml),并且搅拌反应混合物。分离水层,并且用饱和盐水(3×50ml)洗涤有机层。将洗涤的有机层在40℃下在真空下浓缩,以得到作为红色油状产物的3-甲基-5-(2-甲基-1,3-二氧戊环-2-基)噻吩-2-羧酸(19.2g),其在环境温度下在储存期间固化。ms:esi+228.96;esi-:226.98。
109、将3-甲基-5-(2-甲基-1,3-二氧戊环-2-基)噻吩-2-羧酸(19.2g)、碳酸钾(24.9g)和60ml的二甲基甲酰胺(dmf)合并。用冰/水浴将反应混合物冷却至0-5℃,然后在保持温度为0-5℃的同时滴加甲基碘(13.1ml)。将反应混合物在环境温度搅拌1小时,然后冷却至0℃至10℃并用水(180ml)和乙酸乙酯(180ml)猝灭。分离水层,并且用水(2×60ml)和盐水溶液(60ml)洗涤有机层。然后在40℃下在真空下蒸发有机层,以得到作为红色油状产物的3-甲基-5-(2-甲基-1,3-二氧戊环-2-基)噻吩-2-羧酸甲酯(21.3g)。ms:esi+243.00。
110、将对甲苯磺酸一水合物(1.7g)、3-甲基-5-(2-甲基-1,3-二氧戊环-2-基)噻吩-2-羧酸甲酯(21.3g)、丙酮(140ml)和水(14ml)合并,并且在35℃下搅拌2小时,然后冷却至20℃,然后加入碳酸氢钠(1.5g),并且将反应混合物在20℃下搅拌10分钟。然后将混合物在40℃下在真空下浓缩,以得到残余物。残留物用200ml乙酸乙酯溶解,并且用水(50ml)洗涤。分离各层,并用水(2×50ml)洗涤有机层。将有机层在40℃真空浓缩,以得到残余物,将其通过快速色谱法用mtbe在正庚烷中的混合物(0-15%v/v)纯化,以得到5-乙酰基-3-甲基-噻吩-2-羧酸甲酯(4.9g)。1h nmr(500mhz,cdcl3)δppm 2.51(d,j=5.87hz,6h)3.85(s,3h)7.43(s,1h)。13c nmr(126mhz,cdcl3)δppm 15.85(s,1c)26.80(s,1c)52.06(s,1c)76.74(s,1c)77.00(s,1c)77.26(s,1c)132.65(s,1c)135.25(s,1c)145.37(s,1c)146.02(s,1c)162.57(s,1c)190.78(s,1c)。
111、将5-乙酰基-3-甲基-噻吩-2-羧酸甲酯(4.1g)、2,2,2-三氟-1-(3,4,5-三氯苯基)乙酮(5.74g)、三乙胺(8.4ml)和mtbe(41ml)合并,并且在约57℃加热反应混合物。3小时后,将反应混合物冷却至环境温度并搅拌12小时。然后将反应混合物冷却至0-5℃,并且滴加亚硫酰氯(2.3ml),同时将温度保持在0-10℃。然后将反应混合物温热至环境温度并搅拌过夜。然后用mtbe(45ml)稀释混合物,并且冷却至0-5℃。滴加饱和碳酸氢钠水溶液(45ml)和水(45ml)的混合物。然后将反应混合物与乙酸乙酯(60ml)合并,并且分离各层。用乙酸乙酯(41ml)提取水层,并且合并有机层,并且用盐水溶液(2×40ml)洗涤。然后在30℃至40℃下在真空下蒸发有机层,以得到残余物。将残余物悬浮于乙醇(50ml)中,搅拌1小时,然后冷却至0℃至5℃。在搅拌下,在0℃至5℃滴加水(50ml),并将混合物搅拌3小时,以得到固体。通过过滤收集固体,用预冷的1∶3乙醇/水混合物(2×10ml)洗涤,并且在35℃至40℃下在真空下干燥,以得到作为棕色固体的3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(8.43g)。e/z比率:77:23(通过1h nmr)。
112、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和dcm(50ml)合并并冷却至-10至-15℃。经由注射器滴加水性氢氧化钠(10n,0.33ml)和水性羟胺(50%,0.223ml)的预冷混合物,同时将温度保持在-10℃至-15℃。5小时后,缓慢地添加水性盐酸(2n,25ml),然后将反应混合物温热至10℃至15℃。然后将各层分离,并且将有机层用水(2x,25ml)洗涤并在50℃真空蒸发,以得到3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯(640mg),其不经进一步纯化即用于下一步骤。
113、将3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯(640mg)依次与thf(5ml)合并两次,并且蒸发以得到残余物,将该残余物与thf(4.2ml)、水(1.6ml)和氢氧化钠水溶液(10n,0.22ml)合并。然后在搅拌下将反应混合物加热至60℃。4小时后,将反应混合物蒸发至接近干燥,以得到残余物,将其在乙酸乙酯(50ml)与水性盐酸(0.5n hcl,25ml)之间分配。将各层分离,用水(2x 25ml)洗涤有机层,并在50℃真空蒸发,以得到残余物。将残余物与甲苯(5ml)合并,然后在60℃真空蒸发,以得到泡沫状固体形式的标题化合物(450mg)s/r比率:89:11。1h nmr(500mhz,cdcl3)δppm 2.53-2.60(m,3h)3.63-3.73(m,1h)4.03-4.12(m,1h)7.12-7.14(m,1h)7.60-7.65(m,2h)。
114、实例7
115、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯
116、
117、在环境温度将3-甲基-2-噻吩羧酸(2.5g)和thf(5ml)合并,然后经由注射器历经15分钟添加2,2,6,6-四甲基哌啶基氯化镁氯化锂复合物(50ml 0.94m在thf中),同时控制温度低于45℃。将反应混合物在25℃搅拌1小时,然后经由注射器添加n-甲氧基-n-甲基乙酰胺(5.0ml),同时控制温度低于40℃。在环境温度搅拌约90分钟后,将反应混合物冷却至0-5℃并添加水性盐酸(2m,100ml),同时控制温度低于45℃。添加mtbe(100ml),将各层分离并用mtbe(50ml)萃取水层。合并的有机层用盐水溶液(2×25ml)洗涤,然后在45℃下在真空下蒸发,以得到作为黄色固体的5-乙酰基-3-甲基-噻吩-2-羧酸(4.8g)。
118、将5-乙酰基-3-甲基-噻吩-2-羧酸(4.8g)与碳酸钾(3.0eq)和dmf(30ml)合并,然后滴加碘甲烷(2.5eq)。在45分钟后,在混合的情况下加入水(90ml)和mtbe(120ml),然后分离各层,并且水层用mtbe(60ml)提取。用水(2×30ml)洗涤合并的有机层,然后在55℃下在真空下蒸发,以得到5-乙酰基-3-甲基-噻吩-2-羧酸甲酯(4.5g)。
119、将5-乙酰基-3-甲基-噻吩-2-羧酸甲酯(4.5g)、2,2,2-三氟-1-(3,4,5-三氯苯基)乙酮(3.66g)、三乙胺(2.9ml)和mtbe(30ml)合并,并且在约60℃加热反应混合物。6.5小时后,添加另外的三乙胺(2.0ml)并在60℃继续加热3小时。将反应混合物冷却至0℃至5℃,并滴加亚硫酰氯(1.7ml),同时保持温度低于12℃。然后将反应混合物加热至环境温度并且搅拌1小时,然后用mtbe(30ml)稀释,随后冷却至10℃,接着缓慢添加饱和水性碳酸氢钠(30ml)和水(30ml)的混合物。然后分离各层,并且水层用mtbe(30ml)提取。用盐水溶液(2×30ml)洗涤合并的有机层,然后在30℃至40℃下在真空下蒸发,以得到残余物。残留物两次悬浮在乙醇(30ml)中,并且蒸发至接近干燥。然后将残余物悬浮在乙醇(30ml)中,并且在0℃至5℃下搅拌1小时,以得到固体。通过过滤收集固体,用预冷的1:3乙醇/水混合物(2x10ml)洗涤,并在40℃真空干燥,以得到3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(2.54g),几乎纯的e异构体(通过1h nmr)。
120、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和dcm(50ml)合并并且冷却至-10至-15℃。在搅拌下经由注射器滴加氢氧化钠(10n,0.33ml)和水性羟胺(50%,0.223ml)的水性预冷混合物,同时将温度保持在-10℃至-15℃。在-10℃至-15℃5小时后,分析混合物。s/r比率:89:11。
121、实例8
122、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯
123、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(三氟甲基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和甲苯/甲基环己烷(1:1(v/v)50ml)合并并且冷却至-10℃至-15℃。在搅拌下经由注射器滴加水性氢氧化钠(10n,0.33ml)和水性羟胺(50%,0.223ml)的预冷混合物,同时将温度保持在-10℃至-15℃。在-10℃至-15℃46小时后,分析混合物。s/r比率:92:8。
124、实例9
125、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯
126、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(叔丁基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和dcm(50ml)合并并且冷却至-10至-15℃。在搅拌下经由注射器滴加水性氢氧化钠(10n,0.33ml)和水性羟胺(50%,0.223ml)的预冷混合物,同时将温度保持在-10℃至-15℃。在-10℃至-15℃18小时后,分析混合物。s/r比率:81:19。
127、实例10
128、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯
129、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(叔丁基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和dipe(50ml)合并并且冷却至-10至-15℃。在搅拌下经由注射器滴加水性氢氧化钠(10n,0.33ml)和水性羟胺(50%,0.223ml)的预冷混合物,同时将温度保持在-10℃至-15℃。在-10℃至-15℃18小时后,分析混合物。s/r比率:88:12。
130、实例11
131、3-甲基-5-[(5s)-5-(3,4,5-三氯苯基)-5-(三氟甲基)-4h-异噁唑-3-基]噻吩-2-羧酸甲酯
132、将3-甲基-5-[(e/z)-4,4,4-三氟-3-(3,4,5-三氯苯基)丁-2-烯酰基]噻吩-2-羧酸甲酯(500mg)、(r)-[(2s)-1-[[3,5-双(叔丁基)苯基]甲基]-5-乙烯基-奎宁环-1-鎓-2-基]-(6-甲氧基-4-喹啉基)甲醇溴化物(69mg)和二异丙基醚(40ml)及dcm(10ml)合并并且冷却至-10至-15℃。在搅拌下经由注射器滴加水性氢氧化钠水溶液(10n,0.33ml)和水性羟胺(50%,0.223ml)的预冷混合物,同时将温度保持在-10℃至-15℃。在-10℃至-15℃18小时后,分析混合物。s/r比率:91:9。
133、出于完整性的原因,本公开的各个方面在以下编号的条款中阐述。
134、条款1.一种用于制备对映异构体纯的式(1)的异噁唑啉化合物的方法,其包括以下步骤:
135、(i)使式(2)化合物与羟胺(其中x选自由卤素和-c(o)or4组成的组,其中r4是c1-c4烷基)以及合适的碱和式(3)化合物(其中y-是阴离子,r1选自由氢和甲氧基组成的组,r2选自由乙基和乙烯基组成的组,r3选自由芳基和杂芳基组成的组,该芳基任选地被独立地选自由硝基、卤素、氨基、三氟甲基、c1-c4烷基、c1-c4烷氧基和苄氧基组成的组的1至5个取代基取代,该杂芳基任选地被独立地选自由卤素、三氟甲基、c1-c4烷基和c1-c4烷氧基组成的组的1至3个取代基取代)反应,
136、以得到式(4)化合物;
137、(ii)将式(4)化合物的x转化成式(5)化合物的羧酸;
138、(iii)任选地用选自由c1-5醇、c2-5烷基氰、c3-9烷基酮、c2-8烷基醚、c2-8烷基乙酸酯组成的组的溶剂以及任选地用选自由水和c5-8烃组成的组的反溶剂使式(5)化合物结晶,
139、和
140、(iv)将式5化合物与合适的胺偶联,
141、其中合适的胺是2-氨基-炔丙基-乙酰胺或由甘氨酸任选地被羧基保护、随后如果需要去保护、然后与炔丙基胺偶联的顺序反应得到的胺。
142、条款2.根据条款1所述的方法,其中该合适的胺是2-氨基-炔丙基-乙酰胺。
143、条款3.根据条款1所述的方法,其中该合适的胺是由甘氨酸任选地被羧基保护、随后如果需要去保护、然后与炔丙基胺偶联的顺序反应得到的胺。
144、条款4.根据条款1至3中任一项所述的方法,其中x是卤素。
145、条款5.根据条款4所述的方法,其中x是溴。
146、条款6.根据条款4所述的方法,其中x是氯。
147、条款7.根据条款1至3中任一项所述的方法,其中x是-c(o)or4,其中r4是c1-c4烷基。
148、条款8.根据条款7所述的方法,其中r4是甲基。
149、条款9.根据条款7所述的方法,其中r4是乙基。
150、条款10.根据条款1至9中任一项所述的方法,其中r1是甲氧基。
151、条款11.根据条款1至10中任一项所述的方法,其中步骤(i)在-40℃至-10℃的温度进行。
152、条款12.根据条款1至10中任一项所述的方法,其中步骤(i)在-30℃至-20℃的温度进行。
153、条款13.根据条款1至10中任一项所述的方法,其中步骤(i)在约-30℃的温度进行。
154、条款14.根据条款1至13中任一项所述的方法,其中式(2)化合物与羟胺、合适的碱和式(3)化合物的反应在包括二氯甲烷和醚的溶剂体系的存在下进行。
155、条款15.根据条款14所述的方法,其中该醚是甲基叔丁基醚、乙基叔丁基醚、二异丙基醚或甲基叔戊基醚。
156、条款16.根据条款14所述的方法,其中该醚是甲基叔丁基醚或乙基叔丁基醚。
157、条款17.根据条款1至16中任一项所述的方法,其中式(4)化合物的对映异构体过量大于或等于80%。
158、条款18.根据条款1至16中任一项所述的方法,其中式(4)化合物的对映异构体过量大于或等于93%。
159、条款19.根据条款1至18中任一项所述的方法,其中发生步骤(iii)。
160、条款20.根据条款19所述的方法,其中存在(iii)中的反溶剂。
161、条款21.根据条款19或20所述的方法,其中(iii)中的溶剂是c1-5醇。
162、条款22.根据条款19或20所述的方法,其中(iii)中的溶剂是c2-5烷基氰。
163、条款23.根据条款19或20所述的方法,其中(iii)中的溶剂是c3-9烷基酮。
164、条款24.根据条款19或20所述的方法,其中(iii)中的溶剂是c2-8烷基醚。
165、条款25.根据条款19或20所述的方法,其中(iii)中的溶剂是c2-8烷基乙酸酯。
166、条款26.根据条款21所述的方法,其中(iii)中的c1-5醇是异丙醇。
167、条款27.根据条款21所述的方法,其中(iii)中的c1-5醇是乙醇。
168、条款28.根据条款22所述的方法,其中(iii)中的c2-5烷基氰是乙腈。
169、条款29.根据条款23所述的方法,其中(iii)中的c3-9烷基酮是丙酮。
170、条款30.根据条款23所述的方法,其中(iii)中的c3-9烷基酮是甲基乙基酮。
171、条款31.根据条款24所述的方法,其中(iii)中的c2-8烷基醚是四氢呋喃。
172、条款32.根据条款24所述的方法,其中(iii)中的c2-8烷基醚是2-甲基四氢呋喃。
173、条款33.根据条款25所述的方法,其中(iii)中的c2-8烷基乙酸酯是乙酸乙酯。
174、条款34.根据条款25所述的方法,其中(iii)中的c2-8烷基乙酸酯是乙酸异丙酯。
175、条款35.根据条款19至34中任一项所述的方法,其中(iii)中的反溶剂是水。
176、条款36.根据条款19至34中任一项所述的方法,其中(iii)中的反溶剂是c5-8烃。
177、条款37.根据条款36所述的方法,其中c5-8烃是戊烷。
178、条款38.根据条款36所述的方法,其中c5-8烃是己烷。
179、条款39.根据条款36所述的方法,其中c5-8烃是庚烷。
180、条款40.根据条款36所述的方法,其中c5-8烃是环己烷。
181、条款41.根据条款36所述的方法,其中c5-8烃是甲基环己烷。
182、条款42.根据条款1至41中任一项所述的方法,其中式(5)化合物的对映异构体过量大于或等于90%。
183、条款43.根据条款1至41中任一项所述的方法,其中式(5)化合物的对映异构体过量大于或等于96%。
184、条款44.根据条款1至41中任一项所述的方法,其中式(5)化合物的对映异构体过量大于或等于98%。
185、条款45.根据条款1至41中任一项所述的方法,其中式(5)化合物的对映异构体过量大于或等于99%。
186、条款46.根据条款1至41中任一项所述的方法,其中式(5)化合物的对映异构体过量大于或等于99.6%。
187、条款47.根据条款1至46中任一项所述的方法,其中合适的碱选自由氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钡、氢氧化铯、磷酸钠、磷酸钾、甲醇钠、甲醇钾、叔丁醇钾及它们的混合物组成的组。
188、条款48.根据条款1至47中任一项所述的方法,其中y-选自由甲苯磺酸根、对溴苯磺酸根、甲磺酸根、硝基苯磺酸根、三氟甲磺酸根、乙酸根、卤化物、硫酸根、磷酸根、氢氧化物和四氟化硼组成的组。
189、条款49.根据条款48所述的方法,其中y-是卤化物。
190、条款50.根据条款49所述的方法,其中y-是氯化物。
191、条款51.根据条款49所述的方法,其中y-是溴化物。
192、条款52.一种组合物,其包括98%或更高的对映异构体纯度的式(1)化合物。条款53.一种组合物,其包括99%或更高的对映异构体纯度的式(1)化合物。条款54.一种组合物,其包括99.8%或更高的对映异构体纯度的式(1)化合物。
- 还没有人留言评论。精彩留言会获得点赞!